一种用于早期检测动脉粥样硬化的诊断试剂的制作方法
[0001]
本发明涉及诊断试剂技术领域,尤其涉及一种用于早期检测动脉粥样硬化的诊断试剂。
背景技术:
[0002]
由动脉粥样硬化引起的心血管疾病(cvd)事件导致全世界三分之一的死亡,研究证实动脉粥样硬化的发病过程较为缓慢,起病多在青少年,发病多在中老年。动脉粥样硬化早期,机体无任何症状,仅仅表现为动脉弹性下降,僵硬度增加,随着时间推移和不良生活习惯及环境因素的持续性影响,胆固醇等脂质成分在动脉壁沉着,造成动脉管壁狭窄,出现心绞痛、心肌梗塞、脑中风甚至猝死等严重的后果,因此动脉粥样硬化的早期检测对预防疾病的发生有着至关重要的意义,一些非侵入性成像技术在亚临床动脉粥样硬化负荷评估中的应用,为早期发现心血管高危人群提供了很好的选择。
[0003]
目前,临床上的检测手段如:mri、micro-ct和对比增强x射线成像等一般在动脉发生较大的形态学改变时才能检测出来,此时动脉粥样硬化已经处于中后期。动脉粥样硬化发生和发展中的大多数生理过程都发生在纳米尺度,纳米技术为动脉粥样硬化的分子成像和靶向治疗提供了机会。纳米颗粒可以增加治疗药物的稳定性、水溶性和吸收性,延长其循环时间,使其在靶细胞或靶组织中具有较高的结合和吸收效率,保护它们不被组织和生理液体中的酶降解,并减少它们的副作用和毒性。
[0004]
近十年来,纳米颗粒技术在动脉粥样硬化病变分子成像中的应用发展迅速。该领域主要通过检测动脉粥样硬化不同阶段中某些特定的分子组成如巨噬细胞和脂质积累或钙化等方法来实现动脉粥样硬化的监测。这些靶点包括血管细胞粘附分子-1(vcam-1),细胞间粘附分子-1(icam-1)、cd40、p-selectin等,但是,目前用于研究的探针存在不足之处,这些信号分子在其他血管疾病中也会高表达,例如:icam-1在动脉瘤中会高表达;vcam-1在内膜增生中高表达;cd40在血栓中高表达;p-selectin在经皮冠状动脉介入治疗(pci)中高表达,因此,它们作为动脉粥样硬化的靶点可能造成疾病的误诊。
[0005]
cd47也称为整联素关联蛋白,属于免疫球蛋白家族。动脉粥样硬化中凋亡细胞是过表达cd47的,它们传递给巨噬细胞一种“不要吃我”的信号,从而逃避巨噬细胞对它们的吞噬和清除,cd47只在肿瘤和动脉粥样硬化中存在高表达现象,因此,以cd47为靶点的成像将会提高动脉粥样硬化诊断的准确率。
技术实现要素:
[0006]
本发明的目的是提供一种用于提高动脉粥样硬化检测准确度以及诊断早期动脉粥样硬化的探针,以解决“临床上的ct或mri只有到达动脉粥样硬化的中晚期,板块较大或发生明显钙化的情况下,才能检测到,此时动脉粥样硬化已经不能逆转,只能通过药物减缓动脉粥样硬化发展进程”的问题。
[0007]
为解决上述技术问题,本发明采用如下技术方案:
[0008]
一种用于早期检测动脉粥样硬化的诊断试剂,以具有聚集诱导发光性质的荧光小分子/聚合物为母核,以表面活性剂为载体制备纳米粒子,再通过化学合成法在纳米粒表面连接anti-cd47抗体,制备anti-cd47抗体修饰的荧光纳米探针。
[0009]
进一步的,所述的荧光小分子/聚合物具有聚集诱导发光(aie)性质。
[0010]
进一步的,所述荧光小分子/聚合物采用包含但不限于通式(i)、(ⅱ)、(ⅲ)、(ⅳ)、(
ⅴ
)、(
ⅵ
)、(
ⅶ
)、(
ⅷ
)所示的分子结构或其盐、水合物、螯合物中的至少一种:
[0011][0012]
还提供所述诊断试剂在动脉粥样硬化的早期对其进行精准的特异性检测的应用。
[0013]
进一步的,所述表面活性剂为peg-dspe-cooh
2000
[0014]
还提供了一种用于早期检测动脉粥样硬化的诊断试剂的制备方法,具体为:
[0015]
步骤一,纳米粒的制备:将适量所述的aie小分子/聚合物与peg-dspe-cooh
2000
,溶解于适量thf中,得混合溶液备用;
[0016]
在细胞破碎仪中取适量上述混合溶液逐滴缓慢滴入到适量去离子水中,超声处理,得纳米粒子溶液;用氮气单口吹以蒸发溶剂,一定时间后得到目标纳米粒子备用;
[0017]
步骤二,在剩余液体中依次加入适量1-乙基-3(3-二甲基丙胺)碳二亚胺(edci)、n-羟基琥珀酰亚胺磺酸钠盐(sulfo-nhs),室温下反应;再加入anti-cd47抗体适量,4℃下反应8小时,得修饰的荧光纳米探针;将上述的纳米粒子用透析袋进行透析,期间每隔2-3小时更换去离子水,换水频率约为3-4次;用去离子水将溶液定容,即可制备成anti-cd47抗体修饰的荧光纳米探针。
[0018]
进一步的,所述荧光小分子/聚合物的制备方法如下:
[0019]
步骤一,4,4'-(2-(4-溴苯基)-2-苯基乙烯-1,1-二基)双(甲氧基苯)(化合物2)的制备:将锌粉(13g,200mmol)置于100ml的超干四氢呋喃溶液中,0℃下滴加四氯化钛(19.278g,102mmol),升温至70℃反应3小时,再降温至0℃,滴加吡啶(3.95g,50mmol)后滴加溶于50ml超干四氢呋喃溶液的4-溴苯甲酰苯(5.22g,20mmol)与4,4'-二羟基二苯甲酮
(4.708g,22mmol)再升温至70℃反应12小时,反应结束后,加入饱和碳酸氢钠溶液淬灭,用乙酸乙酯萃取有机层,合并有机相,以乙酸乙酯/石油醚为洗脱剂,经硅胶柱层析纯化,得到8.01g化合物1,产率为90.6%;将8.01g化合物1与碳酸钠(12.42g,90mmol)溶于100ml的丙酮溶液中,再加入ch3i(6.39g,45mmol),40℃反应12小时后,以乙酸乙酯/石油醚为洗脱剂,经硅胶柱层析纯化,得到7.70g4,4'-(2-(4-溴苯基)-2-苯基乙烯-1,1-二基)双(甲氧基苯)(化合物2),产率为91%;
[0020]
步骤二,2-(4-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)苯基)-4,4,5,5-四甲基-1,3,2-二氧杂硼烷(化合物3)的制备:将适量化合物2(4.70g,10mmol)与双(频哪醇合)二硼(5.08g,20mmol),[1,1'-双(二苯基膦基)二茂铁]二氯化钯(439mg,6mmol),醋酸钾(2.94g,30mmol)溶于25ml甲苯溶液,回流反应12小时,反应完毕后,以乙酸乙酯/石油醚为洗脱剂进行硅胶柱层层析纯化,得到4.81g的2-(4-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)苯基)-4,4,5,5-四甲基-1,3,2-二氧杂硼烷(化合物3),产率为92.86%;
[0021]
步骤三,5-(4-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)苯基)噻吩-2-甲醛(化合物4)的制备:将化合物3(4.81g,9.89mmol),5-溴-2-噻吩甲醛(2.1g,11.14mmol),四(三苯基膦)钯(228mg,0.198mmol),四丁基溴化铵(312mg,0.989mmol)置于20ml甲苯中后,向反应体系中加入2mol/l的碳酸钾(2.76g,20.29mmol)10ml水溶液,回流反应12小时,反应完毕后使用乙酸乙酯(50ml
×
3)萃取,合并有机相,以乙酸乙酯/石油醚为洗脱剂,硅胶柱层析纯化粗品,得4.769g5-(4-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)苯基)噻吩-2-甲醛(化合物4),产率为95%;
[0022]
步骤五,5-((5-(4-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)苯基)噻吩-2-基)亚甲基)-3-乙基-2-硫代噻唑烷(化合物5)的制备:将适量化合物4(1.58g,3.15mmol)、3-乙基-2-硫代噻唑啉酮-4-酮(1.52g,9.45mmol)、醋酸铵(727mg,9.45mmol)置于10ml醋酸中,回流反应12小时,用饱和盐水萃取有机层,合并有机相,以乙酸乙酯/石油醚为洗脱剂,经硅胶柱层析纯化,得到1.89g的5-((5-(4-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)苯基)噻吩-2-基)亚甲基)-3-乙基-2-硫代噻唑烷(化合物5),产率为93%。
[0023]
与现有技术相比,本发明的有益技术效果:
[0024]
1、本发明制备的cd47抗体修饰的aie荧光纳米粒子,能够在动脉粥样硬化的早期对其进行精准的检测,早期诊断出的动脉粥样硬化可以通过药物进行逆转,消除班块。
[0025]
2、本发明制备的cd47抗体修饰的aie荧光纳米粒子能够实现动脉粥样硬化的早期诊断,而且不会对动脉粥样硬化的发展产生影响,因此可以用于药物研发,缩短药物研发的周期,经济效益巨大。
附图说明
[0026]
下面结合附图说明对本发明作进一步说明。
[0027]
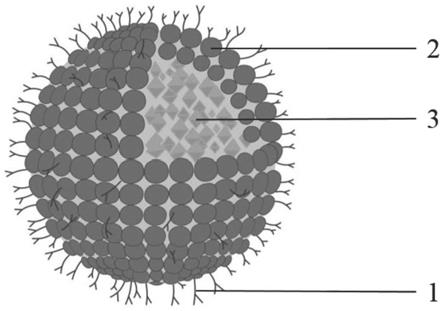
图1为:本发明制备的连接anti-cd47抗体的纳米荧光探针(anti-cd47 nps)的结构示意图;
[0028]
图2为:实施例1制备的连接anti-cd47抗体的纳米荧光探针(anti-cd47nps)的荧光内核5-((5-(4-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)苯基)噻吩-2-基)亚甲基)-3-乙基-2-硫代噻唑烷(化合物5)的合成路线图;
[0029]
图3为:马尔文纳米粒度分析仪测定实施例1制备的anti-cd47 nps和对比例1制备的未连接anti-cd47抗体的纳米荧光探针(free nps)的粒径(a,b)和zeta电位图(c,d);
[0030]
图4为:采用cck-8检测实施例1制备的anti-cd47 nps和对比例1制备的free nps对内皮细胞,平滑肌细胞,巨噬细胞增殖率影响结果图,control组为空白对照组,control组的细胞增殖被定义为100%;
[0031]
图5为:apoe-/-和c57bl/6两种小鼠模型在高脂喂养16周后通过尾静脉分别注射150μl盐水(saline)、对比例1制备的free nps溶液和实施例1制备的anti-cd47 nps溶液并在12h后分离主动脉,依次进行cri荧光成像和组织油红o染色(a)、主动脉cri平均荧光强度统计分析(b),主动脉油红o染色版块面积统计分析(c)、冰冻切片油红o染色和激光共聚焦成像的结果(d);;
[0032]
图6为:从喂养高脂饲料第16周开始用一次性胰岛素注射器分别抽取150μl saline、对比例1制备的free nps溶液和实施例1制备的anti-cd47 nps溶液通过尾静脉注射入apoe-/-小鼠和c57bl/6小鼠体内,为期4周,每周1次,距最后一次注射12h后分离主动脉,依次进行cri荧光成像和组织油红o染色(a)、主动脉cri平均荧光强度统计分析(b),主动脉油红o染色版块面积统计分析(c)、冰冻切片油红o染色和激光共聚焦成像的结果(d);
[0033]
图7为:从喂养高脂饲料开始,将阿托伐他汀(at)和肝脏x受体激动剂gw3965(gw)以每天10mg/kg/只的量与高脂饲料混合喂养apoe-/-小鼠8周,control组为无药物干预仅高脂饲料混合喂养apoe-/-小鼠8周,8周后通过尾静脉注射150μl实施例1制备的anti-cd47 nps溶液,12小时后取出主动脉依次进行cri荧光成像(a-a)、组织油红o染色(a-b)、micro-ct扫描(a-c)、mri成像(a-d)、冰冻切片油红o染色(a-e)和激光共聚焦照相的结果(a-f),并对主动脉cri平均荧光强度统计分析(b),主动脉油红o染色版块面积统计分析(c);
[0034]
图8为:实施例7制备的anti-cd47 nps的荧光内核5-((5-(4-(4-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)苯基)噻吩-2-基)亚甲基)-3-乙基噻唑烷-2,4-二酮的结构式;
[0035]
图9为:实施例8制备的anti-cd47 nps的荧光内核2-(5-((5-(4-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)苯基)噻吩-2-基)亚甲基)-3-乙基-4-氧噻唑烷-2-亚丙基)丙二腈的结构式;
[0036]
图10为:实施例9制备的anti-cd47 nps的荧光内核2-((4-((4-甲氧基苯基)(4-(1,2,2-三苯基乙烯基)苯基)氨基)苯基)(苯基)亚甲基)丙二腈的结构式;
[0037]
图11为:实施例10制备的anti-cd47 nps的荧光内核2-(2-(2-(2-(4'-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)-[1,1'-联苯基]-4-基)乙烯基)-4h-chromen-4-yylne)丙二腈的结构式;
具体实施方式
[0038]
一种用于提高动脉粥样硬化检测准确度以及诊断早期动脉粥样硬化的探针,其特征在于:以具有聚集诱导发光性质的荧光小分子/聚合物为母核,以表面活性剂为载体制备纳米粒子,再通过化学合成法在纳米粒表面连接anti-cd47抗体,制备anti-cd47抗体修饰的荧光纳米探针。
[0039]
参见图1,图1为本发明制备的anti-cd47 nps的结构示意图,其中1为anti cd47抗体,2为peg-dspe-cooh2000制备的纳米粒,3为具有聚集诱导发光性质的荧光小分子/聚合
peg-dspe-cooh2000,溶解于1ml的四氢呋喃。在细胞破碎仪中将溶解好的1ml的上述混合溶液逐滴缓慢滴入到9ml的去离子水中,超声处理60秒。用氮气单口吹24小时蒸发溶剂。在剩余液体中依次加入100μl edci、100μl sulfo-nhs,室温下反应30分钟。加入anti-cd47抗体20μl,4℃下反应8小时。将制备好的纳米粒子用透析袋(8000-14000kda)进行透析,期间每隔2-3小时更换去离子水,换水频率约为3-4次。用去离子水将溶液定容到2ml,制备成连接anti-cd47抗体的纳米荧光探针(anti-cd47nps)。
[0048]
对比例1
[0049]
free np的合成:依次称取1.5mg上述5-((5-(4-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)苯基)噻吩-2-基)亚甲基)-3-乙基-2-硫代噻唑烷(化合物5)、4.5mg peg-dspe-cooh
2000
,溶解于1ml的四氢呋喃。在细胞破碎仪中将溶解好的1ml的上述混合溶液逐滴缓慢滴入到9ml的去离子水中,超声处理60秒。用氮气单口吹24小时蒸发溶剂。将制备好的纳米粒子用透析袋(8000-14000kda)进行透析,期间每隔2-3小时更换去离子水,换水频率约为3-4次。用去离子水将溶液定容到2ml,制备成荧光纳米粒子(free nps)。
[0050]
实施例2
[0051]
马尔文纳米粒度分析仪测定实施例1制备的anti-cd47 nps和对比例1制备的free nps的粒径和zeta电位
[0052]
采用马尔文纳米粒度分析仪进行测定的实施例1制备的anti-cd47 nps和对比例1制备的free nps的粒径和zeta电位。结果如图3所示,实施例1制备的anti-cd47 np和对比例1制备的free np的粒径都分布在100nm左右,其中,对比例1制备的free np的粒径为89.91
±
0.20nm(图3a),实施例1制备的anti-cd47 np的粒径为105.10
±
0.20nm(图3b)。对比例1制备的free np的zeta电位为-45.43mv(图3c),实施例1制备的anti-cd47 np的zeta电位为-37.17mv(图3d),可见有很好的稳定性。
[0053]
实施例3
[0054]
体外cck-8实验检测实施例1制备的anti-cd47 nps和对比例1制备的free nps对细胞增殖的影响。
[0055]
分别将巨噬细胞(raw264.7)、平滑肌细胞(smcs)、人脐静脉内皮细胞(huvecs)培养24小时后,接种于96孔培养板,分别加入实施例1制备的anti-cd47 nps和对比例1制备的free nps并调节纳米颗粒的终浓度为分别为0.002、0.005、0.010、0.020、0.040、0.100μmol/ml,进行cck-8检测。结果如图4所示:与实施例1制备的anti-cd47 nps和对比例1制备的free nps共同孵育后,巨噬细胞raw264.7、smcs、huvecs的增殖能力与不添加纳米粒的对照组相比,均没有显著性差异,细胞增殖情况良好。
[0056]
实施例4
[0057]
实施例1制备的anti-cd47 nps和对比例1制备的free nps对动脉粥样硬化的靶向效果检测。
[0058]
本发明选用apoe-/-和c57bl/6两种小鼠模型,高脂喂养16周后,通过尾静脉分别注射150μl saline、对比例1制备的free nps溶液和实施例1制备的anti-cd47 np溶液,12h后分离主动脉。结果如图5所示,cri荧光成像显示,在apoe-/-小鼠的主动脉弓和腹主动脉中,saline组几乎没有荧光信号,实施例1制备的anti-cd47 nps组的荧光信号强于对比例1制备的free nps组(图5a)。荧光强度的定量分析表明实施例1制备的anti-cd47 nps组的平均
荧光强度是对比例1制备的free nps组的4倍左右(图5b)。通过对斑块面积的定量统计可知saline、对比例1制备的free nps和实施例1制备的anti-cd47nps各组间发生病变的面积基本一致,没有显著性差异(图5c)。通过对比主动脉荧光成像与油红o染色图像可以看出,荧光信号出现的位置和斑块形成的位置几乎是一一对应的(图5a),但是在发生相同程度病变的情况下,实施例1制备的anti-cd47 nps组的荧光强度显著高于对比例1制备的free nps组,这些结果表明anti-cd47修饰的荧光纳米颗粒显著提高了纳米颗粒靶向动脉粥样硬化斑块的效率。从微观组织学上发现在apoe-/-小鼠中实施例1制备的anti-cd47 nps在动脉粥样硬化斑块的聚集程度高于对比例1制备的free nps(图5d),该结果与cri荧光成像的结果是一致的。
[0059]
c57bl/6小鼠验证了实施例1制备的anti-cd47 nps和对比例1制备的free nps对未病变血管是否具有非特异性聚集。通过对c57bl/6小鼠的主动脉进行cri荧光成像和油红o染色发现实施例1制备的anti-cd47和对比例1制备的free nps均没有出现荧光信号(图5a。)这一结果表明实施例1制备的anti-cd47nps和对比例1制备的free nps不会在未病变血管中发生非特异性聚集。
[0060]
实施例5
[0061]
实施例1制备的anti-cd47 nps和对比例1制备的free nps对动脉粥样硬化发展进程的影响检测。
[0062]
从喂养高脂饲料第16周开始,用一次性胰岛素注射器分别抽取150μl saline、对比例1制备的free np溶液和实施例1制备的anti-cd47 nps溶液通过尾静脉注射入apoe-/-小鼠和c57bl/6小鼠体内,为期4周,每周1次,距最后一次注射12h后分离主动脉。结果如图6所示,cri荧光成像显示,在apoe-/-小鼠的主动脉弓和腹主动脉中,saline组几乎没有荧光信号,实施例1制备的anti-cd47 nps组的荧光信号强于对比例1制备的free nps组(图6a)。荧光强度的定量分析表明实施例1制备的anti-cd47 nps组的平均荧光强度是对比例1制备的free np组的4倍左右(图6b)。油红o染色结果表明各组apoe-/-小鼠在主动脉弓和腹主动脉发生了严重的动脉粥样硬化,通过对斑块面积的定量统计可知saline、对比例1制备的free nps和实施例1制备的anti-cd47 nps各组间发生病变的面积基本一致,没有显著性差异(图6c)。通过对比主动脉荧光成像与油红o染色图像可以看出(图6a),荧光信号出现的位置和斑块形成的位置几乎是一一对应的,但是在发生相同程度病变的情况下,实施例1制备的anti-cd47 nps组的荧光强度显著高于对比例1制备的free nps组,这些结果表明多次注射实施例1制备的anti-cd47 nps仍然对动脉粥样硬化斑块具有很高的靶向效率。从微观组织学上发现在apoe-/-小鼠中实施例1制备的anti-cd47 nps在动脉粥样硬化斑块的聚集程度高于对比例1制备的free nps(图6d),该结果与cri荧光成像的结果是一致的。
[0063]
通过对c57bl/6小鼠的主动脉进行cri荧光成像和油红o染色发现,实施例1制备的anti-cd47 nps和对比例1制备的free nps均没有出现荧光信号(图6a)。这一结果表明多次注射实施例1制备的anti-cd47 nps和对比例1制备的free nps不会在未病变血管中发生非特异性聚集。
[0064]
通过对apoe-/-小鼠主动脉根部的斑块进行定量分析发现,各组间斑块形成的面积并没有显著性差异,由此可见实施例1制备的anti-cd47 nps的多次注射没有影响动脉粥样硬化的发展。
[0065]
实施例6
[0066]
实施例1制备的anti-cd47 nps对动脉粥样硬化的早期检测。
[0067]
从喂养高脂饲料开始,将阿托伐他汀(at)和肝脏x受体激动剂gw3965(gw)以每天10mg/kg/只的量与高脂饲料混合喂养apoe-/-小鼠8周,8周后通过尾静脉注射150μl实施例1制备的anti-cd47 nps溶液,12h后取出主动脉依次进行cri荧光成像(图7a-a)、组织油红o染色(图7a-b)、micro-ct扫描(图7a-c)、mri成像(图7a-d)、冰冻切片油红o染色(图7a-e)和激光共聚焦成像图片(图7a-f)。
[0068]
结果如图7所示,cri荧光成像中,与不给予药物治疗的对照组(control)相比,给予at和gw两种药物治疗后主动脉弓和腹主动脉的荧光信号显著降低(图7a-a)。荧光强度的定量分析表明(图7b),at和gw两组的平均荧光强度约为对照组的一半,但两组之间并没有显著性差异,通过荧光信号的改变反映出at和gw两组形成的动脉粥样硬化远不及对照组严重,给予药物治疗后显著减缓了动脉粥样硬化的发展。为了从组织学上验证at和gw的治疗效果,我们对主动脉组织进行油红o染色(图7a-b),通过斑块面积的定量统计发现(图7c),对照组中形成的斑块面积是at和gw两组的2倍,而at和gw两组之间没有显著性差异,油红o染色表明at和gw具有抑制动脉粥样硬化的作用。通过对比主动脉荧光成像与油红o染色图像可以看出,荧光成像所反映的at和gw对动脉粥样硬化的疗效与油红o染色的结果相一致,说明可以通过实施例1制备的anti-cd47 nps荧光成像的手段筛选药物的治疗效果。以上结果还表明,实施例1制备的anti-cd47 nps荧光成像可以检测apoe-/-小鼠造模8周形成的动脉粥样硬化斑块,为探讨micro-ct和mri是否也能实现检测,我们将用于cri荧光成像的样品分别进行micro-ct和mri扫描。结果显示micro-ct(图7a-c)和mri扫描(图7a-d)都未能检测出动脉粥样硬化斑块。从微观组织学上发现大量的纳米粒聚集在发生动脉粥样硬化病变的区域(图7a-e,图7a-f),由此可见在微观组织学上,实施例1制备的anti-cd47 nps也能检测动脉粥样硬化,且实施例1所述分子为优选的结构。
[0069]
实施例7
[0070]
anti-cd47 nps的合成:依次称取1.2mg结构式如图8所示的5-((5-(4-(4-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)苯基)噻吩-2-基)亚甲基)-3-乙基噻唑烷-2,4-二酮(化合物6)、4.5mg peg-dspe-cooh
2000
,溶解于1ml的四氢呋喃。在细胞破碎仪中将溶解好的1ml的上述混合溶液逐滴缓慢滴入到9ml的去离子水中,超声处理60秒。用氮气单口吹24小时蒸发溶剂。在剩余液体中依次加入100μl edci、100μl sulfo-nhs,室温下反应30分钟。加入anti-cd47抗体20μl,4℃下反应8小时。将制备好的纳米粒子用透析袋(8000-14000kda)进行透析,期间每隔2-3小时更换去离子水,换水频率约为3-4次。用去离子水将溶液定容到2ml,制备成连接anti-cd47抗体的纳米荧光探针(anti-cd47 nps)。
[0071]
对比例2:
[0072]
free nps的合成:依次称取1.2mg结构式如图8所示的5-((5-(4-(4-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)苯基)噻吩-2-基)亚甲基)-3-乙基噻唑烷-2,4-二酮(化合物6)、4.5mg peg-dspe-cooh
2000
,溶解于1ml的四氢呋喃。在细胞破碎仪中将溶解好的1ml的上述混合溶液逐滴缓慢滴入到9ml的去离子水中,超声处理60秒。用氮气单口吹24小时蒸发溶剂。将制备好的纳米粒子用透析袋(8000-14000kda)进行透析,期间每隔2-3小时更换去离子水,换水频率约为3-4次。用去离子水将溶液定容到2ml,制备成未连接anti-cd47抗体的
纳米荧光探针(free nps)。
[0073]
实施例8
[0074]
anti-cd47 nps的合成:依次称取1.3mg结构式如图9所示的2-(5-((5-(4-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)苯基)噻吩-2-基)亚甲基)-3-乙基-4-氧噻唑烷-2-亚丙基)丙二腈(化合物7)、4.5mg peg-dspe-cooh
2000
,溶解于1ml的四氢呋喃。在细胞破碎仪中将溶解好的1ml的上述混合溶液逐滴缓慢滴入到9ml的去离子水中,超声处理60秒。用氮气单口吹24小时蒸发溶剂。在剩余液体中依次加入100μl edci、100μl sulfo-nhs,室温下反应30分钟。加入anti-cd47抗体20μl,4℃下反应8小时。将制备好的纳米粒子用透析袋(8000-14000kda)进行透析,期间每隔2-3小时更换去离子水,换水频率约为3-4次。用去离子水将溶液定容到2ml,制备成连接anti-cd47抗体的纳米荧光探针(anti-cd47 nps)。
[0075]
对比例3:
[0076]
free nps的合成:依次称取1.3mg结构式如图9所示的2-(5-((5-(4-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)苯基)噻吩-2-基)亚甲基)-3-乙基-4-氧噻唑烷-2-亚丙基)丙二腈(化合物7)、4.5mg peg-dspe-cooh
2000
,溶解于1ml的四氢呋喃。在细胞破碎仪中将溶解好的1ml的上述混合溶液逐滴缓慢滴入到9ml的去离子水中,超声处理60秒。用氮气单口吹24小时蒸发溶剂。将制备好的纳米粒子用透析袋(8000-14000kda)进行透析,期间每隔2-3小时更换去离子水,换水频率约为3-4次。用去离子水将溶液定容到2ml,制备成未连接anti-cd47抗体的纳米荧光探针(free nps)
[0077]
实施例9
[0078]
anti-cd47 nps的合成:依次称取1.7mg结构式如图10所示的2-((4-((4-甲氧基苯基)(4-(1,2,2-三苯基乙烯基)苯基)氨基)苯基)(苯基)亚甲基)丙二腈(化合物8)、4.5mg peg-dspe-cooh
2000
,溶解于1ml的四氢呋喃。在细胞破碎仪中将溶解好的1ml的上述混合溶液逐滴缓慢滴入到9ml的去离子水中,超声处理60秒。用氮气单口吹24小时蒸发溶剂。在剩余液体中依次加入100μl edci、100μl sulfo-nhs,室温下反应30分钟。加入anti-cd47抗体20μl,4℃下反应8小时。将制备好的纳米粒子用透析袋(8000-14000kda)进行透析,期间每隔2-3小时更换去离子水,换水频率约为3-4次。用去离子水将溶液定容到2ml,制备成连接anti-cd47抗体的纳米荧光探针(anti-cd47 nps)。
[0079]
对比例4:
[0080]
free nps的合成:依次称取1.7mg结构式如图10所示的2-((4-((4-甲氧基苯基)(4-(1,2,2-三苯基乙烯基)苯基)氨基)苯基)(苯基)亚甲基)丙二腈(化合物8)、4.5mg peg-dspe-cooh
2000
,溶解于1ml的四氢呋喃。在细胞破碎仪中将溶解好的1ml的上述混合溶液逐滴缓慢滴入到9ml的去离子水中,超声处理60秒。用氮气单口吹24小时蒸发溶剂。将制备好的纳米粒子用透析袋(8000-14000kda)进行透析,期间每隔2-3小时更换去离子水,换水频率约为3-4次。用去离子水将溶液定容到2ml,制备成未连接anti-cd47抗体的纳米荧光探针(free nps)。
[0081]
实施例10:
[0082]
anti-cd47 nps的合成:依次称取1.3mg结构式如图11所示的2-(2-(2-(2-(4'-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)-[1,1'-联苯基]-4-基)乙烯基)-4h-chromen-4-yylne)丙二腈(化合物9)的制备纳米粒子、4.5mg peg-dspe-cooh2000,溶解于1ml的四氢呋
喃。在细胞破碎仪中将溶解好的1ml的上述混合溶液逐滴缓慢滴入到9ml的去离子水中,超声处理60秒。用氮气单口吹24小时蒸发溶剂。在剩余液体中依次加入100μl edci、100μl sulfo-nhs,室温下反应30分钟。加入anti-cd47抗体20μl,4℃下反应8小时。将制备好的纳米粒子用透析袋(8000-14000kda)进行透析,期间每隔2-3小时更换去离子水,换水频率约为3-4次。用去离子水将溶液定容到2ml,制备成连接anti-cd47抗体的荧光纳米粒子(anti-cd47 nps)。
[0083]
对比例5:
[0084]
free nps的制备:依次称取1.3mg结构式如图11所示的2-(2-(2-(2-(4'-(2,2-双(4-甲氧基苯基)-1-苯基乙烯基)-[1,1'-联苯基]-4-基)乙烯基)-4h-chromen-4-yylne)丙二腈(化合物9)、4.5mg peg-dspe-cooh2000,溶解于1ml的四氢呋喃。在细胞破碎仪中将溶解好的1ml的上述混合溶液逐滴缓慢滴入到9ml的去离子水中,超声处理60秒。用氮气单口吹24小时蒸发溶剂。将制备好的纳米粒子用透析袋(8000-14000kda)进行透析,期间每隔2-3小时更换去离子水,换水频率约为3-4次。用去离子水将溶液定容到2ml,制备成未连接anti-cd47抗体的荧光纳米粒子(free nps)。
[0085]
实施例7-10制备的anti-cd47 nps检测靶向动脉粥样硬化位点的效果、对动脉粥样硬化发展的影响和早期检测动脉粥样硬化的效果与实施例1制备的anti-cd47 nps基本一致,而相应的对比例2-5与对比例1的检测结果基本一致。这说明anti cd47修饰的前提下,采用不同的母核用于动脉粥样硬化的早期检测同样有效,即anti cd47修饰后无论哪种荧光小分子/聚合物作为母核形成的anti-cd47 nps均能够用于早期检测动脉粥样硬化,而且均不会对动脉粥样硬化发展的影响产生影响,均可用于治疗动脉粥样硬化药物的早期筛查。
[0086]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1