一种高灵敏生物传感器及其制作方法与应用与流程
[0001]
本发明属于生物传感器及其应用技术领域,尤其是涉及一种高灵敏生物传感器及其制作方法与应用。
背景技术:
[0002]
慢性疾病(chronic disease)即慢性非传染性疾病,是一种长期存在的,或随着时间推移而发展形成疾病形态损害的一类疾病的统称。常见的慢性疾病主要包括心脑血管疾病、神经退行性疾病、糖尿病和癌症等。慢性疾病可以造成患者心脑肝肾等重要器官的损害,大大影响患者及其家庭的生活质量,更给社会带来巨大的医疗与经济负担。2018年世界卫生组织(wto)指出每年约有4100万人死于慢性疾病,相当于全球总死亡人数的71%。其中每年有1500万30-69岁慢性病人“过早”死亡,这类“过早”死亡中85%来自低收入和中等收入国家。2030年wto可持续发展议程确认慢性疾病是可持续发展的一项重大挑战,并指出预防医学尤其是早期诊断与早期治疗可大大降低慢性疾病的过早死亡率。
[0003]
目前,临床常用的慢性疾病的早期检测方法为基因检测,肿瘤标志物检测,基础研究中主要为酶联免疫吸附测定(elisa),电化学检测,电化学免疫测定,表面-增强拉曼光谱,比色测定和局部表面等离子体共振等。其中电化学检测由于其灵敏性,专一性,设备可小型化等优势而逐渐被广泛应用于基础研究中。以阿尔兹海默症为例,研究人员使用不同形貌的材料修饰电极提高传感器的导电性,并引入纳米材料放大电化学信号,最终提高传感器的灵敏度,使最低检测限达到pm级别。尽管上述这些电化学方法的组合可以有效地提高电化学的灵敏度,实现慢性疾病的早期检测,但是复杂的制造和较多不可控影响因素可能限制电极表面上的电子转移并导致检测范围变窄。
技术实现要素:
[0004]
本发明的目的在于提供一种高灵敏生物传感器及其制作方法与应用,以避免现有技术中电化学传感器制造复杂和不可控影响因素较多的问题,进而可以避免现有检测方法检测范围窄的问题。
[0005]
本发明的目的可以通过以下技术方案来实现:
[0006]
本发明首先提供一种高灵敏生物传感器,包括电极,所述电极表面修饰有金,在金的表面修饰有导电高分子,所述导电高分子上固定有生物识别物,所述生物识别物用于不同生物标志物的特异性检测。
[0007]
在本发明的一个实施方式中,所述金的形貌为纳米金颗粒或松树状金。
[0008]
在本发明的一个实施方式中,所述导电高分子为导电聚合物,选自聚(吡咯-2-羧酸),聚(吡咯-3-羧酸)或聚(3-噻吩乙酸)。实际制备时,可以利用导电高分子单体来在金的表面电化学聚合形成导电高分子。
[0009]
在本发明的一个实施方式中,所述生物识别物选自抗体、酶或多肽,例如细胞阮蛋白95-110。
[0010]
在本发明的一个实施方式中,所述电极选择为金电极。
[0011]
本发明还提供所述高灵敏生物传感器的制作方法,包括以下步骤:
[0012]
a.使用电镀的方法将纳米金颗粒或松树状金修饰在电极的表面,使用扫描电镜、循环伏安法和电化学阻抗法验证纳米金颗粒或松树状金是否已经修饰在电极的表面;
[0013]
b.使用电化学聚合的方法将导电高分子修饰在电极金材料的表面,使用循环伏安法和电化学阻抗法验证导电高分子是否已经修饰在电极金材料的表面;
[0014]
c.激活电极上导电高分子表面的羧基;
[0015]
d.将步骤c活化后的电极浸入到特异性生物识别物中,通过酰胺反应固定生物识别物,使用循环伏安法和电化学阻抗法,检测生物识别物是否已经成功固定,得到所述高灵敏生物传感器。
[0016]
在本发明的一个实施方式中,在将纳米金颗粒或松树状金修饰在电极的表面之前,对电极进行抛光处理。
[0017]
在本发明的一个实施方式中,优选地,抛光处理的方法包括:
[0018]
(11)使用不同粒径的三氧化二铝将金电极物理抛光,获得镜面形貌;
[0019]
(12)将电极浸入在食人鱼刻蚀液中,去除表面杂质;
[0020]
(13)依次使用氢氧化钾与硫酸进行电化学抛光,激活电极。
[0021]
在本发明的一个实施方式中,优选地,所述电极选择为金电极。当使用金电极时,对金电极进行物理抛光、化学抛光去除表面杂质以及电化学抛光处理后,通过电镀的方法更易获得形貌规整的纳米金颗粒以及松树状金表面。
[0022]
在本发明的一个实施方式中,进一步优选地,当使用氢氧化钾与硫酸进行电化学抛光时,氢氧化钾与硫酸均采用0.5m的浓度。
[0023]
在本发明的一个实施方式中,激活电极上导电高分子表面的羧基的方法为:将所制备的电极浸没在含有1-(3-二甲氨基丙基)-3-乙基碳二亚胺和n-羟基琥珀酰亚胺的2-吗啉乙磺酸缓冲溶液中,进行激活。
[0024]
在本发明的一个实施方式中,提供一种具体的高灵敏生物传感器的制作方法,包括以下步骤:
[0025]
a.使用不同粒径的三氧化二铝将电极物理抛光,获得镜面形貌;
[0026]
b.将电极浸入在食人鱼刻蚀液中,去除表面杂质;
[0027]
c.依次使用氢氧化钾与硫酸激活电极;
[0028]
d.使用电镀的方法将纳米金颗粒或松树状金修饰在电极的表面,使用扫描电镜、循环伏安法和电化学阻抗法验证纳米金颗粒或松树状金是否已经修饰在电极的表面;
[0029]
e.使用电化学聚合的方法将导电高分子修饰在电极金材料的表面,使用扫描电镜、循环伏安法和电化学阻抗法验证导电高分子是否已经修饰在电极金材料的表面;
[0030]
f.激活电极上导电高分子表面的羧基:将所制备的电极浸没在含有1-(3-二甲氨基丙基)-3-乙基碳二亚胺和n-羟基琥珀酰亚胺的2-吗啉乙磺酸缓冲溶液激活;
[0031]
g.将活化的电极浸入到特异性生物识别物中,通过酰胺反应固定生物识别物,使用循环伏安法和电化学阻抗法,检测生物识别物是否已经成功固定上,得到所述高灵敏生物传感器。
[0032]
本发明进一步提供所述高灵敏生物传感器的应用,包括以下步骤:
[0033]
将所述高灵敏生物传感器浸没在含有不同浓度的生物标志物的溶液中,使用循环伏安法和电化学阻抗法,检测所述生物传感器的电化学性能,制备标准曲线;
[0034]
将所述高灵敏生物传感器浸入待检测样品溶液中,使用循环伏安法和电化学阻抗法,检测所述高灵敏生物传感器的电化学性能,通过与标准曲线比较,计算出样品中生物标志物的浓度。
[0035]
在本发明的一个实施方式中,所述样品溶液包括脑脊髓液、血浆、汗液、尿液、粪便以及磷酸缓冲溶液等。
[0036]
在本发明的一个实施方式中,标准曲线是通过以下方法制作的:使用电化学阻抗法检测溶液中不同浓度生物分析物的电阻值,以浓度的log值为x轴,所对应的电阻变化值为y轴,制作线性曲线。
[0037]
本发明利用导电聚合物(cp)具有较高的导电性和较好的电化学稳定性,将其作为电化学传感器中的导电层和连接剂(linking agents)。cp的电化学沉积可以有效地改善物理化学性质,例如稳定性,粘附性,电化学活化表面积和电导率。
[0038]
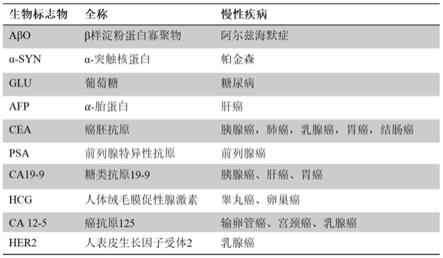
同时,本发明中,将松树状金或纳米金颗粒修饰在电极表面,并在此基础上修饰不同的导电聚合物,如聚(吡咯-2-羧酸),聚(吡咯-3-羧酸)和聚(3-噻吩乙酸)。随后在其表面固定生物识别物(如抗体,酶,多肽等),用于不同生物标志物的特异性检测,可以为慢性疾病的早期检测提供数据指导。具体慢性疾病及其生物标志物如图1所示。
[0039]
本发明将金纳米颗粒或松树状金材料修饰在电极表面,随后使用化学沉积法将不同导电高分子修饰在金材料的表面,通过绑定不同的生物识别物以实现不同生物标志物的微量检测,可以为慢性疾病的早期检测提供客观数据指导,本发明所得的高灵敏生物传感器可以用在慢性疾病的早期检测方面。本发明高灵敏生物传感器的技术原理,如图2所示,流程图如图3所示。
[0040]
与现有技术相比,本发明的创新点主要体现在以下方面:
[0041]
(1)本发明使用松树状金或纳米金修饰的电极,大大增加其表面活性面积,提高传感器的灵敏度;
[0042]
(2)本发明中,导电高分子不仅可以提高材料的稳定性,更为传感器提供较多活性位点;
[0043]
(3)修饰后的电极可以大大提高灵敏度,实现生物标志物的微量检测,最低检测限达到am级别(10-9
nm)。
附图说明
[0044]
图1为常见慢性疾病及其生物标志物。
[0045]
图2为本发明高灵敏生物传感器的技术路线
[0046]
图3为本发明高灵敏生物传感器的流程图。
[0047]
图4为实施例1中高灵敏生物传感器的制备流程。
[0048]
图5为实施例1循环伏安法和电化学电阻法测试的电极表面电化学性能。
[0049]
图5包括图5a和图5b,其中,图5a为循环伏安曲线,图5b为电化学阻抗谱。
[0050]
图6为实施例1中电化学电阻法测试不同浓度的生物分析物的电极表面电化学性能及其标准曲线。
[0051]
图6包括图6a和图6b,其中,图6a为电化学阻抗谱,图6b为检测的标准曲线。
[0052]
图7为实施例2中高灵敏生物传感器的制备流程。
[0053]
图8为实施例2中纳米金-导电高分子修饰电极形貌。
[0054]
图9为实施例2循环伏安法和电化学电阻法测试的电极表面电化学性能。
[0055]
图9包括图9a和图9b,其中,图9a为循环伏安曲线,图9b为电化学阻抗谱。
[0056]
图10为实施例2电化学电阻法测试不同浓度的生物分析物的电极表面电化学性能及其标准曲线。
[0057]
图10包括图10a和图10b,其中,图10a为电化学阻抗谱,图10b为检测的标准曲线。
[0058]
图11为实施例3中高灵敏生物传感器的制备流程。
[0059]
图12为实施例3中松树状金-导电高分子修饰电极形貌。
[0060]
图13为实施例3循环伏安法和电化学电阻法测试的电极表面电化学性能
[0061]
图13包括图13a和图13b,其中,图13a为循环伏安曲线,图13b为电化学阻抗谱。
[0062]
图14为实施例3电化学电阻法测试不同浓度的生物分析物的电极表面电化学性能及其标准曲线。
[0063]
图14包括图14a和图14b,其中,图14a为电化学阻抗谱,图14b为检测的标准曲线。
[0064]
图15为实施例3电化学电阻法测试不同浓度的小鼠/临床样品的实际数据。
具体实施方式
[0065]
下面结合附图和具体实施例对本发明进行详细说明。
[0066]
如无特别说明,本申请的实施例中的原料均通过商业途径购买。
[0067]
实施例1
[0068]
高灵敏生物传感器的制备流程如图4所示,使用0.3μm,0.05μm三氧化二铝依次将金电极物理抛光,使用大量的去离子水,乙醇清洗电极表面,获得镜面形貌;将电极浸入在食人鱼刻蚀液中(30%h2o2:18m h2so4体积比=1:3)十分钟,通过化学抛光,去除表面杂质;使用循环扫描法在0.5m氢氧化钾中(电压范围:-1.5-0.1v,扫描速率100mv/s扫描次数20次)中电化学抛光;使用计时电流法和循环伏安法在0.5m硫酸中电化学抛光(计时电流法,2v,5s;-0.35v,10s;循环伏安法,电压范围:-0.3-1.6v,扫描速率100mv/s,扫描次数20次),使用水和无水乙醇清洗电极,并使用氮气吹干。
[0069]
将导电高分子单体(本实施例中为3-吡咯羧酸)与高氯酸锂溶于无水乙腈中,通入氮气,去除溶液中空气,使用循环伏安法将导电高分子电镀在纳米金表面,获得导电高分子修饰的电极。其中,导电高分子单体与高氯酸锂在乙腈中的浓度均为0.1m,循环伏安法的电压范围-0.3-1.5v,扫描速率50mv/s,循环次数为10次。
[0070]
将修饰好的电极浸入到含有1-(3-二甲氨基丙基)-3-乙基碳二亚胺/n-羟基琥珀酰亚胺(edc/nhs)的2-(n-吗啉代)乙磺酸缓冲液中激活电极表面羧基,随后浸入到含有特异性生物识别物的溶液中(本实施例中为细胞阮蛋白95-110),其中,95-110是指氨基酸序列,当氨基酸序列为95-110时可以通过末端非结构化的氮端特异性识别β淀粉蛋白寡聚物,通过酰胺反应固定生物识别物,获得高灵敏生物传感器。
[0071]
通过使用三元电极法测定电极表面的电流和阻抗,揭示不同修饰条件下的电极的电化学性能。如图5所示。
[0072]
使用电化学阻抗法检测磷酸缓冲溶液中不同浓度生物分析物(本实施例中为β淀粉蛋白寡聚物)的电阻值,以浓度的log值为x轴,所对应的电阻变化值为y轴,制作线性曲线,即为检测的标准曲线,如图6所示。
[0073]
提取小鼠模型的体液(本实施例中为患有阿尔兹海默症小鼠的脑脊髓液),通过缓冲溶液稀释后,将本实施例所得高灵敏生物传感器浸入待检测样品溶液中,使用循环伏安法和电化学阻抗法,检测所述高灵敏生物传感器的电化学性能,通过与标准曲线比较,计算出样品中生物标志物的浓度。
[0074]
实施例2
[0075]
高灵敏生物传感器的制备流程如图7所示,使用0.3μm,0.05μm三氧化二铝依次将金电极物理抛光,使用大量的去离子水,乙醇清洗电极表面,获得镜面形貌;将电极浸入在食人鱼刻蚀液中(30%h2o2:18m h2so4体积比=1:3)十分钟,通过化学抛光,去除表面杂质;使用循环扫描法在0.5m氢氧化钾中(电压范围:-1.5-0.1v,扫描速率100mv/s扫描次数20次)中电化学抛光;使用计时电流法和循环伏安法在0.5m硫酸中电化学抛光(计时电流法,2v,5s;-0.35v,10s;循环伏安法,电压范围:-0.3-1.6v,扫描速率100mv/s扫描次数20次),使用水和无水乙醇清洗电极,并使用氮气吹干。
[0076]
取10mm氯金酸,0.5m硫酸,在氯金酸与硫酸溶液中,使用计时电流法(-0.2v20s)对电极表面进行电镀后获得纳米金,所得纳米金形貌如图8所示。使用循环伏安法和电化学阻抗法比较纳米金修饰前后,电极的电流电阻值,如图9所示。
[0077]
将导电高分子单体(本实施例中为3-吡咯羧酸)与高氯酸锂溶于无水乙腈中,通入氮气,去除溶液中空气,使用循环伏安法将导电高分子电镀在纳米金表面,获得表面修饰有纳米金和导电高分子的电极。其中,导电高分子单体与高氯酸锂在乙腈中的浓度均为0.1m,循环伏安法的电压范围-0.3-1.5v,扫描速率50mv/s,循环次数为10次。所得纳米金-导电高分子如图7所示。使用循环伏安法和电化学阻抗法比较纳米金修饰前后,电极的电流电阻值,如图9所示。
[0078]
将修饰好的电极浸入到含有1-(3-二甲氨基丙基)-3-乙基碳二亚胺/n-羟基琥珀酰亚胺(edc/nhs)的2-(n-吗啉代)乙磺酸缓冲液中激活电极表面羧基,随后浸入到含有特异性生物识别物的溶液中(本实施例中为细胞阮蛋白95-110,可以通过末端非结构化的氮端特异性识别β淀粉蛋白寡聚物),通过酰胺反应固定生物识别物,得到高灵敏生物传感器。
[0079]
通过使用三元电极法测定电极表面的电流和阻抗,揭示不同修饰条件下的电极的电化学性能。如图9所示。
[0080]
使用电化学阻抗法检测磷酸缓冲溶液中不同浓度生物分析物(本实施例中为β淀粉蛋白寡聚物)的电阻值,以浓度的log值为x轴,所对应的电阻变化值为y轴,制作线性曲线,即为检测的标准曲线如图10所示。
[0081]
提取小鼠模型的体液(本实施例中为患有阿尔兹海默症小鼠的脑脊髓液),通过缓冲溶液稀释后,将本实施例所得高灵敏生物传感器浸入待检测样品溶液中,使用循环伏安法和电化学阻抗法,检测所述高灵敏生物传感器的电化学性能,通过与标准曲线比较,计算出样品中生物标志物的浓度。
[0082]
实施例3
[0083]
高灵敏生物传感器的制备流程如图11所示,使用0.3μm,0.05μm三氧化二铝依次将
金电极物理抛光,使用大量的去离子水,乙醇清洗电极表面,获得镜面形貌;将电极浸入在食人鱼刻蚀液中(30%h2o2:18m h2so4体积比=1:3)十分钟,通过化学抛光,去除表面杂质;使用循环扫描法在0.5m氢氧化钾中(电压范围:-1.5-0.1v,扫描速率100mv/s扫描次数20次)中电化学抛光;使用计时电流法和循环伏安法在0.5m硫酸中电化学抛光(计时电流法,2v,5s;-0.35v,10s;循环伏安法,电压范围:-0.3-1.6v,扫描速率100mv/s扫描次数20次),使用水和无水乙醇清洗电极,并使用氮气吹干。
[0084]
取10mm氯金酸,0.5m硫酸,在氯金酸与硫酸溶液中,使用计时电流法(-0.2v20s)对电极表面进行电镀后获得纳米金,所得松树状金形貌如图12所示。使用循环伏安法和电化学阻抗法比较松树状金修饰前后,电极的电流电阻值,如图12所示。
[0085]
将导电高分子单体(本实施例中为3-吡咯羧酸)与高氯酸锂溶于无水乙腈中,通入氮气,去除溶液中空气,使用循环伏安法将导电高分子电镀在纳米金表面,获得表面修饰有松树状金和导电高分子的电极。其中,导电高分子单体与高氯酸锂在乙腈中的浓度均为0.1m,循环伏安法的电压范围-0.3-1.5v,扫描速率50mv/s,循环次数为10次。所得松树状金-导电高分子形貌如图12所示。使用循环伏安法和电化学阻抗法比较松树状金修饰前后,电极的电流电阻值,如图12所示。
[0086]
将修饰好的电极浸入到含有1-(3-二甲氨基丙基)-3-乙基碳二亚胺/n-羟基琥珀酰亚胺(edc/nhs)的2-(n-吗啉代)乙磺酸缓冲液中激活电极表面羧基,随后浸入到含有特异性生物识别物的溶液中(本实施例中为细胞阮蛋白95-110,可以通过末端非结构化的氮端特异性识别β淀粉蛋白寡聚物),通过酰胺反应固定生物识别物,得到高灵敏生物传感器。
[0087]
通过使用三元电极法测定电极表面的电流和阻抗,揭示不同修饰条件下的电极的电化学性能。如图13所示。
[0088]
使用电化学阻抗法检测磷酸缓冲溶液中不同浓度生物分析物(本实施例中为β淀粉蛋白寡聚物)的电阻值,以浓度的log值为x轴,所对应的电阻变化值为y轴,制作线性曲线,即为检测的标准曲线如图14所示。
[0089]
提取小鼠模型的体液(本实施例中为患有阿尔兹海默症小鼠的脑脊髓液),通过缓冲溶液稀释后,将本实施例所得高灵敏生物传感器浸入待检测样品溶液中,使用循环伏安法和电化学阻抗法,检测所述高灵敏生物传感器的电化学性能,通过与标准曲线比较,计算出样品中生物标志物的浓度,如图15所示。
[0090]
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1