一种基于功能化纳米探针的单细胞电化学传感器及其应用的制作方法
[0001]
本发明涉及一种基于功能化纳米探针的单细胞电化学传感器及其应用,属于电化学传感器和毒素检测技术领域。
背景技术:
[0002]
细胞传感器可用于定性或定量地检测未知有毒物质,并基于兴奋作用电位和细胞机制的特定特性确定这种物质的存在和含量,以检测和评估有害物质。在单个细胞水平上进行研究,可以获得反映细胞生理状态和过程更为准确、全面的信息,更好地了解细胞群体中某些特殊的细胞功能,更加深入的认识细胞间差异、细胞间相互作用信息和神经递质、药物刺激的生理影响等更深层次的信息。纳米电化学在生物化学、神经科学、催化、分子电子学、纳米科学(如纳米孔、纳米气泡和纳米颗粒)、聚合物科学、电沉积和可再生技术等广泛的跨学科研究中发挥着关键作用。纳米电极由于其体积小,可将穿透活细胞过程中的损伤降至最低,特别有利于对这些物种的细胞内测量。近年来,随着纳米电化学的发展,在溶液中进行化学测量具有纳米的空间分辨率、高的时间分辨率和超高的灵敏度和选择性。
[0003]
t-2毒素是由镰刀菌属产生的一种真菌毒素,属于a类单端孢霉烯族毒素,也是毒性最强的一种。因为t-2毒素在自然界中分布极其广泛,在田间生长的作物如大麦、小麦、燕麦、黑麦和玉米等,以及库存的谷物中都可能有t-2毒素的存在,而且t-2毒素在-2~35℃之间都可以产生,产量会随着环境湿度的升高而增加。t-2毒素难以降解,普通的烹饪方式不会降低它的毒性,因此对人类和动物的健康都是一个严重威胁。1973年,世界粮食组织/卫生组织(jecfa)将t-2毒素认定为最危险的天然食品污染毒素之一,2017年中国发布了关于植物性饲料原料及猪、禽配合饲料国家标准,规定了t-2毒素在饲料中不能超过0.5mg/kg。t-2毒素能够引起动物体内和体外多种细胞中发生氧化应激反应。许多研究者也从氧化应激角度解释t-2毒素引起的多种毒性作用,如细胞毒性、免疫毒性、遗传毒性、生殖毒性和神经毒性等。过氧化氢是细胞内活性氧(ros)最具有代表性的自由基,细胞内活性氧过氧化氢水平与生物的生理、病理密切相关。然而,ros的过度生成会压倒细胞自由基清除和修复系统,导致组织功能障碍和氧化应激。t-2毒素能够激活ros依赖的线粒体凋亡通路,从而引起线粒体功能损伤。
[0004]
目前毒性评价方法主要依赖于多细胞实验及动物实验,多细胞实验方法成本低、周期短、与机体具有一定同源性,但是多细胞培养灵敏度低,无法实现实时监测,动物毒理实验的结果虽能够真实全面系统地反映药物对机体的影响,但存在着成本高、周期长、重复性不够理想等缺点。
[0005]
随着科技发展与进步,传统细胞和传感器技术相结合的多种新技术、新方法为毒性机制研究提供更多新的手段。细胞传感器的构建中,细胞作为感受器被固定到界面上,当受到外界药物刺激后会引起细胞生理活性改变,这些变化可被转化为光电信号,信号变化的大小可对细胞受到的药物刺激进行定性定量分析。目前专利(cn201610231154.0)提供了一种细胞检测石房蛤毒素的方法,检测线性范围1-10nm,即2.99-29.9ppb,检测限较高,灵
敏度较低,且该发明结合elisa检测方法,并没有利用电化学传感方式。专利(cn201310511626.4)公开了一种基于石墨烯的单细胞传感方法,具体是将石墨烯转移到透明基底上,根据待测细胞大小选择合适的微流通道粘贴到石墨烯上,将光束聚焦照射到覆盖有微流通道的石墨烯位置,出射光分成s和p偏振分别照射到平衡探测器的两个探头,对电压信号进行采集,进行细胞信号分析处理,获得细胞的表征信息。但此方法只能区别单细胞形态,对药物检测还需进一步研究。
技术实现要素:
[0006]
为了解决上述至少一个问题,本发明提供了一种基于功能化纳米探针的单细胞电化学传感器及其在真菌毒素t-2毒素上的应用。本发明利用纳米探针和电化学细胞传感器结合,构建一种可靠、操作简便、可重复性强的肝癌单细胞体系,通过电化学计时电流法测定其电流值判断单个细胞受毒素刺激后的受损情况,从而快速、有效地评价真菌毒素细胞毒性。
[0007]
本发明的第一个目的是提供一种用于单细胞电化学传感的功能化纳米探针,所述功能化纳米探针的构建方法包括如下过程:将毛细管拉制成纳米显微针,在显微针针尖上沉积金纳米粒子制成纳米探针;然后将普鲁士蓝沉积在所得纳米探针上,获得功能化纳米探针。
[0008]
在本发明的一种实施方式中,所述沉积金纳米粒子的过程是将显微针针尖浸泡在含氯金酸的硫酸溶液中,初始电位-0.25v,沉积15-20s。
[0009]
在本发明的一种实施方式中,所述硫酸溶液中氯金酸的浓度为1mmol
·
l-1
;硫酸的浓度为0.5mol
·
l-1
。
[0010]
在本发明的一种实施方式中,普鲁士蓝沉积的过程为:在含有0.1m hcl,2mm fecl3,0.1m kcl和2mm k3[fe(cn)6]的电镀液中电化学沉积;电位在0.2~-0.6v之间循环50个周期。
[0011]
在本发明的一种实施方式中,所述功能化纳米探针的针尖半径为200-400nm。
[0012]
在本发明的一种实施方式中,所述纳米探针的具体过程包括:初始拉制尖口开端为200nm;电镀金纳米粒子50-100nm,初始点位-0.25v,时间20s;探针尖端露出1-2cm金层作为电化学感应部分。
[0013]
在本发明的一种实施方式中,所述功能化纳米探针的制备方法具体包括:
[0014]
(1)将玻璃毛细管采用拉针仪拉制出的纳米显微针,通过电沉积法在待表征的针尖上镀约金纳米粒子,在电极外层采用pdms绝缘,用apiezon蜡包裹纳米探针表面,尖端露出金层作为电化学感应部分;
[0015]
(2)通过电化学沉积普鲁士蓝对纳米探针进行进一步修饰,电位循环50个周期,用去离子水冲洗普鲁士蓝修饰的纳米探针,并在室温下干燥。
[0016]
本发明的第二个目的是提供一种单细胞电化学传感器,所述单细胞电化学传感器的工作电极为上述的功能化纳米探针。
[0017]
本发明的第三个目的是提供一种单细胞毒性检测方法,所述方法是利用上述功能化纳米探针
[0018]
将上述功能化纳米探针夹持在显微操作系统上进行自动化操控,直接刺入细胞进
行电化学检测。
[0019]
在本发明的一种实施方式中,所述单细胞电化学传感器是对单个细胞进行直接电化学检测。
[0020]
在本发明的一种实施方式中,所述细胞为人肝癌细胞hepg2。
[0021]
在本发明的一种实施方式中,所述检测方法是将功能化纳米探针定位于一个单独细胞的细胞上,且距离其他细胞至500μm。
[0022]
本发明的第四个目的是提供一种利用上述的单细胞电化学传感器检测a类单端孢霉烯族t-2毒素毒性的方法,所述方法为:将毒素标准物质用mem细胞培养液稀释成梯度浓度溶液,加入细胞培养皿中,5min后进行电化学检测,利用电化学计时电流法it分析毒素的细胞毒性。
[0023]
本发明的一种实施方式中,所述电化学计时电流法it分析毒素的细胞毒性的过程包括:
[0024]
利用不同浓度的h2o2标准样品的浓度值与单细胞电化学传感器输出的电流值构建标准曲线a;然后在利用不同浓度的毒素标样的浓度值与h2o2浓度值构建标准曲线b;通过检测待测样的电流值,基于标准曲线a、b,测得待测样中毒素的浓度。
[0025]
本发明的一种实施方式中,所述的单细胞传感器在应用之前需要先进行细胞培养,具体操作为:将对数生长期的细胞进行1:5传代,放入37℃、二氧化碳浓度5%、湿度95%培养箱中孵育6~12h;将毒素标准物质用mem细胞培养液稀释成梯度浓度溶液,分别加入培养皿中,5min后进行电化学检测。
[0026]
在本发明的一种实施方式中,所述的电流信号是在autolab pgstat302n电化学工作站测得,采集工作信号600mv。
[0027]
在本发明的一种实施方式中,所述的过氧化氢检测之前需要对确定浓度的过氧化氢溶液进行浓度与电流值的标准曲线绘制。
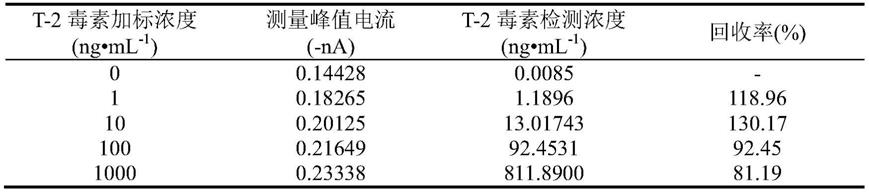
[0028]
在本发明的一种实施方式中,所述的单细胞检测采用微操作系统sensapex ump在倒置显微镜下进行。
[0029]
在本发明的一种实施方式中,所述的t-2毒素评价是对细胞中产生的活性氧,特别是过氧化氢进行检测。
[0030]
本发明的第五个目的是所述的单细胞电化学传感器在非疾病的诊断和治疗的药物开发、毒理学测试、纳米环境实时监测领域的应用。
[0031]
与现有技术相比,本发明具有如下优势:
[0032]
(1)本发明采用修饰功能化的纳米探针,可以特异性的检测细胞中过氧化氢,从而使所制备的传感器对毒素的检测具有更高的灵敏性和更低的检测限。
[0033]
(2)本发明采用纳米电极由于其体积小,可将穿透活细胞过程中的损伤降至最低,进行单细胞内测量,可以对毒素进行实时信号检测。
[0034]
(3)本发明的单细胞传感器可对真菌毒素t-2毒素毒性作用程度进行评价。一直以来,我国粮食、饲料受到真菌毒素的污染严重,本发明可以评价单一毒素的细胞毒性,还可以进一步判断其机理类型,可为相关检测标准确定提供参考依据。
[0035]
(4)本发明通过功能化纳米探针与单细胞电化学传感领域合理结合,构建了单细胞电化学检测体系,该方法操作便捷、可靠、灵敏,为评价真菌毒素毒性纳米环境评价提供
一种新方法、新思路,有望应用于食品安全、生物医药等领域。
附图说明
[0036]
图1:基于功能化纳米探针的单细胞电化学传感器流程示意图。
[0037]
图2:功能化纳米电极构建表征图。其中,a为纳米电极电镜表征图;b为普鲁士蓝修饰前后的电化学表征。
[0038]
图3:稳态电流对h2o2浓度的校准图。插图显示了1nm-100nm h2o2与峰值电流的线性关系。
[0039]
图4:单细胞电化学传感器评价t-2毒素检测结果。其中,a为a.1ppb,b.10ppb,c.100ppb,d.1ppm,e.0ppb(对照组)t-2毒素刺激的细胞实时计时电流图(探针在35s时刺入单个细胞中),插图是纳米探针渗透到单个hepg2细胞中的光学显微照片;b为hepg2单细胞传感器检测t-2毒素的峰值电流(n=4)。p<0.05=*,p<0.005=**,p<0.001=***,p<0.0001=****,以下相同;c为通过单细胞电化学传感检测到的t-2毒素刺激细胞的峰值电流值对应h2o2浓度,并进行线性拟合。.
[0040]
图5:cck8法评价细胞增殖活性的实验结果。
[0041]
图6:dcfh-da荧光法评价细胞内活性氧的实验结果。a为hepg2细胞内活性氧测定获得的荧光强度;b为hepg2细胞中活性氧荧光图像。
[0042]
图7:1ppbt-2毒素刺激hepg2单细胞的实时计时电流图(纳米探针在0s穿透单个细胞,t-2毒素在60秒时加入培养皿)。
[0043]
图8:a.通过gelma/aunps/gce细胞电化学传感检测到t-2毒素刺激的hepg2细胞的dpv曲线,t-2毒素浓度从下到上依次为0ppb,1ppb,2ppb,5ppb,10ppb,20ppb,100ppb,200ppb,500ppb,1pppm,2pppm;b.gelma/aunps/gce多细胞电化学传感器检测的t-2毒素刺激细胞峰值电流的线性拟合。
[0044]
图9:不同镀金时间对纳米探针信号影响的dvp曲线。
[0045]
图10:修饰普鲁士蓝不同循环周期对纳米探针影响的计时电流曲线。
具体实施方式
[0046]
以下对本发明的优选实施例进行说明,应当理解实施例是为了更好地解释本发明,不用于限制本发明。
[0047]
实施例1单细胞电化学传感器的制备
[0048]
一种基于功能化纳米探针构建单细胞电化学传感器的方法(图1),包括以下步骤:
[0049]
(1)细胞培养:将hepg2人肝癌细胞用含有10%胎牛血清和1%的100μg/ml青霉素-链霉素的mem培养液,于饱和湿度5%co2的37℃恒温培养箱中进行培养。细胞为贴壁生长,每隔3天更换培养液一次,当细胞覆盖瓶底面积90%时,可传代培养。
[0050]
(2)纳米探针的制备:将玻璃毛细管采用拉针仪拉制出尖端开口约200nm的纳米显微针,通过电沉积法在待表征的针尖上镀约50-100nm的金纳米粒子(将纳米探针浸泡在含1mmol
·
l-1
氯金酸的0.5mol
·
l-1
硫酸溶液中,初始电位-0.25v,20秒),在电极外层采用pdms绝缘,用apiezon蜡包裹纳米探针表面,尖端露出1-2cm au层作为电化学感应部分。
[0051]
(3)功能化纳米探针的修饰:在含有0.1m hcl,2mm fecl3,0.1m kcl和2mm k3[fe
(cn)6]的沉积液中通过电化学沉积普鲁士蓝(pb)对纳米探针进行进一步修饰。电位在0.2~-0.6v之间循环50个周期。然后用去离子水冲洗pb修饰的纳米探针,并在室温下干燥。
[0052]
制备好的功能化纳米探针采用扫描电子显微镜表征(图2a)。纳米探针尖端直径在200-400nm范围内。
[0053]
利用chi660e电化学工作站测试循环伏安图表征,探针尖端在2.5mm fe(cn)
63-/4-和1.0m kcl电解液中进行,参比电极和辅助电极分别是ag电极和pt电极,循环电压为-0.1~0.6v,扫描速度为0.1v/s。对比修饰前后氧化还原信号,图2b显示在pb修饰后在~-0.1v出现特征信号峰,还原峰响应为pb到普鲁士白(pw)的转化,这对于h2o2的电催化是必需的,pw作为电子传递介质具有还原h2o2的功能,表明pb成功沉积在纳米探针上。
[0054]
用纳米探针对不同浓度的h2o2溶液在0.6v电压下进行电流信号采集,图3为对应的校准曲线,在0.1μm~100μm h2o2与电流值成线性,r
12
=0.98841,插图为1nm~100nm h2o2与电信号的线性关系,r
22
=0.97385。
[0055]
实施例2基于功能化纳米探针的单细胞电化学传感器的应用
[0056]
将实施例1得到的单细胞电化学传感器进行真菌毒素t-2毒素的单细胞毒性的评价,具体如下:
[0057]
(1)药物刺激:移除培养皿中原有的培养液,将毒素标准物质用mem细胞培养液稀释成梯度浓度溶液,然后将0ppb、1ppb、10ppb、100ppb、1ppmt-2毒素加在细胞培养皿中,5min后对其进行单细胞电化学检测。
[0058]
(2)电化学信号值检测:电流信号是在autolab pgstat302n电化学工作站上采用计时电流法于室温下测得,采集工作信号600mv。所有电化学实验均采用传统三电极体系,工作电极定位于一个单独细胞的细胞上,且距离其他细胞至少500μm。单细胞检测采用微操作系统sensapex ump在倒置显微镜下进行。pb修饰后的金纳米探针通过微操系统扎入hepg2细胞中。
[0059]
以空气为空白对照,在600mv(vs-ag/agcl)的固定电位下记录了不同浓度t-2对细胞刺激的计时电流图。空白减法后,绘制电流与浓度的关系图,以获得线性图并得到检测限。检测限的计算方程如(1)所示:
[0060][0061]
其中,sd为最低浓度标准差,slope为曲线的拟合斜率。
[0062]
(3)结果判断
[0063]
如图4a所示,在600mv时,纳米探针位于远离细胞的位置,然后逐渐接近并在约35秒时穿透细胞。不同浓度t-2毒素刺激的细胞中出现不同的阴极电流尖峰。对照组细胞的峰值电流为-0.14na,1ppm t-2毒素刺激的细胞的峰值电流达到-0.24na。图4b显示了每个峰值和控制组之间的显著差异。t-2毒素的浓度越高,峰值电流越高。此电流信号表明,在t-2毒素的刺激下,hepg2细胞不同程度地表现出氧化应激,产生h2o2并促使探针产生反应,导致电化学信号发生变化。将t-2毒素浓度与h2o2浓度对应并对其进行线性拟合图4c,由t-2毒素刺激的h2o2细胞在1ppb-1ppm下产生的h2o2浓度呈线性相关,r2=0.99055,检测限为0.13807ng/ml,检测浓度最低为1ng/ml。
[0064]
(4)样品加标实验
[0065]
在面粉上进行了样品添加实验,并以以下浓度添加了t-2毒素:0、1、10、100、1000ppb(表1)。基于单细胞电化学传感的样品的平均加标回收率为81.19%-130.17%,表明该方法具有较高的准确度和检测效率,可用于实际样品中t-2毒素的检测。
[0066]
表1样品加标回收结果
[0067][0068]
实施例3验证实验
[0069]
cck8法检测t-2毒素作用后的细胞毒性:将密度为5
×
104个/ml的人肝癌细胞hepg2贴壁接种到96孔板中,培养24h后去除培养液,加入100μl与实施例2中相同剂量的毒素溶液。毒素刺激24h后,吸出上清每孔加入100μl含10%cck8的培养液,37℃孵育2h,然后在450nm下利用酶标仪测定吸光度值,并计算细胞活性抑制率,计算方法如下:
[0070][0071]
其中,od
加药
:毒素刺激24h后的吸光度值,od
0加药
:无毒素刺激24h后的吸光度值,od
空白
:纯细胞培养液的吸光度值。
[0072]
由图5可知,实施例1构建的单细胞电化学传感器评价t-2毒素细胞毒性的测定结构与传统细胞毒理学方法测定的结果一致性较好,能够有效判断毒素的细胞毒性。
[0073]
细胞内活性氧(ros)水平的测定:采用dcfh-da荧光探针来检测细胞受真菌毒素刺激后体内活性氧的水平。将hepg2细胞接种到六孔板中,待细胞贴壁进入对数生长期后,加入含不同浓度t-2毒素的完全培养液,于二氧化碳培养箱中孵育24h,弃除培养液用pbs离心洗涤并吹悬,加入终浓度为l0μmol/l的dcfh-da混匀,37℃避光孵育30min,以促使探针和细胞充分结合。最后用无血清mem培养液洗涤细胞两次,酶标仪测定其平均荧光强度(激发波长488nm,发射波长530nm),倒置荧光显微镜拍摄荧光图片。
[0074]
由图6可知,实施例1构建的单细胞电化学传感器测量确定的剂量反应关系与ros荧光测定值一致性较好,能够有效判断毒素的细胞毒性。
[0075]
实施例4单细胞电化学传感实时监测
[0076]
电化学传感器可以轻松地量化目标并进一步分析实时数据以获得关键参数的生化过程。为了实现对细胞生化过程的实时监控,将纳米探针与细胞质接触,并将1ppb t-2毒素添加到培养皿中。图7表明,在t-2毒素刺激后,通过单细胞电化学传感检测到单个hepg2细胞中h2o2的实时电流轨迹。当在大约60s的时间内将t-2毒素添加到培养皿中进行刺激时,刺激后20s电流值增加。与对照组相比,实验组在刺激后约70s出现了明显的峰值电流。当达到峰值电流时,电流稳定1-5min,然后逐渐减小。通过平衡ros产生和通过ros清除系统消除ros来控制细胞的氧化还原平衡。
[0077]
对照例1
[0078]
将实施例1的单细胞电化学传感调整为多细胞电化学传感:
[0079]
将经过清洗和抛光的玻碳电极(gce)浸入含有1mm haucl4的0.5m h2so4溶液中,并使用电势控制库仑法(电势为-0.25v,100s)进行电沉积。将修饰的电极放置在电解质中以进行cv扫描。循环电压为-0.6
–
0.6v,扫描速度为0.1v/s。消化后的细胞悬液与明胶-甲基丙烯酰基(gelma)水凝胶混合,以确保106细胞/ml的浓度。随后将6μl的混合物添加到电极表面。用光固定后,将不同浓度的t-2毒素刺激8小时,并进行gelma/aunp/gce的电化学检测(图8a)。并线性拟合峰值电流(图8b)。在10ppb-1ppm范围内t-2毒素浓度与峰值电流具有良好的线性关系,r2=0.9776,最低检测浓度为10ng/ml。
[0080]
结果表明,与传统的使用玻碳电极的多细胞电化学检测相比,单细胞电化学检测对t-2毒素检测操作更便捷、效率更快、更灵敏。
[0081]
实施例5金沉积工艺对传感器的影响
[0082]
参照实施例1,替换金沉积工艺为:优化金沉积时间,将纳米探针浸泡在1mmol
·
l-1氯金酸和0.5mol
·
l-1硫酸溶液中,初始电位-0.25,分别电沉积5s、10s、15s、20s、25s、30s,通过dpv检测镀金电极电信号,并通过纳米探针刺入细胞观察细胞形态的变化。
[0083]
其他条件不变,制得相应的功能化纳米探针。
[0084]
参照实施例2,如图9所示,镀金时间越长,dpv显示峰值电流越大。但是将镀金后的纳米探针刺入细胞,镀金时间25s、30s的纳米探针对细胞有明显损伤,细胞刺入后有明显凹陷,说明镀金时间过长使探针直径过大,所以选取镀金时间20s。
[0085]
实施例6普鲁士蓝沉积工艺对传感器的影响
[0086]
参照实施例1,替换普鲁士蓝沉积工艺为:优化普鲁士蓝沉积周期,含有0.1m hcl,2mm fecl3,0.1m kcl和2mm k3[fe(cn)6]的电镀液中通过电化学沉积普鲁士蓝(pb)对纳米探针进行进一步修饰。电位在0.2~-0.6v之间分别循环10、20、50、100、150个周期。通过计时电流分析法检测20μm h2o2。
[0087]
其他条件不变,制得相应的功能化纳米探针。
[0088]
参照实施例2,如图10所示,循环周期越多,测得过氧化氢的电流值越大,到50周期以上时,电流值趋于稳定,因此选用循环50个周期作为普鲁士蓝修饰条件。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1