一种新型冠状病毒IgM抗体的元素质谱法检测试剂盒的制作方法
一种新型冠状病毒igm抗体的元素质谱法检测试剂盒
技术领域
1.本发明涉及体外诊断试剂技术领域,具体涉及一种新型冠状病毒igm抗体的元素质谱法检测试剂盒。
背景技术:
2.2019新型冠状病毒,正式命名为sars
‑
ncov
‑
2019,也称“新冠病毒”,属于有包膜的β属冠状病毒,其遗传物质为单条正义rna链,该rna由表面布满刺突蛋白(s protein)的蛋白质外壳包裹,这些刺突蛋白使新冠病毒具有高度传染性。新冠病毒具有人传人的能力,其传播途径包括呼吸道飞沫传播及接触传播、可以透过直接接触带有病毒的分泌物传染,而且当前对于新冠病毒所致疾病没有特异治疗方法。
3.因此,有必要针对新冠病毒开发检测体系来满足临床需要。目前已开发出的诊断试剂盒按检测目标可以分为两类,一类是检测病毒的核酸,一类是检测病毒的抗体。但是这些诊断试剂盒还存在下述不足,以致无法完全满足防疫及临床工作的需求,特别是流行病学调查普检的需求:核酸检测试剂盒的特异性接近100%,但由于取样困难等原因导致灵敏度偏低,仅为30%
‑
50%,即存在较多的漏检;使用s蛋白、n蛋白等sars
‑
ncov
‑
2019组成蛋白的抗体检测试剂盒的灵敏度可达95%以上,但由于原理缺陷导致特异性偏低,特别是对于一些疾病的患者,其体内的非sars
‑
ncov
‑
2019抗体也能被这些组成蛋白识别,即存在较多的误检。
技术实现要素:
4.为了解决上述技术问题,本发明旨在提供一种能够实现降低检测成本,缩短检测时间,提高检测灵敏度及线性范围的新型冠状病毒检测方法。
5.第一方面,本发明要求保护一种新型冠状病毒igm抗体的元素质谱法检测试剂盒。
6.本发明所要求保护的新型冠状病毒igm抗体的元素质谱法检测试剂盒,含有:
7.(1)包被有新型冠状病毒抗原的酶标板;
8.(2)经镧系元素标记的抗人igm抗体标记物。
9.其中,所述经镧系元素标记的抗人igm抗体标记物是镧系元素
‑
螯合剂与抗人igm抗体反应得到的(即是通过螯合剂将所述镧系元素标记到所述抗人igm抗体上的)。
10.所述镧系元素包括但不限于铥(tm)、镥(lu)。所述螯合剂包括但不限于二乙基三胺五乙酸(dtpa)。
11.在本发明的具体实施方式中,所述镧系元素为镥(lu);所述螯合剂为二乙基三胺五乙酸(dtpa)。
12.在本发明的具体实施方式中,所述经镧系元素标记的抗人igm抗体标记物是将所述抗人igm抗体与dtpa
‑
lu反应得到的。反应过程中,所述抗人igm抗体与dtpa
‑
lu加量比为1:10(摩尔比),反应温度为25℃,反应时间为18h。
13.其中,所述dtpa
‑
lu可按照包括如下步骤的方法制备得到:将螯合剂(dtpa)与
lucl3按照摩尔比1:2的比例反应得到dtpa
‑
lu。反应条件可为:25℃反应30min。
14.进一步地,所述试剂盒还可包括如下中的全部或部分:
15.(3)免疫缓冲液;
16.所述免疫缓冲液的组成如下:每升所述免疫缓冲液中含有钠盐酪蛋白4
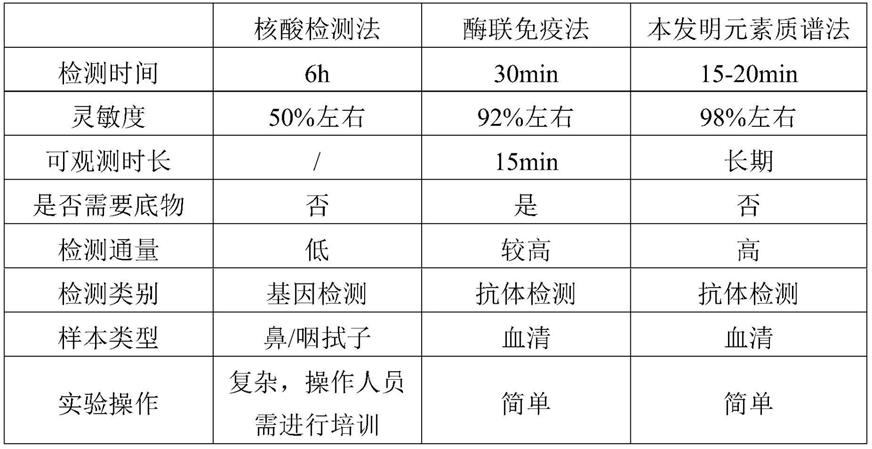
‑
6g(如5g)、蔗糖45
‑
55g(如50g)、鱼皮明胶1.8
‑
2.2g(如2g)、proclin
‑
300液体900
‑
1100μl(如1000μl)、吐温20液体900
‑
1100μl(如1000μl),余量为ph值为7.8的tris
‑
hcl溶液。
17.在本发明的具体实施方式中,所述ph值为7.8的tris
‑
hcl溶液按照包括如下步骤的方法制备得到:三羟甲基氨基甲烷(tris)56
‑
66g(如60.57g)和氯化钠85
‑
95g(如90g)加入800ml去离子水中充分搅拌使其完全溶解,加盐酸溶液调节溶液ph值为7.8,加入去离子水定容至1l,得到tris
‑
hcl溶液。
18.(4)浓缩清洗液(10倍浓缩清洗液);
19.所述浓缩清洗液的溶剂为水,溶质及其浓度为三羟甲基氨基甲烷(tris)60.57g/l、氯化钠90g/l、吐温20 500μl/l;加盐酸溶液调节ph值为7.8。
20.(5)解离液;
21.所述解离液为采用1%(体积比)的稀硝酸溶液配制的re浓度为1ng/ml的溶液。所述铼(re)为电感耦合等离子体质谱(icp
‑
ms)的内标元素。
22.在所述试剂盒中,包被在酶标板中的所述新型冠状病毒抗原可为新型冠状病毒表面蛋白(s蛋白)受体结合区(rbd)。
23.根据需要,所述试剂盒中还可含有封闭液。
24.所述封闭液的溶剂可为水,溶质及浓度可如下:kcl 0.4g/l、kh2po
4 0.48g/l、na2hpo
4 2.88g/l、nacl 16g/l,bsa 10g/l、钠盐酪蛋白10g/l、蔗糖50g/l、0.1%(体积百分含量)的proclin
‑
300。
25.所述包被有新型冠状病毒抗原的酶标板具体可按照包括如下步骤的方法制备:将所述新型冠状病毒抗原使用0.02
‑
0.05m(如0.02m)碳酸盐缓冲液稀释至1
‑
3μg/ml(如1μg/ml),将其加入到酶标板中,在4℃条件下包被20小时。包被完成后,还可包括进行封闭的步骤。
26.在所述试剂盒中,所述抗人igm抗体可为鼠源抗人igm抗体。
27.在本发明的具体实施方式中,所述鼠源抗人igm抗体具体为北京百奥莱博公司产品,鼠抗人igm(μ链)抗体,货号为f010204。
28.第二方面,本发明要求保护一种用于检测待测样本是否被新型冠状病毒感染的系统。
29.本发明所要求保护的用于检测待测样本是否被新型冠状病毒感染的系统,含有前文所述的试剂盒和数据处理装置。
30.所述数据处理装置可包括如下模块:
31.(a1)数据采集模块;所述数据采集模块被配置为接收待测样本经前文所述试剂盒利用电感耦合等离子体质谱检测所得的s/co值;所述s/co值为所述待测样本的检测浓度值/cutoff值;所述cutoff值为0.9。
32.其中,所述检测浓度值为标记抗人igm抗体的镧系元素与内标元素的响应值的比例。
33.(a2)数据比较模块;所述数据比较模块被配置为接收来自所述数据采集模块的所述待测者的所述s/co值,并将其与数值1进行比较。
34.(a3)结果判定模块;所述结构判定模块被配置为接收来自所述数据比较模块的比较结果,然后根据预定条件对结果进行判定。
35.进一步地,所述预定条件为:若所述待测者的所述s/co值≥1,则判定所述待测样本为阳性(即所述待测样本含有新型冠状病毒igm抗体,所述待测样本被新型冠状病毒感染);若所述待测者的所述s/co值<1,则判定所述待测样本为阴性(即所述待测样本不含有新型冠状病毒igm抗体,所述待测样本未被新型冠状病毒感染)。
36.第三方面,本发明要求保护前文所述的试剂盒或前文所述的系统在如下任一中的应用:
37.p1、检测待测样本中是否含有新型冠状病毒igm抗体;
38.p2、制备用于检测新型冠状病毒的产品;
39.p3、制备用于诊断covid
‑
19的产品。
40.其中,p1所述应用可为非疾病诊断治疗性应用,如单纯性检测血液制品(如血清)中是否含有新型冠状病毒igm抗体。
41.在上述各方面中,所述待测样本可为离体的人血液样本或血清样本。
42.在上述各方面中,所述新型冠状病毒均指sars
‑
ncov
‑
2019。
43.包被有新型冠状病毒抗原的酶标板,其固相载体可为96孔的透明微孔板,孔间变异不超过10%,功能性:配对其他合格的组分,能确保新型冠状病毒抗体的阴性参考品符合率、阳性参考品符合率、精密度、检出限。储存于4℃。
44.镥(lu)标记的鼠抗人igm抗体,需满足外观澄清透明,无沉淀,无浑浊。功能性:配对其他合格的组分,能确保新型冠状病毒抗体的阴性参考品符合率、阳性参考品符合率、精密度、检出限。储存于4℃。
45.阴性参考品:对20份阴性参考品进行检测,不得出现假阳性。阳性参考品:对5份阳性参考品进行检测,不得出现假阴性。
46.与现有技术相比,本发明有益效果在于:本方法使用了元素质谱法,大大缩短了反应时间,同时具备准确性高、特异性强、灵敏度高、线性范围宽及检测稳定且方便的优点。此试剂盒同样可以实现大通量检测,满足不同城市的人流量的检测需求。
47.相对于现有技术,本发明所述的一种新型冠状病毒igm的元素质谱法检测试剂盒,具有以下优势:
48.效果对比数据如表1所示。
49.表1、效果对比数据
50.附图说明
51.图1为本发明roc曲线。
具体实施方式
52.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
53.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
54.实施例1、新型冠状病毒igm抗体的元素质谱法检测试剂盒的制备
55.本发明所提供的新型冠状病毒igm抗体的元素质谱法检测试剂盒包括包被有新型冠状病毒抗原的酶标板、经镧系元素镥标记的鼠抗人igm抗体标记物、免疫缓冲液、浓缩清洗液、解离液、封闭液。
56.一、各种溶液的配制
57.1、免疫缓冲液
58.①
称取三羟甲基氨基甲烷(tris)60.57g和氯化钠90g加入800ml去离子水中充分搅拌使其完全溶解得到溶液;
59.②
加盐酸溶液调节溶液ph值为7.8,加入去离子水定容至1l,得到tris
‑
hcl溶液;
60.③
称取钠盐酪蛋白5g、蔗糖50g、鱼皮明胶2g加入tris
‑
hcl搅拌充分溶解;
61.④
加proclin
‑
300液体1000μl和吐温20液体1000μl于溶液中,搅拌均匀,使其充分溶解;
62.⑤
加入tris
‑
hcl溶液定容至1l。
63.2、浓缩清洗液
64.①
称取三羟甲基氨基甲烷(tris)60.57g和氯化钠90g加入800ml去离子水中充分搅拌使其完全溶解得到溶液;
65.②
加盐酸溶液调节溶液ph值为7.8;
66.③
加吐温20液体500μl于步骤
②
溶液中,搅拌均匀,使其充分溶解;
67.④
去离子水定容至1l,常温环境下保存。
68.上述制备的是10倍浓缩清洗液,使用时将10倍浓缩清洗液用纯化水按照1:10稀释(100ml浓缩清洗液加900ml纯化水),得到1
×
清洗液。若洗液有结晶,将洗液置于室温,或37℃待结晶溶解后再进行稀释。
69.3、解离液
70.解离液为re浓度为1ng/ml的溶液,该溶液采用1%(体积比)的稀硝酸溶液配制。铼(re)为电感耦合等离子体质谱(icp
‑
ms)的内标元素。
71.4.pbs封闭液
72.①
称取kcl 0.4g、kh2po
4 0.48g、na2hpo
4 2.88g、nacl 16g,加入去离子水800ml溶解;
73.②
加10g bsa、10g钠盐酪蛋白、50g蔗糖和0.1%(体积百分含量)的proclin
‑
300;
74.③
加去离子水定容至1l。
75.5.探针的制备.
76.将螯合剂(dtpa)与lucl3按照摩尔比1:2的比例加样,25℃反应30min,得到dtpa
‑
lu。
77.二、包被有新型冠状病毒抗原的酶标板的制备
78.酶标板的固相载体为96孔的透明微孔板,孔间变异不超过10%,功能性:配对其他合格的组分,能确保新型冠状病毒抗体的阴性参考品符合率、阳性参考品符合率、精密度、检出限。储存于4℃。
79.①
将新型冠状病毒抗原(吉纳邦盛2019
‑
ncov
‑
s
‑
rbdc
‑
mfc
‑
ag,ag0016)使用0.02m碳酸盐缓冲液稀释至1μg/ml,将其加入到酶标板中,在4℃条件下包被20小时。
80.②
包被完成后,弃去孔内液体,用稀释后的1
×
清洗液洗板,加入pbs封闭液在37℃条件下封闭2小时。
81.③
装入铝箔袋并放入适当干燥剂,贴标签,在4℃条件下密封保存。
82.三、经镧系元素镥(lu)标记的鼠抗人igm抗体标记物的制备
83.①
将鼠抗人igm抗体(北京百奥莱博鼠抗人igm(μ链)抗体f010204)置于25kd截留量的透析袋中,以0.05m碳酸盐缓冲液为透析液,分别在2小时,4小时,8小时置换三分之二的透析液,至24小时后收集透析好的抗体。
84.②
将透析好的抗体与0.1m碳酸盐缓冲液及dtpa
‑
lu混合,新冠抗体与镥加量比为1:10(摩尔比),25℃反应18小时。
85.③
标记溶液过夜后,经0.05m tris
‑
hcl缓冲液平衡的凝胶柱层析纯化,在a280检测收集第一峰,并分装。
86.四、喷码、贴标签,组装成成品试剂盒
87.实施例2、新型冠状病毒igm抗体的元素质谱法检测试剂盒的使用方法
88.一、将试剂盒各组分在室温下平衡(18
‑
25℃)。
89.二、配液:将10倍浓缩洗液用纯化水按照1:10稀释(100ml浓缩洗液加900ml纯化水),得到1
×
清洗液。若洗液有结晶,将洗液置于室温,或37℃待结晶溶解后再进行稀释。
90.三、样品分析过程
91.1、将待检样本用免疫缓冲液按照1:200体积比稀释,混匀,涡旋混匀仪混匀3秒。
92.2、根据实验需要取出适量的包被有新型冠状病毒抗原的酶标板。设置阳性对照及阴性对照各两孔,其余为待检样本孔。
93.3、每孔加入50μl稀释后的样本,以及阴性、阳性对照样品。
94.阳性对照样品:新冠血清质控,万博生物,货号abncovn001。
95.阴性对照样品:正常人血清。
96.4、手动轻轻晃动摇匀,使用封板膜将各样品孔封好,于37℃温箱中反应30分钟。
97.5、反应完成后,揭开封板膜,弃去反应液并拍干,手动加入1
×
清洗液,每孔洗液不得少于200μl,弃去洗液,重复洗板五次。也可使用洗板机进行洗涤。
98.6、洗板完成后,每孔加入50μl浓度为0.1mg/ml的lu元素标记的鼠抗人igm抗体。
99.7、手动轻轻晃动摇匀,使用封板膜将各样品孔封好,于37℃温箱中反应15分钟。
100.8、反应完成后,揭开封板膜,弃去反应液并拍干,手动加入1
×
清洗液,每孔洗液不得少于200μl,弃去洗液,重复洗板五次。也可使用洗板机进行洗涤。
101.9、每孔加入解离液100μl,解离5分钟
102.10、解离完成后,将样品上机检测。即步骤9处理后的样本导入到电感耦合等离子体质谱(icp
‑
ms)中进行检测,采集镧系元素lu和内标元素re的响应值—相应离子每秒计数值(cps),得到lu与内标元素re的响应值比值lu/re,即样品检测浓度值。根据lu/re的比值(即检测浓度值)进一步计算s/co,s/co是指lu/re的比值再比上cutoff值。
103.实施例3、新型冠状病毒igm抗体的元素质谱法检测试剂盒的应用实例
104.1、供试样本:5例临床上确诊的新型冠状病毒(sars
‑
ncov
‑
2019)阳性患者血清;20例临床上确诊的新型冠状病毒(sars
‑
ncov
‑
2019)阴性患者血清。
105.以下检测使用仪器:电感耦合等离子质谱仪。型号:icap q。生产厂家:thermo scientific。
106.2、精密度设计要求:
107.精密度参考品n:阴性检出率应为100%,(n=20);
108.精密度参考品l:阳性检出率应≥95%,(n=20);
109.精密度参考品cv值:阳性检出率应为100%,且cv值≤10%,(n=20)。
110.3、试验方法
111.批内精密度:检测精密度参考品,使参考品平行测定20次,计算阴性检出率及阳性检出率。结果应符合精密度设计要求。
112.变异系数:cv=sd/av
×
100%;
113.其中cv为变异系数,sd为检测结果的标准差,av为检测结果的平均值。
114.4、结果
115.根据检验结果使用spss软件进行roc曲线分析,具体结果如表2所示,roc曲线分析图如图1所示。样本s/co≥1,检测结果判定为新型冠状病毒阳性(即待测样本中含有新型冠状病毒igm抗体,所述待测样本被新型冠状病毒感染);样本s/co<1,检测结果判定为新型冠状病毒阴性(即待测样本中不含有新型冠状病毒igm抗体,所述待测样本未被新型冠状病毒感染)。通过roc曲线确定试剂盒在不同的cutoff值情况下,试剂盒精密度的体现,筛选出
最优cutoff值为0.9。
116.roc曲线分析结果显示曲线下面积为0.936,表明本发明所述试剂盒在临床诊断中准确性较高。
117.表2、roc曲线分析结果
[0118][0119]
在最优cutoff值(0.9)下,各供试样本的阴性、阳性符合率及精密度检测数据如表3所示。
[0120]
表3、各供试样本的阴性、阳性符合率及精密度检测数据(cutoff值=0.9)
[0121]
[0122]
[0123][0124]
注:表中,p1
‑
p5表示5例临床上确诊的新型冠状病毒(sars
‑
ncov
‑
2019)阳性患者血清;n1
‑
n20表示20例临床上确诊的新型冠状病毒(sars
‑
ncov
‑
2019)阴性患者血清。
[0125]
在最优cutoff值(0.9)下,新型冠状病毒感染检测结果(部分)如表4和表5所示。可见本发明试剂盒检测结果与核酸检测结果一致。
[0126]
表4、部分新型冠状病毒感染阴性检测结果(cutoff值=0.9)
[0127]
[0128][0129]
表5、部分新型冠状病毒感染阳性检测结果(cutoff值=0.9)
[0130]
样品编号性别年龄诊断lu/re比值s/coigm判断核酸ts
‑
009男66阳性5.816.458659675++ts
‑
037男89阳性6.116.790554662++ts
‑
066女73阳性6.427.129781349++ts
‑
073男62阳性14.9416.59795238++ts
‑
129女87阳性8.008.892336581++ts
‑
187男19阳性28.7931.99265++ts
‑
243男2阳性2.452.719894231++ts
‑
259女26阳性1.972.191490166++ts
‑
332男37阳性2.172.406055065++ts
‑
451女48阳性6.327.023279621++
[0131]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1