新型冠状病毒抗体检测试剂盒及其制备方法与应用与流程
[0001]
本发明是关于一种血清学检测新型冠状病毒抗体的方法,具体地说,是关于一种检测新型冠状病毒igg和igm抗体的荧光免疫检测试剂盒及其制备方法与应用,属于细胞生物学和免疫检验技术领域。
背景技术:
[0002]
新型冠状病毒sars-cov-2 (2019-ncov)是2019年新发现的一种病毒,可导致人类病毒性肺炎或肺部感染。它包含四种主要的结构蛋白:刺突蛋白(spike protein,s蛋白),核衣壳蛋白(nucleocapsid,n蛋白),膜蛋白(membrane protein,m蛋白),包膜蛋白(envelope protein,e蛋白)。s蛋白是冠状病毒非常重要的表面蛋白,与病毒的传染能力密切相关,s蛋白包含s1、s2和受体结合域(rbd)。n蛋白在冠状病毒中含量丰富,是一种高度免疫原性蛋白,参与基因组复制和细胞信号通路调节。被新型冠状病毒感染后,人体会产生相应的特异性抗体进行防御,其中特异性抗体igm最早产生并进行早期防御,随后产生igg抗体。igm抗体多在发病3-5天后开始出现阳性,可提示近期感染。igg抗体是再次免疫应答产生的主要抗体,通常提示病情进入恢复期或存在既往感染。新型冠状病毒感染的血清学检测便是通过检测血液样本中s蛋白和n蛋白的特异性抗体igm和igg的存在及含量,来间接判断体内有无病毒及病毒感染情况。目前,在国家卫生健康委员会已发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》中也明确提出:在原有诊疗方案的基础上增加了血清学检测,作为确诊病例和疑似病例的诊断依据之一。
[0003]
此外,在新型冠状病毒疫苗的评估过程中,因疫苗本身的限制,并不能百分之百保护接种者(临床保护数据:moderna mrna疫苗 94.5%,biontech mrna疫苗 95%,阿斯利康腺病毒疫苗62%-90%),对于疫苗本身的效价,以及疫苗接种后的保护效力,都有必要进行评估。对于sars-cov-2而言,直接针对s蛋白的中和抗体才能够中和病毒的毒力、阻止病毒对机体的感染。但是这并不意味着针对其他部分的抗体无效,包含n蛋白或者其他非结构蛋白的疫苗抗原也许可以诱导机体产生更为均衡的体液免疫和t细胞免疫应答。因此接种疫苗后,血清中s蛋白和n蛋白的特异性抗体igm和igg的存在和滴度也是新型冠状疫苗评估指标之一。
[0004]
目前用于血清学检测新型冠状病毒抗体的方法包括酶联免疫法(elisa)、胶体金免疫层析法法、s-flow流式检测和荧光素酶免疫沉淀法。elisa法操作简单且较为常见,此方法灵敏度相对高,载体标准化难度较低,但是检测速度慢、易污染、步骤较为繁琐。胶体金法特点是无需特殊处理标本,操作简单,用时短,无需检测仪器,对检测技术对人员、场所的限制较低,可广泛应用于基层医疗单位及现场检测,然而胶体金法对结果的确定只能是定性检测,无法定量,也无法进行抗体滴度比较。s-flow流式检测是基于过表达s蛋白的293t细胞株建立的,受细胞培养条件和细胞状态的限制,并且只能检测s蛋白的抗体,无法同时兼顾n蛋白抗体的检测。荧光素酶免疫沉淀法是将荧光素酶偶联在s蛋白或n蛋白上,抗体与蛋白结合后,再通过能够与抗体fc段结合的磁珠将荧光素酶-s蛋白或n蛋白-抗体复合物沉
淀下来,使用荧光素酶底物显色试剂盒进行显色检测,此方法操作繁琐,而且检测灵敏度较elisa和s-flow低。
[0005]
因此,关于新型冠状病毒igg和igm抗体检测分析方法仍需进一步研发。
技术实现要素:
[0006]
本发明的一个目的是提供一种检测新型冠状病毒igg和igm抗体的试剂盒。
[0007]
本发明的另一目的是提供一种检测新型冠状病毒igg和igm抗体的新方法(含非诊断目的的检测方法)。
[0008]
具体而言,一方面,本发明提供检测新型冠状病毒igg和igm抗体的试剂盒,其是一种新型冠状病毒抗体的荧光免疫检测试剂盒,所述试剂盒包括:igg结合分子,抗 igm 抗体,荧光标记的新型冠状病毒s1蛋白,荧光标记的新型冠状病毒n蛋白,s1蛋白的 higg 抗体阳性标准品,n蛋白的 higg 抗体阳性标准品,s1蛋白的 higm 抗体阳性标准品,n蛋白的 higm抗体阳性标准品,阴性对照 higg 抗体样品,阴性对照 higm 抗体样品;其中,所述igg结合分子负载于第一纳米颗粒上,所述抗igm抗体负载于第二纳米颗粒上,所述第一纳米颗粒与第二纳米颗粒粒径不同。
[0009]
根据本发明的具体实施方案,本发明的试剂盒中,所述第一纳米颗粒、第二纳米颗粒各自独立地为非磁性纳米颗粒或磁性纳米颗粒,各纳米颗粒粒径1-30μm,并且,第一纳米颗粒与第二纳米颗粒的粒径差为2-20μm,可被流式细胞仪区分。纳米颗粒的材质可以是所属领域中任何可行的材质,例如可以是水凝胶颗粒。
[0010]
根据本发明的具体实施方案,本发明的试剂盒中,所述igg结合分子可以为protein g、protein a、protein l或抗igg的抗体;所述抗igm抗体为抗人源 igm 的鼠源单克隆抗体或抗igm的其他种属单克隆抗体或多克隆抗体。
[0011]
根据本发明的具体实施方案,本发明的试剂盒中,所述荧光标记的新型冠状病毒s1蛋白为荧光标记的新型冠状病毒s-trimer蛋白或荧光标记的新型冠状病毒s1蛋白的rbd。
[0012]
根据本发明的具体实施方案,本发明的试剂盒中,所述荧光标记的新型冠状病毒s1蛋白所用的荧光染料包括pe、fitc、apc或alexa flour染料等荧光素中的一种或多种;荧光标记的新型冠状病毒n蛋白中所用的荧光染料为fitc、pe、apc或 alexa flour等荧光素中的一种或多种。在本发明的优选的具体实施方案中,标记新型冠状病毒s1蛋白与标记新型冠状病毒n蛋白的荧光染料不同,例如,所述荧光标记的新型冠状病毒s1蛋白为pe标记的新型冠状病毒s1蛋白;荧光标记的新型冠状病毒n蛋白为fitc标记的新型冠状病毒n蛋白。
[0013]
根据本发明的具体实施方案,本发明的试剂盒中:s1蛋白的 higg抗体阳性标准品,为抗新型冠状病毒s1蛋白的人igg1亚型单克隆抗体,或为抗新型冠状病毒s1蛋白人源igg型多克隆抗体;n蛋白的 higg抗体阳性标准品,为抗新型冠状病毒n蛋白的人igg1亚型单克隆抗体,或为抗新型冠状病毒n蛋白人源igg型多克隆抗体;s1蛋白的 higm 抗体阳性标准品, 为抗新型冠状病毒s1蛋白的人igm亚型单克隆抗体,或为抗新型冠状病毒s1蛋白人源igm型多克隆抗体;
n蛋白的 higm抗体阳性标准品,为抗新型冠状病毒n蛋白的人igm亚型单克隆抗体,或为抗新型冠状病毒n蛋白人源igg型多克隆抗体;阴性对照higg抗体样品(higg同型对照样品),为与新型冠状病毒s1蛋白和新型冠状病毒n蛋白无结合的人源免疫球蛋白igg;阴性对照higm抗体样品(higm同型对照样品),为与新型冠状病毒s1蛋白和n蛋白无结合的人源免疫球蛋白igm;所述试剂盒还包括最低检出限参考品,其为8~20份不同发病时间的新型冠状病毒igg和igm抗体阳性血清样本灭活后混合得到的,检测时按照比例稀释使用。
[0014]
根据本发明的具体实施方案,本发明的试剂盒,其中还包括流式检测缓冲液,所述流式检测缓冲液为含有0.5-2% bsa蛋白的0.01m磷酸盐缓冲液,ph7.4。
[0015]
本发明的试剂盒可用于同时检测新型冠状病毒s1蛋白和n蛋白的igg和igm抗体。
[0016]
另一方面,本发明还提供了一种利用本发明的试剂盒进行非诊断目的的新型冠状病毒抗体检测方法,其包括:分别取负载igg结合分子的纳米颗粒和负载抗 igm 抗体的纳米颗粒加入反应管内,加入流式检测缓冲液洗涤,加入荧光标记的新型冠病毒s1蛋白、荧光标记的新型冠状病毒n蛋白和待测样品,于4℃孵育20min~1h;用流式检测缓冲液洗涤后,加入pbs液重悬细胞,进行流式检测。
[0017]
本发明检测原理如下:igg结合分子能够特异性结合所有人igg亚型型免疫球蛋白的fc段,而不结合人iga、igd、ige 和igm,因此负载igg结合分子的纳米颗粒能够捕获待测样品中的人igg型抗体。如果捕获的igg抗体中含有抗s1蛋白的抗体,就能够与荧光(例如pe)标记的新型冠病毒s1蛋白结合,进而将pe标记在第一纳米颗粒上,通流式细胞仪检测就能检测到pe的荧光强度信号;如果igg结合分子捕获的igg蛋白是抗n蛋白的抗体,就能够与荧光(例如fitc)标记的新型冠病毒n蛋白结合,进而将fitc标记在第二纳米颗粒上,通流式细胞仪检测就能检测到fitc的荧光强度信号;如果捕获的igg抗体中没有抗s1蛋白抗体或抗n蛋白的抗体,第一纳米颗粒就不能被标记上pe或fitc,流式检测不到荧光信号。第二纳米颗粒表面的抗人源 igm抗体为特异性行识别人igm的μ链的鼠源单克隆抗体,与iga、igd、ige 和igg无较差反应,同理如果待测样品中含有igm型的抗s1蛋白的抗体或抗n蛋白的抗体,第二纳米颗粒就会被标记上pe和fitc,可被流式细胞仪检测到荧光强度信号。待测样品中抗体的浓度和亲和力与荧光强度信号成正相关。此外,第一纳米颗粒与第二纳米颗粒的粒径大小不同,通过流式细胞仪的前向散射光测定就可将其二者区分。所以此方法可同时检测待测样品中的s1蛋白和n蛋白的igm和igg抗体的存在和滴度。
[0018]
在本发明的一些具体实施方案中,负载igg结合分子的纳米颗粒为磁珠
ⅰ-
protein g,磁珠i粒径为2.8μm,采用缓冲液保存,缓冲液为含0.03% 叠氮钠的0.01m磷酸盐缓冲液,ph7.4,使用量为10μl/样品。
[0019]
在本发明的一些具体实施方案中,负载抗人源igm抗体的纳米颗粒为磁珠
ⅱ-
抗人源igm抗体,磁珠ii粒径为10μm,采用缓冲液保存,缓冲液为含0.03% 叠氮钠的0.01m磷酸盐缓冲液,ph7.4,使用量为10μl/样品。
[0020]
在本发明的一些具体实施方案中,优选地,所述pe标记的新型冠状病毒s1蛋白,使用量为1μg/样品。
[0021]
在本发明的一些具体实施方案中,优选地,所述fitc标记的新型冠状病毒n蛋白,使用量为0.5μg/样品。
[0022]
在本发明的一些具体实施方案中,优选地,本发明所用s1蛋白的 higg 抗体阳性标准品、n蛋白的 higg抗体阳性标准品,s蛋白的 higm 抗体阳性标准品、n蛋白的 higm抗体阳性标准品,均为从新冠康复患者体内获取可变区序列并使用hek293细胞重组表达获得。
[0023]
在本发明的一些具体实施方案中,优选地,本发明所用 higg 同型对照样品和 higm 同型对照样品均为本实验室重组表达,且通过流式和 elisa 验证均与新型冠状病毒s1蛋白和新型冠状病毒n蛋白无非特异性结合。
[0024]
在本发明的一些具体实施方案中,优选地,最低检出限参考品的3个最佳浓度稀释梯度:l1应检为阳性,稀释比例为1:100;l2可检为阳性或阴性,稀释比例为1:300;l3应检出阴性,稀释比例为1:500。
[0025]
在本发明的一些具体实施方案中,优选地,所述流式检测缓冲液为含有0.5-2% bsa蛋白的0.01m磷酸盐缓冲液,ph7.4。
[0026]
在本发明的一些优选具体实施方案中,本发明提供的新型冠状病毒igg和igm抗体检测方法包括:分别取10μl负载protein g的第一纳米颗粒和负载抗 igm 抗体的第二纳米颗粒加入反应管内,加入200μl 流式检测缓冲液洗涤1次,加入50μl 稀释后的pe标记的新型冠病毒s1蛋白、50μl 稀释后的fitc标记的新型冠状病毒n蛋白 和50μl稀释后的待测样品,于4℃孵育0.5h;用流式检测缓冲液洗涤3次后,加入200μl pbs重悬细胞,进行流式检测。
[0027]
借由上述技术方案,本发明至少具有下列优点及有益效果:本发明以粒径不同的两种纳米颗粒作为载体,通过流式细胞仪进行结果分析,既可同时分析s蛋白的抗体和n蛋白的抗体,又能区分两种蛋白各自的抗体类型(igg和igm),可同时检测同一份待测样本中四种抗体,检测效率高,待测样品用量少,这是已有的elisa法,s-flow法和荧光素酶免疫沉淀法无法实现的。胶体金法虽然可以实现同时检测igg和igm两种不同抗体,但其不能定量分析,本发明中待测样品中抗体的浓度和亲和力与荧光强度信号成正相关,进而可对待测样品中抗体的滴度进行分析,这也弥补胶体金法检测的不足。
[0028]
本发明中通过检测荧光信号来评估抗体滴度,这较elisa中通过hrp酶活信号检测更为灵敏,较荧光素酶免疫沉淀法操作更简单。
[0029]
本发明中用纳米颗粒作为载体,不受细胞培养条件和细胞状态限制,又使用protein g和抗igm抗体捕获待测抗体,因此与s-flow法对比,使用更方便、操作更简单,重复性更好,灵敏度更高。
[0030]
本发明提供的快速评估新型冠状病毒抗体的分析方法,是对现有新型冠状病毒抗体检测技术的有益补充和提高。即可应用于判断体内有无病毒及病毒感染情况,又可用于新型冠状病毒疫苗接种后的免疫反应的评估。
附图说明
[0031]
图1为本发明中磁珠ⅰ和磁珠ⅱ流式示意图。
[0032]
图2显示本发明新型冠病毒抗体检测流式图案例。
具体实施方式
[0033]
为了更清楚地理解本发明,现参照下列实施例及附图进一步描述本发明。实施例仅用于解释而不以任何方式限制本发明。实施例中未注明具体条件的实验方法为所属领域熟知的常规方法和常规条件,或按照制造商所建议的条件。若未特别指明,实施例中所用原料均为市售商品。
[0034]
本发明实施例所用组分中磁珠
ⅰ-
protein g(invitrogen,cat.no.1009d)为直接购买的市售商品。
[0035]
本发明实施例所用组分磁珠
ⅱ-
抗人源igm抗体是本实验室通过常规小鼠杂交瘤方法筛选到特异性抗人源igm抗体,经表面等离子共振 (spr)技术(biacore t200))检测其与人源igm蛋白的亲和力为0.5-1nm水平。扩大杂交瘤细胞生产抗体,将纯化后的抗体按pureproteome
™ꢀ
nhs flexibind magnetic bead system(sigma, cat.no. lskmagn04 )使用说明偶联到nhs-磁珠上获得磁珠
ⅱ-
抗人源igm抗体。
[0036]
本发明实施例所用pe标记的新型冠状病毒s1蛋白(acrobiosystems,cat.no. spn-c52h9)和fitc标记的新型冠状病毒n蛋白(acrobiosystems,cat.no. nun-c51h9)均为本实验通过真核细胞hek293细胞表达,再通过常规偶联方法标记上pe和fitc荧光素获得。
[0037]
本发明实施例所用s1蛋白的 higg 抗体阳性标准品、s蛋白的 higm 抗体阳性标准品、为从新冠康复患者体内获取可变区序列并使用hek293细胞重组表达获得,两个抗体的可变区相同,恒定区分别为人源igg1和igm。可变区序列为:vh:evqlqqsgaelvrpgasvklsctasgfnikddymhwvkqrpeqglewigwidpdngdteyaskfqgkatitadtssntaylqlssltsedtavyycttliyyygsnsdywgqgttltvss(seq id no. 1)vl:diqmtqspsslsaslggkvtitckasqdinkyiawyqhkpgkgprllihytstlqpgipsrfsgsgsgrdysfsisnlepediatyyclqydnlprtfgggtkleik(seq id no. 2)。
[0038]
本发明实施例所用n蛋白的 higg抗体阳性标准品, n蛋白的 higm抗体阳性标准品,为从新冠康复患者体内获取可变区序列并使用hek293细胞重组表达获得。n蛋白的 higg 抗体阳性标准品和n蛋白的 higm 抗体阳性标准品所用抗体的可变区相同,恒定区分别为人源igg1和igm。可变区序列为: vh:evqlvesgaevkasgaavkvsckasggtfssyaiswvrqapgqglewmggiipifgtanyaqkfqgrvtitadegaytmymelsslrsedtavyycarggwadggnkgwyfdlwgrgtmvtvss(seq id no. 3)vl:divmtqspsslstsvndrvtitcrasqsissylnwyqqrpgkapklliyaasslqsgvpsrfsgsgsgaddtltisslqpedfataacqqsystpptfgqgtkveik(seq id no. 4)。
[0039]
本发明实施例所用阴性对照 higg 抗体样品(acrobiosytems,cat.no. dn1-h5257) 。阴性对照 higm 抗体样品为本实验室使用hek293细胞重组表达,其可变区与阴性对照 higg 抗体样品(acrobiosytems,cat.no. dn1-h5257)相同,恒定区改为igm亚型,且通过流式和 elisa 验证均与新型冠状病毒s1蛋白和新型冠状病毒n蛋白无非特异性结合。
[0040]
本发明实施例中待测样品的稀释、磁珠洗涤均使用流式检测缓冲液,其组成为含有0.5-2% bsa蛋白的0.01m磷酸盐缓冲液,ph7.4。
[0041]
本发明实施例中,确定每个待测样品对应pe标记的新型冠状病毒s1蛋白的量为0.1μg,对应 fitc标记的新型冠状病毒n蛋白使用量为0.05μg。
[0042]
本发明实施例中,所用最低检出限参考品为10份不同发病时间的新型冠状病毒
igg和igm抗体阳性血清样本,灭活后混合,通过优化实验条件,获得3个最佳浓度稀释梯度,l1应检为阳性,l2可检为阳性或阴性,l3应检出阴性。
[0043]
本发明采用流式细胞仪检测新型冠状病毒抗体的磁珠免疫荧光方法,并进行灵敏度、特异性和精密度的优化。
[0044]
实施例1、新型冠状病毒抗体检测试剂盒构建本实施例提供的新型冠状病毒抗体的磁珠荧光免疫检测试剂盒,规格为100test,包括如下组分:1. 磁珠
ⅰ-
protein g,规格为1ml;磁珠i粒径为2.8μm,采用缓冲液保存,缓冲液为含0.03% 叠氮钠的0.01m磷酸盐缓冲液,ph7.4,使用量为10μl/样品;2. 磁珠
ⅱ-
抗人源 igm抗体,规格为1ml;磁珠ii粒径为10μm,采用缓冲液保存,缓冲液为含0.03% 叠氮钠的0.01m磷酸盐缓冲液,ph7.4,使用量为10μl/样品;3. pe标记的新型冠状病毒s1蛋白,冻干粉形式,1瓶,规格为10μg;4. fitc标记的新型冠状病毒n蛋白,为冻干粉形式,1瓶,规格为5μg;5. s蛋白的 higg 抗体阳性标准品,为冻干粉形式,1瓶,规格为10μg;6. n蛋白的 higg 抗体阳性标准品,为冻干粉形式,1瓶,规格为10μg;7. s蛋白的 higm抗体阳性标准品,为冻干粉形式,1瓶,规格为10μg;8. n蛋白的 higm抗体阳性标准品,为冻干粉形式,1瓶,规格为10μg;9. higg 同型对照样品,为冻干粉形式,1瓶,规格为10μg;10. higm 同型对照样品,为冻干粉形式,1瓶,规格为10μg;11. 最低检测限参考品,规格为100μl。
[0045]
12. 流式检测缓冲液:2% bsa蛋白的0.01m磷酸盐缓冲液,1瓶,规格为200ml。
[0046]
实施例2、试剂盒操作方法实施例1的试剂盒使用时,操作方法如下:1. 取pe标记的新型冠状病毒s1蛋白,加入100μl无菌超纯去离子水重构,浓度为100μg/ml,使用流式检测缓冲液配制浓度为2μg/ml工作液,备用。
[0047]
2. 取fitc标记的新型冠状病毒n蛋白,加入100μl无菌超纯去离子水重构,浓度为50μg/ml,使用流式检测缓冲液配制浓度为1μg/ml工作液,备用。
[0048]
3. 抗体阳性标品和抗体同型对照样品,均加入100μl无菌超纯去离子水重构,浓度为100μg/ml,再使用流式检测缓冲液稀释一系列浓度梯度,推荐浓度为0.003μg/ml,0.03μg/ml,0.3μg/ml和3μg/ml,备用。
[0049]
4. 取最低检测限参考品,使用流式检测缓冲液按1:100、1:300和1:500稀释成工作液,备用。
[0050]
5. 将磁珠
ⅰ-
protein g和磁珠
ⅱ-
抗人源 igm抗体分别吹打均匀,分别取10μl置于1.5ml 离心管内或96孔u型板的孔内,加入200μl 流式检测缓冲液,吹打均匀,使用磁力器或离心(1000rpm,5min),弃上清液,备用。
[0051]
6. 向含有混合磁珠的离心管内或96孔u型板的孔内分别加入50μl 稀释后的pe标记的新型冠病毒s1蛋白、50μl 稀释后的fitc标记的新型冠状病毒n蛋白 和50μl稀释后的待测样品,于4℃孵育0.5h。
[0052]
7. 孵育后使用磁力器或离心(1000rpm,5min),弃上清液,加200μl 流式检测缓冲
液,洗涤3次后,弃上清液。
[0053]
8. 向含反应管或板孔内,加入200μl pbs 重悬磁珠,并转移至流式上样管内,进行流式检测。
[0054]
9. 保存fcs格式文件,拷贝于装备流式分析软件的电脑上,进行数据分析。
[0055]
本发明的磁珠ⅰ和磁珠ⅱ流式图见图1。新型冠病毒抗体检测流式图参见图2。
[0056]
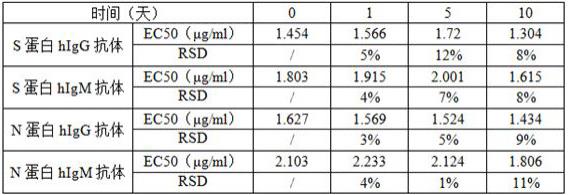
实施例3、加速稳定性验证将实施例2的试剂盒分别置于37℃存放0、1、5、10天,再对新型冠状病毒抗体阳性标准品进行检测,每个样品8个浓度梯度,对检测数据进行统计分析,可接受标准为:与对照组(0小时组)比较,ec
50
值的rsd值≤20.0%。不同时间测定结果见表1,与对照组比较,ec50值的rsd均小于20%,试剂盒在-20℃下至少可保存12个月。
[0057]
表1 试剂盒加速稳定性实验结果实施例4、冻融稳定性验证将实施例2的试剂盒中冻干组分重构后,按每管20μl进行分装,置于-70℃分别冻融1、2、3次,再对新型冠状病毒抗体阳性标准液样品进行检测,每个样品8个浓度梯度,对检测数据进行统计分析,可接受标准为:与对照组(0小时组)比较,ec50值的rsd值≤20.0%。不同时间测定结果见表2,与对照组比较,ec50值的rsd均小于20%,冻融3次对该试剂盒检测结果无影响。
[0058]
表2 试剂盒组分冻融稳定性实验结果实施例5、专属性验证按实施例2试剂盒中的操作方法,在稀释样品的流式检测缓冲液中添加0,10%,20%和50%的正常人血清配制含人血清基质的稀释液,分别用这些稀释液去配制新型冠状病毒抗体阳性标准品,每个样品8个浓度梯度,进行实验检测后对数据进行分析,可接受标准为:与
对照组(流式检测缓冲液组)的检测数据进行比较,ec
50
值的rsd值≤20.0%。检测结果见表3,ec
50
之间的rsd值,均≤20.0%,证明该检测方法不受人血清成分感染,专属性强,可用于人血清样本检测。
[0059]
表3 检测方法的专属性检测结果实施例6、检测方法精密度验证按实施例2试剂盒中的操作方法,由2名操作人员不同天各自独立检测3份新型冠状病毒抗体阳性标准品,每个样品8个浓度梯度,对检测数据进行统计分析,可接受标准为:6组检测数据的ec50值的rsd值均≤20.0%。检测结果见表4,由该6组数据计算ec50值的rsd值为19%,小于20.0%,证明该检测方法有重复性和中间精密度良好。
[0060]
表4 检测方法的重复性与中间精密度的检测结果虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1