一种区分R-联萘酚及其同分异构体S-联萘酚的方法
一种区分r
‑
联萘酚及其同分异构体s
‑
联萘酚的方法
技术领域
1.本发明涉及一种区分方法,具体地说是一种四氮杂十四环二烯镍配合物[nil](clo4)2催化的非线性化学体系对r
‑
联萘酚及其同分异构体s
‑
联萘酚的区分方法,属于定性分析化学领域。
背景技术:
[0002]
联萘酚是典型的手性化合物, 具有很强的面不对称性, 易于拆分成高纯度的对映体, 已成功的应用于诱导一些不对称合成反应。手性化合物是有机化合物的一个特殊种类, 它是包含一个和多个不对称原子而形成的旋光性化合物, 某些手性化合物是优良的植物生长激素、除草剂和杀虫剂。在农作物培养方面发挥着很大的作用。因此, 手性化合物的分析是区别于一般化学工业技术的高技术领域, 也是当今化学前沿非常活跃的领域。我国的化学试剂供应短缺已成为发展化学研究的瓶颈, 手性化学试剂及其相关化合物更是如此, 几乎完全依赖进口, 为了摆脱进口依赖和赶上发达国家在这一领域的发展趋势,我国相关机构对手性药物及其化合物的合成研究已逐渐开展,该领域的研究已经迅速发展起来。因此, 对具有代表性的手性化合物联萘酚进行研究是有意义的。r
‑
联萘酚与s
‑
联萘酚在我们的生产生活中扮演着举足轻重的角色。r
‑
联萘酚在不对称选择性还原中常作为酮类的助剂、手性钛催化剂中的配体、用于立体选择性反应:如乙醛酸反应和diels
‑
alder反应、用于催化硫化物不对称氧化为亚砜的反应中的手性助剂、生成手性镧系三氟甲磺酸,作为催化剂,应用于不对称diels
‑
alder反应;r
‑
联萘酚也常用于合成多种手性试剂。此类同分异构体很难区分,目前常用的检测r
‑
联萘酚及其同分异构体s
‑
联萘酚的方法主要有薄层色谱法,气相色谱法,分光光度法,高效液相色谱法。但是区分两者的鉴别方法还未被报道出来,因此寻找一种区分效果好且操作简便快速,结果容易判断的定性分析方法就显得十分必要。两者结构式如式(1) r
‑
联萘酚
ꢀꢀꢀꢀꢀꢀꢀ
s
‑
联萘酚
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(1)结构式 1r
‑
联萘酚和s
‑
联萘酚结构。
技术实现要素:
[0003]
本发明旨在为r
‑
联萘酚及其同分异构体s
‑
联萘酚提供一种新颖且方便快捷的区分方法,即应用[nil](clo4)2催化的非线性化学振荡体系对r
‑
联萘酚及其同分异构体s
‑
联萘酚的区分方法,本区分方法是基于该配合物催化的非线性化学振荡体系对r
‑
联萘酚及其
同分异构体s
‑
联萘酚的敏锐响应而开发的一种电化学振荡体系法。具体地说,是将相同浓度待区分样品(含有r
‑
联萘酚及其同分异构体s
‑
联萘酚的溶液)分别加入到两组振荡体系中,根据待区分样品对振荡体系的振荡图谱影响不同,实现对待区分样品的定性分析:若加入待区分溶液后,体系的振荡受到抑制,经过一段较长的抑制时间(t
in
)后恢复振荡,则所加入的待区分样品为r
‑
联萘酚;若加入待区分溶液后,体系的振荡受到抑制,经过一段较短的抑制时间(t
in
)后恢复振荡,则所加入的待区分样品为s
‑
联萘酚。
[0004]
本发明处理样品时间短,测定条件简单易控制便于推广和应用。
[0005]
本发明解决技术问题,采用如下技术方案:本发明为r
‑
联萘酚及其同分异构体s
‑
联萘酚提供了区分方法,其特点在于:以乙醇为溶剂,配制含有r
‑
联萘酚及其同分异构体s
‑
联萘酚的待区分样品的溶液;应用“h2so
4 –ꢀ
kio3‑ꢀ
[nil](clo4)
2 –
丙二酸
‑
h2o
2”非线性化学振荡体系作为区分溶液,记录振荡体系的振荡图谱,任意一个稳定的电位最低点处,向振荡体系中加入待区分样品的溶液,根据待区分样品对振荡体系的振荡图谱的影响不同,实现对待区分样品的定性分析;向两组区分溶液(非线性体系)中,分别加入待区分样品(含有r
‑
联萘酚及其同分异构体s
‑
联萘酚的溶液)溶液。若加入待区分溶液后,体系的振荡受到抑制,经过一段较长的抑制时间(t
in
)后恢复振荡,则所加入的待区分样品为r
‑
联萘酚;若加入待区分溶液后,体系的振荡受到抑制,经过一段较短的抑制时间(t
in
)后恢复振荡,则所加入的待区分样品为s
‑
联萘酚;所述振荡产生的任意一个稳定的电位最低点是指振荡产生的第7~21个电位最低点中的任意一个。
[0006]
本发明所称的四氮杂十四环二烯镍配合物是5, 7, 7, 12, 14, 14
‑
六甲基
‑
1, 4, 8, 11
‑
四氮杂十四
‑
4, 11
‑
二烯为配体的四氮杂大环镍()配合物,结构式如式(2)所示,并记作[nil](clo4)2,l即为5,7,7,12,14,14
‑
六甲基
‑
1,4,8,11
‑
四氮杂十四
‑
4,11
‑
二烯;
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2)本配合物的结构与生命体内肌红蛋白、血红蛋白、叶绿素以及一些金属酶的关键结构卟啉环很相似,这种以[nil](clo4)2催化的化学振荡反应与植物和动物细胞内的生化振荡类似。所以,该体系具有稳定的振荡振幅、较长的振荡寿命及对r
‑
联萘酚及其同分异构体s
‑
联萘酚的敏锐响应。
[0007]
[nil](clo4)2的制备分两步:1) 制备l
·
2hclo4; 2) 由l
·
2hclo4制备[nil](clo4)2。
[0008]
1) 制备l
·
2hclo4:将98.5ml乙二胺装入一只500ml三颈瓶中,在冰浴条件下,120分钟内搅拌下缓慢
amplifier)连接到数据采集器,再连接至电脑,打开电脑中logger lite程序对采集时间和取样速度进行设置后,迅速点击开始键从而对溶液进行电位监测,得到所采集的e
‑
t曲线(电位值随时间变化的曲线)即化学电位振荡图谱(此时尚未加入待测试样),以作空白对照。向两组与空白对照实验中的各组分浓度相同的区分溶液中,在振荡产生的任意一个稳定的电位最低点处,分别迅速加入待区分样品的溶液,根据待区分样品对振荡体系的振荡图谱的影响不同,实现对待区分样品的定性分析。即:在向振荡体系中加入待区分样品的溶液后,根据待区分样品会使振荡体系受到的抑制时间长短不同的现象,实现对待区分样品的定性分析。
[0015]
化学电位振荡图谱的基本参数包括:抑制期(或称抑制时间,t
in
):从加入待测液振荡受到抑制开始,到振荡重新恢复所需时间。
[0016]
振荡振幅:在振荡过程中从一个最低电位到下一个最高电位之间的电位差值。
[0017]
振荡周期:在振荡过程中从一个最低(高)电位到下一个最低(高)电位所需时间。
[0018]
最高电位:稳定振荡时体系出现的电位最高点。
[0019]
最低电位:稳定振荡时体系出现的电位最低点。
附图说明
[0020]
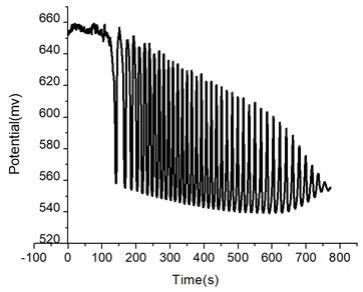
图1是实施例1中,未加入待区分样品时,区分溶液(振荡体系)的振荡图谱。
[0021]
图2是实施例1中,加入1.25
×
10
‑6mol/lr
‑
联萘酚溶液后,振荡体系所获得的振荡响应图谱。
[0022]
图3是实施例1中,加入1.25
×
10
‑6mol/ls
‑
联萘酚溶液后,振荡体系所获得的振荡响应图谱。
[0023]
图4是实施例2中,未加入待区分样品时,区分溶液(振荡体系)的振荡图谱。
[0024]
图5是实施例2中,加入 2.5
×
10
‑6mol/lr
‑
联萘酚溶液后,区分溶液(振荡体系)的振荡图谱。
[0025]
图6是实施例2中,加入2.5
×
10
‑6mol/ls
‑
联萘酚溶液后,区分溶液(振荡体系)的振荡图谱。
[0026]
图7是实施3中,未加入待区分样品时,区分溶液(振荡体系)的振荡图谱。
[0027]
图8是实施例3中,加入 6.25
×
10
‑6mol/lr
‑
联萘酚溶液后,区分溶液(振荡体系)的振荡图谱。
[0028]
图9是实施例3中,加入6.25
×
10
‑6mol/ls
‑
联萘酚溶液后,区分溶液(振荡体系)的振荡图谱。
具体实施方式
[0029]
实施例1:本实施例按如下步骤验证本发明r
‑
联萘酚及其同分异构体s
‑
联萘酚的区分方法的可行性:(1) 配制首先用98%的浓硫酸和蒸馏水配制0.02mol/l的硫酸作为储备液,然后用0.02mol/
l的硫酸溶液分别配制0.10mol/l的碘酸钾溶液、0.05mol/l的[nil](clo4)2溶液、1.57mol/l的丙二酸溶液、4.1mol/l的过氧化氢溶液。向50ml小烧杯中依次加入11.0ml 0.02mol/l硫酸溶液、6.5ml 0.10mol/l碘酸钾溶液、3.5ml 0.05mol/l [nil](clo4)2溶液、4.0ml 1.57mol/l丙二酸溶液和15.0ml 4.1mol/l过氧化氢溶液,以保证“h2so
4 ‑ꢀ
kio
3 ‑ꢀ
[nil](clo4)
2 ‑
丙二酸
ꢀ‑ꢀ
h2o
2”非线性化学振荡体系中各组分的浓度为硫酸0.00658mol/l、碘酸钾0.0135mol/l、[nil](clo4)
2 0.0052436mol/l、丙二酸0.157mol/l、过氧化氢1.5348mol/l;同时以乙醇作溶剂,分别配制 1.25
×
10
‑6mol/lr
‑
联萘酚、s
‑
联萘酚的溶液。
[0030]
(2) 振荡图谱振荡体系的振荡图谱由装有logger lite程序的计算机记录,图1是在典型浓度下(硫酸0.00658mol/l、碘酸钾0.0135mol/l、[nil](clo4)
2 0.0052436mol/l、丙二酸0.157mol/l、过氧化氢1.5348mol/l),上述区分溶液未加入待测试样的振荡图谱,以作空白对照。向两组各组分浓度与上述浓度相同的区分溶液中,分别加入50
µ
l 0.001mol/l的r
‑
联萘酚及其同分异构体s
‑
联萘酚的溶液,使得其在区分溶液中的浓度均为1.25
×
10
‑6mol/l,当时间处在第7个电位最低点时,所获得的振荡响应图谱分别如图2、图3所示。
[0031]
(3) 区分r
‑
联萘酚及其同分异构体s
‑
联萘酚由于r
‑
联萘酚及其同分异构体s
‑
联萘酚的性质不同,r
‑
联萘酚及其同分异构体s
‑
联萘酚对振荡体系的影响不相同。将图2、图3分别与图1相比较可知, r
‑
联萘酚的加入,体系的振荡受到抑制,经过一段较长的抑制时间(t
in
)后恢复振荡;s
‑
联萘酚的加入,体系的振荡受到抑制,经过一段较短的抑制时间(t
in
)后恢复振荡。由上述实验可知,通过比较r
‑
联萘酚及其同分异构体s
‑
联萘酚对图谱的影响不同,实现对r
‑
联萘酚及其同分异构体s
‑
联萘酚的区分。
[0032]
取事先配制的两个0.001mol/l待区分的r
‑
联萘酚及其同分异构体s
‑
联萘酚的溶液(但两者尚未区分),将其分别标记为样品1、样品2;配制两组各组分浓度与上述浓度相同的振荡溶液,分别采集相应的振荡图谱,并在第7个电位最低点处分别加入50
µ
l 0.001mol/l的样品1、样品2,使得它们在区分溶液中的浓度为1.25
×
10
‑6mol/l。
[0033]
分析比较可知:样品1的加入,体系的振荡受到抑制,经过一段较长的抑制时间(t
in
)后恢复振荡(振荡图谱与图2相对应、与图3不对应);样品2的加入,体系的振荡受到抑制,经过一段较短的抑制时间(t
in
)后恢复振荡(振荡图谱与图3相对应、与图2不对应)。因此,样品1是含有r
‑
联萘酚的溶液、样品2是含有s
‑
联萘酚的溶液,从而实现了对r
‑
联萘酚及其同分异构体s
‑
联萘酚溶液的区分。
[0034]
实施例2:本实施例按如下步骤验证本发明r
‑
联萘酚及其同分异构体s
‑
联萘酚的区分方法的可行性:(1) 配制首先用98%的浓硫酸和蒸馏水配制0.02mol/l的硫酸作为储备液,然后用0.02mol/l的硫酸溶液分别配制0.10mol/l的碘酸钾溶液、0.05mol/l的[nil](clo4)2溶液、1.57mol/l的丙二酸溶液、4.1mol/l的过氧化氢溶液。向50ml小烧杯中依次加入11.0ml 0.02mol/l硫
酸溶液、6.5ml 0.10mol/l碘酸钾溶液、3.5ml 0.05mol/l [nil](clo4)2溶液、4.0ml 1.57mol/l丙二酸溶液和15.0ml 4.1mol/l过氧化氢溶液,以保证“h2so
4 ‑ꢀ
kio
3 ‑ꢀ
[nil](clo4)
2 ‑
丙二酸
ꢀ‑ꢀ
h2o
2”非线性化学振荡体系中各组分的浓度为硫酸0.00658mol/l、碘酸钾0.0135mol/l、[nil](clo4)
2 0.0052436mol/l、丙二酸0.157mol/l、过氧化氢1.5348mol/l;同时以乙醇作溶剂,分别配制2.5
×
10
‑6mol/lr
‑
联萘酚、s
‑
联萘酚的溶液。
[0035]
(2) 振荡图谱振荡体系的振荡图谱由装有logger lite程序的计算机记录,图4是在典型浓度下(硫酸0.00658mol/l、碘酸钾0.0135mol/l、[nil](clo4)
2 0.0052436mol/l、丙二酸0.157mol/l、过氧化氢1.5348mol/l),上述区分溶液未加入待测试样的振荡图谱,以作空白对照。向两组各组分浓度与上述浓度相同的区分溶液中,分别加入100
µ
l 0.001mol/l的r
‑
联萘酚及其同分异构体s
‑
联萘酚的溶液,使得其在区分溶液中的浓度均为2.5
×
10
‑6mol/l,当时间处在第7个电位最低点时,所获得的振荡响应图谱分别如图5、图6所示。
[0036] (3) 区分r
‑
联萘酚及其同分异构体s
‑
联萘酚由于r
‑
联萘酚及其同分异构体s
‑
联萘酚的性质不同,r
‑
联萘酚及其同分异构体s
‑
联萘酚对振荡体系的影响不相同。将图5、图6分别与图4相比较可知, r
‑
联萘酚的加入,体系的振荡受到抑制,经过一段较长的抑制时间(t
in
)后恢复振荡;s
‑
联萘酚的加入,体系的振荡受到抑制,经过一段较短的抑制时间(t
in
)后恢复振荡。由上述实验可知,通过比较r
‑
联萘酚及其同分异构体s
‑
联萘酚对图谱的影响不同,实现对r
‑
联萘酚及其同分异构体s
‑
联萘酚的区分。
[0037]
取事先配制的两个0.001mol/l待区分的r
‑
联萘酚及其同分异构体s
‑
联萘酚的溶液(但两者尚未区分),将其分别标记为样品3、样品4;配制两组各组分浓度与上述浓度相同的振荡溶液,分别采集相应的振荡图谱,并在第7个电位最低点处分别加入100
µ
l 0.001mol/l的样品3、样品4,使得它们在区分溶液中的浓度为2.5
×
10
‑6mol/l。
[0038]
分析比较可知:样品3的加入,体系的振荡受到抑制,经过一段较长的抑制时间(t
in
)后恢复振荡(振荡图谱与图5相对应、与图6不对应);样品4的加入,体系的振荡受到抑制,经过一段较短的抑制时间(t
in
)后恢复振荡(振荡图谱与图6相对应、与图5不对应)。因此,样品3是含有r
‑
联萘酚的溶液、样品4是含有s
‑
联萘酚的溶液,从而实现了对r
‑
联萘酚及其同分异构体s
‑
联萘酚溶液的区分。
[0039]
实施例3:本实施例按如下步骤验证本发明r
‑
联萘酚及其同分异构体s
‑
联萘酚的区分方法的可行性:(1) 配制首先用98%的浓硫酸和蒸馏水配制0.02mol/l的硫酸作为储备液,然后用0.02mol/l的硫酸溶液分别配制0.10mol/l的碘酸钾溶液、0.05mol/l的[nil](clo4)2溶液、1.57mol/l的丙二酸溶液、4.1mol/l的过氧化氢溶液。向50ml小烧杯中依次加入11.0ml 0.02mol/l硫酸溶液、6.5ml 0.10mol/l碘酸钾溶液、3.5ml 0.05mol/l [nil](clo4)2溶液、4.0ml 1.57mol/l丙二酸溶液和15.0ml 4.1mol/l过氧化氢溶液,以保证“h2so
4 ‑ꢀ
kio
3 ‑ꢀ
[nil]
(clo4)
2 ‑
丙二酸
ꢀ‑ꢀ
h2o
2”非线性化学振荡体系中各组分的浓度为硫酸0.00658mol/l、碘酸钾0.0135mol/l、[nil](clo4)
2 0.0052436mol/l、丙二酸0.157mol/l、过氧化氢1.5348mol/l;同时以乙醇作溶剂,分别配制6.25
×
10
‑6mol/lr
‑
联萘酚、s
‑
联萘酚的溶液。
[0040]
(2) 振荡图谱振荡体系的振荡图谱由装有logger lite程序的计算机记录,图7是在典型浓度下(硫酸0.00658mol/l、碘酸钾0.0135mol/l、[nil](clo4)
2 0.0052436mol/l、丙二酸0.157mol/l、过氧化氢1.5348mol/l),上述区分溶液未加入待测试样的振荡图谱,以作空白对照。向两组各组分浓度与上述浓度相同的区分溶液中,分别加入50
µ
l 0.005mol/l的r
‑
联萘酚及其同分异构体s
‑
联萘酚的溶液,使得其在区分溶液中的浓度均为6.25
×
10
‑6mol/l,当时间处在第7个电位最低点时,所获得的振荡响应图谱分别如图8、图9所示。
[0041] (3) 区分r
‑
联萘酚及其同分异构体s
‑
联萘酚由于r
‑
联萘酚及其同分异构体s
‑
联萘酚的性质不同,r
‑
联萘酚及其同分异构体s
‑
联萘酚对振荡体系的影响不相同。将图8、图9分别与图7相比较可知, r
‑
联萘酚的加入,体系的振荡受到抑制,经过一段较长的抑制时间(t
in
)后恢复振荡;s
‑
联萘酚的加入,体系的振荡受到抑制,经过一段较短的抑制时间(t
in
)后恢复振荡。由上述实验可知,通过比较r
‑
联萘酚及其同分异构体s
‑
联萘酚对图谱的影响不同,实现对r
‑
联萘酚及其同分异构体s
‑
联萘酚的区分。
[0042]
取事先配制的两个0.005mol/l待区分的r
‑
联萘酚及其同分异构体s
‑
联萘酚的溶液(但两者尚未区分),将其分别标记为样品5、样品6;配制两组各组分浓度与上述浓度相同的振荡溶液,分别采集相应的振荡图谱,并在第7个电位最低点处分别加入50
µ
l 0.005mol/l的样品5、样品6,使得它们在区分溶液中的浓度为6.25
×
10
‑6mol/l。
[0043]
分析比较可知:样品5的加入,体系的振荡受到抑制,经过一段较长的抑制时间(t
in
)后恢复振荡(振荡图谱与图8相对应、与图9不对应);样品6的加入,体系的振荡受到抑制,经过一段较短的抑制时间(t
in
)后恢复振荡(振荡图谱与图9相对应、与图8不对应)。因此,样品5是含有r
‑
联萘酚的溶液、样品6是含有s
‑
联萘酚的溶液,从而实现了对r
‑
联萘酚及其同分异构体s
‑
联萘酚溶液的区分。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1