一种RNA生物芯片及其制备方法与应用
31.seq id no.10 5
’‑
gcaauagugc gaccacccuu acgaaga-3’;
32.步骤2:互补单链rna的3’端修饰巯基聚乙二醇;
33.步骤3:制备碳量子点溶液;
34.步骤4:将所述互补单链rna溶液滴加在c-au复合敏感膜的支持物上。
35.本发明的有益效果:
36.通过上述结果可知,通过将seq id no.1~10中的一种或多种互补单链rna作为受体,能够有效地捕获样品中的sars-cov-2,并能够产生明显的反馈信号,从而能够快速获取检测结果。
附图说明
37.下面结合附图对本公开作进一步的说明。
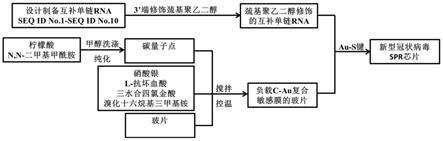
38.图1为本公开的生物芯片的制备流程图;
39.图2为本公开的示例中的生物芯片检测sars-cov-2的信号图;
40.图3为本公开的示例中的生物芯片检测不同浓度的sars-cov-2的信号图;
41.图4为经过再生后的生物芯片检测sars-cov-2的基线信号图;
42.图5为本公开中的经过不同再生次数的生物芯片检测sars-cov-2的信号图。
具体实施方式
43.下面将结合本公开实施例中的附图,对本公开实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本公开一部分实施例,而不是全部的实施例。同样,本公开中的步骤顺序与试剂及其用量仅作为举例,不应当被理解为对整个发明的限制。基于本公开中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本公开保护的范围。
44.本公开的一个示例中,涉及一种生物芯片,其包括玻片、金属膜与互补单链rna。其中,玻片作为支持物,金属膜覆盖在玻片的表面,互补单链rna键合在金属膜上。并且在本示例中,互补单链rna为seq id no.1~10中的一种或多种,其基因序列如下:
45.seq id no.1 5
’‑
acccgcuaac agugcagaag uguauugag-3’46.seq id no.2 5
’‑
caagaacaac agcccuugag acaacu-3’47.seq id no.3 5
’‑
caagaauacc acgaaagcaa gaaa-3’48.seq id no.4 5
’‑
guacgcuauu aacuauuaac guaccugucu-3’49.seq id no.5 5
’‑
ccuguuggca uaggcaaauu guagaagac-3’50.seq id no.6 5
’‑
cgcugcgaag cucccaauuu guaau-3’51.seq id no.7 5
’‑
gcacgcuagu agucgucguc ggu-3’52.seq id no.8 5
’‑
gaaauaggac uuguugugcc aucaccu-3’53.seq id no.9 5
’‑
aagccaauca aggacggguu ugaguuuu-3’54.seq id no.10 5
’‑
gcaauagugc gaccacccuu acgaaga-3’55.其中,互补单链rna根据sars-cov-2的s基因、e基因、m基因、orf3基因和orf 1ab基因序列的特异性靶点设计,以提高其与目标检测物的结合能力。
56.本公开还提出了一种制备生物芯片的方法,如图1所示,具体可以包括以下步骤:
57.步骤1:首先制备互补单链rna,该互补单链rna可以与上述示例中的互补单链rna相同。步骤2:再使用巯基聚乙二醇修饰互补单链rna的3’端。
58.步骤3:称取柠檬酸置于n,n-二甲基甲酰胺溶液中,超声20-60min充分分散溶质,其中柠檬酸的浓度为0.1-0.5mg/ml,随后将配好的柠檬酸溶液转移至高压反应釜中于120~180℃反应6~24h,反应结束后采用甲醇洗涤、纯化产物,并分散于去离子水中,即制备得到碳量子点溶液。
59.将步骤3制备得到的碳量子点溶液中转移至烧杯中,依次加入溴化十六烷基三甲基铵、三水合四氯金酸、硝酸银和l-抗坏血酸,搅拌混匀,随后将玻片浸没于溶液中,在20-40℃下搅拌反应12~24小时,以合成纳米金。随后,用乙醇和去离子水洗涤纯化,纳米金与碳量子点结合,得到附着碳量子点的纳米金膜,即c-au复合敏感膜。其中,碳量子点、三水合四氯金酸、硝酸银、l-抗坏血酸和溴化十六烷基三甲基铵的浓度范围是1:1:0.5:1.5:100~5:5:3:9:200。
60.可以理解的是,以玻璃为基质表面负载碳量子点和金纳米颗粒,形成c-au复合敏感膜能够有效降低基质噪音,优化检测效果,减少干扰信号。
61.步骤4:将步骤2制备得到的巯基聚乙二醇修饰的互补单链rna用三羟甲基氨甲烷缓冲液稀释成适当的浓度,并移取1-10μl巯基聚乙二醇修饰的互补单链rna溶液均匀的滴加于步骤3制备得到的c-au复合敏感膜的玻片上,制备得到生物芯片。其中,巯基聚乙二醇修饰的互补单链rna的浓度范围为5~50pmol。
62.另外,本公开还提出了使用上述生物芯片检测sars-cov-2的应用,具体可以采用以下步骤,将本公开中的生物芯片插入光学检测仪的样品检测腔的卡槽内,合上面板保证密闭性。将稀释成不同倍数的待测样品(10μl)置于样品瓶中置于自动进样器中,以含有4-(2-羟乙基)-1-哌嗪乙磺酸、氯化钠和吐温的缓冲液为载流,仪器温度设为37℃,流速为10μl/min,进样时间为60s,捕获时间为300s,并实时记录所有待测样品流经检测腔时光电信号的变化曲线。由于金属膜的纳米粒子的尺寸效应及量子效应通过激发光照射使得金属膜的表面等离子产生共振,从而大大增强拉曼散射信号,达到痕量检测的目的。检测得到的信号图如图2所示。
63.通过上述结果可知,通过将seq id no.1~10中的一种或多种互补单链rna作为受体,能够有效地捕获样品中的sars-cov-2,并能够产生明显的反馈信号,从而能够获取可靠的检测结果。
64.需要注意的是,上述制备方法中,仅对c-au复合敏感膜的制备方法做出有限地列举。但实际的制备过程还可以选用与等同的方法。并且,选用c-au复合敏感膜仅仅是一种示例,还可以选用其他材质的复合敏感膜。另外还可以使用金属膜与分子敏感膜的组合代替复合敏感膜。互补单链rna结合在分子敏感膜上后,同样能够实现检测的功能。
65.在上述示例中,执行检测后的生物芯片经过处理后可进行再生,即可以多次重复使用。具体再生步骤例如为,可以先将结合目标rna的本示例的生物芯片插入光学检测仪的样品检测腔的卡槽内,并将洗脱剂置换为再生液,在37℃条件下通过梯度通过酶切作用洗脱结合目标rna的本示例的生物芯片10min,制备得到再生的生物芯片。其中,再生液为双链特异性核酸酶的三羟甲基氨甲烷缓冲液,其浓度范围为0.5%(v/v);梯度洗脱的速度为1μl/min~30μl/min。
66.将再生后的生物芯片芯片插入光学检测仪的样品检测腔的卡槽内,合上面板保证密闭性。将待测样品(10μl)置于样品瓶中置于自动进样器中,以含有4-(2-羟乙基)-1-哌嗪乙磺酸、氯化钠和吐温的缓冲液为载流,仪器温度设为37℃,流速为10μl/min,进样时间为60s,捕获时间为300s,实时记录待测样品流经检测腔时光电信号的变化曲线。本示例中还提供了上述生物芯片经过1次再生、3次再生与5次再生后的监测信号对比图,如图5所示。可见,三次反馈信号中,反馈信号随再生次数增多而略有衰减,且与图4所示的再生生物芯片的基线信号相比,图5中的三次反馈信号依然较为显著,远高于0值。
67.在本说明书的描述中,参考术语“一个实施例”、“示例”、“具体示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本公开的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
68.以上显示和描述了本公开的基本原理、主要特征和本公开的优点。本行业的技术人员应该了解,本公开不受上述实施例的限制,上述实施例和说明书中描述的只是说明本公开的原理,在不脱离本公开精神和范围的前提下,本公开还会有各种变化和改进,这些变化和改进都落入要求保护的本公开范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1