一种检测糖化血红蛋白与总血红蛋白浓度比值的试剂盒及应用的制作方法
1.本发明属于预防与诊断医学检验领域,涉及免疫分析方法,具体涉及一种检测糖化血红蛋白与总血红蛋白浓度比值的试剂盒及应用。
背景技术:
2.糖尿病是一组以高血糖和糖尿为特征的代谢性疾病。糖尿病患者长期存在的高血糖症状会导致各种组织,特别是眼、肾、心脏、血管、神经的慢性损害及功能障碍。根据ada(美国糖尿病协会)的数据,中国有1.14亿糖尿病患者和1.4亿糖尿病前期人群。自1969年rahbar首次发现糖尿病患者的糖化血红蛋白升高,在余后的四十余年中,糖化血红蛋白(hba1c)逐渐成为糖尿病诊断和治疗中的一个不可或缺的监测指标。美国糖尿病协会和国际临床化学协会(ifcc)致力于用一致性、标准化、可参比的方法检测糖化血红蛋白,并规定以hba1c的百分比含量作为其检测结果。ada在2010年发布的糖尿病诊断指南中指出以hb a1c/总血红蛋白(浓度比)≥6.5%为糖化血红蛋白检测的cutoff值。准确的hb a1c检测方法将简化糖尿病诊断过程,并在一定程度上实现糖尿病的早期诊断。糖化血红蛋白的测定方法有几十种之多,目前常用的基本上可分为两大类:一类是基于糖化血红蛋白和血红蛋白的电荷不同,如离子交换层析法、电泳法;另一类是基于血红蛋白上糖化基团的结构特点,如亲和层析法、免疫法和酶法等。
3.离子交换层析法又包括常见的高效液相色谱(hplc),低相液相色谱和手工做柱法。ada和ifcc均已hplc的检测结果作为糖化血红蛋白检测的标准结果,这种方法虽然较为稳定、有参考价值且线性度好,但也有许多缺点:离子交换层析法受血红蛋白变异体和hba1c前体的干扰,血红蛋白变异体因其表面净电荷与hba1c近似,从而影响测定值。所以hplc检测前需要经过复杂的预处理步骤以除去血红蛋白变异体和hba1c前体;其次,hplc检测所需要的仪器、试剂及耗材昂贵,仅适合在大医院推广且hplc检测有较严苛的环境要求,同时hplc检测时间较长。免疫法基于抗体-抗原特异性结合的原理,又有多种不同的应用形式,主要包括免疫比浊,胶乳凝集和免疫侧向层析法。其中,免疫学法检测方法比较常见的都是采用一株糖化血红蛋白特异性抗体和一株血红蛋白特异性抗体进行检测,实际上仅可以对糖化血红蛋白进行捕获和标记,并未对总血红蛋白检测。仅对糖化血红蛋白测定会导致检测结果常常容易受到检测条件的影响而波动,如环境温度,样本处理不完全,系统误差等,因而导致免疫学的检测具有精密度不高,准确度不足等缺点。针对hba1c检测的方法学研究已经有很多年,亟需要一种准确、快速的糖化血红蛋白检测方法,既可满足糖化血红蛋白检测的国际标准,又可突破现有方法的局限,同时实现准确度、线性范围、现场即时检验(poct)等方面的需求。
技术实现要素:
4.本发明的目的在于提供一种检测糖化血红蛋白与总血红蛋白浓度比值的试剂盒,
实现在同一反应杯中对血红蛋白和糖化血红蛋白的免疫检测,准确、快速,而且准确度和精密度高。
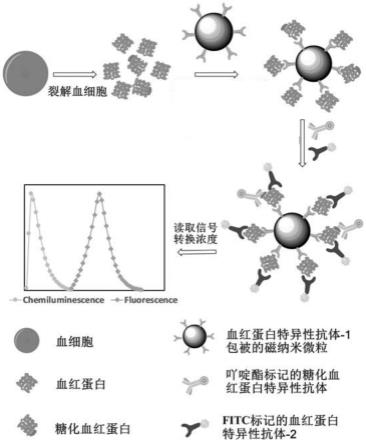
5.本发明采用的技术方案如下:一种检测糖化血红蛋白与总血红蛋白浓度比值的试剂盒,包括血红蛋白特异性抗体-1包被磁纳米微粒、化学发光物质标记的糖化血红蛋白特异性抗体和荧光分子标记的血红蛋白特异性抗体-2。
6.其中,血红蛋白特异性抗体-1和血红蛋白特异性抗体-2针对的血红蛋白的表位不同。检测时,血红蛋白和糖化血红蛋白被血红蛋白特异性抗体-1包被磁纳米微粒捕获,捕获了糖化血红蛋白的磁纳米微粒同时捕获化学发光物质标记的糖化血红蛋白特异性抗体和荧光分子标记的血红蛋白特异性抗体-2,而捕获了血红蛋白的磁纳米微粒只能捕获荧光分子标记的血红蛋白特异性抗体-2,即糖化血红蛋白被化学发光物质标记,而糖化血红蛋白和血红蛋白同时被荧光分子标记,本发明用化学发光信号指示糖化血红蛋白浓度,荧光信号指示总血红蛋白(包括血红蛋白和糖化血红蛋白)浓度,两种信号互不干扰,实现在同一反应杯中对总血红蛋白和糖化血红蛋白的免疫检测。
7.优选地,血红蛋白特异性抗体-1、糖化血红蛋白特异性抗体和血红蛋白特异性抗体-2与糖化血红蛋白的结合不存在空间位阻效应。
8.优选地,所述血红蛋白特异性抗体-1包被磁纳米微粒的用量为0.0125~0.0375mg,所述化学发光物质标记的糖化血红蛋白特异性抗体用量为0.01μg-0.04μg,所述荧光分子标记的血红蛋白特异性抗体-2用量为0.05μg-0.2μg;或进一步优选地血红蛋白特异性抗体-1包被磁纳米微粒浓度为2.5-7.5mg/ml,化学发光物质标记的糖化血红蛋白特异性抗体浓度为0.2μg/ml~0.8μg/ml,荧光分子标记的血红蛋白特异性抗体-2用量为1μg/ml~4μg/ml。
9.优选地,所述血红蛋白特异性抗体-1包被磁纳米微粒制备中,血红蛋白特异性抗体-1与磁纳米微粒的质量比为1:10~50,所述的磁纳米微粒的粒径为0.5-3μm。
10.优选地,所述血红蛋白特异性抗体-1包被磁纳米微粒中,所述的磁纳米微粒为羧基,氨基,甲苯磺酰基、氯甲基磁纳米微粒中的一种或其他任一种可以与蛋白的氨基或羧基共价偶联的基团修饰的磁纳米微粒。
11.优选地,所述化学发光物质标记的糖化血红蛋白特异性抗体制备中,糖化血红蛋白特异性抗体与化学发光物质按摩尔比为1:5~20投料。
12.优选地,所述血红蛋白特异性抗体-1包被磁纳米微粒中,所述发光物质选自n-(4-氨丁基)-n-乙基异鲁米诺,吖啶酯,吖啶磺酰胺,辣根过氧化物酶,碱性磷酸酶中的一种或其他任一种可以和化学发光激发液或者底物作用产生化学发光的物质。
13.优选地,所述荧光分子标记的血红蛋白特异性抗体-2制备中,血红蛋白特异性抗体-2与荧光物质按摩尔比1:5~1:40投料。
14.优选地,所述荧光分子标记的血红蛋白特异性抗体-2,所述荧光分子itc、rhodamine、alexa488、cy3、cy5、dio、dii、dir中的一种。
15.优选地,还包括化学发光激发液a液和b液,所述化学发光激发液a液为含有过氧化氢和硝酸的水溶液,其中,所述的过氧化氢的浓度为0.5v/v%,硝酸的浓度为0.2m;
16.所述化学发光激发液b液为含有tween-20和氢氧化钠的水溶液,其中吐温的浓度为1v/v%,氢氧化钠的浓度为0.5m。
17.上述检测糖化血红蛋白与总血红蛋白浓度比值的试剂盒的应用,按照以下步骤使用:
18.1)将全血样本裂解后,与红蛋白特异性抗体-1包被磁纳米微粒、化学发光物质标记的糖化血红蛋白特异性抗体和荧光分子标记的血红蛋白特异性抗体-2混合,形成磁性捕获抗体-待测抗原-标记抗体免疫复合物;
19.2)将磁性捕获抗体-待测抗原-标记抗体免疫复合物经清洗分离后,检测荧光强度;
20.3)向检测荧光强度后的磁性捕获抗体-待测抗原-标记抗体免疫复合物加入化学发光激发液a和b,使复合物产生化学发光信号,检测发光强度,荧光强度和发光强度分别通过标准曲线计算得出血红蛋白浓度和糖化血红蛋白浓度,再计算出其比值。
21.上述检测糖化血红蛋白与总血红蛋白浓度比值的试剂盒的应用,所述的全血样本裂解中,加入裂解液,所述的裂解液含10mm~100mm十六烷基三甲基溴化铵(ctab)和0.5~2m氯化铵的磷酸盐缓冲液,所述裂解液的加入体积与全血样本的加入体积为1:40~1:400。
22.本发明的有益效果如下:本发明选用化学发光信号指示糖化血红蛋白浓度,荧光信号指示总血红蛋白浓度,采用本发明的化学发光标记和荧光标记双信号体系其优势在于两个指标检测仅需一个测试周期,检测结果报告时间节省50%,测试通量增加2倍;其次两个指标检测在一个反应杯中进行可以避免由于重复加样、样本预处理(裂解红细胞)、免疫反应、清洗过程等一系列仪器导致的系统误差,从而得出高准确度和高精密度的糖化血红蛋白比值。
附图说明
23.为了更清楚地说明本发明的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
24.图1为本发明所述试剂盒反应模式示意图;
25.图2为实施例1的总血红蛋白标准曲线;
26.图3为实施例1的糖化血红蛋白标准曲线;
27.图4为对比例1的总血红蛋白标准曲线;
28.图5为对比例1的糖化血红蛋白标准曲线;
29.图6采用实施例1试剂盒测试的全血标本中糖化血红蛋白浓度和伯乐的测定值的相关性;
30.图7采用实施例1试剂盒测试的全血标本中糖化血红蛋白浓度和伯乐的偏差分析;
31.图8采用比例1试剂盒测试的全血标本中糖化血红蛋白浓度和伯乐的测定值的相关性;
32.图9采用对比例1试剂盒测试的全血标本中糖化血红蛋白浓度和伯乐的偏差分析;
具体实施方式
33.为使本发明的目的、技术方案和优点更加清楚,下面将结合本发明具体实施例及相应的附图对本发明技术方案进行清楚、完整地描述。显然,所描述的实施例仅是本发明一
部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。以下结合附图,详细说明本发明各实施例提供的技术方案。
34.实验仪器和试剂:
35.a.实验仪器
36.加热磁力搅拌器(德国ika),全自动化学发光仪magicl6000(基蛋生物科技股份有限公司),恒温水浴锅(hh-60,常州国华电器有限公司),恒温摇床(太仓市科教器材厂),微量移液器(thermo公司)。离心机(德国eppendorf公司),磁分离架(天津倍思乐色谱技术开发中心),透析袋(上海泰伯)。
37.b.实验试剂
38.血红蛋白特异性抗体-1和血红蛋白特异性抗体-2购自fitzgerald,糖化血红蛋白抗体购自abcam,糖化血红蛋白标准品,血红蛋白校准品和磁纳米微粒均由基蛋生物医药有限公司提供,吖啶酯和fitc均购自阿拉丁。小牛血清(gibco公司),其它试剂以及耗材若无特殊说明,均购自sigma-aldrich公司。
39.实施例1
40.一种检测糖化血红蛋白与总血红蛋白浓度比值试剂盒
41.包括血红蛋白特异性抗体-1包被羧基磁纳米微粒、吖啶酯标记糖化血红蛋白特异性抗体和fitc标记的血红蛋白特异性抗体-2,血红蛋白特异性抗体-1和血红蛋白特异性抗体-2针对的血红蛋白的表位不同,还包括化学发光激发液a液和b液,清洗液,不同浓度的糖化血红蛋白和总血红蛋白的标准品。
42.上述检测糖化血红蛋白与总血红蛋白浓度比值试剂盒的制备
43.1.1血红蛋白特异性抗体-1包被羧基磁纳米微粒的制备:
44.a.将羧基磁纳米微粒清洗并替换为所需缓冲液。具体步骤:取1ml粒径为1μm的羧基磁纳米微粒于离心管放置微磁性分离架上磁性分离,约1分钟后,吸取澄清液体,加入1ml的50mm ph=5.5mes缓冲液重新吹打分散,重复两次以上步骤。
45.b.按照羧基磁纳米微粒:edc:nhs=1:0.5:0.5的质量比将edc和nhs加入悬浮mes的羧基磁性微球中反应30分钟,反应结束后清洗三次。
46.c.根据溶液中分散磁性微球的质量浓度推算出所需偶联的血红蛋白抗体-1的质量浓度,按照血红蛋白特异性抗体-1:磁纳米微粒=1:20的质量比将血红蛋白抗体-1缓慢滴加到分散好的磁性微球中。室温充分搅拌反应12小时后,向体系中加入bsa以及甘氨酸溶液封闭磁性微球上空余的位点,bsa及甘氨酸的浓度为0.2wt%,充分搅拌封闭1小时后用pbs-t缓冲液清洗3次即可。使用含2wt%bsa的pbs缓冲液将工作浓度调整为2.5mg/ml。
47.1.2.吖啶酯标记糖化血红蛋白特异性抗体的制备:
48.吖啶酯用dmso溶解成浓度为1mg/ml,根据糖化血红蛋白特异性抗体:吖啶酯=1:10的摩尔比,将糖化血红蛋白特异性抗体用50mm ph=7.6的磷酸盐缓冲液稀释成所需浓度后,加入吖啶酯溶液。37摄氏度下反应1小时后,透析除去未结合的吖啶酯即可。与以上相同的方案对血红蛋白特异性抗体-2标记吖啶酯。吖啶酯标记的抗体用含2wt%bsa的pbs缓冲液稀释至使用工作浓度为0.4μg/ml。
49.1.3 fitc标记的血红蛋白特异性抗体-2的制备:
50.fitc浓度10mg/ml,根据血红蛋白特异性抗体-2:fitc=1:10的摩尔比,将血红蛋白特异性抗体-2用50mm ph=9.0的碳酸盐缓冲液稀释成所需浓度后,加入fitc溶液。37摄氏度下反应2小时后,透析除去未结合的fitc即可。用含2wt%bsa的pbs缓冲液稀释至使用工作浓度为2μg/ml。
51.1.4化学发光激发液a液和b液的制备
52.化学发光激发液a液:含有过氧化氢和硝酸的水溶液,其中,所述的过氧化氢的浓度为0.5v/v%,硝酸的浓度为0.2m;
53.化学发光激发液b液:含有tween-20和氢氧化钠的水溶液,其中吐温的浓度为1v/v%,氢氧化钠的浓度为0.5m。
54.1.5化学发光清洗液的制备
55.清洗液为pbs-t缓冲液,配方如下(以配置量1l为例):ph6.96
56.kh2po43.35gna2hpo4-12h2o17.9gkcl0.2gnacl8.77gtween-200.5gproclin-3001ml
57.1.6糖化血红蛋白和总血红蛋白的标准品的制备
58.将糖化血红蛋白标准品按照如下浓度进行配置:1.0μg/ml,2.0μg/ml,4.8μg/ml,6.7μg/ml,8.6μg/ml,10.5μg/ml,12.4μg/ml,14.3μg/ml,16.2μg/ml,18.1μg/ml,20.0μg/ml。
59.将总血红蛋白标准品按照如下浓度进行配置:50μg/ml,60μg/ml,80μg/ml,90μg/ml,100μg/ml,110μg/ml,120μg/ml,130μg/ml,140μg/ml,150μg/ml。
60.标准品稀释液为含20v/v%小牛血清的pbs缓冲液。
61.采用上述制备的试剂盒检测糖化血红蛋白与总血红蛋白浓度比值
62.2.1样本预处理:
63.新鲜的全血样本放置在magicl6000仪器上进行预混匀,以下操作由仪器自动进行,仪器自动吸取5μl全血样本,加入495ul含有20mmol/l ctab和1mol/l氯化铵的磷酸盐缓冲液震荡裂解血细胞。
64.2.2在全自动化学发光仪magicl6000上进行免疫分析
65.1)获得血红蛋白和糖化血红蛋白标准曲线
66.用校准品稀释液分别稀释配制浓度梯度的血红蛋白标准品和糖化血红蛋白标准品,获得血红蛋白和糖化血红蛋白标准曲线(如图2和图3),其横坐标分别为血红蛋白标准品和糖化血红蛋白标准品梯度浓度数值,纵坐标分别为浓度梯度的血红蛋白和糖化血红蛋白进行步骤2)所得的荧光强度和发光强度。
67.2)在反应杯中,加入血红蛋白特异性抗体-1包被羧基磁纳米微粒10μl,吖啶酯标记的糖化血红蛋白特异性抗体50μl,fitc标记的血红蛋白特异性抗体-2试剂50μl,校准品/质控品/经过预处理的样本10μl,混匀后37℃温育10min;反应结束后用pbs-t清洗液磁性分离清洗三次后,首先经过荧光定量检测仪读取复合物的信号,测量荧光强度,然后泵入化学
发光激发液a液100μl和化学发光激发液b液100μl,使复合物产生化学发光信号,通过光电倍增器测量发光强度,最后对信号进行转换浓度分析,荧光信号和光子信号分别通过标准曲线计算得出总血红蛋白浓度和糖化血红蛋白浓度,再计算出其比值。
68.对比例单信号化学发光体系检测糖化血红蛋白与总血红蛋白浓度比值试剂盒
69.与实施例1相同,不同的是采用吖啶酯标记的血红蛋白特异性抗体-2替代fitc标记血红蛋白特异性抗体-2,采用单信号化学发光体系分别测试总血红蛋白和糖化血红白浓度,再计算比值。
70.单信号化学发光体系检测糖化血红蛋白与总血红蛋白浓度比值试剂盒的制备
71.与实施例1相同,不同的是吖啶酯标记血红蛋白特异性抗体-2的制备(吖啶酯标记的血红蛋白特异性抗体-2的制备方法与1.2.吖啶酯标记糖化血红蛋白特异性抗体的制备方法相同)
72.采用该单信号化学发光体系检测糖化血红蛋白与总血红蛋白浓度比值试剂盒检测糖化血红蛋白与总血红蛋白浓度比值
73.用校准品稀释液分别稀释配制浓度梯度的血红蛋白标准品和糖化血红蛋白校准品,获得血红蛋白和糖化血红蛋白标准曲线(如图4和图5),其横坐标分别为血红蛋白标准品和糖化血红蛋白标准品梯度浓度数值,纵坐标分别为浓度梯度的血红蛋白和糖化血红蛋白进行以下步骤所得的发光强度。
74.糖化血红蛋白检测:在反应杯中,加入血红蛋白特异性抗体-1包被羧基磁纳米微粒10μl,吖啶酯标记的糖化血红蛋白特异性抗体50μl,校准品/质控品/经过预处理的样本10μl,混匀后37℃温育10min;血红蛋白检测:取另外一个新的反应杯中加入血红蛋白特异性抗体-1包被羧基磁纳米微粒10μl,吖啶酯标记的血红蛋白特异性抗体-2 50μl,校准品/质控品/经过预处理的样本10μl,混匀后37℃温育10min。对糖化血红蛋白和血红蛋白检测均用pbs-t清洗液磁性分离清洗三次后,泵入化学发光激发液a液和化学发光激发液b液各100μl,使复合物产生化学发光信号,通过光电倍增器测量发光强度,绘制出相应地标准曲线,最后对两个反应杯中的发光信号进行转换浓度分析,分别通过标准曲线计算得出总血红蛋白浓度和糖化血红蛋白浓度,再计算出其比值。
75.精密度测试
76.应用clsiep5-a2评价实施例和对比例的精密度性能,应用clsiep15-a3进行验证。该方案使用了一个嵌套的方差设计,每个样本有20个测试日,每个测试日由两人各运行一次(一天共两次),每次运行两次重复测量(一个20
×2×
2的设计)。所有测试在一个地点用一个仪器进行。具体结果如表1-3所示,表1采用实施例1试剂盒检测糖化血红蛋白与总血红蛋白浓度比值数据,表2为采用对比例试剂盒检测糖化血红蛋白与总血红蛋白浓度比值数据,表3为本实施例1和对比例1精密度(cv%)95%可信限分析。
77.表1采用实施例1试剂盒检测糖化血红蛋白与总血红蛋白浓度比值数据
[0078][0079][0080]
表2采用对比例试剂盒检测糖化血红蛋白与总血红蛋白浓度比值数据
[0081][0082]
表3本实施例1和对比例1精密度(cv%)95%可信限分析
[0083][0084]
从20天的精密度数据可得出:采用对比例1试剂盒检测糖化血红蛋白与总血红蛋白浓度比值,质控品1重复性的95%置信限为2.44%~3.80%,室内精密度的95%置信限为4.93%~6.79%,质控品2的重复性的95%置信限为2.11%~3.29%,室内精密度的95%置信限为3.51%~4.85%;而采用实施1试剂盒检测糖化血红蛋白与总血红蛋白浓度比值精密度数据如下:质控品1重复性的95%置信限为1.13%~1.77%,室内精密度的95%置信限为2.09%~3.19%,质控品2的重复性的95%置信限为1.23%~1.91%,室内精密度的95%
置信限为2.31%~3.17%。从以上数据可得出采用本发明的试剂盒测定糖化血红蛋白与总血红蛋白浓度的比值的重复性和精密度都得到明显改善,主要原因在于本发明的双信号同时检测血红蛋白和糖化血红蛋白在同一个反应杯内进行,避免了由于重复加样、样本预处理(裂解红细胞)、免疫反应、清洗过程等一系列仪器导致的系统误差。
[0085]
方法学比对
[0086]
采用实施例1以及对比例1测定228份临床全血的糖化血红蛋白浓度,并与临床方法(伯乐d10分析仪hplc)进行比较。首先进行线性相关分析:用回归方程和相关系数来判断两种方法之间的相关性;然后为了确定测试的一致性,我们采用bland-altman方法对它们的差异进行随机效应分析,x轴为两种方法确定的浓度平均值,y轴为误差(与平均值的差值)。最后,计算得出平均相对误差和误差的95%置信区间,其结果如图6-9所示:图6采用实施例1试剂盒测试的全血标本中糖化血红蛋白浓度和伯乐的测定值的相关性;图7采用实施例1试剂盒测试的全血标本中糖化血红蛋白浓度和伯乐的偏差分析;图8采用比例1试剂盒测试的全血标本中糖化血红蛋白浓度和伯乐的测定值的相关性;
[0087]
图9采用对比例1试剂盒测试的全血标本中糖化血红蛋白浓度和伯乐的偏差分析;
[0088]
从图6-9可看出,采用对比例1试剂盒测试样本浓度与对照试剂伯乐测试的样本浓度的线性回归拟合r2=0.9851,95%置信区间的误差为-0.46%-0.41%区间,而采用本发明实施1试剂盒测试样本浓度与对照试剂伯乐测试的样本浓度的线性回归拟合r2=0.9959,95%置信区间的误差为-0.24%-0.23%区间,说明采用本发明实施1试剂盒测试浓度与对照试剂伯乐测试的样本浓度具有更好的一致性,也意味着双信号同时检测血红蛋白和糖化血红蛋白在临床实践中具有更好的准确度和巨大的应用前景。
[0089]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1