温经汤的指纹图谱检测方法、物质基准及其应用与流程
1.本发明涉及中药质控技术领域,特别涉及一种温经汤的指纹图谱检测方法、物质基准及其应用。
背景技术:
2.温经汤,又称良方温经汤,原载于南宋陈自明著《妇人大全良方》卷一调经门“月水行或不行心腹刺痛方论第十二”篇,温经汤原文记载为“当归、川芎、芍药、桂心、牡丹皮、莪术各半两,人参、甘草、牛膝各一两。右咀,每服五钱。水一盏半,煎至八分,去滓温服”。本方由温通散寒、活血化瘀、补养气血的药物组成,有温经散寒、活血调经、益气养血之效,全方温而不燥、攻而不伤、补而不滞、治寒邪外客所致的经闭,是妇科调经要方,临床上广泛用于治疗寒凝血瘀型痛经,具有很好的开发价值。
3.物质基准的制备和质量控制是经典名方制剂申报的前提和基础,全面、准确的物质基准质控体系对于经典名方复方制剂的质量保障具有重要意义。然而中药成分的复杂性使得保持其质量一致性成为质量控制的难点,鉴于中药组成的多样性和辨证施治的治疗方案,检测任何一种活性成分均不能代表其整体药效,当前研究者多采用hplc特征图谱分析和高分辨质谱分析相结合来反映中药所包含的复杂化学信息,hplc指纹图谱法成为最常见的中药质量控制手段。目前,关于经典名方温经汤的研究主要集中于临床研究或工艺研究方面,质量控制方面的研究较少。
技术实现要素:
4.本发明的目的在于提供一种温经汤的指纹图谱检测方法及其应用,该检测方法具有良好的系统适用性、重复性和稳定性,可为后续温经汤的开发和质量控制提供可靠依据。
5.为了实现以上目的,本发明提供了以下技术方案:
6.一种温经汤的指纹图谱检测方法,包括:
7.将温经汤的冻干粉用甲醇-水混合溶剂溶解,得到供试品溶液;优选所述甲醇-水混合溶剂中甲醇的体积比为40%~60%;
8.制备对照品溶液,所述对照品溶液含以下至少一种物质的对照品:芍药苷、芹糖甘草苷、甘草苷、阿魏酸、甘草素、桂皮醛、甘草酸铵、丹皮酚;
9.在相同条件下,采用hplc检测所述供试品溶液和所述对照品溶液,得到所述供试品溶液和所述对照品溶液的液相色谱图;
10.将所述液相色谱图导入中药色谱指纹图谱相似度评价系统分析,得到温经汤的共有特征峰;
11.其中所述hplc检测的条件为:
12.十八烷基硅烷键合硅胶色谱柱;
13.流动相包括流动相a和流动相b,所述流动相a选自乙腈,所述流动相b 选自0.05~0.2体积%甲酸水溶液,优选0.1体积%甲酸水溶液。
14.本发明通过对色谱条件的不断优化及特征图谱方法学的考察,发现采用上述样品处理方式和hplc检测条件可以达到以下效果:使温经汤中的主要成分获得良好的分离度,同时在不同品牌色谱仪和色谱柱中都具有良好的系统适用性,具有良好的精密度、稳定性和重复性,同时能兼顾分析时间,在1小时内完成分析。
15.本发明在选用对照品时主要参考了中国药典对各味药材规定的指标性成分、活性成分等,也参考了君臣佐使的配伍原则,最终选定了芍药苷、芹糖甘草苷、甘草苷、阿魏酸、甘草素、桂皮醛、甘草酸铵、丹皮酚中的至少一种作为对照品。为了提高结果的准确性,对照品溶液中对照品的类型尽量多样化,例如在对照品溶液中引入芍药苷、芹糖甘草苷、甘草苷、阿魏酸、甘草素、桂皮醛、甘草酸铵、丹皮酚共8种成分,各成分的比例可依据温经汤配方比以及各药材中活性成分的常规含量而定。
16.在一些实施方式中,本发明配制的对照品溶液中,每1ml溶液含芍药苷 107.0μg、芹糖甘草苷102.0μg、甘草苷24.5μg、阿魏酸120.0μg、甘草素106.0μg、桂皮醛55.2μg、甘草酸铵40.7μg、丹皮酚56.8μg。实际应用时,各成分的含量可以在上述值的
±
20%或
±
10%范围内调整,本发明对此不作特别限制。
17.配制对照品溶液时可以采用与供试品同样的溶剂,也可以采用单一的甲醇作为溶剂。
18.在一些实施方式中,配制供试品溶液所用的混合溶剂中甲醇与水的比例是任意的,例如10%~90%(体积比)的甲醇-水,为了提高特征峰的峰面积,优选40%~60%的甲醇-水,包括但不限于40%甲醇-水、41%甲醇-水、42%甲醇
‑ꢀ
水、43%甲醇-水、44%甲醇-水、45%甲醇-水、46%甲醇-水、47%甲醇-水、48%甲醇-水、49%甲醇-水、50%甲醇-水、51%甲醇-水、52%甲醇-水、53%甲醇-水、 54%甲醇-水、55%甲醇-水、56%甲醇-水、57%甲醇-水、58%甲醇-水、59%甲醇-水、60%甲醇-水等。
19.在一些实施方式中,采用甲醇-水混合溶剂溶解冻干粉(尤其是40%~60%甲醇-水)时,为了提高特征峰的峰面积,溶剂与所述冻干后的粉末的比例优选为5~15ml:0.25g,即每0.25g冻干粉加入5~15ml溶剂(例如可以是5ml、 7ml、9ml、10ml、12ml、13ml、14ml、15ml等)。
20.在一些实施方式中,hplc检测的波长为230~250nm,以兼顾更多类型成分的紫外吸收,达到更全面的鉴别功能。具体地,波长可以是230nm、235nm、 240nm、245nm、250nm等。
21.在一些实施方式中,hplc检测的进样量为5~15μl,流速为0.8~1.2ml/min,柱温20~30℃,色谱柱规格为5μm,250mm
×
4.6mm,能够在分离度、分析时间、重现性等因素之间取得平衡。
22.在一些实施方式中,对温经汤的冻干粉溶解时,可以借助搅拌、超声等手段,加速溶解,同时提高溶解率。以超声为例,超声时间控制在15~45min之间,能在效率和峰面积两方面获得较好的平衡。
23.在一些实施方式中,所述hplc检测的流动相梯度洗脱:0~15min,流动相 a为17体积%;15~25min,流动相a由17体积%升至27体积%;25~45min,流动相a由27体积%升至40体积%;45~55min,流动相a为40体积%。
24.在一些实施方式中,所述hplc检测采用如下表的流动相进行梯度洗脱:
[0025][0026][0027]
在一些实施方式中,经中药色谱指纹图谱相似度评价系统分析,发现温经汤有8个共有特征峰,分别为芍药苷、芹糖甘草苷、甘草苷、阿魏酸、甘草素、桂皮醛、丹皮酚、甘草酸;优选地,所述8个共有峰以甘草苷为参比物,其余 7个共有特征峰的相对保留时间分别为芍药苷0.640
±
10%、芹糖甘草苷 0.907
±
10%、阿魏酸1.101
±
10%、甘草素2.169
±
10%、桂皮醛2.749
±
10%、丹皮酚3.051
±
10%、甘草酸3.173
±
10%。需要注意的是,此处的
“±
10%”并非指绝对值0.1,而是指可以波动的相对偏差范围,以0.640
±
10%为例,其含义是相对保留时间在0.576~0.704范围内。
[0028]
在一些实施方式中,经中药色谱指纹图谱相似度评价系统分析,发现温经汤有10个共有特征峰,除了包括上述实施方式的8种成分外(芍药苷、芹糖甘草苷、甘草苷、阿魏酸、甘草素、桂皮醛、甘草酸铵、丹皮酚),还含有另外两个共有特征峰,以甘草苷为参比物,这两个共有特征峰的相对保留时间分别为 1.687
±
10%、2.626
±
10%。
[0029]
本发明所说的温经汤指已被广泛应用的中药方,其通常由以下方法制得:
[0030]
按重量份数计,取当归1-3份、川芎1-3份、白芍1-3份、肉桂1-3份、牡丹皮1-3份、莪术1-3份、人参1-3份、牛膝1-3份、甘草1-3份,混合,水煎 30min以上,过滤,得到水煎液。水煎时,水加入量通常为固体药材总质量的 1~1.5倍,本发明仅仅为列举,对用水量并不做限制。
[0031]
本发明另一方面还在hplc检测特征峰的基础上增加了uplc-qtof-ms 检测,以指认温经汤中的成分,作为hplc检测评价的补充,能提高质量评价标准的可靠性。
[0032]
具体地,还包括:采用超高效液相色谱-四级杆飞行时间串联质谱法 uplc-qtof-ms对温经汤中的化学成分进行指认,并且uplc的流动相包括流动相a’和流动相b’,所述流动相a’选自乙腈,所述流动相b’选自0.05~0.2体积%甲酸水溶液;优选,0.1体积%甲酸水溶液;
[0033]
所述uplc的流动相梯度洗脱:0~2.8min,流动相a’为10体积%;2.8~8.0min,流动相a’由10体积%升至18体积%;8.0~12.2min,流动相a’由18体积%升至25体积%;12.2~15.3min,流动相a’由25体积%升至40体积%;15.3~17.4min,流动相a’由25体积%升至40体积%;15.3~17.4min,流动相a’为40体积%; 17.4~20.5min,流动相a’由40体积%升至90体积%。
[0034]
uplc采用十八烷基硅烷键合硅胶色谱柱;
[0035]
质谱检测条件:电喷雾离子源,正、负离子模式扫描,毛细管电压为2.2kv,锥孔电压为40v,离子源温度120℃,脱溶剂气体流量500l
·
h-1
,脱溶剂气温度450℃,锥孔气体流量
50l
·
h-1
,母离子碰撞能量6ev,碎片离子碰撞能量20~50 ev,扫描范围m/z 50~1600da。
[0036]
采用上述方法可以检测指认出温经汤中更多的化学成分,至少能指认出20 种以上,甚至30种。
[0037]
在一些实施方式中,uplc采用如下表的流动相梯度洗脱:
[0038]
时间(min)乙腈(体积%)0.1体积%甲酸水(体积%)010902.810908.0188212.2257515.3406017.4406020.59010
[0039]
在一些实施方式中,uplc的色谱柱规格为1.7μm,2.1mm
×
100mm;进样量为1~3μl,流速为0.3~0.5ml/min,柱温25~35℃。
[0040]
在一些实施方式中,采用uplc-qtof-ms指认的成分包括以下:蔗糖,柠檬酸,绿原酸,香草酸,芍药内酯苷,芍药苷,阿魏酸,甘草苷,甘草苷元
ꢀ‑
7-o-糖-4
′‑
o-葡萄糖苷,芹糖异甘草苷,没食子酰芍药苷,β-蜕皮甾酮,人参皂苷rg1,人参皂苷re,甘草皂苷g,苯甲酰芍药苷,人参皂苷rf,羟基甘草酸,人参皂苷rb1,西洋参皂苷r1,人参皂苷rb2/rb3,羟基甘草酸,甘草酸,乌拉尔甘草皂苷b,甘草皂苷b,甘草皂苷h2,甘草皂苷k2,甘草皂苷j2。可以将是否含有以上所有成分作为评价温经汤质量是否达标的条件之一,作为 hplc特征峰的补充条件。
[0041]
进一步地,采用uplc-qtof-ms指认的成分还包括相对分子质量为954 和956的两个化学成分。在质谱分析中,这两种成分表现的负离子流数据分别为:
[0042]
953.437 6,837.389 6,793.435 9,351.0561;
[0043]
955.452 9,835.448 4,793.437 7,631.3842。
[0044]
对以上成分指认时,本发明还检测了温经汤的水煎液、各味药材的化学成分,同时查阅文献进行对照,确定各成分的来源/归属,以保证结果的准确性。
[0045]
本发明还提供了一种温经汤物质基准,其包括温经汤的指纹图谱检测方法得到的图谱中的化学成分。
[0046]
本发明所述温经汤物质基准包括化成成分芍药苷、芹糖甘草苷、甘草苷、阿魏酸、甘草素、桂皮醛、丹皮酚、甘草酸。
[0047]
进一步地,本发明温经汤物质基准中所述8个化学成分,以甘草苷为参比物,相对保留时间分别为芍药苷0.640
±
10%、芹糖甘草苷0.907
±
10%、阿魏酸 1.101
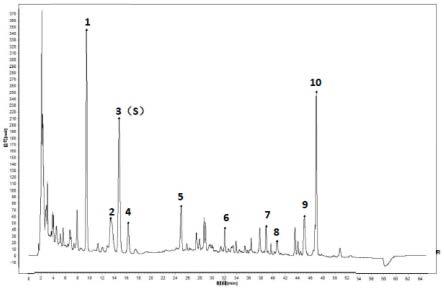
±
10%、甘草素2.169
±
10%、桂皮醛2.749
±
10%、丹皮酚3.051
±
10%、甘草酸3.173
±
10%。
[0048]
进一步地,优选,本发明温经汤物质基准中除上述8种物质外,还包括以甘草苷为参比物,相对保留时间分别为1.687
±
10%、2.626
±
10%的两种化学成分。
[0049]
更进一步地,本发明温经汤物质基准包括蔗糖,柠檬酸,绿原酸,香草酸,芍药内酯苷,芍药苷,阿魏酸,甘草苷,甘草苷元-7-o-糖-4
′‑
o-葡萄糖苷,芹糖异甘草苷,没食子酰芍药苷,β-蜕皮甾酮,人参皂苷rg1,人参皂苷re,甘草皂苷g,苯甲酰芍药苷,人参皂苷rf,羟基
甘草酸,人参皂苷rb1,西洋参皂苷r1,人参皂苷rb2/rb3,羟基甘草酸,甘草酸,乌拉尔甘草皂苷b,甘草皂苷b,甘草皂苷h2,甘草皂苷k2,甘草皂苷j2中多种。
[0050]
更进一步地,本发明温经汤物质基准还包括相对分子质量为954和相对分子质量为956的两个化学成分;进一步优选,相对分子质量为954化学成分,其负离子流数据953.437 6,837.389 6,793.435 9,351.056 1;相对分子质量为 956的化学成分其负离子流数据955.452 9,835.448 4,793.437 7,631.384 2。
[0051]
本发明所述的物质基准即经典名方物质基准,是指以古代医籍中记载的古代经典名方制备方法为依据制备而得到的中药药物物质的标准,除成型工艺外,其制备方法应当与股改医籍记载基本一致。
[0052]
本发明上文提供的所有指纹图谱检测方法或温经汤物质基准均可用于温经汤的质量控制,应用时,采用相同检测条件检测待评价的样品,观察其所得谱图是否含有指定的共有特征峰(例如上文所述的8/10个特征峰),和/或是否含有上文所述的28/30种化学成分。经过中药色谱指纹图谱相似度评价系统,相似度不低于0.9为温经汤质量达标指标。
[0053]
本发明既可用于评价温经汤的出厂质量,也可以评价其长期存放后的稳定性等,本发明对此不作限制。
[0054]
综上,与现有技术相比,本发明达到了以下技术效果:
[0055]
1.建立了温经汤物质基准hplc特征图谱定性鉴别方法,同时采用 uplc-qtof-ms对温经汤物质基准中的化学成分进行推测与指认,并做了来源药材归属研究,初步明确了温经汤冻干粉的物质基础及质量传递关系,所建立的温经汤冻干粉特征图谱分析方法具有良好地系统适用性、重复性和稳定性,可为后续温经汤的开发和质量控制提供依据。
[0056]
2.本发明研究确立经典名方温经汤物质基准能够全面反映对应的温经汤样品的质量信息,满足了精品传承经典的要求。
附图说明
[0057]
通过阅读下文优选实施方式的详细描述,各种其他的优点和益处对于本领域普通技术人员将变得清楚明了。附图仅用于示出优选实施方式的目的,而并不认为是对本发明的限制。而且在整个附图中,用相同的参考符号表示相同的部件。在附图中:
[0058]
图1至6为本发明提供六种不同流动相条件下的hplc检测谱图;
[0059]
图7为本发明提供的15批次温经汤物质基准特征图谱叠加;
[0060]
图8为本发明经分析后得到的温经汤对照特征图谱。
具体实施方式
[0061]
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用原药、试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品或者可以根据现有技术制备得到。
[0062]
下文结合多个实验验证本发明检测方法的科学性、稳定性、重复性和适用性等。
[0063]
一、温经汤中9味药材的来源
[0064]
9味药材均购于其道地产地或主产区,经中国科学院中药研究所生药研究中心张
志杰研究员鉴定,均符合2020年版《中华人民共和国药典》(以下简称《中国药典》),具体药材信息见表1。
[0065]
表1温经汤的组方药材信息
[0066]
[0067][0068]
采用随机表法将上述药材组合制备出温经汤冻干粉样品15批,进行后续试验。
[0069]
二、温经汤的制备
[0070]
取当归、川芎、芍药、桂心、牡丹皮、莪术各1.67g,人参、甘草、牛膝各 3.33g,微型植物粉碎机粉碎制成黄豆粒大小药材颗粒,约20g药材,加22.5倍量水,砂锅煎煮,加热设备为最大功率为2000w的电炉,5档煮沸,时间约 5~6min,2.5档煎煮30min,水煎液9号药典筛(200目)过滤,得到温经汤。
[0071]
三、供试品溶液制备和对照品溶液制备
[0072]
取温经汤真空冷冻干燥,得冻干粉,低温干燥保存,制备温经汤冻干粉样品15批,备用。之后取温经汤物质基准冻干粉约0.25g,精密称定,置于锥形瓶中,精密加入5~15ml 40~60%甲醇-水溶液,称定重量,超声处理(功率250w,频率45khz)15~45分钟,放冷,补足失重,离心10分钟(12000转/分钟),滤过,取滤液,即得。
[0073]
取芍药苷、芹糖甘草苷、甘草苷、阿魏酸、甘草素、桂皮醛、甘草酸铵、丹皮酚对照品适量,精密称定,加甲醇制成每1ml含芍药苷107.0μg、芹糖甘草苷102.0μg,甘草苷24.5μg,阿魏酸120.0μg,甘草素106.0μg,桂皮醛55.2 μg,甘草酸铵40.7μg,丹皮酚56.8μg的混合溶液,作为对照品参照物溶液。
[0074]
四、hplc的检测条件摸索
[0075]
1、摸索流动相比例
[0076]
采用以下六种流动相条件洗脱供试品溶液,得到谱图,观察分离效果。其余色谱条件为:kromasilc18(5μm,250mm
×
4.6mm),流速:1ml
·
min-1
,柱温25℃,检测波长240nm,进样量10μl。
[0077]
供试品溶液的制备为:取温经汤真空冷冻干燥,得冻干粉,低温干燥保存,制备温经汤冻干粉样品15批,备用。之后取温经汤物质基准冻干粉约0.25g,精密称定,置于锥形瓶中,精密加入10ml 50%甲醇溶液,称定重量,超声处理(功率250w,频率45khz)30分钟,放冷,补足失重,离心10分钟(12000 转/分钟),滤过,取滤液,即得。
[0078]
流动相条件1至6的比例分别如表2至7所示,得到的谱图分别如图1至 6。
[0079]
表2流动相条件1
[0080][0081]
表3流动相条件2
[0082][0083]
表4流动相条件3
[0084][0085][0086]
表5流动相条件4
[0087][0088]
表6流动相条件5
[0089][0090]
表7流动相条件6
[0091][0092]
结果显示,流动相条件1下分离效果较差。流动相条件2、3、4下分离效果仍不好。流动相条件5下a流动相过高,部分目标峰分离度尚可,但部分色谱峰未分开。流动相条件6下可见目标峰,分离度较好,在此条件下能实现完全分离,表明此色谱条件较为理想。由此确定“流动相条件6”作为特征图谱的色谱条件。
[0093]
2、摸索提取溶剂
[0094]
供试品溶液的制备为:分别称取温经汤冻干样品3份,质量分别如下,249.58mg、249.99mg、250.18mg,分别用纯水、50%甲醇、纯甲醇10ml溶解,超声提取15min,离心12000转/min,10分钟,0.45μm滤膜过滤,备用,检测波长240nm。其余检测条件为上述第1点确定的条件6。
[0095]
结果如表8,可以看出:提取溶剂选纯水时,各特征峰峰面积均较大;提取溶剂选50%甲醇时,各特征峰峰面积均最大;各特征峰峰面积均较小;故选 50%甲醇为最佳提取溶剂。
[0096]
表8不同提取溶剂
[0097][0098]
3、摸索提取时间
[0099]
分别称取温经汤冻干样品三份,称重量分别为0.25023g、0.25015g、 0.25017g,置25ml锥形瓶中,加甲醇:水=50:50溶液10ml,称重,超声提取,提取时间分别为15min、30min、45min,功率为240w,频率为45khz,放冷,补重,12000转离心10min,摇匀,滤过,取续滤液,即得,检测波长240nm。其余检测条件为上述第1点确定的条件6。
[0100]
结果如表9,可以看出:提取时间选15min时,各特征峰峰面积较小;提取时间选30min时,各特征峰峰面积最高;提取时间选45min时,各特征峰峰面积较高;结合时间长短,提高效率,故选30min为最佳提取时间。
[0101]
表9不同提取时间
[0102][0103]
4、摸索不同提取溶剂量
[0104]
分别称取温经汤冻干样品三份,称重量分别为0.25029g、0.24999g、0.25023g,置25ml锥形瓶中,加甲醇:水=50:50溶液10ml,称重,超声提取,提取溶剂量分别为5ml、10ml、15ml,功率为240w,频率为45khz,放冷,补重,12000转离心10min,摇匀,滤过,取续滤液,即得,检测波长240nm。
[0105]
结果如表10,可以看出:提取剂量选5ml时,各特征峰峰面积较小;提取剂量选10ml时,各特征峰峰面积最大;提取剂量选15ml时,各特征峰峰面积较大;结合峰面积,考虑节约成本,故选10ml为最佳提取剂量。
[0106]
表10不同提取剂用量
[0107][0108][0109]
根据上述摸索,确定较佳的检测条件:流动相乙腈(a)-0.1%甲酸水溶液 (b)梯度洗脱(0~15min,17%a;15~25min,17~27%a;25~45min,27~40%a; 45~55min,40%a);50%甲醇-水作为提取溶剂,每0.25g冻干粉加入10ml提取溶剂,超声时间30min。
[0110]
五、hplc特征图谱的建立及其方法学考察
[0111]
1、特征图谱生成
[0112]
将15批次的温经汤冻干粉供试品溶液和混合对照品溶液,按照前述的色谱条件进样分析,并采用国家药典委员会《中药色谱指纹图谱相似度评价系统软件》(2012.130723版)对15批次特征图谱进行分析。
[0113]
其中,供试品溶液的制备为:取温经汤真空冷冻干燥,得冻干粉,低温干燥保存,制备温经汤冻干粉样品15批,备用。之后取温经汤物质基准冻干粉约0.25g,精密称定,置于锥形瓶中,精密加入10ml 50%甲醇溶液,称定重量,超声处理(功率250w,频率45khz)30分钟,放冷,补足失重,离心10分钟(12000转/分钟),滤过,取滤液,即得。
[0114]
hplc色谱条件:
[0115]
kromasilc18(5μm,250mm
×
4.6mm),流动相乙腈(a)-0.1%甲酸水溶液(b)梯度洗脱(0~15min,17%a;15~25min,17~27%a;25~45min,27~40%a; 45~55min,40%a),流速:1ml
·
min-1
,柱温25℃,检测波长240nm,进样量 10μl。
[0116]
以s1号样品的特征图谱作为参照谱进行指纹匹配(中位数法,时间窗为0.1 min),确定了10个特征峰(如图7和8中标识的峰号),15批温经汤物质基准供试品hplc特征图谱叠加图见图7,生成的对照特征图谱见图8。
[0117]
通过与对照品比较指认了其中8个特征峰,分别为芍药苷(1号峰)、芹糖甘草苷(2号峰)、甘草苷(3号峰)、阿魏酸(4号峰)、甘草素(6号峰)、桂皮醛(8号峰)、丹皮酚(9号峰)、甘草酸(10号峰)。其中,1号峰芍药苷来自白芍和牡丹皮;2号峰芹糖甘草苷、3号峰甘草苷、6号峰甘草素、10号峰甘草酸来自甘草;4号峰阿魏酸来自于当归和川芎,5号峰和9号峰丹皮酚来自牡丹皮,8号峰桂皮醛来自肉桂。该结果也与君臣佐使多药味兼顾的原则相符,特征峰里包含有:君药肉桂的主要有效成分桂皮醛(8号峰),臣药当归、川芎的主要有效成分阿魏酸(4号峰),佐药白芍、牡丹皮的主要有效成分芍药苷(1 号峰)、丹皮酚(1号峰),使药甘草的主要有效成分甘草苷(3号峰)、甘草酸 (10号峰)等,均为《中国药典》2020年版单味药项下规定的指标性成分、活性成分。
[0118]
以峰面积较大、较稳定的3号色谱峰作为参比峰计算,15批温经汤样品中 10个共有特征峰的相对保留值结果如表11,确定温经汤物质基准特征图谱鉴别标准,具体建议如下:供试品特征图谱中应有10个特征峰,与参比物峰甘草苷相应的峰为s峰,计算各特征峰与s峰的相对保留时间,其相对保留时间应在规定值的
±
10%之内。规定值为0.640(峰1)、0.907(峰2)、1.000(峰3(s))、 1.101(峰4)、1.687(峰5)、2.169(峰6)、2.626(峰7)、2.749(峰8)、3.051 (峰9)、3.173(峰10)。
[0119]
表11 15批温经汤物质基准样品特征图谱相对保留值
[0120][0121]
2、方法学考察
[0122]
(1)不同仪器系统适应性考察
[0123]
实验分别采用了三个不同厂家的hplc仪器,精密吸取供试品溶液10μl,进样分析,
供试品溶液的制备方法和检测条件同上述特征图谱的生成。分别统计不同仪器各特征峰的相对保留时间和相对峰面积(均以甘草苷作为参比物),结果如表12所示。
[0124]
表12不同品牌仪器相对保留时间的重现性
[0125][0126]
相对保留时间分析结果显示,各特征峰的相对保留时间在三台不同仪器上重现性均较好。其中watres 2695和安捷伦1260重现性最好,相对保留时间,偏差值均小于5%。与岛津仪器保留时间稍有差异,原因分析为:不同仪器色谱柱后端到检测器所用管线内径,长度不一样,样品在色谱柱分离后到达检测器时间不一样,管线越长,内径越大,保留时间相对来说会滞后,从而造成时间差异;进样计量泵的区别,柱前死体积,两元泵或四元泵都会造成保留时间的差别。但各特征峰出峰顺序一致,不影响各色谱峰的分离度和指认。由此表明,不同仪器下该方法系统适应性良好。
[0127]
(2)精密度考察
[0128]
分别精密吸取同一供试品溶液,连续进样6次,每次10μl,按上述(1) 的方法色谱条件测定。以峰面积较大、较稳定的3号色谱峰作为参照峰,计算各特征峰相对保留时间的rsd。结果相对保留时间的rsd为0.03~0.29%,表明精密度好。
[0129]
(3)稳定性的考察
[0130]
精密吸取同一供试品溶液,分别在0,2,4,6,10,12,24,48h时进样,每次10μl,按上述(1)的方法色谱条件测定。以峰面积较大、较稳定的3号色谱峰作为参照峰,计算各特征峰相对保留时间的rsd。结果相对保留时间的 rsd为0.11~0.73%,表明供试品溶液在放置48h内稳定性良好。
[0131]
(4)重复性的考察
[0132]
取同一批温经汤冻干粉,按上述(1)的方法制备供试品溶液6份,分别进样,每次10μl,按上述方法色谱条件测定。以峰面积较大、较稳定的3号色谱峰作为参照峰,计算各特征峰相对保留时间的rsd。结果相对保留时间的rsd 为0.07~0.69%,表明重复性良好。
[0133]
(5)不同色谱柱系统适应性考察
[0134]
收集市面上常见的几种色谱柱品牌、两种常用的色谱仪,重点进行了比较。分别统计各特征峰的相对保留时间和偏差。
[0135]
结果见表13和表14,waters 2695仪器下,不同品牌11根色谱柱之间相对保留时间和偏差:经统计不同品牌色谱柱之间相对保留时间的偏差值相对较大,部分大于5%,小于10%;但各特征峰分离度和重现性仍较高,不存在出峰顺序改变。同品牌不同色谱柱之间的偏差:3根kromasil色谱柱其保留值偏差均小于5%,3根waters色谱柱其保留值偏差均小于5%,3根迪马色谱柱其保留值偏差均小于5%,2根phenomenex色谱柱其保留值偏差均小于
5%结果见表 15。由此可知,使用同一品牌色谱柱即可获得良好的保留时间重现性。其中, kromasil色谱柱的分离度、重现性均较好,可以作为首选。因在waters 2695仪器下同品牌色谱柱之间保留值偏差均小于5%,故在安捷伦1260仪器下,只选择了不同品牌色谱柱的第1根进行了比较,相对保留时间和偏差结果见表6,偏差均小于5%,重现性良好。
[0136]
表13 waters 2695仪器下不同品牌色谱柱相对保留时间的重现性
[0137][0138][0139]
表14 waters2695仪器不同品牌色谱柱相对保留时间偏差/
±
%
[0140][0141]
表15安捷伦1260下不同品牌色谱柱相对保留时间的重现性
[0142][0143]
上述方法学考察结果表明,本发明的检测方法在分离度、特征峰数量、分析时间、重现性、稳定性和系统适应性方面表现良好。
[0144]
六、温经汤物质基准化学成分质谱指认
[0145]
采用uplc-qtof-msn推测温经汤冻干粉、水煎液、以及各味饮片的化学成分。
[0146]
uplc色谱条件
[0147]
色谱柱:acquity uplc beh c18(2.1mm
×
100mm,1.7μm),流动相乙腈(a)-0.1%甲酸水溶液(b)梯度洗脱(0~2.8min,10%a;2.8~8.0min, 10~18%a;8.0~12.2min,18~25%a;12.2~15.3min,25~40%a;15.3~17.4min, 40~40%a;17.4~20.5min,40~90%a),流速为0.4ml
·
min-1,柱温:30℃,进样体积2μl。
[0148]
质谱条件:电喷雾离子源,正、负离子模式扫描,毛细管电压为2.2kv,锥孔电压为40v,离子源温度120℃,脱溶剂气体流量500l
·
h-1
,脱溶剂气温度450℃,锥孔气体流量50l
·
h-1
,母离子碰撞能量6ev,碎片离子碰撞能量 20~50ev,扫描范围m/z 50~1600da。
[0149]
查阅文献并结合对照品指认,从单味药材、饮片、水煎液中间体、物质基准冻干粉、对照品等5个样品中的目标峰,进行紫外吸收特征和出峰时间双重比对,以保证准确指认,最后指认鉴定了30个化合物(具体信息见表16所示),结果表明,温经汤主要含有甘草中的三萜皂苷、人参皂苷、白芍中的单萜苷、鞣质类、牛膝中甾酮类、当归中酚酸类等,由此初步明确了温经汤水煎液或冻干粉中主要物质基础。
[0150]
表16质谱指认结果
[0151]
[0152][0153][0154]
综上,本发明采用hplc建立了温经汤冻干粉hplc特征图谱分析方法,在对15批温经汤冻干粉样品进行特征图谱分析的基础上,确定温经汤冻干粉的 10个共有特征峰,并且其具有良好地系统适用性,重复性和稳定性,可为后续温经汤的开发和质量控制提供依据。
进一步采用uplc-qtof-msn对冻干粉中的化学成分进行推测与指认,共指认鉴定了30个化合物,并做了来源药材归属,初步确定了温经汤冻干粉的主要物质基础。以上两方面数据结合来评价温经汤的质量更可靠。
[0155]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1