一种检测中和抗体的方法与流程
1.本发明属于生物检测领域,具体涉及一种检测中和抗体的方法。
背景技术:
2.疫苗是预防细菌病毒感染的重要手段之一。中和抗体是一种人体免疫系统产生,能够阻碍入侵的细菌或病毒感染人体。因此,测量体内中和抗体的效果是评估疫苗接种后有效性的主要方法。中和抗体的主要检测方法是利用抗原抗体的特异性结合和阻断感染的原理,通过显色反应或荧光强弱的变化来测量中和抗体浓度的高低。酶联免疫吸附剂测定(elisa)是中和抗体检测的常用方法之一,具有很好的灵敏度和检测稳定性,搭配自动化仪器也能实现高通量样本检测。但是对于大量样本的筛查工作,单孔单样本的检测方法限制了检测的灵活性和检测通量。
3.现有的elisa方法利用病毒蛋白-受体蛋白之间的相互作用,模拟活细胞感染病毒,通过显色反应来判断结果。当人体被2019-ncov感染未产生中和抗体时,酶标记的rbd蛋白片段就会与受体蛋白ace-2相结合,如果机体被2019-ncov感染产生中和抗体时,就会阻断rbd蛋白片段与受体蛋白ace-2相结合,从而导致显色减弱,与中和抗体有无呈负相关,通过校准品曲线可计算中和抗体的浓度。然而现有的elisa方法有诸多缺陷:1)在一个反应孔内对单靶标进行检测,不能对多靶标同时检测;2)在一个反应孔内只能检测一个患者样本,不能对多个患者样本同时检测;3)现有elisa方法的检测时间较长,由于孵育步骤较多,总体时间通常要2h以上(例如:加待检测样10分钟、孵育30min、洗涤10min、加标记抗体,孵育30min、洗涤10min、加染料孵育30min、洗涤10min,放机器里读数);4)现有elisa方法只能验证患者体内中和抗体对一种病毒阻断抑制效果,无法同时评估突变类型的阻断效果。
技术实现要素:
4.本发明所要解决的技术问题是为克服现有技术中抗体进行检测时存在的效率低下的缺陷,提供一种利用编码磁珠特别是数字编码磁珠对多样本中和抗体同时检测的方法。通过编码的磁珠也能对多靶标的中和抗体进行检测,大大的提高了检测的灵活性和检测通量,对于大样本的筛查有很大帮助。
5.本发明主要通过以下技术方案解决上述技术问题。
6.本发明提供一种检测待测样品中病原微生物中和抗体的方法,所述的方法包括如下步骤:
7.(1)将病原微生物受体结合域抗原修饰的编码磁珠与生物素标记的病原微生物受体以及待测样品进行混合、孵育,得孵育产物1;
8.(2)将所述孵育产物1与链霉亲和素-荧光染料混合、孵育,得孵育产物2;
9.(3)清洗所述孵育产物2并进行荧光强度分析、根据标准曲线计算待测样品中中和抗体的浓度。
10.步骤(1)中所述生物素标记的病原微生物受体的使用浓度较佳地为0.1μg/ml~
100μg/ml。
11.步骤(1)中所述孵育的时间较佳地为1min~60min,优选20min。
12.步骤(1)中所述病原微生物受体结合域抗原较佳地为新冠受体结合域抗原。
13.步骤(2)中所述链霉亲和素-荧光染料的用量优选依据步骤(1)中所述生物素标记的病原微生物受体的用量而定,所述生物素标记的病原微生物受体和所述链霉亲和素-荧光染料的质量比较佳地为5:6;
14.步骤(2)中所述孵育的时间较佳地为20min。
15.步骤(3)较佳地进一步包括:明场拍照,得到每种磁珠的编码信息,然后和荧光照片信息合并,得到不同样本或待测物的中和抗体信息。
16.在本发明一优选实施方案中,步骤(1)中先将所述生物素标记的血管紧张素转化酶2与所述待测样品孵育1min-60min后,再与病原微生物受体结合域抗原修饰的编码磁珠进行混合、孵育。
17.步骤(1)中所述病原微生物受体结合域抗原修饰的编码磁珠可为本领域常规,其制备方法包括如下步骤:
18.a).使用反应物nhs/edc处理编码磁珠;
19.b).加入病原微生物受体结合域抗原、孵育,得抗原修饰的编码磁珠。
20.其中,所述nhs(n-羟基琥珀酰亚胺)和所述edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)的用量摩尔比较佳地为1:10~10:1,两者浓度优选分别为5~500mg/ml,更优选均为20mg/ml。
21.以上步骤a)中所述处理的时间较佳地为10~60min,优选30min。
22.步骤b)中所述孵育的时间较佳地为14-22小时。
23.本发明中所用荧光染料较佳地为异硫氰酸荧光素(fluorescein isothiocyanate,fitc)或者alexafluor系列染料。
24.所述编码磁珠可为本领域常规,例如数字编码磁珠、荧光编码磁珠、条形码编码磁珠或者结构编码磁珠;所述数字编码磁珠具有多种编码图案,每种图案标记一种样本或一种中和抗体。
25.此外,本发明中步骤(3)中所述标准曲线的建立包括如下步骤:
26.1)将病原微生物受体结合域抗原修饰的编码磁珠与生物素标记的病原微生物受体以及一系列浓度梯度的待检测中和抗体进行混合、孵育,得孵育产物1;
27.2)将所述孵育产物1与链霉亲和素-荧光染料混合、孵育,得孵育产物2。
28.本发明还提供编码磁珠在竞争法检测抗体中的应用;所述编码磁珠优选数字编码磁珠、荧光编码磁珠、条形码编码或者结构编码磁珠。
29.如上所述,所述数字编码磁珠具有多种编码图案,每种图案标记一种样本或一种中和抗体。
30.利用数码磁珠对抗体类检测的通用流程:首先将抗原修饰在数码磁珠上,通过免疫反应对待测物进行捕获,然后通过生物素修饰的另一个抗体对检测物进行结合,并且加入链霉亲和素修饰的荧光基团,使荧光基团结合在待测物上(如图1所示)。最后进行拍照,可以先在白光下获得磁珠编码,再利用激光激发测荧光强度,或者先检测荧光强度,在进行明场拍照,得到待测物的荧光值和磁珠编码信息,和标准曲线进行对比,计算待测物浓度。
31.通过具有不同编码信息的数码磁珠对待测样本进行孵育后,检测的荧光强度可对应到相应编码信息,从而获得对应荧光值下的样本信息。当多靶标样本或者多患者样本混合检测时,通过磁珠上的编码信息进行患者区分。因此可以进行多靶标检测和多患者同时检测。
32.如本示例方法中对多患者模拟样本的新冠中和抗体的抑制效果进行检测,将新冠抗原通过新冠受体结合域抗原(rbd)上氨基和数码磁珠上的羧基进行偶联反应,使新冠受体结合域抗原(rbd)通过化学键修饰在数码磁珠上。当无中和抗体阻断时,新冠受体结合域抗原(rbd)与有生物素标记的血管紧张素转化酶2(ace2)结合,然后链霉亲和素修饰的藻红蛋白结合到生物素标记的血管紧张素转化酶2(ace2)上,通过拍照获取数码磁珠的编码信息,同时也得到荧光信号。当有中和抗体存在时,新冠受体结合域抗原(rbd)与有生物素标记的血管紧张素转化酶2(ace2)结合受到抑制,随着中和抗体的浓度越来越大,阻碍的效果越明显,所以显示的荧光强度会越来越弱(如图1所示)。
33.对于不同患者样本的检测流程:先将患者样本,新冠受体结合域抗原(rbd)修饰的编码磁珠,生物素标记的血管紧张素转化酶2(ace2)三者进行孵育,然后将孵育后的产物混合到一个反应孔内,可以5混1,10混1或者20混1。混合后的样本进行荧光染色,最后进行拍照,所得到的待测物的荧光值可以对应到编码信息,进而进行患者样本的区分(如图2所示)。具体地:编码的信息通过明场的磁珠形状进行区分,荧光是暗场中磁珠荧光强度。因此,明场拍照一次,暗场拍照一次,荧光的强度显示抗体浓度。
34.利用图案编码磁珠标记不同的样本,混合检验的方法是本方案特有的,且使用明暗场拍照解码的方式进行区分(其他的编码方式可能为条形码编码,荧光编码)
35.为了进一步提高抗体在磁珠上偶联的效率降低,从而不影响检测效果,所述nhs和所述edc的用量摩尔比为1:10~10:1,两者浓度优选分别为5~500mg/ml,更优选均为20mg/ml。
36.对于普通类型和突变类型的区分:在不同的编码磁珠上分别修饰不同类型的新冠受体结合域抗原,如0001对应普通型,0002对应突变类型a,0003对应突变类型b。当患者样本进行检测孵育时,3种抗原修饰的编码磁珠同时加入同一反应孔中,根据对应编码的荧光强弱进行阻断抑制效果的评估(如图3所示)。
37.本发明的积极进步效果:
38.a.本方案利用编码磁珠对于多靶标检测,和多患者检测具有可实施性,提高一次检测的效率和通量,降低检测荧光染料的用量,降低试剂盒成本。
39.b.检测流程大大缩减了检测孵育时间,只需要加入检测试剂盒待测样本后一次20分钟孵育即可检测。总检测时间控制在1小时以内得到检测结果。
40.c.多靶标检测的另一个好处是:当病毒存在变异时,可同时评估多种疫苗对于变异病毒的阻断抑制效果。比如一个人打完疫苗后对普通新冠病毒的阻碍效果,和英国突变株,南非突变株的抑制效果同时检测。
附图说明
41.图1为利用数码磁珠对抗体类检测的通用流程;对中和抗体的竞争法检测原理。
42.图2为不同患者混合检测流程。
43.图3为对不同突变类型的阻断抑制效果检测流程。
44.图4为不同浓度的标准品溶液的检测荧光强度。
45.图5a为采用本技术示例1方法测试混有不同浓度的血浆模拟样本的抑制效率。
46.图5b为用现有技术elisa测试的混有不同浓度的血浆模拟样本的抑制效率。
47.图6为采用本技术示例2方法混合测试混有不同浓度的血浆模拟样本的抑制效率;a-e:5种编码磁珠单独测试结果和混合测试结果的对比,圆形曲线代表单独检测结果,方形代表混合检测结果。f:5种混合测试结果。
具体实施方式
48.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
49.数字编码磁珠,新冠受体结合域抗原(菲鹏生物股份有限公司);
50.生物素修饰的血管紧张素转化酶2(菲鹏生物股份有限公司);
51.链霉亲和素藻红蛋白(sa-pe)(生工生物工程(上海)股份有限公司);
[0052]1×
tbst缓冲液(生工生物工程(上海)股份有限公司),胎牛血清。
[0053]
以上物料均直接从供应商采购,拍照仪器为本公司自制原型机。
[0054]
缓冲液配制:
[0055]
清洗缓冲液(50mm的mes):准备800ml的超纯水加入到烧杯中,加入9.762g mes粉末,充分溶解后用10m的氢氧化钠溶液调节ph至5.0-6.0之间,最后补水至总体积1l。
[0056]
封闭液(含2%bsa的tbst):配制1l的1x的tbst溶液,在溶液里加入20mg的bsa粉末充分溶解。
[0057]
分析缓冲液(含10%fbs的tbst):配制1l的1x的tbst溶液,在溶液里加入100ml胎牛血清。
[0058]
实施例1 新冠受体结合域抗原修饰的数字编码磁珠制备(dmb-rbd)
[0059]
1、抗体的预处理
[0060]
a)在节流孔径50k的超滤管中加入500μl抗体,4℃8000rpm离心4分钟。
[0061]
b)弃掉管中下部液体,加入500μl 1x的pbs,4℃8000rpm离心4分钟。
[0062]
c)重复上述步骤3次。
[0063]
d)超滤后用nanodrop测量抗体浓度。
[0064]
2、数字编码磁珠处理
[0065]
1)取出50μl数字编码磁珠母液,用500μl清洗缓冲液清洗2-3次,最后加入200μl清洗缓冲液;
[0066]
2)用清洗缓冲液配制20mg/ml的nhs和edc母液,加入30μl edc和6μl nhs,室温孵育30分钟;
[0067]
3)加入30μg病毒s蛋白抗原量进行室温过夜孵育;
[0068]
4)加入500μl封闭液进行室温孵育2小时;
[0069]
5)用500μl tbst溶液清洗3次,清洗后定容到200μl后保存待用。
[0070]
实施例2 待测物检测
[0071]
1)新冠受体结合域抗原修饰的数字编码磁珠配制:
[0072]
取实施例1制备得到的数字编码磁珠母液,用分析缓冲液进行稀释100倍。
[0073]
2)生物素标记的血管紧张素转化酶2配制:
[0074]
用分析缓冲液稀释到2.5μg/ml。
[0075]
3)链霉亲和素藻红蛋白配制:用分析缓冲液配制终浓度3μg/ml。
[0076]
a.示例1测试流程
[0077]
1)在黑色96孔板中加入50μl不同浓度的标准品或者混有不同浓度标准品的血浆模拟样本,50μl生物素标记的血管紧张素转化酶2试剂;
[0078]
2)孵育20min后加入50μl新冠受体结合域抗原修饰的数字编码磁珠,孵育20min;
[0079]
3)清洗后加入50μl链霉亲和素藻红蛋白37℃温育20min;
[0080]
4)洗板机清洗4次;
[0081]
5)清洗后用分析缓冲液补齐液面放入拍照机器中检测。
[0082]
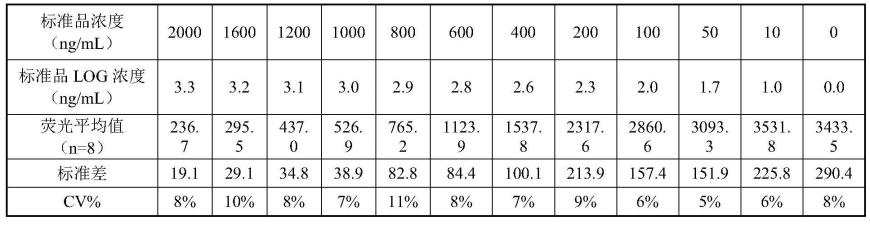
结果如图4所示,以浓度的log值作为x轴横坐标,检测的相对荧光强度作为y轴。曲线呈s型分步,相关系数r2值为0.999。说明对于浓度10-4000ng/ml的标准品检出效果很好。并且每个检测结果稳定计算变异系数cv小于15%。
[0083]
从图4、图5a和图5b可以看出本技术方案对于新冠中和抗体的抑制效率的检测结果用下面公式进行计算,抑制率大于20%的判定为阳性,小于等于20%的判定为阴性,和现有技术elisa检测的结果一致,如表1所示对于同一样本的阳线检出结果一致。
[0084][0085]
表1:不同浓度的标准品溶液的检测对应的荧光值统计
[0086][0087]
表2:现有方案和本方案对于同一模拟样本的判定结果。
[0088]
样本荧光值抑制率理论浓度(ng/ml)本方案结果现有方案结果262.194%2000++343.692%1800++427.390%1600++620.986%1400++703.884%1200++941.679%1000++1171.973%800++1626.663%600++2459.644%400++
2799.337%300++3079.030%200++3849.913%100
‑‑
3999.69%80
‑‑
4168.65%10
‑‑
4060.78%1
‑‑
[0089]
注:+代表阳线,-代表阴性
[0090]
b.示例2测试流程
[0091]
1)在黑色96孔板中加入50μl不同的模拟样本,来模拟不同患者样本,50μl生物素标记的血管紧张素转化酶2试剂;
[0092]
2)加入50μl具有不同编码的新冠受体结合域抗原修饰的数字编码磁珠;
[0093]
3)清洗后将样本转移至同一个反应孔中,加入50μl链霉亲和素藻红蛋白37℃温育20min;
[0094]
4)洗板机清洗4次;
[0095]
5)清洗后用分析缓冲液补齐液面放入拍照机器中检测。
[0096]
通过示例2方法流程对5种模拟样本进行混合检测,分别采用编码3551、4085、0005、4055和3775对不同模拟样本(样本a-e,模拟代表来自不同患者的样本)进行孵育进行区分。结合后的产物转移至同一个反应孔内进行荧光染色。通过图6的结果来看,a-e为模拟样本分别进行单独检测和混合检测的结果对比,可以发现混合检测的结果和单独检测的结果一致。对五种数码磁珠赋予不同的结果判定值,对同一组样本进行分析,得到的结果一致(表3)。因此可以证明此方案可以同时进行多样本检验。
[0097]
表3:本方案示例2对于同一模拟样本的判定结果五种样本混合检测的抑制率结果。
[0098][0099]
虽然以上描述了本发明的具体实施方式,但是本领域的技术人员应当理解,这些仅是举例说明,在不背离本发明的原理和实质的前提下,可以对这些实施方式做出多种变更或修改。因此,本发明的保护范围由所附权利要求书限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1