一种用于生猪运输应激预警的试剂盒及其预警方法
1.本发明属于活体应激预警技术领域,尤其涉及一种用于生猪运输应激预警的试剂盒及其预警方法。
背景技术:
2.运输是畜牧兽医生产中重要的环节之一。运输应激是动物在运输过程中因为晕车,高湿,高温,寒冷,挤压,缺水等应激作用产生的紧张状态和防御性综合反应。生猪是运输应激敏感的动物,运输应激常导致其免疫力及抗氧化能力降低,抗病能力下降,传染病流行甚至死亡,严重影响猪肉品质、生产效益和防疫安全,给生猪屠宰、肉制品销售以及畜牧生产等造成重大经济损失,因此预防和缓解生猪运输应激是畜牧生产中的重要研究领域。由于生猪运输应激缺乏特征性、典型的临床表现,且无简便、敏感的检测方法及特异性的生物标志物,生猪运输应激预警与检测一直是一个棘手的难题,因此建立高灵敏检测方法和有效的运输应激预警模型对采取相应措施预防或缓解生猪运输应激具有重要的意义。研究显示,运输应激会引起生猪多器官损伤,对肠道损失尤为明显,肠道作为应激反应的始动器官,其损伤程度可反映生猪应激水平。二胺氧化酶(dao)是哺乳动物小肠粘膜上层绒毛中具有高度活性的细胞内酶,在组胺和多种多胺代谢中起作用,血清中dao活性能反映肠道机械屏障的完整性和受损伤程度,并且dao被认为是肠道损伤重要的生物标志物,但dao能否作为生猪运输应激的标志物参与预警的作用并不清楚。
3.dao的检测主要有速率法或分光光度法,速率法测定需要全自动或半自动生化分析仪,仪器设备昂贵,操作过程繁琐,计算复杂;分光光度法一次性检测的样品较少,不能用于大量样品检测,重复性差、误差大;免疫学检测方法具有高特异性、高灵敏度和易操作、实用性广等优点,该技术便于运输应激预警和生产实际中推广应用。本发明通过分析生猪运输时间、血清dao水平、肠道损伤评分之间的关系,建立猪dao免疫学检测方法,初步阐明dao在生猪运输应激预警中的作用。
技术实现要素:
4.本发明实施例提供一种用于生猪运输应激预警的试剂盒及其预警方法,旨在解决目前生猪运输应激预警及高灵敏预警方法中缺失的问题。dao是哺乳动物小肠粘膜上层绒毛中具有高度活性的细胞内酶,在组胺和多种多胺代谢中起作用,本发明通过分析生猪运输时间、血清dao水平与肠道损伤之间的关系,制备猪dao多克隆抗体,并建立了基于dao的免疫学检测方法与预警模型,明确dao在生猪运输应激预警中的作用。
5.本发明实施例是这样实现的,一种用于生猪运输应激预警的试剂盒,包括微孔板、猪dao标准品、包被液、洗涤液、封闭液、磷酸盐缓冲液、dao多克隆抗体、hrp标记的二抗、tmb底物溶液、终止液。
6.所述包被液,由以下方法制备获得:取nahco
3 2.93g,na2co
3 1.59g于 900ml ddh2o中,搅拌至完全溶解,调ph值至9.6,定容至1l。
7.所述洗涤液(pbst),由以下方法制备获得:取kcl 0.2g,nacl 8g, kh2po
4 0.27g,nahpo
4 1.42g于900ml ddh2o中,搅拌至完全溶解,加入 0.5ml tween 20,定容至1l。
8.所述磷酸盐缓冲液,由以下方法制备获得:称取kh2po
4 0.41g,k2hpo
4 5.59g,调ph值至8,定容至1l。
9.所述终止液为2mol/l h2so4溶液。
10.本发明提供了一种用于生猪运输应激预警的预警方法,采用上述生猪运输应激预警的试剂盒,将肠道损伤标志物dao可用于生猪运输应激预警,具体方法步骤为:
11.(1)分离待测的生猪血清,将血清作为待测血清样品;
12.(2)将梯度浓度的猪dao标准品、待测血清样品分别加入微孔板,包被;
13.(3)弃去微孔板中的液体,每孔加250μl洗涤液进行洗涤,拍干;
14.(4)每孔加250μl封闭液,湿盒封闭,甩出封闭液后洗3-4次,拍干;
15.(5)用磷酸盐缓冲液将dao多克隆抗体进行稀释,100μl/孔,第一次湿盒孵育,将微孔板内液体甩出后洗4-5次,拍干;
16.(6)将hrp标记的二抗用磷酸盐缓冲液稀释成工作浓度,100μl/孔,进行第二次湿盒孵育;甩出孔内液体后洗4-5次,拍干;
17.(7)加tmb底物液100μl/孔,避光孵育15min;
18.(8)每孔加50μl终止液,用酶标仪测定450nm处的od值;
19.(9)根据测定的od值进行回归分析,绘制标准曲线,得到该标准曲线的回归方程,通过所述回归方程计算dao浓度;
20.(10)根据建立的预警方程y=4.4x+15.4,计算chiu’s评分等级;其中 y为dao浓度,x为肠道损伤评分;
21.(11)根据chiu’s评分等级评估肠道损伤水平和生猪运输应激状态。
22.其中:
23.步骤(2)中所述的梯度浓度的猪dao标准品,优选为标准品浓度分别是 5μg/μl、2.5μg/μl、1.25μg/μl、0.625μg/μl、0.3126μg/μl、0.15625μg/μl、 0.078125μg/μl、0.0390625μg/μl。
24.步骤(2)中所述的包被条件优选为:100μl/孔,4℃包被24h。
25.步骤(3)中所述的洗涤条件优选为:静置5min洗3次。
26.步骤(4)中所述的湿盒封闭的条件优选为:置37℃湿盒封闭2h。
27.步骤(5)中所述的第一次湿盒孵育的条件优选为:37℃湿盒孵育1h。
28.步骤(5)中所述的稀释优选为:dao多克隆抗体:磷酸盐缓冲液=1: 8000-16000。
29.步骤(6)中所述的工作浓度为,hrp标记的二抗:磷酸盐缓冲液=1:5000。
30.步骤(6)中所述的第二次湿盒孵育的条件优选为:于37℃湿盒孵育0.5h。
31.步骤(10)中所述chiu’s评分等级标准为:0级为正常肠绒毛;1级为小肠上下皮间隙增大,通常发生在绒毛的尖端,常伴随有毛细血管淤血;2级为上下皮间隙扩张伴随上皮层固有层的中度分离;3级为绒毛两侧上皮层大量的同固有层分离,部分绒毛顶端破损;4级为绒毛破损伴随固有层毛细血管暴露,可能观察到固有层的细胞成分增多;5级为固有层破坏和不完整、出血和溃疡。
32.步骤(11)中所述生猪运输应激状态,评判标准为:chiu's评分大于或等于2.24,为
应激状态;chiu's评分小于2.24,为非应激状态。
33.本发明与现有技术相比具有如下的有益效果:
34.1.确定了dao作为肠道损伤生物标志物可用于生猪运输应激预警。本发明中生猪分别运输3.5h和5h后,利用速率法检测dao水平,随着运输时间延长,血清中dao水平逐渐增加,运输5h后差异显著,表明dao与运输应激相关。利用肠黏膜损伤程度评分与血浆dao活性变化进行回归分析,可得下列方程,y=0.2513x2+0.1617x+13.54(y为dao浓度,x为肠道损伤评分),利用该方程,可计算肠道损伤评分,表明dao作为生物标志物可用于生猪运输应激预警和检测。目前dao的测定是主要是速率法或分光光度法,速率法需要昂贵的全自动或半自动生化分析仪器,该方法操作繁琐,计算过程复杂,分光光度法测定误差大,而免疫学检测方法具有高特异性、高灵敏度和易操作、实用性广等优点,便于运输应激预警和生产实际中推广应用。
35.2.制备了dao多克隆抗体并建立了间接elisa检测。本发明以dao为免疫原,弗氏佐剂和弗氏不完全佐剂免疫新西兰大白兔,采用间接elisa方法检测免疫效果,兔多抗效价均达到50万。在此基础上建立了间接elisa检测方法,标准曲线为:y=4.8393x+0.1585(r2=0.9774),最低检出量为0.01953125 μg/ml,组内变异系数、组间变异系数均低于10%,有较好的重复性。在此基础上,建立了针对dao的检测的间接elisa检测系统,检测灵敏度和特异性良好。
36.3.建立了基于dao的生猪运输应激预警模型。本发明利用肠黏膜损伤程度chiu
′
s 6级评分与dao水平变化进行回归分析,利用dao间接elisa技术建立了猪肠道损伤评分与血清dao之间的线性预警模型,其预警方程为:y= 4.41x+15.45(y为dao浓度,x为肠道损伤评分),根据诊断试验评价标准,敏感性为93.33%,准确性为87.5%,利用该方程,可根据血清dao含量计算肠道损伤的chiu
′
s 6级评分,通过chiu
′
s 6级评分判断应激水平;建立了运输应激评判标准:chiu's评分大于等于2.24,为应激状态;chiu's评分小于2.24,为非应激状态。本发明建立的方法操作简单、使用的酶标仪价格便宜,预警方程计算简便,建立的模型对运输应激预警有较高的应用价值,可应用于生猪运输应激肠道损伤的预警。
37.4.本发明通过分析血清dao含量、肠道损伤评分与生猪运输应激预警的关联,提供一种用于生猪运输应激预警的试剂盒及其预警方法,通过对待测生猪血液中的dao的间接elisa检测,可计算肠道损伤水平,准确判断生猪是否发生应激反应,为生猪运输应激提供预警,可以有效减少运输应激带来的经济损失。
附图说明
38.图1为本发明实施例1的生猪不同运输时间血清dao活性的变化柱状图。
39.图2为本发明实施例1的不同运输时间对肠道形态结构影响的he染色结果图;其中:a对照组,b运输3.5h组,c运输5h组。
40.图3为本发明实施例1中不同运输时间肠绒毛长度的变化结果图。
41.图4为本发明实施例1中不同运输时间隐窝深度的变化结果图。
42.图5为本发明实施例1中肠黏膜损伤评分结果图。
43.图6为本发明实施例1中生猪运输时间与肠黏膜损伤的关系结果图。
44.图7为本发明实施例1中血清dao活性与肠道损伤评分值曲线拟合图。
45.图8为本发明实施例2中dao多克隆抗体效价结果图。
46.图9为本发明实施例2中最佳包被条件的选择的结果图。
47.图10为本发明实施例2中最佳封闭液的选择的结果图。
48.图11为本发明实施例2中最佳封闭时间的选择的结果图。
49.图12为本发明实施例2中的一抗最佳反应时间的结果图。
50.图13为本发明实施例2中的hrp山羊抗兔酶标二抗最佳稀释倍数结果图。
51.图14为本发明实施例2中的hrp山羊抗兔酶标二抗最佳反应时间结果图。
52.图15为本发明实施例2中的标准曲线结果图。
53.图16为本发明实施例3中不同运输时间dao含量间接elisa检测的结果图。
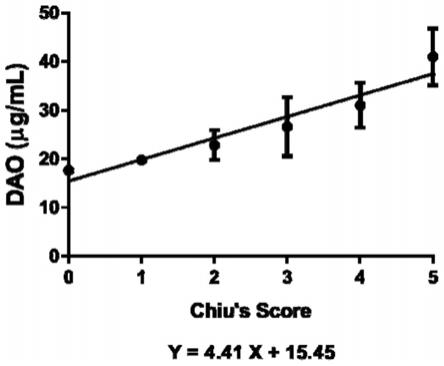
54.图17为本发明实施例3中dao含量与肠道损伤chiu’s评分之间的关系回归分析图。
55.图18为本发明实施例3中不同肠道chiu
′
s评分dao含量的结果图。
具体实施方式
56.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
57.目前生猪运输应激预警及高灵敏预警方法缺失的问题,为了解决上述技术问题,本发明提出了一种用于生猪运输应激预警的试剂盒及其预警方法。
58.实施例一.dao可用于生猪运输应激预警
59.1实验方法
60.1.1实验动物与主要试剂
[0061][0062][0063]
1.2实验动物
[0064]
选取24头体重约100kg的杜长大三元商品猪,适应性饲养一周。实验前禁食24h,自由饮水。随机分为三组,每组8头。将每组杜长大生猪驱赶至车况相近的运输车内,沿相同路线,从湖北省武汉市新州区养殖场运输至中粮集团武汉市江夏区屠宰场。对照组:生猪运输
至屠宰场过夜休息,第二天屠宰; 3.5h组:生猪运输3.5h至屠宰场立即屠宰;5h组:生猪运输5h至屠宰场立即屠宰。
[0065]
1.3标本采集
[0066]
每只杜长大生猪取血50ml,4℃析出血清,4℃3000r/min离心10min,冻存至-80℃以备检测。取每头猪空肠相同部位2cm,4%福尔马林固定,he 染色。
[0067]
1.4血清dao水平分析
[0068]
dao活性的速率法检测,所得血清用全自动生化分析仪(荷兰威图selectra xl)进行dao活性的测定。其具体检测方法如下:
[0069]
1.4.1 dao速率法试剂盒成分
[0070]
试剂盒由tris-hcl缓冲液(ph 7.4)、nadh(0.25mmol/l),gldh(> 2000u/l),1.4丁二胺(≥12mmol/l)混合配制成单一试剂。
[0071]
1.4.2检测原理
[0072]
用速率法检测dao的活性,即利用dao催化丁二胺产生nh3和h2o2。 nh3和α酮戊二酸在谷氨酸脱氢酶(gldh)作用下,生成谷氨酸,使nadh 氧化成nad
+
,在340nm波长下测定nadh每min吸光度下降值,即为dao 活性。
[0073]
1.4.3主要参数(见表1)
[0074]
表1参数表
[0075][0076]
将表中参数输入全自动生化分析仪,按说明书指示加入试剂盒和血清,测定,得到血清dao活性。
[0077]
1.4.4计算公式
[0078]
酶活力单位定义:每升血清或血浆在37℃条件下每min催化1μmol nad +定义为一个酶活力单位。
[0079]
[0080]
△
a/min为每min吸光度的变化值;103为mmol/l转化μmol/l的因数; 6.3为nadh在340nm处的毫摩尔消光系数;vt为反应液总体积,vs为样品体积。
[0081]
1.5组织学检查
[0082]
1.5.1空肠he染色
[0083]
(1)固定过夜后将空肠段常规脱水、包埋,切片,-20℃保存备用。
[0084]
(2)60℃烤15min,常规脱蜡入水:二甲苯(ⅰ,ⅱ)各5min
→
100%乙醇,1min,重复一次
→
95%乙醇,1min
→
90%乙醇,1min
→
80%乙醇,1min
→
70%乙醇,1min
→
pbs洗涤,5min
→
自来水洗5min
[0085]
(3)苏木素染色5min,自来水洗净,在盐酸乙醇中提插数下,自来水浸泡15min,返蓝。
[0086]
(4)伊红染色2min,蒸馏水洗净。
[0087]
(5)常规脱水透明:70%乙醇,1min
→
80%乙醇,1min
→
90%乙醇, 1min
→
95%乙醇,1min
→
100%乙醇,1min,重复一次
→
二甲苯各5min.
[0088]
(6)中性树胶封片。
[0089]
(7)显微镜下镜检观察并照相。
[0090]
1.5.2小肠组织学观察结果判断标准
[0091]
采用chiu’s等六级评分法对小肠黏膜损伤程度进行评分(chiu et al1970),使用image-pro plus分析切片的肠绒毛长度和隐窝深度。评分标准见表2。
[0092]
表2 chiu’s评分标准
[0093][0094][0095]
1.5.3统计处理
[0096]
用xlstat对所得数据进行单因素方差分析(anova),线性回归分析(linear
regression),用graphpad prism分析组间数据的差异性。
*
p《0.05有统计学差异,
**
p《0.01有显著统计学差异,
***
p《0.001有极其显著的统计学差异。
[0097]
2.实验结果与分析
[0098]
2.1运输时间对血清dao活性的影响
[0099]
利用速率法测定各组血清dao活性,如图1所示,与对照组相比,运输3.5 h后生猪血清dao活性显著升高(p<0.01),运输5h后,生猪血清dao活性进一步升高(p<0.001),表明随着运输时间的延长,生猪血清dao活性逐渐增加,提示生猪肠道损伤水平可能会增加。
[0100]
2.2运输应激对肠道形态结构的影响
[0101]
利用he染色分析运输应激肠黏膜损伤情况。结果如图2显示:对照组肠黏膜形态结构基本完整,肠绒毛直立,无形态破损(图2-a);运输3.5h组,绒毛两侧上皮层部分同固有层分离,大量绒毛顶端破损(图2-b);运输5h组,固有层被破坏,明显观察到固有层不完整,并常常伴随肠道出血和溃疡(图 2-c)。证明随着运输时间的延长,肠道损伤逐渐增加。
[0102]
2.3运输应激对肠绒毛长度及隐窝深度变化的影响
[0103]
对肠道进行he染色,用image-pro plus分析肠绒毛长度,如图3所示,与对照组相比,运输3.5h后,肠绒毛长度没有明显变化,运输5h后,肠绒毛长度变短且差异极显著(p<0.001)。表明随着运输时间的延长,肠绒毛损伤加重,肠绒毛越短。
[0104]
将得到的he染色切片用image-pro plus分析隐窝深度,如图4所示,与对照组相比,运输3.5h组空肠段隐窝深度显著加深(p<0.01),随着运输时间达到5h,隐窝深度进一步加深(p<0.001),表明随着运输时间的延长,隐窝深度会进一步的加深。
[0105]
2.4不同运输时间肠黏膜损伤情况
[0106]
如图5所示,采用chiu’s评分标准对不同组别的he染色切片进行评分, (评分标准见表2)。将评分结果进行统计,得到表3。对照组肠黏膜损伤最小,但肠道损伤评分离散程度较大,其中0分有1头,1分有3头,2分有两头,3 分1头,4分1头。运输3.5h组肠黏膜损伤评分集中在3分,运输5h组肠黏膜损伤最为严重,评分2分1头,4分2头,5分5头。
[0107]
表3不同组别肠黏膜损伤情况
[0108][0109]
2.5运输时间与肠黏膜损伤程度的相关性
[0110]
将评分结果按照运输时间用graphpad进行统计分析,如图6所示,小肠黏膜的损伤程度随运输时间延长而加重,小肠黏膜的损伤评分增高,表明生猪运输时间与肠黏膜损伤评分呈明显的正相关关系。对照组空肠壁完整、柔软,无明显异物,食糜正常,光镜下可见小肠壁结构基本正常,肠绒毛直立,绒毛上皮连续,基本无脱落破损,固有层无充血,水肿,小肠腺完整,未见明显淋巴及吞噬细胞浸润,黏膜损伤评分数chiu’s=1.67
±
1.5分。运输
3.5h组,肠管充血水肿,光镜下可见上下皮间隙增大,通常在绒毛的尖端,常伴随有毛细血管的淤血,黏膜损伤评分数chiu’s=3.125
±
0.35分(p<0.01)。运输5h组,肠管充血,有黄色粘液状渗出物,光镜下可见绒毛两侧上皮层大量同固有层分离,绒毛破损,固有层成分增多。chiu’s=4.375
±
1.06分。由图6可以看出,随着运输时间延长,肠黏膜损伤逐渐加重(p<0.001)。
[0111]
2.6不同肠黏膜损伤程度血清dao活性的变化
[0112]
将所有样本根据肠黏膜损伤评分,并对应其肠黏膜损伤程度,进行统计学分析。由表4可见,与肠黏膜损伤chiu’s=0分相比,chiu’s=2分时dao 活性即有显著升高(14.87
±
0.33u/l versus 13.6
±
0u/l,p<0.01),肠黏膜损伤程度越重,dao活性越高,当黏膜损伤程度评分为5时,dao达到峰值(20.7
±
1.04u/l,p<0.001)
[0113]
表4不同肠黏膜损伤程度血清dao活性变化
[0114][0115]
用graphpad prism进一步分析所得数据,得到血清dao活性与肠道损伤评分值曲线拟合图(图7),得到生猪肠黏膜损伤程度评分与血清dao活性曲线拟合方程y=0.2513x2+0.1617x+13.54(r2=0.9956p<0.05);其中y是测得的血清dao活性,将其带入拟合方程,得到chiu’s评分的值,再结合实际情况,可以判断肠黏膜损伤程度,预估生猪应激状态。
[0116]
本实验通过模拟运输应激,分析不同运输时间肠道的损伤程度、血清中dao 的活性变化,探讨由血清中dao的活性来推测肠道病理损伤程度,进而判断运输过程中动物的应激情况,目前未见有相似的文献报道。本次实验选取dao也是为了验证dao在运输应激中作为一种血清标志物的灵敏度、特异性和时效性,为进一步建立dao的血清学检测方法打下基础。
[0117]
本实验结果显示(图1),运输3.5h时,与对照组相比dao发生显著升高,证明运输3.5h时dao通过肠细胞间隙进入血液循环,使血清中dao活性迅速升高。运输到5h时,虽与3.5h相比血清dao活性进一步升高,但是差异显著性缩小。同时由图2-b染色切片可以看出,运输3.5h时,小肠绒毛顶端开始大量破损、断裂;由图3、4可以看出,运输3.5h时,肠绒毛长度尚未见没有明显变化,但隐窝深度开始加深,血清中dao活性已有明显的升高,表明dao 是一种优秀的运输应激预警的标志物。
[0118]
由图6可以看出,生猪运输时间与肠黏膜损伤程度呈明显正相关(p< 0.01),随运输时间的延长,肠黏膜的损伤程度逐渐加重,在运输5h时,有个别猪只出现了肠黏膜大量脱
落,肠管内含大量黄色内容物,显微镜下可见肠绒毛几乎完全脱落只剩固有层(图2-c),肠黏膜损伤。从图表中可以看出,在运输过程中,chiu’s=2时,与chiu’s=0时相比血清dao水平明显升高,此时生猪肠黏膜损伤程度较轻微,如果适当干预,损伤是完全可逆的,已有学者研究证明,在肠道发生应激损伤的早期,通过人为干预降低应激反应或给予药物治疗,肠道的损伤是完全可逆的。
[0119]
通过进一步分析不同损伤水平与dao活性之间的变化,可得血清dao活性与肠道损伤评分值曲线拟合图(图7),其回归方程为y=0.2513x2+0.1617x+ 13.54(r2=0.9956p<0.05),其中y为血清中dao的活性,x为肠道损伤 chiu’s评分,只需要检测生猪血清中dao的活性,就可以代入方程式,得出肠道损伤的程度,为运输应激做出预警,为进一步进行预防和干预提供依据。从上述研究中可以看出,dao可以作为运输应激肠道损伤标志物,用于运输应激预警和检测。
[0120]
实施例二.dao多克隆抗体的制备
[0121]
1.实验方法
[0122]
1.1兔多克隆抗体的制备
[0123]
选用约2.0kg的spf级健康雌性新西兰大白兔2只,免疫前先取耳静脉血为阴性对照。以dao为免疫原,取1mg dao用生理盐水稀释到1ml,加入等体积弗氏佐剂(初次免疫用弗氏完全佐剂,加强免疫用弗氏不完全佐剂),混匀器混匀,形成油包水。采用背部皮下注射法每次打8~10个点,首次按0.5mg/ 只皮下多点接种,第2次将减半计量的dao抗原与弗氏不完全佐剂充分混合乳化,加强免疫一次。第3次以二次免疫的剂量进行,免疫进行3次加强免疫,每次间隔10~14d。最后1次加强免疫后的第7d,兔子耳缘静脉采血,间接 elisa测定免疫效价合格后,颈动脉取血,3000r/min,离心10min收集抗血清。分装成小管,冻存于-80℃冰箱备用。
[0124]
1.2兔多克隆克隆抗体的纯化
[0125]
抗体纯化试剂盒选择北京博奥龙蛋白g重力预装柱套装(bdtl0003-k)。
[0126]
(1)将预装柱固定在铁架台上,依次去掉下端塞和上端塞,流干预装柱的保护液;
[0127]
(2)向柱管中加入5ml结合buffer,平衡柱子,流干结合buffer后,再重复2次,共使用15ml结合buffer平衡;
[0128]
(3)将处理好的样品加入柱管,收集流出液,用于sds-page分析蛋白质的结合情况;
[0129]
(4)柱管加入5ml洗杂buffer,进行洗杂,去除非特异性吸附的杂蛋白,收集洗杂液,目的与收集流出液的目的相同,洗杂buffer流干后,再重复 5次,共使用30ml洗杂buffer洗杂;
[0130]
(5)使用15-30ml的洗脱buffer进行洗脱目的蛋白,分段收集,每5ml 收集1管,分别检测;
[0131]
(6)依次使用5ml结合buffer和5ml去离子水交替平衡填料,重复2 次,最后再用5ml 20%的乙醇平衡填料,重复1次,然后保存在等体积的20%的乙醇中,置于4℃保存,防止填料被细菌污染。
[0132]
纯化后的抗体sds-page鉴定,针对有条带的洗脱液选用超滤管进行浓缩。注意截留分子量越大,越容易离心,不要一次浓缩很高倍数。通常4ml 的浓缩管,加3ml样品,浓缩
到500μl左右,就要取出,用枪头混匀一次,避免极化效应。
[0133]
1.3elisa检测多克隆抗体效价
[0134]
(1)将dao用ph 9.6碳酸盐缓冲液稀释为0.625μg/ml,每孔100μl,4℃包被过夜,pbst洗涤3次;
[0135]
(2)加入50g/l的脱脂奶粉封闭,每孔200μl,37℃封闭2h,
[0136]
(3)pbst洗涤3次;加入倍比稀释的多抗血清(1∶1000~1∶4096000), 100μl/孔,37℃孵育1h,同时用免疫前血清作为阴性对照,用pbst洗涤3 次;
[0137]
(4)二抗为hrp标记的羊抗兔igg(1∶5 000),37℃孵育0.5h,用pbst 洗涤3次;
[0138]
(5)加入100μl/孔tmb工作液,避光显色15min;
[0139]
(6)加入50μl/孔的2mol/l h2so4终止液,酶标仪测定od450nm。
[0140]
判定标准:s/n=(样品od450nm)/(阴性对照od450nm),s/n》2.1为阳性。实验以免疫前血清为阴性对照,以稀释液pbs为空白对照。结果如图所示(图 8),两只兔子效价均达到50万。
[0141]
1.4elisa检测方法的建立
[0142]
1.4.1方阵滴定:
[0143]
1)将dao用ph 9.6的碳酸盐缓冲液倍比稀释成一系列浓度,然后将每种浓度的dao横向加入一行酶标板,每孔100μl,4℃过夜;
[0144]
2)弃去孔内液体,在吸水纸上轻轻扣打以除去残留液体,加入洗涤液约 250μl/孔,洗3次,静止5min;
[0145]
3)按每250μl/孔加入封闭液,置于37℃的湿盒2h,然后弃去孔内封闭液,在吸水纸上轻轻扣打以除去残留液体,加入洗涤液约250μl/孔,洗3次,每次3~5min。
[0146]
4)用磷酸盐缓冲液将dao多克隆抗体稀释至一系列浓度,纵向加入一列酶标板,每孔100μl,同时设阴性和空白对照,37℃反应1h;
[0147]
5)弃去孔内液体拍干,洗4次,将酶标抗体稀释成1:5000的工作浓度, 100μl/孔加入酶标板,37℃孵育1h;
[0148]
6)弃去孔内液体,洗5次,按100μl/孔加入tmb底物溶液,室温避光反应15min;
[0149]
7)每孔50μl加入终止液(2mol/l h2so4溶液),用酶标仪测出在450nm 处的od值。
[0150]
1.4.2间接elisa检测:
[0151]
1)将dao用碳酸盐缓冲液稀释成方阵滴定确定的最佳包被浓度,100μl/ 孔,4℃包被过夜;
[0152]
2)弃去孔内液体,每孔加250μl洗涤液,静置5min洗3次,拍干;
[0153]
3)每孔加250μl封闭液,置37℃湿盒封闭2h,甩出封闭液后洗3次,拍干;
[0154]
4)用磷酸盐缓冲液将dao多克隆抗体稀释至所需浓度,100μl/孔,37℃湿盒孵育1h;
[0155]
5)将微孔板内液体甩出后洗4次,拍干;
[0156]
6)将hrp标记羊抗兔二抗用磷酸盐缓冲液稀释成工作浓度1:5000,100μl/ 孔,于37℃湿盒孵育0.5h;
[0157]
7)甩出孔内液体后洗5次,拍干;
[0158]
8)加底物液100μl/孔,避光孵育15min;
[0159]
9)每孔加50μl终止液(2mol/l h2so4溶液),用酶标仪测定450nm处的 od值。
[0160]
1.4.3兔抗igg与dao最佳工作浓度的确定
[0161]
采用棋盘滴定法确定抗原抗体最佳反应浓度:
[0162]
将dao用包被稀释液作5μg/μl、2.5μg/μl、1.25μg/μl、0.625μg/μl、 0.3126μg/μl、0.15625μg/μl、0.078125μg/μl、0.0390625μg/μl倍比稀释,用脱脂奶粉将多克隆抗体稀释至1:2000、1:4000、1:8000、1:16000、1:32000、1:64000,每个浓度作一行加入酶标板中,通过分析od450nm值和p/n的值,选择最佳工作浓度。结果如下表(表5)所示,抗原最佳浓度为0.15625ng/μl,兔抗最佳稀释倍数为1:16000。
[0163]
表5抗原抗体最佳反应浓度
[0164][0165]
注:“+”标示为孵育的一抗为兔抗;
“‑”
标示为孵育的一抗为免疫前的兔血清
[0166]
1.4.4dao包被条件的选择
[0167]
dao用最佳工作浓度进行包被,将包被条件设置为37℃2h后4℃过夜、37℃1h后4℃过夜、4℃过夜、37℃1h、37℃2h等五个条件,其余步骤按照先前建立方法进行操作,分析od 450nm值以及p/n的值选择最佳包被条件。结果如图所示(图9),最佳包被条件为4℃过夜。
[0168]
1.4.5封闭液的确定
[0169]
最佳包被浓度和最佳包被条件将dao进行包被,只改变封闭夜,选择1% bsa、2%bsa、3%bsa、5%bsa和5%脱脂乳进行封闭,37℃封闭2h,其余步骤按照之前建立方法操作,在分析od 450nm值以及p/n值的基础上选择最佳封闭液。结果如图所示(图10),筛选出最佳封闭夜为5%脱脂乳。
[0170]
1.4.6封闭时间的确定
[0171]
最佳包被浓度和最佳包被条件将dao进行包被,封闭时用最佳封闭夜进行封闭,将
封闭时间分别设定为37℃60min,37℃90min,37℃120min,4℃过夜,只改变封闭时间,其余步骤按照之前所建立方法操作,分析od450nm 值以及p/n值选择最佳封闭时间,结果如图所示(图11),37℃120min和 4℃过夜差不多的效果,考虑到节约实验时间的问题,故最佳封闭时间为37℃ 120min。
[0172]
1.4.7兔抗反应时间的确定
[0173]
将dao按照已确定的最佳工作浓度和最佳包被条件进行包被,最佳封闭液和时间封闭,兔抗的反应时间分别设为37℃30min,37℃60min,37℃90 min,37℃120min,其余步骤按照所建立方法操作,分析od 450nm值比较接近1以及p/n值选择最佳反应时间,结果如图所示(图12),最佳兔抗反应时间为37℃60min。
[0174]
1.4.8酶标二抗最佳稀释倍数的确定
[0175]
最佳包被浓度和最佳包被条件将dao进行包被,选择最佳的封闭条件,兔抗的最佳反应时间,将二抗浓度按1:1000、1:2000、1:3000、1:4000、1:5000、 1:6000进行稀释,只对二抗浓度进行改变,其余步骤按照之前所建立的步骤进行,分析od450nm值比较接近1以及酶标二抗的稀释倍数越大选择二抗的最佳稀释倍数,结果如图所示(图13),酶标二抗的最佳稀释倍数为1:5000。
[0176]
1.4.9酶标二抗最佳反应时间的确定
[0177]
最佳包被浓度和最佳包被条件将dao进行包被,选择最佳封闭条件,兔抗最佳反应时间,二抗最佳反应浓度,只改变二抗反应时间,将二抗反应时间设为37℃30min,37℃45min,37℃60min,37℃90min,其余步骤按照之前建立方法操作,分析od 450nm值比较接近1以及p/n值选择最佳反应时间,结果如图所示(图14),最佳反应时间为37℃45min。
[0178]
1.4.10线性范围的确定
[0179]
将dao(最佳反应浓度)稀释后进一步倍比稀释直至蛋白标准品的浓度为横坐标,a450为纵坐标,找出线性范围较好的区间,绘制标准曲线,确定最低检测限,结果如图所示(图15)间接elisa标准曲线为:y=4.8393x+0.1585 (r2=0.9774)检测上限:1.25μg/ml,检测下限:0.00976562μg/ml检测范围: 0.01953125-0.3125μg/ml。
[0180]
1.4.11试剂性状的检测
[0181]
相关试剂置于4℃密封保存,在保存的6个月内,各试剂均清澈、透明、无絮状沉淀的存在。
[0182]
2.实验结果及分析
[0183]
成功制备了兔多克隆抗体,抗体效价达到50万;
[0184]
抗原最佳反应浓度:0.15625μg/ml;
[0185]
抗体的最佳稀释倍数:1:16000;
[0186]
最佳包被条件:为4℃过夜;
[0187]
最佳封闭液:5%脱脂奶粉;
[0188]
一抗反应时间:37℃60min;
[0189]
二抗稀释倍数:1:5000;
[0190]
二抗最佳反应条件:37℃45min;
[0191]
酶标二抗时间:15min;
[0192]
间接elisa标准曲线为:y=4.8393x+0.1585r2=0.9774;
[0193]
检测上限:1.25μg/ml;
[0194]
检测下限:0.01μg/ml;
[0195]
检测范围:0.02-0.3μg/ml。
[0196]
本试验通过dao多克隆抗体的制备,多抗效价达到50万,采用棋盘滴定法确定了抗原抗体的最佳反应浓度,并在此基础上优化了包被条件、封闭液、封闭时间和反应时间等条件,通过条件优化后建立了间接elisa检测方法,用于检测dao抗原,标准曲线为:y=4.8393x+0.1585(r2=0.9774),最低检出量为0.01953125μg/ml,证明了本检测方法的敏感性。组内变异系数、组间变异系数筠低于10%,有较好的重复性。综上所述,本试验建立了一个检测dao 的间接elisa检测体系,灵敏度和特异性良好,为氧化应激肠道损伤检测提供一种新方式。
[0197]
实施例三.基于dao运输应激的预警模型及效果
[0198]
1.实验方法
[0199]
1.1运输应激生猪血清dao间接elisa测定
[0200]
利用建立的间接elisa方法,根据筛选的抗原最佳反应浓度:0.15625μg/ml;抗体的最佳稀释倍数:1:16000;最佳包被条件:为4℃过夜;最佳封闭液:5%脱脂奶粉;一抗反应时间:37℃60min;二抗稀释倍数:1:5000;二抗最佳反应条件:37℃45min;酶标二抗时间:15min;分别对对照组、3.5h运输组和 5h运输组生猪血清dao含量进行测定。
[0201]
1.2预警模型建立
[0202]
根据dao水平与肠道损伤chiu’s评分之间的关系进行回归分析,建立预警模型的回归方程,用于运输应激预警分析
[0203]
1.3生猪运输应激评价诊断标准
[0204]
根据医学界诊断试验评价和确定的金标准(张丽帆等,2020.协和医学杂志),该标准是当前医学界认可的诊断疾病的准确可靠的方法。本发明根据该金标准制定了基于肠道损伤和血清dao水平的生猪运输应激诊断标准(表6)。
[0205]
表6诊断实验四格表
[0206][0207][0208]
敏感性=a/(a+c)准确性=(a+d)/n特异性=d/(b+d)
[0209]
1.4生猪运输应激预警模型评价
[0210]
根据诊断试验评价金标准中确定的方法,计算对照组血清dao水平95%双侧置信上限,其值为23.16μg/ml,以此为标准,大于此值的为血清阳性,小于等于此值的为血清阴性;同理根据对照组肠道chiu’s评分(表3),计算其 95%双侧置信上限,其值为2.82,以此为标准,大于此值的定义为肠道损伤阳性,小于此值的为肠道损伤阴性。根据表(6)对其评
价。
[0211]
1.5生猪运输应激状态的判断
[0212]
通过对不同损伤水平dao浓度分析,chiu’s为3的dao水平显著高于 chiu’s为2的水平;chiu’s为2的dao水平与chiu’s为1的dao水平无明显差异,因此将肠道损伤评分为2的dao平均值22.82的95%双侧置信上限 25.36定义为运输应激阳性,根据预警公式,其肠道损伤评分为2.24。
[0213]
2.实验结果与分析
[0214]
利用建立的dao间接elisa技术,检测运输应激生猪血清dao含量,结果如图16所示,随着运输时间的延长,血清中dao的含量明显增加。同时按肠道不同损伤程度的dao水平进行分类(表7),并根据dao水平与肠道损伤chiu’s 评分之间的关系进行回归分析,其回归方程为y=4.41x+15.45(y为dao 浓度,x为肠道损伤评分)(图17)。
[0215]
表7 elisa检测不同肠黏膜损伤程度血清dao含量的变化
[0216][0217][0218]
利用诊断试验评价标准对预警模型进行评价,如表8所示,血清dao水平对运输应激的预警效果:敏感性为93.75%,准确性为87.5%,特异性为75%。其中敏感性与准确性都较高,说明血清dao活性和含量对运输应激预警有一定的应用价值。
[0219]
表8生猪运输应激预警效果判断
[0220][0221]
敏感性15/(15+1)=93.75%准确性(15+6)/24=87.5%特异性6/(6+2)=75%通过对不同损伤水平dao浓度分析,肠道chiu’s评分为3的dao水平显著高于chiu’s评分为2的dao水平,而chiu’s评分为2的dao水平与chiu’s 评分为1的dao水平无明显差异,因此将肠道损伤评分为2的dao平均值22.82 95%双侧置信上限25.36定义为运输应激阳性,根据预警公式,肠道损伤评分为2.24,判断标准如表9所示。
[0222]
表9应激状态判断标准
[0223][0224]
实施例4.用于生猪运输应激预警的试剂盒及其预警方法
[0225]
一种用于生猪运输应激预警的试剂盒,包括微孔板、猪dao标准品、洗涤液、封闭液、磷酸盐缓冲液、dao多克隆抗体、hrp标记的二抗、tmb底物溶液、终止液。
[0226]
本发明提供了一种用于生猪运输应激预警的预警方法,采用上述生猪运输应激预警的试剂盒,具体方法步骤为:
[0227]
(1)分离待测的生猪血清,将血清作为待测血清样品;
[0228]
(2)将梯度浓度的猪dao标准品、待测血清样品分别加入微孔板,包被;
[0229]
(3)弃去微孔板中的孔内液体,每孔加250μl洗涤液进行洗涤,拍干;
[0230]
(4)每孔加250μl封闭液,湿盒封闭,甩出封闭液后洗3-4次,拍干;
[0231]
(5)用磷酸盐缓冲液将dao多克隆抗体进行稀释,100μl/孔,第一次湿盒孵育,将微孔板内液体甩出后洗4-5次,拍干;
[0232]
(6)将hrp标记的二抗用磷酸盐缓冲液稀释成工作浓度,100μl/孔,进行第二次湿盒孵育;甩出孔内液体后洗4-5次,拍干;
[0233]
(7)加tmb底物液100μl/孔,避光孵育15min;
[0234]
(8)每孔加50μl终止液,用酶标仪测定450nm处的od值;
[0235]
(9)根据测定的od值进行回归分析,绘制标准曲线,得到该曲线的回归方程,通过该方程计算dao浓度;
[0236]
(10)根据建立的预警方程y=4.4x+15.4,计算chiu’s评分等级。
[0237]
(11)根据chiu’s评分等级评估肠道损伤水平和应激状态。
[0238]
其中:
[0239]
步骤(2)中所述的包被条件优选为:100μl/孔,4℃包被24h,包被液:取nahco
3 2.93g,na2co
3 1.59g于900ml ddh2o中,搅拌至完全溶解,调 ph值至9.6,定容至1l。标准品浓度分别是5μg/μl、2.5μg/μl、1.25μg/μl、 0.625μg/μl、0.3126μg/μl、0.15625μg/μl、0.078125μg/μl、0.0390625μg/μl。
[0240]
步骤(3)中所述的洗涤条件为:静置5min洗3次,洗涤液(pbst):取kcl0.2g,nacl 8g,kh2po
4 0.27g,nahpo
4 1.42g于900ml ddh2o中,搅拌至完全溶解,加入0.5ml tween 20,定容至1l。
[0241]
步骤(4)中所述的湿盒封闭的条件为:置37℃湿盒封闭2h。
[0242]
步骤(5)中所述的第一次湿盒孵育的条件为:37℃湿盒孵育1h。
[0243]
步骤(5)中所述的稀释为:dao多克隆抗体:磷酸盐缓冲液=1:8000-16000,磷酸盐缓冲液:准确称取kh2po
4 0.41g,k2hpo
4 5.59g,调ph值至8,定容至1l。
[0244]
步骤(6)中所述的工作浓度为,hrp标记的二抗:磷酸盐缓冲液=1:5000。
[0245]
步骤(6)中所述的第二次湿盒孵育的条件为:于37℃湿盒孵育0.5h。
[0246]
步骤(8)中所述的终止液为2mol/l h2so4溶液。
[0247]
步骤(10)中所述的chiu’s评分等级,如表2所示。
[0248]
步骤(11)中所述根据chiu’s评分等级评估肠道损伤水平和应激状态,如表10所示。
[0249]
表10应激状态判断标准
[0250][0251]
本发明血清dao含量与生猪运输应激预警的关联,本实施例提供一种用于生猪运输应激预警的试剂盒及其预警方法,通过对待测生猪血液中的dao 的间接elisa检测,可以准确判断出是否有生猪应激反应的发生,为生猪运输应激提供预警,可以有效减少运输应激带来的经济损失。
[0252]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1