质谱用试剂的制作方法
1.本发明涉及化合物、包含所述化合物的组合物、包含所述组合物和/或化合物的试剂盒以及适用于质谱分析的复合物。此外,本发明涉及使用所述化合物对分析物进行质谱测定的方法。
背景技术:
2.质谱(ms)是一种在小分子至大分子化学物质的定性和定量分析中广泛使用的技术。通常,它是非常灵敏且特异性的方法,甚至允许对复杂的生物样品(例如环境样品或临床样品)进行分析。然而,对于若干种分析物,特别是如果从复杂的生物基质诸如血清分析,则测量的灵敏度仍是问题。
3.ms往往与色谱技术特别是气相色谱和液相色谱诸如hplc联用。这里,将经过分析的目标分子(分析物)进行色谱分离,并且各自进行质谱分析(higashi等人,(2016)j.of pharmaceutical and biomedical analysis 130,第181-190页)。
4.然而,仍需要增加ms分析方法的灵敏度,特别是用于对具有低丰度的分析物进行分析或当仅能获取极少量材料(诸如生物活检组织)时。
5.本领域中,若干种旨在改善这些分析物的测量灵敏度的衍生化试剂(化合物)是已知的。其中,试剂包含组合在单个功能性单元中的带电荷的单元和中性丢失单元(例如,wo 2011/091436 a1)。其他包含独立单元的试剂在结构上相对较大,这影响样品制备和ms测量的一般工作流程(rahimoff等人,(2017)j.am.chem.soc.139(30),第10359-10364页)。已知的衍生试剂是例如丹磺酰氯、rapifluor-ms(rfms)、cookson型试剂、amplifex diene、amplifex keto、girard t、girard p和吡啶胺(hong and wang,anal chem.,2007,79(1):322-326;frey等人,steroids,2016年12月,116:60-66;francis等人,journal of pharmaceutical and biomedical analysis,2005,39(3-4),411-417;alley william,28th international carbohydrate symposium,new orleans,la,united states,7月17-21日(2016),ics-209))。其他描述了在目标分析物上安装永久电荷(正电荷或负电荷)的方式,这使得它能够离子化,且因此绕过离子源内的离子化步骤,这主要是发生分析物损失的部分。所有这些试剂均存在缺点,其原因在于通常标记效率不足、偶联化学反应生成结构异构体、离子化效率不佳、偶联后的色谱分离不佳、许多裂解途径引起裂解行为不佳以及需要高碰撞能量。
6.因此,本领域中亟需衍生化试剂,其允许从复杂生物基质中灵敏地检测分析物并且表现出不对ms测量工作流程造成负面影响的化学结构。这在随机存取的高通量ms设置中尤为重要,其中不得不在短时间内测量表现出不同化学特性的若干种不同分析物。
7.本发明涉及新颖的试剂/化合物,其允许对生物样品中的分析物分子(诸如类固醇、蛋白质和其他类型的分析物)进行灵敏的测定。该试剂以模块化方式设计,以允许针对某些分析物的测量中出现的具体需求或针对具体工作流程调整进行个别调整。
8.本发明的一个目的是提供一种化合物、试剂盒和组合物,它们中的每一个都包含
所述化合物,用于通过质谱法有效地检测分析物。此外,本发明的一个目的是提供一种用于对分析物进行质谱测定的复合物和方法。
9.该目的或这些目的由独立权利要求的主题来解决。另外实施例服从于从属权利要求。
技术实现要素:
10.在下文中,本发明涉及以下方面:
11.在第一方面,本发明涉及用于使用质谱测定来定量检测分析物的化合物,
12.其中所述化合物包含永久电荷,特别是永久净电荷,其中所述化合物能够与该分析物共价结合,
13.其中所述化合物具有质量m1和净电荷z1,
14.其中在经由质谱测定的裂解后,该化合物能够形成具有质量m2<m1和净电荷z2<z1的至少一个子离子,
15.其中m1/z1<m2/z2。
16.在第二方面,本发明涉及一种包含本发明的第一方面的化合物的组合物。
17.在第三方面,本发明涉及一种包含本发明的第一方面的化合物或本发明的第二方面的组合物的试剂盒。
18.在第四方面,本发明涉及用于使用质谱测定来定量检测分析物的复合物,
19.其中该复合物是由彼此共价连接的该分析物和化合物形成,其中该复合物包含永久电荷,特别是永久净电荷,
20.其中所述复合物具有质量m3和净电荷z3,
21.其中在经由质谱测定的裂解后,该复合物能够形成具有质量m4<m3和净电荷z4<z3的至少一个子离子,
22.其中m3/z3<m4/z4。
23.在第五方面,本发明涉及本发明的第一方面的化合物用于对分析物进行质谱测定的用途。
24.在第六方面,本发明涉及一种用于分析物的质谱测定的方法,其包括以下步骤:
25.(a)使该分析物与本发明的第一方面的该化合物反应,从而形成本发明的第四方面的复合物,
26.(b)对来自步骤(a)的该复合物进行质谱分析。
附图说明
27.图1示出ms谱图的示意图(强%与m/z的关系):它描述了本发明的化合物或复合物,特别是包含带两倍电荷的标记分析物的复合物相对于前体的带一倍(单一)电荷的分析物的裂解行为和裂解;多个电荷可以是或分别对应于最终的净电荷。
28.图2示出ms谱图的示意图(强%与m/z的关系):它描述了比较化合物的裂解行为,该化合物带一倍电荷,且具有+/-0.5道尔顿窗口(窗口在两条虚线之间表示)。
29.图3示出ms谱图的示意图(强%与m/z的关系):它描述了本发明的化合物或复合物的裂解行为,该化合物或复合物带两倍电荷且具有两个+/-0.5道尔顿窗口(窗口在两条虚
线之间表示)。
30.图4a至图4e示出复合物的定量下限(lloq),该复合物包含标记的带两倍电荷的雌二醇。图4a示出复合物的结构(与标记物6缀合的雌二醇)。图4b示出相应质量转移时的ms空白色谱图(强度%对保留时间)。图4c示出与标记物6缀合的雌二醇(相关的0.5pg/ml雌二醇)的相应质量转移的色谱图(强度%对保留时间)。图4d示出与标记物6缀合的雌二醇在0-0,01ng/ml的浓度范围内相对于雌二醇的校准曲线。图4e示出与标记物6缀合的雌二醇在0ng/ml至0,05ng/ml范围内相对于雌二醇的校准曲线数据。示出三个单独进样的绝对面积,并且报告了根据din 32645的相应检测限。ng表示检测限,eg表示正确率为95%的检测限,bg表示定量限(loq)。最佳模式/设置的天然雌二醇lloq约为5ng/ml。
31.图5a至图5c示出空白注射的ms色谱图以及分别针对rha139f2、rha171f2和与标记物6缀合的雌二醇各自的质量转移的图示(强度%对三个实施例的保留时间)。
32.图6示出根据本发明的包含作为结合分析物的雌二醇或其片段和作为结合化合物的与标记物6或其片段缀合的雌二醇的带两倍正电荷的复合物的ms谱图的图示(强度%对m/z)。
33.图7示出峰“分裂”的示意图:它描述色谱系统将因分析物分子衍生化反应产生的不同异构体彼此分离的能力。
34.图8示出与未衍生化分析物相比确定增强因子的工作流程的示意图。
35.图9a和图9b示出tfa对带两倍电荷的化合物/衍生物或其复合物的信号猝灭效应。
36.图10a至图10d和图11示出化合物和/或复合物裂解模式的ms谱图(强度%对m/z)。
具体实施方式
37.在下文详细描述本发明之前,应当理解,本发明不限于本文所述的特定实施例和实例,因为这些实施例和实例可以变化。还应当理解,本文所用的术语仅出于描述特定实施例的目的,并非旨在限制本发明的范围,本发明的范围仅受所附权利要求的限制。除非另外指明,否则本文所用的所有科学技术术语具有如本领域的普通技术人员通常理解的相同意义。
38.在本说明书全文中引用了若干文档。本文所引用的文献(包括所有专利、专利申请、科学出版物、制造商的说明书、使用说明等)中的每一篇,无论上文或下文中引用,均通过引用而以其整体并入本文。在此类并入的参考文献的定义或教导与本说明书中引用的定义或教导之间矛盾时,以本说明书文本为准。
39.下面将描述本发明的元件。这些元件与具体实施例一起列出,然而,应理解,它们可以任何方式和任何数目组合以创建另外的实施例。各种描述的实例和优选实施例不应解释为仅将本发明限制为明确描述的实施例。此描述应理解为支持并且涵盖将明确描述的实施例与任何数目的所公开和/或优选元件组合的实施例。此外,除非上下文另有指示,否则本技术中所有所描述元件的任何排列和组合均应视为由本技术的说明书公开。
40.定义
41.词语“包括(comprise)”以及变体诸如“包括(comprises)”和“包括(comprising)”应理解为暗示包括所陈述的整数或步骤或者整数或步骤组,但不排除任何其他整数或步骤或者整数或步骤组。
42.如在本说明书和所附权利要求中所用,除非内容另外明确规定,否则单数形式“一个”、“一种”、“该”和“所述”包括复数指代物。
43.百分比、浓度、量和其他数值数据在本文中可以“范围”格式表达或呈现。应当理解,此类范围格式仅出于方便和简洁而使用,因此应灵活地解释为不仅包括明确列举为范围限值的数值,而且包括该范围所涵盖的所有单独的数值或子范围,就如同明确列举出每个数值和子范围一样。作为例示,数值范围“4%至20%”应解释为不仅包括明确列举出的4%至20%的值,而且包括所示范围内的各个值和子范围。因此,此数值范围中包括个体值诸如4、5、6、7、8、9、10、
…
18、19、20%和子范围诸如4-10%、5-15%、10-20%等。此相同原则适用于引用最小值或最大值的范围。此外,无论所述范围或特征的广度如何,均适用此类解释。
44.当与数值相连使用时,术语“约”意为涵盖处于一定范围内的数值,该范围具有比所指示的数值小5%的下限和比所指示的数值大5%的上限。
45.在本发明的上下文中,术语“化合物”是指具有具体化学结构的化学物质。所述化合物可包含一个或多个反应性基团。每个反应性基团可以履行不同的功能性,或者两个或更多个反应性基团可履行相同功能。反应性基团包括但不限于反应性单元、带电荷的单元和中性丢失单元。在本发明的上下文中,术语“结合化合物”是指与分析物结合的所述化合物。原则上,化合物和结合化合物可以相同。化合物和结合化合物可以基本上相同。基本上相同可以意味着两种化合物具有相同的化学结构,除了它们在反应性单元k的结构和/或偶联基团q的结构方面彼此不同。优选地,化合物能够形成与分析物结合,但尚未与分析物结合。结合化合物与分析物结合。
46.术语“质谱分析”(“mass spec”或“ms”)或“质谱分析(mass spectrometric analysis)”涉及通过化合物的质量用于鉴别化合物的分析技术。ms是基于离子的质荷比或“m/z”来过滤、检测和测量离子的方法。ms技术通常包括(1)将化合物离子化以形成带电荷的化合物;以及(2)检测该带电荷的化合物的分子量并计算质荷比。化合物可通过任何合适的手段来离子化并检测。“质谱仪”通常包括电离器和离子检测器。通常,将一个或多个目标分子离子化,后续将离子引入质谱仪器中,在该仪器中,由于磁场和电场的组合,离子遵循取决于质量(“m”)和电荷(“z”)的空间路径。术语“离子化”或“电离”是指生成具有等于一个或多个单位的净电荷的分析物离子的过程。负离子是那些具有一个或多个单位的净负电荷的离子,而正电荷是那些具有一个或多个单位的净正电荷的离子。ms方法既可以在生成并且检测负离子的“负离子模式”下执行,也可以在生成并且检测正离子的“正离子模式”下执行。“在经由质谱测定的裂解后”可能意味着,例如化合物、组合物或复合物通过质谱仪并裂解。
[0047]“串联质谱分析”或“ms/ms”包括多个质谱分析选择步骤,其中分析物的裂解在各级之间发生。在串联质谱仪中,离子在离子源中形成,并且在第一级质谱(ms1)中按质荷比将其分离。选择特定质荷比的离子(前体离子或母离子),并通过碰撞诱导解离、离子-分子反应或光解离产生碎片离子(或子离子)。然后,在二级质谱分析(ms2)中分离并检测所得离子。
[0048]
由于质谱仪分离并检测质量略有差异的离子,它容易区分给定元素的不同同位素。因此,质谱分析是对包括但不限于低分子量分析物、肽、多肽或蛋白质的分析物进行精
确质量测定和表征的重要方法。其应用包括蛋白质及其翻译后修饰的鉴别;蛋白质复合物、其亚基和功能性相互作用的阐明;以及蛋白质组学中蛋白质的全局测量。通常无需事先了解氨基酸序列,即可通过质谱法对肽或蛋白质进行从头测序。
[0049]
ms中的大多数样品工作流程进一步包括样品制备和/或富集步骤,其中例如使用例如气相色谱法或液相色谱法将一种或多种目标分析物从基质中分离出来。通常,在质谱测量中执行以下三个步骤:
[0050]
1.将包含目标分析物的样品离子化,一般通过与阳离子形成加复合物来进行,经常通过质子化生成阳离子。离子化源包括但不限于电喷雾离子化(esi)和大气压化学离子化(apci)。
[0051]
2.根据离子的质量和电荷对离子进行分选和分离。可使用高场不对称波形离子迁移谱(faims)作为离子过滤器。
[0052]
3.然后,例如以多反应模式(mrm)检测所分离的离子,并将结果展示在图表上。
[0053]
术语“电喷雾离子化”或“esi”是指如下方法:在该方法中,溶液沿着短毛细管行进至被施加高正电位或高负电位的末端。到达该管末端的溶液被蒸发(雾化)成在溶剂蒸汽中存在非常小的溶液液滴的喷射或喷雾。此液滴雾流经蒸发室,将该蒸发室略微加热以防止冷凝并且蒸发溶剂。随着液滴变得更小,表面电荷密度增加,直到同类电荷之间的天然斥力造成离子以及中性分子得以释放。
[0054]
术语“大气压化学离子化”或“apci”是指类似于esi的质谱法;但是,apci通过离子-分子反应产生离子,这些反应在大气压下发生在等离子体内。通过喷雾毛细管与对电极之间的放电来维持等离子体。然后,通常使用一组差分泵分级分离器将离子提取至质量分析仪中。可使用干燥且预热的ni气体逆流以改善溶剂的移除。对于分析极性较低的实体,apci中的气相离子化可能比esi更有效。
[0055]“高场非对称波形离子迁移率谱(faims)”是一种大气压离子迁移率技术,可通过其在强电场和弱电场中的行为来分离气相离子。
[0056]“多反应模式”或“mrm”是ms仪器的一种检测模式,在该模式下,选择性地检测前体离子和一种或多种碎片离子。
[0057]
质谱测定可与另外的分析方法联用,包括色谱方法诸如气相色谱(gc)、液相色谱(lc)特别是hplc和/或基于离子迁移的分离技术。
[0058]
在本公开的上下文中,术语“分析物”、“分析物分子”或“目标分析物”可互换使用,其是指待经由质谱分析的化学物质。适合经由质谱分析的化学物质,即分析物,可以是活体生物体中存在的任何种类的分子,包括但不限于核酸(例如,dna、mrna、mirna、rrna等)、氨基酸、肽、蛋白质(例如,细胞表面受体、胞质蛋白等)、代谢物或激素(例如,睾酮、雌激素、雌二醇等)、脂肪酸、脂质、碳水化合物、类固醇、酮类固醇、开环甾类化合物(例如,维生素d)、以另一分子的某一修饰(例如,蛋白质上的糖部分或磷酰残基、基因组dna上的甲基-残基)为特征的分子或已经由生物体内化的物质(例如,治疗性药物、滥用的药物、毒素等)或此类物质的代谢物。此类分析物可用作生物标志物。在本发明的上下文中,术语“生物标志物”是指生物学系统内的物质,其用作所述系统的生物学状态的指示物。在本发明的上下文中,术语“结合分析物”是指与化合物结合形成复合物的所述分析物。原则上,分析物和结合分析物可以相同。分析物和结合分析物可以基本上相同。基本上相同可以意味着两种分析物具
有相同的化学结构,除了它们在官能团的结构上彼此不同。优选地,分析物能够形成与化合物结合,但尚未与化合物结合。结合分析物与化合物结合。
[0059]
在本公开的上下文中使用的术语“永久电荷”或“带永久电荷的”是例如一个单元的电荷(例如正电荷或负电荷)不容易可逆,例如通过冲洗、稀释、过滤等。特别是,在上下文中,这意味着永久电荷与其非永久电荷不平衡。永久电荷通过形成共价键来形成,即使在高和低ph环境下(例如正电荷ph>12和负电荷ph<1)该永久电荷也很稳定。因此,相应的带永久电荷的分子是强碱或是强酸。对于正电荷z=1,永久电荷表现出pks>12的pks值,而对于负电荷z=-1pks<1。永久电荷可以是例如共价键合的结果。与永久电荷相反,可逆电荷(非永久电荷)可能是例如静电相互作用的结果。本发明的化合物具有净电荷z1,特别是在裂解之前。裂解后,化合物可以分成或分裂成至少一个子离子。子离子具有的净电荷z2小于净电荷z1(z2<z1)。本发明的复合物具有净电荷z3,特别是在裂解之前。裂解后,复合物可以分成或分裂成具有净电荷z4的至少一个子离子,该净电荷小于净电荷z3(z4<z3)。在此上下文中,至少一个子离子可以意指在裂解后形成一个或多个子离子。一个子离子和另一个子离子至少在它们的质量、电荷或结构方面彼此不同。在本公开的上下文中,通过比较子离子的净电荷z2和化合物的净电荷z1,净电荷的绝对值至关重要。例如,如果化合物具有双负净电荷z1(z1=-2),并且子离子具有一个负净电荷z2(z2=-1),则净电荷z2小于净电荷z1(z2<z1),因为净电荷z1(z1=2)的绝对值大于净电荷z2(z2=1)的绝对值。通过比较净电荷z1和z2,比较的是净电荷的绝对值而不是总值。
[0060]
在本公开的上下文中,术语“永久电荷”或“永久净电荷”不包括假分子离子,例如[m
+
h]
+
或[m-h]-或[m+na
+
]
+
或[m+cl-]-等。
[0061]
在本公开的上下文中使用的术语“永久净电荷”或“净电荷”是离子或分子具有的总永久电荷。永久净电荷可计算如下:质子数-电子数=永久净电荷。永久净电荷可以看作是原子的共价组合,其通过键重排在分子中形成带电荷的分子(例如季氮、四甲基铵),而净电荷也可以通过添加或提取原子(例如氢)而存在,以产生由[m
+
h]
+
或[m-h]-组成的假分子离子。例如,如果化合物具有两个永久正电荷和一个永久负电荷,则永久净电荷为+1(2*(+1)+(-1)=(+1))。
[0062]
术语“所述化合物能够与分析物共价结合”意指该化合物适合与分析物结合。化合物与分析物之间的结合是共价结合。
[0063]
术语“使用质谱测定来定量检测分析物”意指通过质谱测量或确定目标分析物的量。
[0064]
术语“质量”(例如m1、m2、m3、m4或x>4的mx)表示原子质量,特别是统一原子质量。统一原子质量的单位是u。在生物医学领域,可以使用道尔顿[da]代替统一原子质量[u]。道尔顿不是si单位。道尔顿相当于统一原子质量,因为这些单位之间没有转换因子。“质谱”是信号强度(纵坐标)与m/z(横坐标)的二维表示。峰的位置(通常称为信号)反映了离子源内的化合物、分析物或它们的组合(复合物)产生的离子的m/z。该峰的强度与该离子的丰度相关。通常但不一定,最高m/z处的峰是由检测到完整的离子化分子,即分子离子m
+
产生的。分子离子峰通常伴随着几个较低或较高m/z的峰,这些峰是由化合物、分析物或复合物裂解产生碎片离子引起的。因此,质谱中的各个峰可以称为碎片离子峰或子离子峰。m/z根据定义是无量纲的。
[0065]
术语“裂解”可以意指化合物、分析物和/或复合物通过使化合物、分析物和/或复合物通过质谱仪的电离室而解离并形成离子,例如至少一个子离子。碎片在质谱中产生独特的模式。术语“裂解”可指单个分子解离成两个或更多个独立分子。如本文所用,术语裂解是指特异性裂解事件,其中母分子中发生裂解事件的断裂点得到良好限定,并且其中由裂解事件导致的两个或更多个子分子得到良好表征。如何确定母分子的断裂点以及两个或多个所得子分子是技术人员众所周知的。所得子分子可以是稳定的,或者可以在后续裂解事件中解离。例如,正在裂解的母分子包括一个n-苄基吡啶鎓单元时,技术人员能够根据该分子的整个结构确定该吡啶鎓单元是将裂解释放苄基实体,还是将从母分子中完全释放出来,即,确定由此产生的子分子将是苄基分子或缺少苄基的母分子。裂解可通过碰撞诱导解离(cid)、电子捕获解离(ecd)、电子转移解离(etd)、负电子转移解离(netd)、电子分离解离(edd)、光解离(特别是红外多光子解离(irmpd)和黑体红外辐射解离(bird))、表面诱导解离(sid)、高能c形阱解离(hcd)、电荷远程裂解发生。
[0066]
术语“m1/z1<m2/z2”意指化合物的质荷比(m1/z1)小于该化合物的至少一个或确切的一个子离子的质荷比(m2/z2)。
[0067]
术语“m3/z3<m4/z4”意指复合物的质荷比(m3/z3)小于该复合物的至少一个或确切的一个子离子的质荷比(m4/z4)。
[0068]
术语“检测限”或“lod”是生物分析过程可将分析物与背景噪声轻易区分时的分析物最低浓度。
[0069]
术语“信噪比”或s/n描述了强度测量的不确定性,并通过量化信号强度相对于噪声的比率来提供信号质量的定量测量。
[0070]
分析物可以存在于目标样品(例如生物样品和临床样品)中。术语“样品”或“目标样品”在本文中可互换使用,其是指组织、器官或个体的一部分或切片,通常小于这种组织、器官或个体,旨在代表整个组织、器官或个体。在分析时,样品提供关于组织状态或者器官或个体的健康或患病状态的信息。样品的实例包括但不限于:流体样品,诸如血液、血清、血浆、滑液、脊髓液、尿液、唾液和淋巴液;或固体样品,诸如干血斑和组织提取物。样品的其他实例是细胞培养物或组织培养物。
[0071]“共价键”或“共价连接”或“共价键合”是涉及在原子或分子之间(例如在化合物与分析物之间)共享电子对的至少一个化学键。
[0072]
术语“单元”和“部分”可以互换使用,例如mc lafferty裂解部分和mclafferty裂解单元可以互换使用。
[0073]
电荷(例如z1、z2、z3、z4或zx,其中x>4)的数值(例如1、2、3、4、5或6)是电荷的绝对值。例如,净电荷z1=2可能意味着净电荷z1为+2或净电荷为-2。优选地,在这种情况下的电荷是正数值,例如2=+2。
[0074]
术语“化合物”和“标记物”可以互换使用。
[0075]
术语“化合物能够形成另外的子离子,每个另外的子离子包含该化合物的一个片段或该化合物的多个片段”中的术语“更多片段”意指该化合物包含一个片段或多于一个片段,这些片段彼此不同或可以彼此不同。特别地,另外的子离子至少在它们的质量、电荷或结构上彼此不同。
[0076]
在本公开的上下文中,样品可以来源于“个体”或“受试者”。通常地,受试者是哺乳
动物。哺乳动物包括但不限于驯养的动物(例如牛、绵羊、猫、犬和马)、灵长类动物(例如人和非人灵长类动物,诸如猴)、兔以及啮齿类动物(例如小鼠和大鼠)。
[0077]
在经由质谱进行分析之前,可按照针对特定样品和/或分析物的方式对样品进行预处理。在本公开的上下文中,术语“预处理”是指允许经由质谱分析对所期望的分析物进行后续分析所需的任何措施。预处理措施通常包括但不限于,洗脱固体样品(例如,洗脱干血斑)、将溶血试剂(hr)添加到全血液样品中、以及将酶试剂添加到尿液样品中。另外,添加内标(istd)也被视为样品的预处理。
[0078]
术语“溶血试剂(hr)”是指裂解样品中存在的细胞的试剂,在本发明的上下文中,溶血试剂特别是指裂解血液样品中存在的细胞(包括但不限于,全血液样品中存在的红细胞)的试剂。众所周知的溶血试剂是水(h2o)。溶血试剂的其他实例包括但不限于去离子水、高渗透性液体(例如,8m尿素)、离子液体和不同的清洗剂。
[0079]
通常地,“内标”(istd)是已知量的物质,当经历质谱检测工作流程(即,包括任何预处理、富集和实际检测步骤)时,其表现出与目标分析物类似的特性。尽管istd表现出与目标分析物类似的特性,它仍可明显地与目标分析物区分开来。举例而言,在色谱分离诸如气相色谱和液相色谱过程中,istd具有大致与来自样品中的目标分析物相同的保留时间。因此,分析物和istd两者均同时进入质谱仪中。然而,istd表现出与来自样品的目标分析物不同的分子质量。这使得在来自istd的离子与来自分析物的离子之间能够通过其不同的质荷(m/z)比进行质谱区分。两者均经历裂解并提供子离子。这些子离子可通过其m/z比而彼此区分并与各自的母离子区分。因此,可对istd和分析物的信号进行单独的测定和定量。由于istd的添加的量是已知的,因此来自样品的分析物的信号强度可归因于该分析物的具体定量性的量。因此,添加istd允许对所检测的分析物的量进行相对比较,并且当一种或多种分析物到达质谱仪时,能够对样品中存在的一种或多种目标分析物进行明确鉴定和定量。通常但不一定,istd是目标分析物的同位素标记的变体(包含例如2h、
13
c或
15
n等标记)。
[0080]
除预处理以外,样品还可经过一个或多个富集步骤处理。在本公开的上下文中,术语“第一富集过程”或“第一富集工作流程”是指在样品的预处理之后发生的富集过程,并且提供包含相对于初始样品富集的分析物的样品。第一富集工作流程可包括化学沉淀(例如,使用乙腈)或使用固相。合适的固相包括但不限于固相萃取(spe)盒和珠。珠可以是非磁性的、磁性的或顺磁性的。珠可以经差异性涂覆以具有对于目标分析物的特异性。依据预期的用途,即依据预期的捕获分子,涂层可以不同。哪种涂层适用于哪种分析物是技术人员众所周知的。珠可以由各种不同材料制成。珠可具有各种尺寸并且包含具有或不具有孔的表面。
[0081]
在本公开的上下文中,术语“第二富集过程”或“第二富集工作流程”是指发生在样品预处理和第一富集过程之后的富集过程,其提供相对于初始样品和经过第一富集过程处理的样品包含富集的分析物的样品。
[0082]
术语“色谱”是指一种过程,在该过程中,随着由液体或气体携带的化学混合物在液体或固体固定相周围或上方流动,作为化学实体的差异性分布的结果,该化学混合物被分离为多种组分。
[0083]
术语“液相色谱法”或“lc”是指当流体均匀地渗透通过细碎物质的柱或通过毛细管通道时,选择性阻滞流体溶液中的一种或多种组分的过程。随着此流体相对于固定相移动,混合物组分在一种或多种固定相与体相流体(即,流动相)之间的分布导致该滞后。固定
相的极性高于流动相(例如,甲苯作为流动相,二氧化硅作为固定相)的方法称为正相液相色谱(nplc),而固定相的极性小于流动相(例如,水-甲醇混合物作为流动相,而c18(十八烷基硅烷基)作为固定相)的方法称为反相液相色谱(rplc)。
[0084]“高效液相色谱”或“hplc”是指一种液相色谱方法,在该方法中,通过迫使流动相在压力下经过固定相,通常为密集填充柱,从而增加分离程度。通常地,使用由不规则形状或球形的颗粒、多孔整体层或多孔膜构成的固定相来填充柱。过去,hplc根据流动相和固定相的极性分为两个不同的亚类。固定相的极性高于流动相(例如,甲苯作为流动相,二氧化硅作为固定相)的方法称为正相液相色谱(nplc),反之(例如,水-甲醇混合物作为流动相,而c18(十八烷基硅烷基)作为固定相)则称为反相液相色谱(rplc)。微流lc是指使用具有窄的内柱直径(通常低于1mm,例如约0.5mm)的柱的hplc方法。“超高效液相色谱”或“uhplc”是指使用120mpa(17,405lbf/in2)或约1200大气压的hplc方法。快速lc是指使用具有如上所述的内径且长度短(<2cm,例如1cm)的柱的lc方法,其采用如上所述的流速并使用如上所述的压力(微流lc、uhplc)。短快速lc方案包括使用单个分析柱的捕捉/洗涤/洗脱步骤,并在<1min的极短时间内实现lc。
[0085]
其他众所周知的lc模式包括亲水作用色谱(hilic)、体积排阻lc、离子交换lc和亲和lc。
[0086]
lc分离可为单通道lc或包括多个平行布置的lc通道的多通道lc。在lc中,可根据分析物的极性或log p值、尺寸或亲和力来分离该分析物,如技术人员通常所知。
[0087]
术语“反应性单元”是指能够与另一分子反应的单元,即该单元能够与另一分子(诸如目标分析物)形成共价键。通常,此类共价键由另一个分子中存在的化学基团形成。据此,在进行化学反应时,化合物的反应性单元与分析物分子中存在的合适化学基团形成共价键。由于分析物分子中存在的此化学基团履行与化合物的反应性单元反应的功能,分析物分子中存在的化学基团也称为分析物的“官能团”。在每种情况下,共价键的形成均发生在化学反应中,其中新共价键在反应性基团的原子与分析物的官能团的原子之间形成。本领域的技术人员众所周知,在反应性基团与分析物的官能团之间形成共价键时,原子在此化学反应过程中丢失。
[0088]
在本公开的上下文中,术语“复合物”是指通过化合物与分析物分子的反应产生的产物。此反应导致在化合物与分析物之间形成共价键。据此,术语复合物是指通过化合物与分析物分子的反应形成的共价结合反应产物。
[0089]“试剂盒”是包含至少一种本发明试剂的任何制品(例如,包装或容器),该试剂例如是用于治疗病症的药品,或用于特异性地检测生物标志物基因或蛋白质的探针。试剂盒优选作为用于执行本发明方法的单元来推销、分发或贩售。通常,试剂盒可进一步包括被分隔开的载体装置以在紧密的限定空间中接纳一个或多个容器装置,诸如小瓶、管等。特别地,每个容器意味着包含将在第一方面的方法中使用的单独元件之一。试剂盒可进一步包含一种或多种其他试剂,包括但不限于反应催化剂。试剂盒可进一步包含一个或多个包含其他材料的其他容器,该其他材料包括但不限于缓冲剂、稀释剂、过滤器、针头、注射器和带有使用说明书的包装插页。标记物可存在于容器上以指示将组合物用于具体应用,并且也可指示体内或体外使用的指南。计算机程序代码可提供于数据存储介质或装置诸如光学存储介质(例如,光盘)上或直接提供于计算机或数据处理装置上。此外,试剂盒可包含如本文
别处所述的用于校准目的生物标志物的标准量。
[0090]
实施例
[0091]
在第一方面,本发明涉及用于使用质谱测定来定量检测分析物的化合物或至少一种化合物,其中所述化合物包含永久电荷,特别是永久净电荷,其中所述化合物能够与分析物共价结合,其中所述化合物具有质量m1和净电荷z1,其中在经由质谱测定的裂解后,该化合物能够形成具有质量m2<m1和净电荷z2<z1的至少一个子离子,其中m1/z1<m2/z2。
[0092]
本发明人惊奇地发现,本文描述的能够安装多个永久电荷(x-倍正电荷、y-倍负电荷或(x-y)-倍正电荷和负电荷作为净电荷)的试剂(化合物)显示出裂解为一个或多个碎片的行为,并且在裂解后带有标记部分和分析物分子离子部分的信息。因此,导致分析物的ms信号增强,这例如对于低丰度的分析物是重要的。
[0093]
例如,对于带两倍永久电荷的分子/化合物,m/z值是同一分析物的带一倍永久电荷的离子(标记前的分析物分子)的一半。如果这种带多倍永久电荷的分子(例如带两倍永久电荷的化合物)裂解成带不同倍永久电荷的分子,则标记物信息的裂解路径从较高m/z值的前体到较低m/z值的标记物信息,以及从较低m/z值的前体到较高m/z值的分析离子(见图1和图6)。
[0094]
通过安装带永久电荷的标记物,分子的裂解行为与天然分子相比是交替的。在msms过程中分析物-标记物分子裂解后,永久电荷留在分析物分子部分或标记物部分上。因此,待测量的高强度量化离子在裂解过程后可以具有分子信息或标记物信息。为了获得标记结构的分子信息,需要对产生的碎片进行另外的离子分离过程,这需要ms3仪器,并且进一步降低相应扫描的整体灵敏度。如果在复合物或化合物中仅安装一个永久电荷,则无法执行本文所述的定性离子和定量离子的概念,因为在裂解过程之后产生的离子可以是标记物信息离子或包含分析物信息的离子。
[0095]
在本发明的第一方面的实施例中,用于使用质谱测定来定量检测分析物的化合物包含永久电荷,特别是永久净电荷,其中所述化合物能够与分析物共价结合,其中所述化合物具有质量m1和净电荷z1,其中在经由质谱测定的裂解后,化合物形成具有质量m2<m1和净电荷z2<z1的至少一个子离子,其中m1/z1<m2/z2。
[0096]
在本发明的第一方面和/或第六方面的实施例中,裂解为一步式过程。这可能意味着化合物直接裂解成至少一个子离子,而没有重排或假分子离子种类形成的中间步骤。
[0097]
在本发明的第一方面的实施例中,该化合物包含至少两种永久电荷,特别是至少两种永久净电荷。
[0098]
在本发明的第一方面的实施例中,m1/z1是至少60或更多。多于60可能意味着61、62、63、64、65、66、67、68、69、70、71、72、73、74或75,例如对于c7h2on
22+
为66。替代地或除了m1/z1是至少60之外,m2/z2是至少70或更大,例如对于c4h
12n+
为74。多于70可能意味着71、72、73、74、75、76、77、78、79或80。此外,m1/z1和m2/z2中的每一者或两者都可以是1500作为最大值,例如1300、1350、1400、1450或1500。换句话说,m1/z1和/或m2/z2可以在60到1500(包含边界值)的范围内。
[0099]
在本发明的第一方面的实施例中,该化合物不含亚砜单元(so)。特别是,该化合物不含亚砜单元(so)以抑制中性丢失,这使得能够实现从带两倍电荷的衍生物到带单一电荷的离子的优选裂解方式。因此,与具有so单元的化合物相比,在没有不含so单元的化合物的
情况下,裂解路径(例如从带两倍电荷的化合物到带一倍电荷的化合物的裂解路径)更容易。
[0100]
在本发明的第一方面的实施例中,z1为整数且为2或大于2。特别是z1是正整数。正整数可以意指整数而不是分数,例如+2、+3、+4、+5。替代地,z1是负整数,例如-2、-3、-4、-5。正整数,例如+2、+3、+4、+5在此上下文中意指化合物在+2的情况下具有双重正净电荷z1或在+3的情况下具有三重正净电荷z1依此类推。负整数,例如-2、-3、-4、-5,在本文中意指化合物在-2的情况下具有双重负净电荷z1或在-3的情况下具有三重负净电荷z1,依此类推。
[0101]
这意味着在本公开的上下文中,通过比较子离子的净电荷z2和化合物的净电荷z1,净电荷的绝对值至关重要。例如,如果化合物具有双负净电荷z1(z1=-2),并且子离子具有一个负净电荷z2(z2=-1),则净电荷z2小于净电荷z1(z2<z1),因为净电荷z1(z1=2)的绝对值大于净电荷z2(z2=1)的绝对值。通过比较净电荷z1和z2,比较的是净电荷的绝对值而不是总值。
[0102]
在本发明的第一方面的实施例中,z1为2、3、4或5,优选地z1为2。在这种情况下,2可以具有+2(2=+2)的含义,3可以具有+3的含义,4可以具有+4的含义,且5可以具有+5的含义。替代地,在化合物带负电荷的情况下,2可以具有-2(2=-2)的含义,3可以具有-3的含义,4可以具有-4的含义,并且5可以具有-5的含义。
[0103]
在本发明的第一方面的实施例中,z2小于z1。特别地,z2=z1-1,优选地z2为1。在这种情况下,1与+1或-1具有相同的含义。
[0104]
在本发明的第一方面的实施例中,z1和z2中的每一者或两者均为永久电荷,特别是永久净电荷。
[0105]
在本发明的第一方面的实施例中,z1和z2中的每一者或两者均为永久正电荷,特别是永久净电荷。
[0106]
在本发明的第一方面的实施例中,z1和z2中的每一者或两者均为永久负电荷,特别是永久净电荷。
[0107]
在本发明的第一方面的实施例中,净电荷z1是化合物的x倍正电荷和y倍负永久电荷的总和。
[0108]
在本发明的第一方面的实施例中,净电荷z2是至少一个子离子的x倍正电荷和y倍负永久电荷的总和。
[0109]
在本发明的第一方面的实施例中,化合物能够形成另外的子离子,其不同于具有质量m2和净电荷z2的至少一个子离子。另外的子离子可以是一个或两个或三个或四个或五个或六个或多于六个子离子。这些子离子中的每一个都具有质量噪声比m/z。另外的子离子的m/z值通常可以命名为mx/zx值,其中x>4。例如,一个另外的子离子具有m5/z5值,两个另外的子离子具有m5/z5和m6/z6值,三个另外的子离子具有m5/z5、m6/z7和m8/z8值等。
[0110]
在本发明的第一方面的实施例中,另外的子离子的m/z小于m1/z1。换句话说,质谱中另外的子离子的峰的位置位于具有m1/z1值的峰(母离子)的左侧。与此相反,具有m2/z2值的至少一个子离子的峰的位置位于母离子峰的右侧。母离子峰也可以称为基峰。大多数情况下,基峰的强度被归一化为100%的相对强度。可以进行归一化,因为相对强度基本上独立于检测器记录的绝对离子丰度。
[0111]
在本发明的第一方面的实施例中,化合物能够形成另外的子离子,该另外的子离
子中的每一个包含化合物的一个或多个碎片并且每个具有x>4的mx/zx值,其中另外的子离子的每个mx/zx值都小于m1/z1值。特别地,化合物的片段至少在它们的m/z值方面彼此不同。
[0112]
在本发明的第一方面的实施例中,化合物包含至少三个单元z1、z2、q和任选另外单元l1,其中这些单元彼此共价连接,
[0113]
其中:
[0114]
q为反应性单元,其能够与分析物形成共价键,
[0115]
z1为带电荷的单元,其包含至少一个带永久电荷的部分,特别是带永久正电荷的部分或带永久负电荷的部分,
[0116]
z2为带电荷的单元,其包含至少一个带永久电荷的部分,特别是带永久正电荷的部分或带永久负电荷的部分,并且
[0117]
l1是取代或未取代的接头,特别是通过裂解可裂解的基团,例如mc lafferty裂解部分、逆diels alder裂解部分、苄基或脂肪族基团,
[0118]
其中该化合物的净电荷大于1。
[0119]
在本发明的第一方面的实施例中,化合物包含能够与分析物分子反应的反应性单元q。反应性单元q能够与分析物分子反应,使得在化合物与分析物分子之间形成共价键。在本发明的第一方面的实施例中,反应性单元q与化合物形成共价键。特别地,共价键在化合物的反应性单元与分析物分子中存在的官能团之间形成。
[0120]
根据待确定的分析物分子中存在的官能团,技术人员将为所述化合物选择合适的反应性单元q。决定哪个反应性单元q将有资格与目的分析物的官能团结合是众所周知的。
[0121]
在本发明的第一方面的实施例中,分析物分子包含选自由以下项组成的组的官能团:羰基基团、二烯基团、羟基基团、胺基团、亚胺基团、酮基团、醛基团、硫醇基团、二醇基团、酚基团、环氧基团、二硫基团、核碱基团、羧酸基团、末端半胱氨酸基团、末端丝氨酸基团和叠氮基团,其中的各者均能与化合物的反应性单元q形成共价键。此外,在本发明的范围内还预期存在于分析物分子上的官能团将首先被转化成更容易与化合物的反应性单元q反应的另一个基团。
[0122]
在本发明的第一方面的实施例中,分析物分子选自由以下项组成的组:类固醇、酮类固醇、开环甾类化合物、氨基酸、肽、蛋白质、碳水化合物、脂肪酸、脂质、核苷、核苷酸、核酸和其他生物分子(包括小分子代谢物和辅因子)以及治疗性药物、滥用的药物、毒素或其代谢物。
[0123]
在本发明的第五方面的实施例中,分析物分子包含羰基基团作为官能团,该羰基基团选自由以下项组成的组:羧酸基团、醛基团、酮基团、掩蔽的醛、掩蔽的酮基团、酯基团、酰胺基团和酐基团。醛糖(醛和酮)以缩醛和半缩醛的形式存在,是母体醛/酮的一种掩蔽形式。
[0124]
在本发明的第一方面的实施例中,羰基基团是酰胺基团,技术人员清楚地知道,这样的酰胺基团是稳定的基团,但可将其水解以将酰胺基团转化为羧酸基团和氨基基团。酰胺基团的水解可经由酸/碱催化的反应或酶促过程实现,以上两者中的任何一种均是技术人员众所周知的。在本发明的第一方面的实施例中,其中羰基基团是掩蔽的醛基团或掩蔽的酮基团,各自的基团是半缩醛基团或缩醛基团,特别是环状半缩醛基团或缩醛基团。在本
发明的第一方面的实施例中,在与化合物反应之前,缩醛基团转化为醛或酮基团。
[0125]
在本发明的第一方面的实施例中,羰基基团是酮基团。在本发明的第一方面的实施例中,酮基团可以在与化合物的反应性单元反应之前转移到中间亚胺基团中。在本发明的第一方面的实施例中,包含一个或多个酮基团的分析物分子是酮类固醇。在本发明的第一方面的特定实施例中,酮类固醇选自由以下项组成的组:睾酮、表睾酮、二氢睾酮(dht)、去氧甲基睾酮(dmt)、四氢孕三烯酮(thg)、醛固酮、雌酮、4-羟基雌酮、2-甲氧基雌酮、2-羟基雌酮、16-酮雌二醇、16α-羟基雌酮、2-羟基雌酮-3-甲基醚、泼尼松、泼尼松龙、孕烯醇酮、孕酮、脱氢表雄酮(dhea)、17-羟基孕烯醇酮、17-羟基孕酮、雄酮、表雄酮和δ4-雄烯二酮、11-脱氧皮质醇、皮质甾酮、21-脱氧皮质醇、11-脱氧皮质酮、别孕烯醇酮和醛固酮。
[0126]
在本发明的第一方面的实施例中,羰基基团是羧基基团。在本发明的第一方面的实施例中,羧基团直接与化合物反应或在与化合物反应之前将其转化为活化的酯基团。在本发明的第一方面的实施例中,包含一个或多个羧基基团的分析物分子选自以下项组成的组:δ8-四氢大麻酚酸、苯甲酰芽子素、水杨酸、2-羟基苯甲酸、加巴喷丁、普瑞巴林、丙戊酸、万古霉素、甲氨蝶呤、霉酚酸、盂鲁司特、瑞格列奈、速尿、替米沙坦、吉非罗齐、双氯芬酸、布洛芬、吲哚美辛、佐美拉克、伊索克酸和青霉素。在本发明的第一方面的实施例中,包含一个或多个羧基基团的分析物分子为选自由以下项组成的组的氨基酸:精氨酸、赖氨酸、天冬氨酸、谷氨酸、谷氨酰胺、天冬酰胺、组氨酸、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸、丙氨酸、异亮氨酸、亮氨酸、蛋氨酸、苯丙氨酸、缬氨酸、脯氨酸和甘氨酸。
[0127]
在本发明的第一方面的实施例中,羰基基团是醛基团。在本发明的第一方面的实施例中,醛基团可以在与化合物的反应性单元反应之前转移到中间亚胺基团中。在本发明的第一方面的实施例中,包含一个或多个醛基团的分析物分子选自由以下项组成的组:吡哆醛、n-乙酰基-d-氨基葡萄糖、阿卡他定、链霉素和交沙霉素。
[0128]
在本发明的第一方面的实施例中,羰基基团是羰基酯基团。在本发明的第一方面的实施例中,包含一个或多个酯基团的分析物分子选自由以下项组成的组:可卡因、海洛因、利他林、醋氯芬酸、乙酰胆碱、安西奈德、阿米洛酯、阿米洛卡因、氨苄哌替啶、阿雷地平、青蒿琥酯和哌替啶。
[0129]
在本发明的第一方面的实施例中,羰基基团是酐基团。在本发明的第一方面的实施例中,包含一个或多个酐基团的分析物分子选自由以下项组成的组:斑蝥素、琥珀酸酐、偏苯三酸酐和马来酸酐。
[0130]
在本发明的第一方面的实施例中,分析物分子包含一个或多个二烯基团,特别是缀合的二烯基团,作为官能团。在本发明的第一方面的实施例中,包含一个或多个二烯基团的分析物分子是开环甾类化合物。在实施例中,开环甾类化合物选自由以下项组成的组:胆钙化醇(维生素d3)、麦角钙化醇(维生素d2)、骨化二醇、骨化三醇、速固醇、光甾醇和他卡西醇。特别地,开环甾类化合物是维生素d,特别是维生素d2或d3或其衍生物。在特定的实施例中,开环甾类化合物选自由以下项组成的族:维生素d2、维生素d3、25-羟基维生素d2、25-羟基维生素d3(骨化二醇)、3-表-25-羟基维生素d2、3-表-25-羟基维生素d3、1,25-二羟基维生素d2、1,25-二羟基维生素d3(骨化三醇)、24,25-二羟基维生素d2、24,25-二羟基维生素d3。在本发明的第一方面的实施例中,包含一个或多个二烯基团的分析物分子选自由以下项组成的组:维生素a、维a酸、异维a酸、阿利维a酸、游霉素、西罗莫司、两性霉素b、制霉菌
素、依维莫司、坦西罗莫司和非达霉素。
[0131]
在本发明的第一方面的实施例中,分析物分子包含一个或多个羟基基团作为官能团。在本发明的第一方面的实施例中,分析物分子包含单个羟基基团或两个羟基基团。在其中存在多于一个羟基基团的实施例中,两个羟基基团可以定位成彼此相邻(1,2-二醇)或通过1、2或3个c原子分离(分别为1,3-二醇、1,4-二醇、1,5-二醇)。特别地,在第一方面的特定实施例中,分析物分子包含1,2-二醇基团。在其中仅存在一个羟基基团的实施例中,所述分析物选自由以下项组成的组:伯醇、仲醇和叔醇。在本发明的第一方面的实施例中,其中分析物分子包含一个或多个羟基基团,分析物选自由以下项组成的组:苄醇、薄荷醇、l-肉毒碱、吡哆醇、甲硝哒唑、单硝酸异山梨酯、愈创甘油醚、克拉维酸盐、米吉妥(migitol)、扎西他滨、异丙肾上腺素、阿昔洛韦、美索巴莫、曲马多、文拉法辛、阿托品、氯苯达诺、α-羟基阿普唑仑、α-羟基三唑仑、劳拉西泮、去甲羟基安定、替马西泮、乙基葡糖苷酸、乙基吗啡、吗啡、吗啡-3-葡糖苷酸、丁丙诺啡、可待因、二氢可待因、对-羟基丙氧芬、o-去甲基曲马多、去甲基曲马多、双氢奎尼丁和奎尼丁。在本发明的第一方面的实施例中,其中分析物分子包含多于一个羟基基团,分析物选自由以下项组成的组:维生素c、葡萄糖胺、甘露醇、四氢生物蝶呤、阿糖胞苷、阿扎胞苷、利巴韦林、氟尿苷、吉西他滨、链脲佐菌素、腺苷、阿糖腺苷、克拉屈滨、雌三醇、三氟尿苷、氯法拉滨、纳多洛尔、扎那米韦、乳果糖、单磷酸腺苷、碘苷、瑞加德松(regadenoson)、林可霉素、克林霉素、卡格列净(canaglifozin)、妥布霉素、奈替米星、卡那霉素、替格瑞洛、表柔比星、多柔比星、阿贝卡星、链霉素、喹巴因(quabain)、阿米卡星、新霉素、新霉素b(framycetin)、巴龙霉素、红霉素、克拉霉素、阿奇霉素、长春地辛、洋地黄毒苷、地高辛、甲泛葡胺、乙酰洋地黄毒苷、去乙酰毛花苷、氟达拉滨、氯法拉滨、吉西他滨、阿糖胞苷、卡培他滨、阿糖腺苷和普卡霉素。
[0132]
在本发明的第一方面的实施例中,分析物分子包含一个或多个硫醇基团(包括但不限于烷基硫醇和芳基硫醇基团)作为官能团。在本发明的第一方面的实施例中,包含一个或多个硫醇基团的分析物分子选自由以下项组成的组:硫代扁桃酸、dl-甲巯丙脯酸、dl-塞奥芬、n-乙酰基半胱氨酸、d-青霉胺、谷胱甘肽、l-半胱氨酸、泽芬诺普利(zefenoprilat)、硫普罗宁、二巯基丙醇和琥巯酸。
[0133]
在本发明的第一方面的实施例中,分析物分子包含一个或多个二硫化物基团作为官能团。在本发明的第一方面的实施例中,包含一个或多个二硫化物基团的分析物分子选自由以下项组成的组:谷胱甘肽二硫化物、双硫氧吡啶、二硫化硒、双硫仑、硫辛酸、l-胱氨酸、呋喃硫胺、奥曲肽、去氨加压素、伐普肽、特利加压素、利那洛肽、培奈萨肽(peginesatide)。硫化硒可以是二硫化硒ses2或六硫化硒se2s6。
[0134]
在本发明的第一方面的实施例中,分析物分子包含一个或多个环氧化物基团作为官能团。在本发明的第一方面的实施例中,包含一个或多个环氧化物基团的分析物分子选自由以下项组成的组:卡巴西平-10,11-环氧化物、卡非佐米、呋喃苯胺酸环氧化物、磷霉素、司维拉姆、浅蓝菌素、东莨菪碱、噻托溴铵、甲溴东莨菪碱、依普利酮、莫匹罗星、纳他霉素和醋竹桃霉素。
[0135]
在本发明的第一方面的实施例中,分析物分子包含一个或多个酚基团作为官能团。在本发明的第一方面的实施例中,包含一个或多个酚基团的分析物分子是类固醇或类固醇样化合物。在本发明的第五方面的实施例中,包含一个或多个酚基团的分析物分子是
具有sp2杂化的a环以及位于a环3位置的oh基团的类固醇或类固醇样化合物。在本发明的第一方面的特定实施例中,类固醇或类固醇样分析物分子选自由以下项组成的组:雌激素、雌激素样化合物、雌酮(e1)、雌二醇(e2)、17a-雌二醇、17b-雌二醇、雌三醇(e3)、16-表雌三醇、17-表雌三醇和16,17-表雌三醇和/或其代谢物。在实施例中,代谢物选自由以下项组成的组:雌三醇、16-表雌三醇(16-epie3)、17-表雌三醇(17-epie3)、16,17-表雌三醇(16,17-epie3)、16-酮雌二醇(16-ketoe2)、16a-羟基雌酮(16a-ohe1)、2-甲氧基雌酮(2-meoe1)、4-甲氧基雌酮(4-meoe1)、2-羟基雌酮-3-甲基醚(3-meoe1)、2-甲氧基雌二醇(2-meoe2)、4-甲氧基雌二醇(4-meoe2)、2-羟基雌酮(2-ohe1)、4-羟基雌酮(4-ohe1)、2-羟基雌二醇(2-ohe2)、雌酮(el)、硫酸雌酮(els)、17a-雌二醇(e2a)、17b-雌二醇(e2b)、硫酸雌二醇(e2s)、马烯雌酮(eq)、17a-二氢马烯雌酮(eqa)、17b-二氢马烯雌酮(eqb)、马萘雌酮(eqilenin)(en)、17-二氢马萘雌酮(ena)、17α-二氢马萘雌酮、17β-二氢马萘雌酮(enb)、δ8,9-脱氢雌酮(del)、δ8,9-脱氢雌酮硫酸酯(dels)、δ9-四氢大麻酚、霉酚酸。β或b可以互换使用。α和a可以互换使用。
[0136]
在本发明的第一方面的实施例中,分析物分子包含胺基团作为官能团。在本发明的第一方面的实施例中,胺基团是烷基-胺或芳基-胺基团。在本发明的第一方面的实施例中,包含一个或多个胺基团的分析物选自由以下项组成的组:蛋白质和肽。在本发明的第一方面的实施例中,包含胺基团的分析物分子选自由以下项组成的组:3,4-亚甲二氧安非他明、3,4-亚甲二氧-n-乙基安非他明、3,4-亚甲二氧甲基安非他明、安非他明、甲基安非他明、n-甲基-1,3-苯并二氧杂环戊烯基仲丁胺、7-氨基氯硝西泮、7-氨基氟硝西泮、3,4-二甲基甲卡西酮、3-氟甲卡西酮、4-甲氧基甲卡西酮、4-甲基乙卡西酮、4-甲基甲卡西酮、安非拉酮、2-甲基氨基-1-(3,4-亚甲二氧基苯基)丁-1-酮(butylone)、乙卡西酮(ethcathinone)、氟芬酮(flephedrone)、甲卡西酮、亚甲基二氧基甲卡西酮(methylone)、亚甲二氧吡咯戊酮、苯甲酰爱康宁、去氢去甲氯胺酮、氯胺酮、去甲氯胺酮、美沙酮、去甲美沙酮、6-乙酰基吗啡、二乙酰基吗啡、吗啡、去甲氢可酮(norhydrocodone)、氧可酮、羟吗啡酮、苯环己哌啶、去甲丙氧芬、阿米替林、氯米帕明、度琉平、多虑平、丙咪嗪、去甲替林、三甲丙咪嗪、芬太尼、甘氨酰二甲基苯胺(glycylxylidide)、利多卡因、单乙基甘氨酰二甲基苯胺、n-乙酰基普鲁卡因酰胺、普鲁卡因酰胺、普瑞巴林、2-甲基氨基-1-(3,4-亚甲二氧苯基)丁烷、n-甲基-1,3-苯并二氧杂环戊烯基仲丁胺、2-氨基-1-(3,4-亚甲二氧苯基)丁烷、1,3-苯并二氧杂环戊烯基仲丁胺、去甲哌替啶、o-去甲基曲马多、去甲基曲马多、曲马多、利多卡因、拉莫三嗪、茶碱、阿米卡星、庆大霉素、妥布霉素、万古霉素、甲氨蝶呤、加巴喷丁、西索米星和5-甲基胞嘧啶。
[0137]
在本发明的第一方面的实施例中,分析物分子是碳水化合物或具有碳水化合物部分的物质,例如糖蛋白或核苷。在本发明的第五方面的实施例中,分析物分子是单糖,特别是选自由以下项组成的组:核糖、脱氧核糖、阿拉伯糖、核酮糖、葡萄糖、甘露糖、半乳糖、岩藻糖、果糖、n-乙酰基葡萄糖胺、n-乙酰基半乳糖胺、神经氨酸、n-乙酰基神经氨酸等。在实施例中,分析物分子是寡糖,特别是选自由以下项组成的组:二糖、三糖、四糖、多糖。在本发明的第一方面的实施例中,二糖选自由以下项组成的组:蔗糖、麦芽糖和乳糖。在本发明的第一方面的实施例中,分析物分子是包含上述单糖、二糖、三糖、四糖、寡糖或多糖部分的物质。
[0138]
在本发明的第一方面的实施例中,分析物分子包含叠氮化物基团作为官能团,其选自由以下项组成的组:烷基叠氮化物或芳基叠氮化物。在本发明的第一方面的实施例中,包含一个或多个叠氮化物基团的分析物分子选自由以下项组成的组:齐多夫定和叠氮西林。
[0139]
此类分析物分子可存在于生物样品或临床样品诸如体液(例如血液、血清、血浆、尿液、唾液、脊髓液等)、组织或细胞提取物等中。在本发明的第一方面的实施例中,分析物分子存在于选自由以下项组成的组的生物样品或临床样品中:血液、血清、血浆、尿液、唾液、脊髓液和干血斑。在本发明的第五方面的一些实施例中,分析物分子可存在于样品中,该样品是纯化或部分纯化的样品,例如,纯化或部分纯化的蛋白质混合物或提取物。
[0140]
在本发明的第一方面的实施例中,反应性单元q选自由以下项组成的组:羰基反应性单元、二烯反应性单元、羟基反应性单元、氨基反应性单元、亚胺反应性单元、硫醇反应性单元、二醇反应性单元、酚反应性单元、环氧化物反应性单元、二硫化物反应性单元和叠氮基反应性单元。
[0141]
在本发明的第一方面的实施例中,反应性单元q是羰基反应性单元,其能够与任何类型的具有羰基的分子反应。在本发明的第一方面的实施例中,羰基反应性单元选自由以下项组成的组:羧基反应性单元、酮基反应性单元、醛反应性单元、酐反应性单元、羰基酯反应性单元和酰亚胺反应性单元。在本发明的第五方面的实施例中,羰基反应性单元可以具有通过相邻o或n原子的α-效应强化的超亲核性n原子nh2-n/o或具有二硫醇分子。
[0142]
在本发明的第一方面的实施例中,羰基反应性单元选自由以下项组成的组:
[0143]
(i)肼单元,例如h2n-nh-或h2n-nr1-单元,其中r1为芳基或c1-4烷基,特别是c1或c2烷基,任选地被取代,
[0144]
(ii)酰肼单元,特别是碳酰肼或磺酰肼,特别是h2n-nh-c(o)-或h2n-nr2-c(o)-单元,其中r2为芳基或c1-4烷基,特别是c1或c2烷基,任选地被取代,
[0145]
(iii)羟氨基单元,例如,h2n-o-单元,以及
[0146]
(iv)二硫醇单元,特别是1,2-二硫醇或1,3-二硫醇单元。
[0147]
在本发明第一方面的实施例中,其中羰基反应性单元是羧基反应性单元,羧基反应性单元与分析物分子上的羧基基团反应。在本发明的第一方面的实施例中,羧基反应性单元选自由以下项组成的组:重氮基单元、烷基卤、胺和肼单元。
[0148]
在本发明的第一方面的实施例中,分析物分子包含酮基团或醛基团并且q是羰基反应性单元,其选自以下组:
[0149]
(i)肼单元,
[0150]
(ii)酰肼单元,
[0151]
(iii)羟基氨基单元,和
[0152]
(iv)二硫醇单元。
[0153]
在本发明的第一方面的实施例中,反应性单元q是二烯反应性单元,其能够与包含二烯基团的分析物反应。在本发明的第一方面的实施例中,二烯反应性单元选自由以下项组成的组:cookson型试剂,例如,1,2,4-三唑啉-3,5-二酮,其能够作为亲二烯体发挥作用。
[0154]
在本发明的第一方面的实施例中,反应性单元q是羟基反应性单元,其能够与包含羟基基团的分析物反应。在本发明的第一方面的实施例中,羟基反应性单元选自由以下项
组成的组:磺酰氯、活化的羧酸酯(nhs,或咪唑阴离子)和能够进行氟的亲核取代的含氟芳烃/杂芳烃(t.higashi j steroid biochem mol biol.2016sep;162:57-69)。在本发明的第一方面的实施例中,反应性单元q是二醇反应性单元,其与分析物分子上的二醇基团反应。在本发明的第一方面的实施例中,其中反应性单元是1,2二醇反应性单元,1,2二醇反应性单元包含硼酸。在其他实施例中,二醇可被氧化成相应的酮或醛,并随后与酮/醛反应性单元k反应。
[0155]
在本发明的第一方面的实施例中,氨基反应性单元与分析物分子上的氨基基团反应。在本发明的第一方面的实施例中,氨基反应性单元选自由以下项组成的组:活性酯基团诸如n-羟基琥珀酰亚胺(nhs)酯或磺基-nhs酯、五氟苯基酯、羰基咪唑酯、方酸(quadratic acid)酯、羟基苯并三唑(hobt)酯、1-羟基-7-氮杂苯并三唑(hoat)酯和磺酰氯单元。
[0156]
在本发明的第一方面的实施例中,硫醇反应性单元与分析物分子上的硫醇基团反应。在本发明的第一方面的实施例中,硫醇反应性单元选自由卤代乙酰基基团组成的组,特别是选自由以下项组成的组:br/i-ch
2-c(=o)-单元、丙烯酰胺/丙烯酸酯单元、不饱和酰亚胺单元诸如马来酰亚胺、甲磺酰基苯基噁二唑和磺酰氯单元。
[0157]
在本发明的第一方面的实施例中,酚反应性单元与分析物分子上的酚基团反应。在本发明的第五方面的实施例中,苯酚反应性单元选自由以下项组成的组:活性酯单元诸如n-羟基琥珀酰亚胺(nhs)酯或磺基-nhs酯、五氟苯基酯、羰基咪唑酯、方酸(quadratic acid)酯、羟基苯并三唑(hobt)酯、1-羟基-7-氮杂苯并三唑(hoat)酯和磺酰氯单元。分析物分子上存在的酚基团可经由反应(h.ban等人j.am.chem.soc.,2010,132(5),第1523-1525页)与高活性亲电试剂如三唑二酮(如tad)反应,或可替换地通过重氮化或者通过邻位硝基化,之后还原为胺,然后该胺与胺反应性试剂反应。在本发明的第一方面的实施例中,酚反应性单元是氟-1-吡啶鎓。
[0158]
在本发明的第一方面的实施例中,反应性单元q是环氧化物反应性单元,其能够与包含环氧化物基团的分析物反应。在本发明的第一方面的实施例中,环氧化物反应性单元选自由以下项组成的组:氨基、硫醇、通过相邻o或n原子的α-效应强化的超亲核性n原子nh2-n/o分子。在本发明的第一方面的实施例中,环氧化物反应性单元选自由以下项组成的组:
[0159]
(i)肼单元,例如,h2n-nh-或h2n-nr
1-单元,其中r1是芳基、含有一个或多个杂原子的芳基、或c
1-4
烷基特别是c1或c2烷基,其可选地被例如卤素、羟基和/或c
1-3
烷氧基取代,
[0160]
(ii)酰肼单元,特别是碳酰肼或磺酰肼单元,特别是h2n-nh-c(o)-或h2n-nr
2-c(o)-单元,
[0161]
其中r2是芳基、含有一个或多个杂原子的芳基、或c
1-4
烷基特别是c1或c2烷基,其可选地被例如卤素、羟基和/或c
1-3
烷氧基取代,以及
[0162]
(iii)羟氨基单元,例如,h2n-o-单元。
[0163]
在本发明的第一方面的实施例中,反应性单元q是二硫化物反应性单元,其能够与包含二硫化物基团的分析物反应。在本发明的第一方面的实施例中,二硫化物反应性单元选自由硫醇组成的组。在其他实施例中,二硫化物基团可被还原成相应的硫醇基团,然后与硫醇反应性单元q反应。
[0164]
在本发明的第一方面的实施例中,反应性单元q是硫醇反应性基团或氨基反应性
基团,诸如活性酯基团,例如n-羟基琥珀酰亚胺(nhs)酯或磺基-nhs酯、羟基苯并三唑(hobt)酯或1-羟基-7-氮杂苯并三唑(hoat)酯基团。
[0165]
在本发明的第一方面的实施例中,反应性单元q选自4-取代的1,2,4-三唑啉-3,5-二酮(tad)、4-苯基-1,2,4-三唑啉-3,5-二酮(ptad)或氟取代的吡啶鎓。
[0166]
在本发明的第一方面的实施例中,反应性单元q是叠氮基反应性单元,其与分析物分子上的叠氮基基团反应。在本发明的第一方面的实施例中,叠氮基反应性单元通过叠氮化物-炔环加成而与叠氮基基团反应。在本发明的第一方面的实施例中,叠氮基反应性单元选自由以下项组成的组:炔(烷基或芳基)、线性炔或环状炔。叠氮基与炔之间的反应可在使用或不使用催化剂的情况下进行。在本发明的第一方面的其他实施例中,叠氮基基团可被还原成相应的氨基基团,然后与氨基反应性单元k反应。
[0167]
在本发明的第一方面的实施例中,分析物的官能团选自表1左栏中提到的选项。分析物的相应官能团的反应性基团q选自表1右栏中提到的基团。
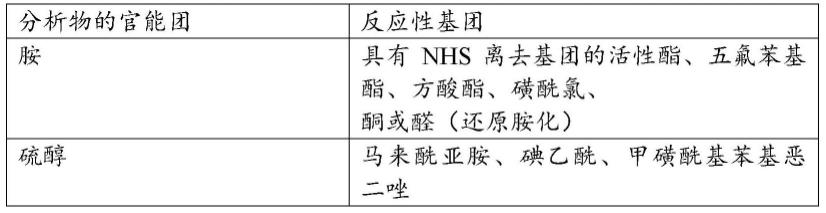
[0168]
表1:分析物的官能团和特定标记的反应性基团
[0169][0170][0171]
在本发明的第一方面的实施例中,该化合物包含两个带电荷的单元,分别命名为z1和z2。z1为带电荷的单元,其包含至少一个带永久电荷的部分,特别是带永久正电荷的部分或带永久负电荷的部分。z2为带电荷的单元,其包含至少一个带永久电荷的部分,特别是带永久正电荷的部分或带永久负电荷的部分。
[0172]
在本发明的第一方面的实施例中,带电荷的单元z1和/或z2是带永久电荷的,特别
在中性条件下,特别在6-8的ph值下。
[0173]
在本发明的第一方面的实施例中,带电荷的单元z1和/或z2中的每一个包含以下项或由其组成
[0174]
(i)至少一个或确切一个带正电荷的部分。替代地,带电荷的单元z1和z2中的每一个包括以下项或由以下项组成
[0175]
(ii)至少一个或确切一个带负电荷的部分。该化合物包含2或大于2例如3、4或5的净电荷z1。
[0176]
在本发明的第一方面的实施例中,z1和z2被至少一个原子例如c原子彼此隔开。
[0177]
在本发明的第一方面的实施例中,带电荷的单元z1或带电荷的单元z2或者两者均为带正电荷的单元。在本发明的第一方面的实施例中,带正电荷的单元z1和/或z2是以所得化合物具有的pka为10或更高,更特别地是以具有的pka为12或更高的方式选择的。在本发明的第一方面的实施例中,带正电荷的单元z1和/或z2选自由以下项组成的组:伯铵、仲铵、叔铵、季铵、伯锍、仲锍、叔锍、季锍、伯咪唑鎓、仲咪唑鎓、叔咪唑鎓、季咪唑鎓、伯吡啶鎓、仲吡啶鎓、叔吡啶鎓、季吡啶鎓、或伯鏻、仲鏻、叔鏻、季鏻。在第一方面的特定实施例中,带正电荷的部分是三甲基铵、n,n-二甲基哌啶鎓或n-烷基-奎宁环鎓。
[0178]
在本发明的第一方面的实施例中,带电荷的单元z1或带电荷的单元z2或者两者均为带负电荷的单元。在本发明的第一方面的实施例中,带负电荷的单元z1和/或z2是以所得化合物具有的pkb为10或更高,更特别地是以具有的pkb为12或更高的方式选择。在本发明的第一方面的实施例中,带负电荷的单元z1和/或z2选自由以下项组成的组:磷酸根、硫酸根、磺酸根或羧基根。
[0179]
在本发明的第一方面的实施例中,l1是取代的接头或未取代的接头,特别是通过裂解可裂解的基团,例如mc lafferty裂解部分、逆diels alder裂解部分或脂肪族基团。在本发明的第一方面的实施例中,l1不可质子化。在第一方面的实施例中,l1包含3-30个c原子,特别是5-20个c原子,特别是8-16个c原子。在实施例中,l1包含一个或多个杂原子,这些杂原子特别地为n、o或s。在本发明的第一方面的实施例中,l1包含至少四个杂原子,特别是五、六或七个杂原子,这些杂原子特别地为n和/或o。在本发明的第一方面的实施例中,l1包含五个杂原子,特别是三个o原子和两个n原子。
[0180]
在本发明的第一方面的实施例中,接头l1包含1至10个c原子,任选地包含1或多个杂原子。
[0181]
在本发明的第一方面的实施例中,接头l1选自由以下项组成的组:mclafferty裂解单元、逆diels alder单元、中性丢失裂解单元、键解离单元、α-裂解和电荷位点重排。
[0182]
mclafferty裂解单元是含有至少一个叮氢的羰基化合物。
[0183]
逆diels alder单元是dials alder反应产物。
[0184]
在本发明的第一方面的实施例中,中性丢失裂解单元在离子化时释放至少一个中性实体。中性实体为低分子量中性实体,特别是分子量在10-100da、特别是20-80da、特别是25-65da的范围内。特别地,中性实体具有100da或更小、特别是80da或更小、特别是70da或更小、特别是50da或更小、特别是30或更小的分子量。
[0185]
在本发明的第一方面的实施例中,中性实体选自由以下项组成的组:n2、no、no2、s2、so、so2、co、co2。在特定实施例中,中性实体为n2。
[0186]
在本发明的第一方面的实施例中,中性实体的丢失导致质荷比(m/z)减小-28da(在失去n2或co的情况下)、-30da(在失去no的情况下)、-44da(在失去co2的情况下)、-46da(在失去no2的情况下)、-48da(在失去so的情况下)或-64da(在失去s2或so2的情况下)。
[0187]
在本发明的第一方面的实施例中,释放出一个中性实体。在本发明的第一方面的实施例中,释放了两个中性实体。特别地,所释放的第二中性实体不同于所释放的第一中性实体。第二中性实体的释放与第一中性实体的释放同时发生或在后者之后发生。特别地,第二中性实体的释放与第一中性实体的释放同时发生,即,两个中性实体一次性释放,即在一次单个裂解事件中释放。
[0188]
在本发明的第一方面的实施例中,中性丢失裂解单元包含能够裂解的环状部分或由其组成。在本发明的第一方面的实施例中,中性丢失裂解单元包含杂环部分或由其组成,特别是4元、5元或6元杂环部分,其能够裂解,特别是通过反向环加成反应。在本发明的第一方面的实施例中,中性丢失裂解单元包含4元、5元或6元杂环部分或由其组成,特别是包含具有至少2个彼此相邻的杂原子、特别是两个彼此相邻的n原子的5元杂环部分或由其组成。在本发明的第一方面的实施例中,中性丢失裂解单元包含三唑、四唑、噁二唑、噻二唑部分或其氢化衍生物或由其组成。在本发明的第一方面的实施例中,中性丢失裂解单元包含1,2,3-三唑、1,4,5-三唑、3,4,5-三唑部分或2,3,4,5-四唑部分、或2,3,5,6四座部分,或由其组成。
[0189]
键解离单元是例如能够在质谱条件下解离成带电荷的物质的化学键。
[0190]
α-裂解是例如与特定官能团相邻的碳碳键。
[0191]
电荷位点重排是来自邻近带电荷的原子的键的电子迁移到该原子,中和原始电荷并使其移动到不同的位点。
[0192]
在本发明的第一方面的实施例中,q共价连接到z1或z2。特别是,因此,q直接连接到z1或直接连接到z2。
[0193]
在本发明的第一方面的实施例中,l1共价连接z1和z2。具体来说,根据下式,l1直接连接到z1并直接连接到z2:z1-l1-z2。
[0194]
在本发明的第一方面的实施例中,化合物在z1与z2之间裂解。具体来说,该化合物通过接头l1的分裂而裂解。
[0195]
在本发明的第一方面的实施例中,该化合物包含下式1-i至1-iii中的一个:
[0196]
(z1-l1-z2-q)n,其中n≥1
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(1-i),
[0197]
(q-z1-l1-z2)n,其中n≥1
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(1-ii),
[0198]
(z1-z2-q)n,其中n≥1
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(1-iii)。
[0199]
在本文中,“n”是指化合物的净电荷。
[0200]
在下文和/或上文提及的公开的上下文中,“n≥1”意指n大于或等于+1(加一)。另外或替代地,“n≥1”意指n大于或等于-1(减一)。
[0201]
在本发明的第一方面的实施例中,化合物包含式1-i并选自由以下项组成的组:
[0202]
标记物1
[0203]
标记物2
[0204]
标记物3
[0205]
标记物4
[0206]
标记物5
[0207]
这些实施例的实例是带两倍电荷的,特别是带两倍正电荷的。
[0208]
在本发明的第一方面的实施例中,z1和z2彼此独立地包含螯合复合物、鏻、铵、碳鎓、吡啶鎓、锍、包含n、s、h和c原子的3-10元环的带电荷的杂环,或它们的衍生物。
[0209]
在本发明的第一方面的实施例中,化合物包含式1-iv:(z1-(l1-z2)
m-(l2-zo)
k-q)n,
[0210]
其中:
[0211]
zo是带电荷的单元,特别是包含带正电荷或带负电荷或带中性电荷的单元,
[0212]
l2是取代的或未取代的接头,特别是l2是l1或l2是通过裂解可裂解的基团,并且
[0213]
m>0,k>0且n≥1。l1、z1、z2和q具有如上所述的相同含义。
[0214]
在本文中,“n”是指化合物的净电荷。特别是,如果zo=0,则n=m+1(-1)或如果zo带电荷,则n=m+1(-1)-k。
[0215]
在本发明的第一方面的实施例中,zo是带电荷的单元。zo可选自由以下项组成的组:伯铵、仲铵、叔铵或季铵、碳鎓、锍、咪唑鎓、吡啶鎓、含有n、s、h和c原子的3-10元环的带电荷的杂环或它们的衍生物、螯合复合物或鏻。在第一方面的特定实施例中,带正电荷的部
分是三甲基铵、n,n-二甲基哌啶鎓或n-烷基-奎宁环鎓。
[0216]
在本发明的第一方面的实施例中,l2是取代的接头或未取代的接头。l2可以是通过裂解可裂解的基团,例如mc lafferty裂解部分、逆diels alder裂解部分、苄基或脂肪族基团,
[0217]
在本发明的第一方面的实施例中,m为0、1、2、3、4或5。
[0218]
在本发明的第一方面的实施例中,k为0、1、2、3、4或5。
[0219]
在本发明的第一方面的实施例中,该化合物包含式1-iv,其中m=1且k=1。例如,该化合物选自以下组:
[0220]
标记物6
[0221]
标记物7
[0222]
在本发明的第一方面的实施例中,化合物包含式1-v:(z1-(l3-z2)
m-(l2-zo)
k-q)n,
[0223]
其中:
[0224]
zo是带电荷的单元,特别是包含带正电荷或带负电荷或带中性电荷的单元,特别是带电荷的单元包含带正电荷或带负电荷的单元,
[0225]
l2是取代的或未取代的接头,特别是l2是l1或l2是通过裂解可裂解的基团,
[0226]
l3是取代或未取代的接头,特别是通过裂解不可裂解的基团,例如苄基或重氮基,
[0227]
m>0,k>0且n≥1。l1、z1、z2和q具有如上所述的相同含义。
[0228]
在本发明的第一方面的实施例中,l3是取代或未取代的接头。l3选自由以下组成的群组:通过裂解可裂解的基团,例如mc lafferty裂解部分、逆diels alder裂解部分、苄基或脂肪族基团,替代地,l3特别是通过裂解不可裂解的基团,例如由至少一个或两个碳原子(c1-c2)组成的苄基、重氮基或脂肪族基团和由c1-c2组成的脂肪族基团。
[0229]
在本发明的第一方面的实施例中,该化合物包含式1-v,其中m=1且k=1。例如,化合物选自标记物6或标记物7。
[0230]
在本发明的第一方面的实施例中,化合物包含式1-vi:((z1)
m-l1-z2-(l2/l3)
k-zo)
n-q,
[0231]
其中:
[0232]
zo是带电荷的单元,特别是包含带正电荷或带负电荷或带中性电荷的单元,
[0233]
l2是取代的或未取代的接头,特别是l2是l1或l2是通过裂解可裂解的基团,
[0234]
l3是取代或未取代的接头,特别是通过裂解不可裂解的基团,例如苄基或重氮基,
[0235]
m>0,k≥0且n≥1。l1、z1、z2和q具有如上所述的相同含义。
[0236]
在本发明的第一方面的实施例中,化合物包含式1-vi,且是
[0237]
标记物8
[0238]
在本发明的第一方面的实施例中,化合物包含式1-vii:(z1-l1-z2-q)n,
[0239]
其中:n≥1。l1、z1、z2和q具有如上所述的相同含义。
[0240]
在本发明的第一方面的实施例中,化合物包含式1-viii:
[0241][0242]
其中:
[0243]
zo是带电荷的单元,其包含,特别是带正电荷或带负电荷或带中性电荷的单元,
[0244]
l2是取代的或未取代的接头,特别是l2是l1或l2是通过裂解可裂解的基团,
[0245]
l3是取代或未取代的接头,特别是通过裂解不可裂解的基团,例如苄基或重氮基,
[0246]
n>1,m>0且k>0。z1、z2和q具有如上所述的相同含义。
[0247]
在本发明的第一方面的实施例中,化合物包含式1-ix:
[0248][0249]
其中:
[0250]
zo是带电荷的单元,特别是包含带正电荷或带负电荷或带中性电荷的单元,
[0251]
l2是取代的或未取代的接头,特别是l2是l1或l2是通过裂解可裂解的基团,
[0252]
l3是取代或未取代的接头,特别是通过裂解不可裂解的基团,例如苄基或重氮基,
[0253]
且n≥1。z1、z2和q具有如上所述的相同含义。
[0254]
在本发明的第一方面的实施例中,化合物包含式1-ix,且选择:
[0255]
标记物9
[0256]
[0257]
标记物10
[0258][0259]
标记物9和10带两倍负电荷。
[0260]
在本发明的第一方面的实施例中,化合物包含式1-x:
[0261][0262]
其中:
[0263]
zo是带电荷的单元,其包含,特别是带正电荷或带负电荷或带中性电荷的单元,
[0264]
n≥1且m>0。l1、z1、z2和q具有如上所述的相同含义。
[0265]
在本发明的第一方面的实施例中,化合物包含式1-xi:
[0266][0267]
其中:
[0268]
zo是带电荷的单元,其包含,特别是带正电荷或带负电荷或带中性电荷的单元,
[0269]
z3是带多倍电荷的单元,特别是带多倍电荷的金属单元,
[0270]
l3是取代或未取代的接头,特别是通过裂解不可裂解的基团,例如由至少一个或两个碳原子(c1-c2)组成的苄基、重氮基或脂肪族基团和由c1-c2组成的脂肪族基团。
[0271]
lig1是带多倍电荷的金属复合物结合配体,尤其依赖于高结合常数logkb>5,
[0272]
且n≥1。l1和q具有如上所述的相同含义。
[0273]
在本发明的第一方面的实施例中,lig1是带多倍电荷的金属复合物结合配体并且选自以下组:乙酰丙酮化物(acac)、2-(2-氨基乙基氨基)乙醇、2,2
′‑
双(二苯基膦)-6,6
′‑
二甲氧基-1,1
′‑
联苯基、2,2-双(二苯基膦基)-1,1-联萘基、1,2-双[4,5-二氢-3h-联萘并[1,2-c2
′
,1
′‑
e]膦]苯(binaphane)、1,1
′‑
联-2-萘酚(binol)、5,5
′‑
二-叔丁基-2,2
′‑
联吡啶、双(噁唑啉)配体(box)、2,2
′‑
联吡啶、双(二苯基膦基)丁烷、1,5-环辛二烯、苄基(甲基)苯基膦、1,2-双(2,5-二乙基膦基)乙烷、叔丁氧羰基-4-二苯基膦基-2-(二苯基膦基甲基)吡咯烷、双(4-异丙基-4,5-二氢噁唑-2-基)苯胺(bopa-ip)、1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(dota)、n-杂环卡宾、1,10-菲咯啉、卟啉、三联吡啶(terpy)、三苯基膦、1,2-双(邻氨基苯氧基)乙烷-n,n,n
′
,n
′‑
四乙酸(bapta)、双(二苯基膦基)甲烷(dppm)、1,2-双
(二苯基膦基)乙烷(dppe)、1,3-双(二苯基膦基)丙烷(dppp)、冠醚、[2.2.2]穴醚、环戊二烯基阴离子、二乙烯三胺五乙酸(dtpa)、乙二胺四乙酸(edta)、乙二氨基三乙酸(ted)、亚乙基双(氧亚乙基次氮基)四乙酸(egta4-)、亚氨基二乙酸(ida)、次氮基三乙酸(nta)、三(邻甲苯基)膦、三(2-氨基乙基)胺、环己基-邻-茴香基甲基膦(camp)、苯基-邻-茴香基甲基膦(pamp)、卓鎓离子、柠檬酸根、环辛烯、环辛四烯(cot)、环戊二烯基离子(cp)、1,2,3,4,5-五甲基环戊二烯基离子(cp*)、1,4-二氮杂双环[2.2.2]辛烷(dabco)、二亚苄基丙酮(dba)、4-二甲氨基吡啶(dmap)、新铜素、双(2,5-二甲基磷酰)苯、(3,5-二氧杂-4-磷杂环庚[2,1-a;3,4-a
′
]二萘-4-基)二甲胺(monophos)、1,3-双烯酮亚胺配体,双环[2.2.1]庚-2,5-二烯、乙酸根、草酸根、8-羟基喹啉、酞菁、甲基吡啶胺、2-苯基吡啶、吡嗪、salen配体、1,4,7-三氮杂环壬烷(tacn)、酒石酸根、三吡唑基硼酸根、四苯基卟啉(tpp)、3,3
′
,3
″‑
膦三基三(苯磺酸)三钠根(tppts)、5-(3-吡啶基)-1h-四唑、2-(1h-咪唑-2-基)吡啶、2-(1h-1,2,4-三唑-3-基)吡啶、甲基吡啶、2,2
′‑
联吡啶-4-丁酸。
[0274]
在本发明的第一方面的实施例中,化合物包含式1-xi,是
[0275]
标记物11:
[0276][0277]
在本发明的第一方面的实施例中,化合物包含式1-xii:
[0278][0279]
其中:
[0280]
zo是带电荷的单元,其包含,特别是带正电荷或带负电荷或带中性电荷的单元,
[0281]
z3是带多倍电荷的单元,特别是带多倍电荷的金属单元,
[0282]
l3是取代或未取代的接头,特别是通过裂解不可裂解的基团,例如苄基或重氮基,
[0283]
lig1是带多倍电荷的金属复合物结合配体,尤其依赖于结合常数logkb>5
[0284]
lig2是带多倍电荷的金属复合物结合配体,尤其依赖于结合常数:1≤logkb≤5
[0285]
且n≥1。q具有如上所述的相同含义。
[0286]
在本发明的第一方面的实施例中,lig1在复合物中存在2次。
[0287]
在本发明的第一方面的实施例中,lig1等于lig2。
[0288]
在本发明的第一方面的实施例中,lig1可以选自上述组。
[0289]
在本发明的第一方面的实施例中,lig2是带多倍电荷的金属复合物结合配体。lig2可以选自以下组:
[0290]
2-(2-氨基乙基氨基)乙醇、1,1
′‑
联-2-萘酚(binol)、双(噁唑啉)-配体(box)、叔丁氧羰基-4-二苯基膦基-2-(二苯基膦基甲基)吡咯啶、1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(dota)、n-杂环卡宾、氨基多羧酸、1,2-双(邻氨基苯氧基)乙烷-n,n,n
′
,n
′‑
四乙酸(bapta)、冠醚、二亚乙基三胺五乙酸(dtpa)、乙二胺四乙酸(edta)、亚乙基双(氧亚乙基次氮基)四乙酸(egta4-)、亚氨基二乙酸、次氮基三乙酸(nta)、三(2-氨基乙基)胺、柠檬酸根、环辛烯、环辛四烯(cot)、乙酸根、草酸根、吡啶甲胺、酒石酸根、乙二氨基三乙酸根(ted)、2,2
′‑
联吡啶-4-丁酸。
[0291]
在本发明的第一方面的实施例中,化合物包含式1-xiii:(z1-l3-z2-l1-z3-l2-zo-q)n。z1、l3、z2、l1、z3、l2、zo、q和n中的每一个具有与上述相同的含义。
[0292]
在本发明的第一方面的实施例中,化合物为:
[0293]
标记物12:
[0294][0295]
在本发明的第一方面的实施例中,m为1,k为1,且n为2。
[0296]
在本发明的第一方面的实施例中,m、n、k中的每一个为整数且大于0。这意味着式1-i至1-xiii括号中的部分可以重复m次或k次。n是所得分子的净电荷。
[0297]
在本发明的第一方面的实施例中,l1和l2可以在具有源内裂解的离子源中或在碰撞池中被裂解,即在不同的电势(电压)下。
[0298]
在本发明的第一方面的实施例中,该化合物包含用于形成盐的抗衡离子,其中该抗衡离子优选地选自以下组:cl-、br-、f-、甲酸根、pf
6-、磺酸根、磷酸根、乙酸根。
[0299]
在本发明的第一方面的实施例中,其中该化合物不含三氟乙酸根(tfa)。tfa作为强配位阴离子能够补偿每个tfa分子的净电荷,因此通过形成作为tfa加合物的带单一电荷的物质来抑制带两倍电荷的部分。
[0300]
在本发明的第一方面的实施例中,化合物选自由以下项组成的组:
[0301]
标记物13
[0302]
标记物14
[0303]
标记物15
[0304]
标记物16
[0305]
标记物17
[0306]
在本发明的第一方面的实施例中,化合物带两倍电荷,特别是带两倍永久正电荷。
[0307]
在本发明的第一方面的实施例中,化合物选自由以下项组成的组:
[0308]
标记物18
[0309]
标记物19
[0310]
标记物20
[0311]
在第二方面,本发明涉及包含如上文关于本发明的第一方面详细公开的化合物的组合物。对于本发明的第一方面提及的所有实施例都适用于本发明的第二方面,反之亦然。
[0312]
在第三方面,本发明涉及包含如上文中关于本发明的第一方面详细公开的化合物或如上文中详细公开的本发明的第二方面的组合物的试剂盒。对于本发明的第一方面和/或本发明的第二方面提及的所有实施例都适用于本发明的第三方面,反之亦然。
[0313]
在第四方面,本发明涉及一种用于使用质谱测定来定量检测分析物的复合物,其中该复合物由彼此共价连接的分析物和化合物形成,其中该复合物包含永久电荷,特别是永久净电荷,其中所述复合物具有质量m3和净电荷z3,其中在经由质谱测定的裂解后,该复合物能够形成具有质量m4<m3和净电荷z4<z3的至少一种子离子,其中m3/z3<m4/z4。
[0314]
特别地,分析物选自由以下项组成的组:核酸、氨基酸、肽、蛋白质、代谢物、激素、脂肪酸、脂质、碳水化合物、类固醇、酮类固醇、开环甾类化合物、另一分子的某种修饰的分子特征、已被生物体内化的物质、这种物质的代谢物及它们的组合。对于本发明的第一方面和/或本发明的第二方面和/或本发明的第三方面提及的所有实施例都适用于本发明的第四方面,反之亦然。
[0315]
在本发明的第四方面的实施例中,复合物是由化合物与分析物分子中存在的官能团之间形成共价键而产生的。取决于化合物的反应性单元q和分析物分子的官能团,技术人员能够很好地确定两者之间形成的共价键。
[0316]
在本发明的第四方面的实施例中,m3≥100,例如m3为100、105、110、115、120、125、130、135、140、145或150。
[0317]
在本发明的第四方面的实施例中,z3和z4中的每一者或两者均为永久净电荷。
[0318]
在本发明的第四方面的实施例中,z3和z4中的每一者或两者均为永久正净电荷。
[0319]
在本发明的第四方面的实施例中,z3和z4中的每一者或两者均为永久负净电荷。
[0320]
在本发明的第四方面的实施例中,子离子包含分析物或其片段。
[0321]
在本发明的第四方面的实施例中,子离子包含分析物和化合物的片段,其中化合物的片段通过共价键与分析物连接,特别是其中化合物的片段带有一个永久电荷,特别是一个永久正净电荷或一个永久负净电荷。
[0322]
在本发明的第四方面的实施例中,复合物能够形成另外的子离子,每个子离子包含化合物的片段并且每个子离子具有x>4的mx/zx值,其中另外的子离子的mx/zx值中的每一个小于m3/z3值。另外的子离子可以进一步包含分析物或其片段。
[0323]
在本发明的第四方面的实施例中,z3=2,其中在裂解之后,复合物能够形成z4=1的子离子和另外的子离子,其中另外的子离子具有净电荷z5,其中z5=1,其中子离子或另外的子离子包含分析物或其片段。带两倍电荷的复合物在复合物的两个电荷之间裂解成至少两个子离子,子离子和另外的子离子。子离子以及另外的子离子各自带一倍电荷,例如各自带一倍正电荷或各自带一倍负电荷。
[0324]
在本发明的第四方面的实施例中,分析物选自由以下项组成的组:核酸、氨基酸、肽、蛋白质、代谢物、激素、脂肪酸、脂质、碳水化合物、类固醇、酮类固醇、开环甾类化合物、另一分子的某种修饰的分子特征、已被生物体内化的物质、这种物质的代谢物及它们的组合。对于本发明的第一方面提及的分析物的所有实施例都适用于本发明的第四方面,反之亦然。
[0325]
此外,在本发明的范围内还预期存在于分析物分子上的官能团可首先被转化成更容易与化合物的反应性单元q反应的另一个基团。
[0326]
在本发明的第四方面的实施例中,分析物选自由以下项组成的组:核酸、氨基酸、肽、蛋白质、代谢物、激素、脂肪酸、脂质、碳水化合物、类固醇、酮类固醇、开环甾类化合物、另一分子的某种修饰的分子特征、已被生物体内化的物质、这种物质的代谢物及它们的组合。
[0327]
在本发明的第一方面的实施例中,分析物分子包含选自由以下项组成的组的官能团:羰基基团、二烯基团、羟基基团、胺基团、亚胺基团、硫醇基团、二醇基团、酚基团、环氧基团、二硫基团和叠氮基团,其中的各者均能与化合物的反应性单元q形成共价键。
[0328]
在本发明的第四方面的实施例中,分析物分子选自由以下项组成的组:类固醇、酮类固醇、开环甾类化合物、氨基酸、肽、蛋白质、碳水化合物、脂肪酸、脂质、核苷、核苷酸、核酸和其他生物分子(包括小分子代谢物和辅因子)以及治疗性药物、滥用的药物、毒素或其代谢物。
[0329]
在本发明的第四方面的实施例中,复合物包含两个永久正电荷,它们通过接头l1彼此隔开。特别地,两个永久正电荷中的每一个均为正永久净电荷。
[0330]
在本发明的第四方面的实施例中,复合物包含至少三个单元z1、z2、q和任选另外单元l1,其中这些单元彼此共价连接,
[0331]
其中:
[0332]q′
是反应性单元,其与分析物形成共价键,
[0333]
z1为带电荷的单元,其包含至少一个带永久电荷的部分,特别是带永久正电荷的部分或带永久负电荷的部分,
[0334]
z2为带电荷的单元,其包含至少一个带永久电荷的部分,特别是带永久正电荷的部分或带永久负电荷的部分,并且
[0335]
l1是取代或未取代的接头,特别是通过裂解可裂解的基团,例如mc lafferty裂解部分、逆diels alder裂解部分、苄基或脂肪族基团,且
[0336]
其中复合物的净电荷大于1。z1、z2和l1可以具有与关于本发明的第一方面的实施例针对z1、z2和l1所提到的相同的含义。
[0337]
在本发明的第四方面的实施例中,q’是由本发明的第一方面的化合物的反应性单元q与分析物分子中存在的官能团之间形成共价键而产生的。根据本发明的第一方面的化合物的反应性单元q和分析物分子的官能团,技术人员能够很好地确定两者之间形成的共价键。
[0338]
在本发明的第四方面的实施例中,复合物的净电荷为2、3、4或5。
[0339]
在本发明的第四方面的实施例中,复合物选自下式2-i至2-xi:
[0340]
(z1-l1-z2-q’)nꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2-i)
[0341]
(q
’‑
z1-l1-z2)nꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2-ii)
[0342]
(z1-z2-q’)nꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2-iii)
[0343]
(z1-(l1-z2)
m-(l2-zo)
k-q’)nꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2-iv)
[0344]
(z1-(l3-z2)
m-(l2-zo)
k-q’)nꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2-v)
[0345]
((z1)
m-l1-z2-(l2/l3)
k-zo)
n-q
‘ꢀꢀꢀꢀ
(2-vi)
[0346]
[0347][0348]
其中分析物与q
′
共价键合,
[0349]
z1为带电荷的单元,其包含至少一个带永久电荷的部分,特别是带永久正电荷的部分或带永久负电荷的部分,
[0350]
l1是取代或未取代的接头,特别是通过裂解可裂解的基团,例如mc lafferty裂解部分、逆diels alder裂解部分、苄基或脂肪族基团,
[0351]
z2为带电荷的单元,其包含至少一个带永久电荷的部分,特别是带永久正电荷的部分或带永久负电荷的部分,
[0352]
zo是带电荷的单元,特别是包含带正电荷或带负电荷或带中性电荷的单元,
[0353]
z3是带多倍电荷的单元,特别是带多倍电荷的金属单元,
[0354]
l3是取代或未取代的接头,特别是通过裂解不可裂解的基团,例如苄基或重氮基,
[0355]
lig1是带多倍电荷的金属复合物结合配体,尤其依赖于结合常数logkb>5,
[0356]
l2是取代的或未取代的接头,特别是l2是l1或l2是通过裂解可裂解的基团,
[0357]
lig2是带多倍电荷的金属复合物结合配体,尤其依赖于结合常数:1≤logkb≤5,
[0358]
m>0,k>0且n≥1。
[0359]
在本发明的第四方面的实施例中,结合化合物通过分析物的羰基、羟基或二烯基团共价连接以形成所述复合物。结合化合物意指化合物-分析物复合物的化合物。
[0360]
在第五方面,本发明涉及该化合物用于对分析物进行质谱测定的用途。优选地,质谱测定包括串联质谱测定,特别是三重四极质谱测定。对于本发明的第一方面和/或本发明的第二方面和/或本发明的第三方面和/或本发明的第四方面提及的所有实施例都适用于
本发明的第五方面,反之亦然。
[0361]
在本发明的第五方面的实施例中,与具有的一次性永久净电荷最大值等于或小于1的实例性复合物或实例性化合物的质谱相比,本发明的第一方面的化合物或本发明的第四方面的复合物的质谱的信噪比较低。
[0362]
在第六方面,本发明涉及一种用于分析物的质谱测定的方法,其包括以下步骤:
[0363]
(a)使分析物与本文关于本发明的第一方面所公开的化合物反应,从而形成本文关于本发明的第四方面所公开的复合物,
[0364]
(b)对来自步骤(a)的该复合物进行质谱分析。
[0365]
在本发明的第六方面的实施例中,质谱分析步骤(b)包括:
[0366]
(i)使复合物的离子进入质谱分析的第一级,从而根据复合物的的质荷(m/z)比对其离子进行表征,
[0367]
(ii)使复合物离子裂解,从而释放出第一实体,特别是低分子量实体,并且生成复合物的子离子,其中复合物的子离子在其m/z比上不同于复合物离子,以及
[0368]
(iii)使复合物的子离子进入质谱分析的第二级,从而根据复合物的子离子的m/z比对复合物的子离子进行表征,并且/或者
[0369]
其中(ii)可进一步包括复合物离子的另一种裂解,从而释放出不同于第一实体的第二实体,并且生成复合物的第二子离子,并且
[0370]
其中(iii)可进一步包括使复合物的第一子离子和第二子离子进入质谱分析的第二级,从而根据复合物的第一子离子和第二子离子的m/z比对复合物的第一子离子和第二子离子进行表征。
[0371]
其中第一子离子和/或第二子离子的m/z比大于复合物的离子的m/z比。
[0372]
在本发明的第六方面的实施例中,步骤(a)之前的进一步步骤(a
′
)包括:
[0373]
(a’)对复合物的离子或化合物的离子进行抗衡离子的离子交换,其中特别是强配位阴离子,例如三氟乙酸根,作为抗衡离子被氯离子、溴离子或弱配位抗衡离子交换。
[0374]
若抗衡离子是在气相中不与分析物结合的离子。通过离子源引入质谱仪将其解离。
[0375]
强配位阴离子是指在气相中,包含强配位阴离子作为抗衡离子的复合物或化合物的结合常数大于相应的包含氯作为抗衡离子的复合物或化合物的结合常数。
[0376]
在本发明的第六方面的实施例中,第一实体和/或第二实体选自由以下项组成的组:三甲胺、吡啶、膦、三甲胺、三丙胺、三丁胺、二甲基乙胺、甲基二乙胺和三烷基胺。
[0377]
步骤(a)可在质谱测定之前的样品制备工作流程内的不同阶段发生。包含分析物分子的样品可以进行预处理和/或通过各种方法进行富集。预处理方法取决于样品类型诸如血液(新鲜的或干燥的)、血浆、血清、尿液或唾液,而富集方法取决于目标分析物。哪种预处理样品适用于哪种样品类型是技术人员众所周知的。哪种富集方法适用于哪种目标分析物也是技术人员众所周知的。
[0378]
在本发明的第六方面的实施例中,本方法的对分析物分子进行质谱测定的方法的步骤(a)发生在i)样品的预处理步骤之后,ii)样品的第一次富集之后,或iii)样品的第二次富集之后。
[0379]
在本发明的第六方面的实施例中,其中样品是全血样品,将其分配到两个预定义
的样品预处理(pt)工作流程中的一个,两个工作流程均包括添加内标(istd)和溶血试剂(hr)以及之后的预定义孵育期(inc),两个工作流程之间的差异之处是添加内标(istd)和溶血试剂(hr)的次序。在添加水作为溶血试剂的实施例中,特别是以0.5∶1至20∶1ml水/ml样品的量,以1∶1至10∶1ml水/ml样品的量,以2∶1至5∶1ml水/ml样品的量添加。
[0380]
在本发明的第六方面的实施例中,其中样品是尿液样品,将其分配到其他两个预定义的pt工作流程中的一个,两个工作流程均包括添加内标和酶试剂以及之后的预定义孵育期,两个工作流程之间的差异之处是添加内标和酶试剂的次序。酶试剂通常是用于葡糖苷酸切割或蛋白质切割或分析物或基质的任何预处理的试剂。在另外的步骤中,添加衍生化试剂诸如上文或下文中所公开的本发明化合物,之后为孵育期。
[0381]
在本发明的第六方面的实施例中,酶试剂选自由以下项组成的组:葡萄糖醛酸酶、(部分的)外切型或内切型去糖基化酶、或外切型或内切型蛋白酶。在实施例中,以0.5至10mg/ml的量,特别是以1至8mg/ml的量,特别是以2至5mg/ml的量,来添加葡萄糖醛酸酶。
[0382]
在本发明的第六方面的实施例中,其中样品是血浆或血清,将其分配到另一预定义pt工作流程,该工作流程仅包括添加内标(istd)以及之后的预定义孵育时间。
[0383]
选择哪种孵育时间和温度进行样品处理、化学反应或上文或下文中虑及并命名的方法步骤是技术人员众所周知的。特别地,技术人员知道孵育时间和温度是彼此依赖的,例如,高温通常导致较短的孵育时间,反之亦然。在本发明的第六方面的实施例中,孵育温度在4-45℃的范围内,特别是在10-40℃的范围内,特别是在20-37℃的范围内。在实施例中,时间在30s至120min的范围内,特别是在30s至1min、30s至5min、30s至10min、1min至10min或1min至20min、10min至30min、30min至60min或60min至120min的范围内。在特定实施例中,孵育时间为36s的倍数。
[0384]
据此,在本方法的实施例中,步骤a)发生在上文公开的样品预处理步骤之后。
[0385]
在本发明的第六方面的实施例中,步骤a)中化合物与分析物分子的反应发生在任何富集过程之前,将化合物添加到经过预处理的目标样品中。据此,分析物分子与化合物的复合物在预处理之后并且在第一富集过程之前形成。因此,复合物在经历步骤b)的质谱分析之前经历第一富集过程和第二富集过程。
[0386]
经过预处理的样品可以进一步经历分析物富集工作流程。分析物富集工作流程可包括一种或多种富集方法。富集方法在本领域中众所周知,包括但不限于化学富集方法(包括但不限于化学沉淀)和使用固相的富集方法(包括但不限于固相萃取方法、珠粒工作流程和色谱方法(例如气相色谱法或液相色谱法))。
[0387]
在本发明的第六方面的实施例中,第一富集工作流程包括添加将分析物选择性基团携带至经过预处理的样品的固相,特别是固体珠。在本发明的第六方面的实施例中,第一富集工作流程包括添加将分析物选择性基团携带至经过预处理的样品的磁珠或顺磁珠。在本发明的第六方面的实施例中,磁珠的添加包括搅拌或混合。然后经过预定义的孵育期,将一种或多种目标分析物捕获到珠粒上。在本发明的第六方面的实施例中,工作流程包括在与磁珠一起孵育之后的洗涤步骤(w1)。依据分析物,执行一个或多个另外的洗涤步骤(w2)。一个洗涤步骤(w1、w2)包括一系列包括以下项的步骤:通过包含磁体或电磁体的磁珠处置单元来分离磁珠、抽吸液体、添加洗涤缓冲液、将磁珠重新悬浮、另一个磁珠分离步骤和另一次抽吸液体。此外,除了洗涤循环的体积和数量或组合之外,洗涤步骤可以在溶剂类型层
面(水/有机物/盐/ph)上有所不同。如何选择相应参数是技术人员众所周知的。在最后一个洗涤步骤(w1、w2)之后,添加洗脱试剂,之后将磁珠重新悬浮,并经历预定义孵育期,以用于从磁珠释放目标分析物。然后分离无结合物的磁珠,并捕获含有经过衍生化的目标分析物的上清液。
[0388]
在本发明的第六方面的实施例中,第一富集工作流程包括向预处理后的样品中加入携带基质选择性基团的磁珠。在本发明的第六方面的实施例中,磁珠的添加包括搅拌或混合。之后是用于将基质捕获在珠上的预定义孵育期。此时,目标分析物并未与磁珠结合,而是保留在上清液中。之后,分离磁珠,并收集含有经过富集的目标分析物的上清液。
[0389]
在本发明的第六方面的实施例中,使上清液经历第二富集工作流程。这里,将上清液转移至lc站,或在通过添加稀释液体进行的稀释步骤之后转移至lc站。通过改变例如溶解类型(水/有机物/盐/ph)和体积,也可以使用不同的洗脱规程/试剂。各种参数是技术人员众所周知并且容易选择的。
[0390]
在本发明第六方面的实施例中,其中本方法的步骤a)不直接发生在预处理方法之后,步骤a)可发生在如上文中所述使用磁珠进行的第一富集工作流程之后。
[0391]
在本发明的第六方面的使用分析物特异性磁珠的实施例中,在洗涤步骤(w1、w2)结束之后,将如上文或下文中所公开的化合物在洗脱溶剂之前、与洗脱溶剂一起或在洗脱溶剂之后添加到目标样品中,之后是孵育期(规定的时间和温度)。
[0392]
在本发明的第六方面的实施例中,然后分离无结合物的磁珠,并收集含有步骤a)的复合物的上清液。在本发明的第六方面的实施例中,将包含步骤a)的复合物的上清液转移至第二富集工作流程,特别是直接转移至lc站,或在加入稀释液的稀释步骤之后转移。
[0393]
在本发明的第六方面的实施例中,其中使用了基质特异性磁珠,将如上文或下文中所公开的化合物在分离磁珠之前或在分离磁珠之后添加到目标样品中。在本发明的第六方面的实施例中,将包含步骤a)的复合物的上清液转移至第二富集工作流程,特别是直接转移至lc站,或在加入稀释液的稀释步骤之后转移。
[0394]
据此,在本发明的第六方面的实施例中,其中步骤a)中化合物与分析物分子的反应发生在第一富集过程之后,在第一富集过程特别是使用磁珠进行的第一富集过程结束之后,将化合物添加到目标样品中。据此,样品首先如上文所述经过预处理,然后经历第一富集过程特别是使用如上文所述的携带分析物选择基团的磁珠进行的第一富集过程,并且在从磁珠洗脱之前、同时或之后,添加化合物。据此,分析物分子与化合物的复合物在第一富集过程之后并且在第二富集过程之前形成。因此,复合物在经历步骤b)的质谱分析之前经历第二富集过程。
[0395]
在本发明的第六方面的另一个实施例中,本方法的步骤(a)发生在第二个分析物富集工作流程之后。在第二富集工作流程中,使用色谱分离进一步富集样品中的目标分析物。在本发明的第六方面的实施例中,色谱分离是气相色谱或液相色谱。两种方法均是技术人员众所周知的。在本发明的第六方面的实施例中,液相色谱选自由以下项组成的组:hplc、快速lc、微流-lc、流动注射、以及捕捉和洗脱。
[0396]
在本发明的第六方面的实施例中,本方法的步骤a)在色谱分离的同时或之后发生。在本发明的第六方面的实施例中,将化合物与洗脱缓冲液一起添加到柱内。在另选的实施例中,化合物在柱后添加。
[0397]
在本发明的第六方面的实施例中,第一富集过程包括使用分析物选择性磁珠。在本发明的第六方面的实施例中,第二富集过程包括使用色谱分离,特别是使用液相色谱。
[0398]
据此,在本发明的第六方面的实施例中,其中步骤a)中化合物与分析物分子的反应发生在第二富集过程之后,在使用色谱特别是液相色谱的第二富集过程结束之后,将化合物添加到目标样品中。据此,在此情况下,样品首先如上文所述经过预处理,然后经历第一富集过程特别是使用如上文所述的磁珠,之后是色谱分离特别是使用液相色谱,并且在色谱分离之后添加化合物。据此,分析物分子与结合化合物的复合物在第二富集过程之后形成。因此,复合物在经历步骤b)的质谱分析之前不经历富集过程。
[0399]
在本发明的实施例中,临床诊断系统包含本发明的第一方面的化合物和/或本发明的第二方面的组合物和/或本发明的第三方面的试剂盒和/或本发明的第四方面的复合物。另外或任选地,本发明的第一方面的化合物用于对分析物进行质谱测定,其中临床诊断系统包括质谱测定。另外或可选地,本发明的第六方面的用于分析物的质谱测定的方法由临床诊断系统执行。
[0400]“临床诊断系统”是实验室自动化仪器,专用于分析用于体外诊断的样品。根据需要和/或根据期望的实验室工作流,临床诊断系统可具有不同的配置。通过将多个设备和/或模块耦接在一起,可获得附加配置。“模块”是具有专用功能的工作单元,通常比整个临床诊断系统更小。此功能可以是分析功能,但也可以是分析前功能或分析后功能,或者可以是分析前功能、分析功能或分析后功能中的任一个的辅助功能。特别地,模块可配置为与一个或多个其他模块协作以用于例如通过执行一个或多个分析前步骤和/或分析步骤和/或分析后步骤来执行样品处理工作流的专用任务。特别地,临床诊断系统可以包括一个或多个分析设备,其被设计为执行针对某些类型的分析(例如,临床化学、免疫化学、凝血、血液学、液相色谱分离、质谱分析等)而优化的相应工作流程。因此,临床诊断系统可以包括一个分析设备或者具有各自工作流程的任何这种分析设备的组合,其中分析前和/或分析后模块可以耦接到单独的分析设备或者由多个分析设备共享。在替代方案中,可通过集成在分析设备中的单元来执行分析前功能和/或分析后功能。临床诊断系统可包括功能单元,诸如用于吸移和/或泵送和/或混合样品和/或试剂和/或系统流体的液体处理单元,以及用于分类、存储、运输、识别、分离、检测的功能单元。该临床诊断系统可以包括用于自动制备包含目标分析物的样品的样品制备站、包括多个lc通道的液相色谱(lc)分离站和/或用于将制备的样品输入到任何一个lc通道中的样品制备/lc接口。临床诊断系统可进一步包括控制器,该控制器经编程为将样品分配至预先定义的样品制备工作流,每个工作流包括预先定义的样品制备步骤序列且需要预先定义的完成时间(视目的分析物而定)。临床诊断系统可进一步包括质谱仪(ms)和用于将lc分离站连接到质谱仪的lc/ms接口。如本文所用,术语“自动地”或“自动化”是广义的术语且被赋予对本领域普通技术人员而言普通且惯常的含义,并且不限于特殊或自定义的含义。该术语具体地可指但不限于完全借助于至少一台计算机和/或至少一个计算机网络和/或至少一台机器来执行的过程,特别地,不需要手动操作和/或与用户交互。
[0401]“样品制备站”可耦接至一个或多个分析设备或分析设备中的单元的预分析模块,其设计为执行一系列样品处理步骤,这些样品处理步骤旨在除去或至少减少样品中的干扰基质成分和/或富集样品中的目的分析物。此类处理步骤可包括对一个样品或多个样品顺
序地、并行地或交错地执行的以下处理操作中的任一项或多项:吸移(抽吸和/或分配)流体、泵送流体、与试剂混合、在一定温度下培育、加热或冷却、离心、分离、过滤、筛分、干燥、洗涤、重悬、等分、转移、储存等)。
[0402]
液相色谱(lc)分离站是分析设备或分析设备中的模块或单元,其设计为使制备的样品经历色谱分离,以便例如将目的分析物与基质成分分离,例如在样品制备后仍可能干扰后续检测例如质谱检测的剩余基质成分,和/或以便将目的分析物相互分离,从而实现对其进行单独检测。根据实施例,lc分离站是中间分析设备或分析设备中的模块或单元,其设计为制备用于质谱分析的样品和/或将制备的样品转移至质谱仪。特别地,lc分离站是包括多个lc通道的多通道lc站。
[0403]
临床诊断系统,例如样品制备站还可以包括用于在启动新的样品制备开始序列之前接收多个样品的缓冲单元,其中可以单独随机访问样品并且可以根据样品制备开始序列启动其单独制备。
[0404]
该临床诊断系统使lc与质谱联用更方便、更可靠,且因此适用于临床诊断。特别地,在随机存取样品制备和lc分离情况下,可以获得高通量,例如高达100个样品/小时或更多,同时能够在线耦接到质谱。此外,该过程可以完全自动化,增加了离开时间并降低了所需的技能水平。
[0405]
在另外实施例中,本发明涉及以下方面:
[0406]
1.一种用于使用质谱测定来定量检测分析物的化合物,
[0407]
其中所述化合物包含永久电荷,特别是永久净电荷,其中所述化合物能够与该分析物共价结合,
[0408]
其中所述化合物具有质量m1和净电荷z1,
[0409]
其中在经由质谱测定的裂解后,该化合物能够形成具有质量m2<m1和净电荷z2<z1的至少一个子离子,
[0410]
其中m1/z1<m2/z2。
[0411]
2.根据方面1所述的化合物,其中m1/z1为至少60或更大,例如对于c7h2on
22+
为66,且/或m2/z2为至少70或更大,例如对于c4h
12n+
为74。
[0412]
3.根据方面1或2所述的化合物,其不含亚砜单元(so)。
[0413]
4.根据前述方面中任一项所述的化合物,其中z1为整数且为2或大于2。
[0414]
5.根据前述方面中任一项所述的化合物,其中z1为2、3、4或5,优选地z1为2。
[0415]
6.根据前述方面中任一项所述的化合物,其中z2=z1-1,优选地z2为1。
[0416]
7.根据前述方面中任一项所述的化合物,其中z1和z2中的每一者或两者均为永久电荷,特别是永久净电荷。
[0417]
8.根据前述方面中任一项所述的化合物,其中z1和z2中的每一者或两者均为永久正电荷,特别是永久正净电荷。
[0418]
9.根据前述方面中任一项所述的化合物,其中z1和z2中的每一者或两者均为永久负电荷,特别是永久负净电荷。
[0419]
10.根据前述方面中任一项所述的化合物,其中净电荷z1是化合物的x倍永久正电荷和y倍永久负电荷之和。
[0420]
11.根据前述方面中任一项所述的化合物,其中净电荷z2是至少一个子离子的x倍
永久正电荷和y倍永久负电荷的总和。
[0421]
12.根据前述方面中任一项所述的化合物,其中所述化合物能够形成另外的子离子,所述另外的子离子中的每一个包含所述化合物的一个或多个片段并且各自具有x>4的mx/zx值,其中每个其他子离子的mx/zx值小于m1/z1值。
[0422]
13.根据前述方面中任一项所述的化合物,其包含至少三个单元z1、z2、q和任选的另外单元l1,其中所述单元彼此共价连接,
[0423]
其中:
[0424]
q为反应性单元,其能够与分析物形成共价键,
[0425]
z1为带电荷的单元,其包含至少一个带永久电荷的部分,特别是带永久正电荷的部分或带永久负电荷的部分,
[0426]
z2为带电荷的单元,其包含至少一个带永久电荷的部分,特别是带永久正电荷的部分或带永久负电荷的部分,并且
[0427]
l1为取代或未取代的接头,特别是经由裂解可切割的基团,例如mc lafferty裂解部分、逆diels alder裂解部分或脂肪族基团,
[0428]
其中该化合物的净电荷大于1。
[0429]
14.根据前述方面中任一项所述的化合物,其中z1和z2被至少一个原子彼此隔开。
[0430]
15.根据前述方面中任一项所述的化合物,其中q与z1共价连接或q与z2共价连接。
[0431]
16.根据前述方面中任一项所述的化合物,其中l1共价连接z1和z2。
[0432]
17.根据前述方面中任一项所述的化合物,其中所述化合物在z1与z2之间被裂解。
[0433]
18.根据前述方面中任一项所述的化合物,其包含式1-i:(z1-l1-z2-q)n,其中n≥1。n≥1可能意味着n≥+1和/或n≥-1。n≥+1可以意指例如+1、+2、+3、+4、+5、+6等。n≥-1可以意指例如-1、-2、-3、-4、-5、-6等。
[0434]
19.根据前述方面中任一项所述的化合物,其包含式1-ii:
[0435]
(q-z1-l1-z2)n,其中n≥1。
[0436]
20.根据前述方面中任一项所述的化合物,其包含式1-iii:
[0437]
(z1-z2-q)n,其中n≥1。
[0438]
21.根据前述方面中任一项所述的化合物,其中所述反应性单元q选自由以下项组成的组:羰基反应性单元、二烯反应性单元、羟基反应性单元、氨基反应性单元、亚胺反应性单元、硫醇反应性单元、二醇反应性单元、酚反应性单元、环氧化物反应性单元、二硫化物反应性单元和叠氮化物反应性单元。
[0439]
22.根据前述方面中任一项所述的化合物,其中反应性单元q为羰基反应性基团,特别地,其中q选自由以下项组成的组:
[0440]
(i)肼单元,例如h2n-nh-或h2n-nr1-单元,其中r1为芳基或c1-4烷基,特别是c1或c2烷基,任选地被取代,
[0441]
(ii)酰肼单元,特别是碳酰肼或磺酰肼,特别是h2n-nh-c(o)-或h2n-nr2-c(o)-单元,其中r2为芳基或c1-4烷基,特别是c1或c2烷基,任选地被取代,
[0442]
(iii)羟氨基单元,例如,h2n-o-单元,以及
[0443]
(iv)二硫醇单元,特别是1,2-二硫醇或1,3-二硫醇单元。
[0444]
23.根据前述方面中任一项所述的化合物,其中所述反应性单元q为硫醇反应性基
团或氨基反应性基团,诸如活性酯基团,例如n-羟基琥珀酰亚胺(nhs)酯或磺基-nhs酯、羟基苯并三唑(hobt)酯或1-羟基-7-氮杂苯并三唑(hoat)酯基团。
[0445]
24.根据前述方面中任一项所述的化合物,其中反应性单元q选自4-取代的1,2,4-三唑啉-3,5-二酮(tad)、4-苯基-1,2,4-三唑啉-3,5-二酮(ptad)或氟取代的吡啶鎓。
[0446]
25.根据前述方面中任一项所述的化合物,其中接头l1包含1至10个c原子,任选地包含1个或多个杂原子。
[0447]
26.根据前述方面中任一项所述的化合物,其中接头l1选自由以下项组成的组:mclafferty裂解单元、逆diels alder单元、中性丢失裂解单元、键解离单元、α-裂解和电荷位点重排。
[0448]
27.根据前述方面中任一项所述的化合物,其中z1和z2彼此独立地包含螯合复合物、鏻、铵、碳鎓、吡啶鎓、锍、包含n、s、h和c原子的3-10元环的带电荷的杂环,或其衍生物。
[0449]
28.根据前述方面中任一项所述的化合物,其包含式1-iv:(z1-(l1-z2)
m-(l2-zo)
k-q)n,
[0450]
其中:
[0451]
zo是带电荷的单元,特别是包含带正电荷的单元或带负电荷的单元或带中性电荷的单元,
[0452]
l2是取代的接头或未取代的接头,特别是l2是l1或特别地l2是通过裂解可裂解的基团,
[0453]
m>0,k>0且n≥1。
[0454]
29.根据前述方面中任一项所述的化合物,其包含式1-v:(z1-(l3-z2)
m-(l2-zo)
k-q)n,
[0455]
其中:
[0456]
zo是带电荷的单元,特别是包含带正电荷的单元或带负电荷的单元或带中性电荷的单元,
[0457]
l2是取代的接头或未取代的接头,特别是l2是l1或特别地l2是通过裂解可裂解的基团
[0458]
l3是取代的接头或未取代的接头,特别是通过裂解不可裂解的基团,例如苄基或重氮基,
[0459]
m>0,k>0且n≥1。
[0460]
30.根据前述方面中任一项所述的化合物,其包含式1-vi:((z1)
m-l1-z2-(l2/l3)
k-zo)
n-q,
[0461]
其中:
[0462]
zo是带电荷的单元,特别是包含带正电荷的单元或带负电荷的单元或带中性电荷的单元,
[0463]
l2是取代的接头或未取代的接头,特别是l2是l1或特别地l2是通过裂解可裂解的基团,
[0464]
l3是取代的接头或未取代的接头,特别是通过裂解不可裂解的基团,例如苄基或重氮基,
[0465]
m>0,k≥0且n≥1。
[0466]
31.根据前述方面中任一项所述的化合物,其包含式1-vii:(z1-l1-z2-q)n,
[0467]
其中:n≥1。
[0468]
32.根据前述方面中任一项所述的化合物,其包含式1-viii:
[0469][0470]
其中:
[0471]
zo是带电荷的单元,其包含特别是带正电荷的单元或带负电荷的单元或带中性电荷的单元,
[0472]
l2是取代的接头或未取代的接头,特别是l2是l1或特别地l2是通过裂解可裂解的基团,
[0473]
l3是取代的接头或未取代的接头,特别是通过裂解不可裂解的基团,例如苄基或重氮基,
[0474]
n≥1,m>0且k>0。
[0475]
33.根据前述方面中任一项所述的化合物,其包含式1-ix:
[0476][0477]
其中:
[0478]
zo是带电荷的单元,特别是包含带正电荷的单元或带负电荷的单元或带中性电荷的单元,
[0479]
l2是取代的接头或未取代的接头,特别是l2是l1或特别地l2是通过裂解可裂解的基团,
[0480]
l3是取代的接头或未取代的接头,特别是通过裂解不可裂解的基团,例如苄基或重氮基,
[0481]
且n≥1。
[0482]
34.根据前述方面中任一项所述的化合物,其包含式1-x:
[0483][0484]
其中:
[0485]
zo是带电荷的单元,其包含特别是带正电荷的单元或带负电荷的单元或带中性电荷的单元,
[0486]
n≥1且m>0。
[0487]
35.根据前述方面中任一项所述的化合物,其包含式1-xi:
[0488][0489]
其中:
[0490]
zo是带电荷的单元,其包含特别是带正电荷的单元或带负电荷的单元或带中性电荷的单元,
[0491]
z3是带多倍电荷的单元,特别是带多倍电荷的金属单元,
[0492]
l3是取代的接头或未取代的接头,特别是通过裂解不可裂解的基团,例如由至少一个或两个碳原子(c1-c2)组成的苄基、重氮基或脂肪族基团和由c1-c2组成的脂肪族基团,
[0493]
lig1是带多倍电荷的金属复合物结合配体,尤其依赖于结合常数logkb>5,
[0494]
且n≥1。
[0495]
36.根据前述方面中任一项所述的化合物,其包含式1-xii:
[0496][0497]
其中:
[0498]
zo是带电荷的单元,其包含特别是带正电荷的单元或带负电荷的单元或带中性电荷的单元,
[0499]
z3是带多倍电荷的单元,特别是带多倍电荷的金属单元,
[0500]
l3是取代的接头或未取代的接头,特别是通过裂解不可裂解的基团,例如苄基或重氮基,
[0501]
lig1是带多倍电荷的金属复合物结合配体,尤其依赖于结合常数logkb>5
[0502]
lig2是带多倍电荷的金属复合物结合配体,尤其依赖于结合1≤常数1≤logkb≤5
[0503]
且n≥1。
[0504]
37.根据前述方面中任一项所述的化合物,其包含式1-xiii:(z1-l3-z2-l1-z3-l2-zo-q)n,其中z1、l3、z2、l1、z3、l2、zo、q和n中的每一个可以具有与其他方面中提到的相同的含义。
[0505]
38.根据前述方面中任一项所述的化合物,其中m、n、k中的每一个为整数且大于0。式1-i至1-xiii括号中的部分可以重复m次和k次,并且n是化合物的净电荷。
[0506]
39.根据前述方面中任一项所述的化合物,其中所述化合物包含用于形成盐的抗
衡离子,其中所述抗衡离子优选地选自由以下项组成的组:cl-、br-、f-、甲酸根、pf
6-、磺酸根、磷酸根、乙酸根。
[0507]
40.根据前述方面中任一项所述的化合物,其中所述化合物不含三氟乙酸根(tfa)。
[0508]
41.一种组合物,其包含根据权利要求1至40中任一项所述的化合物。
[0509]
42.一种试剂盒,其包含根据权利要求1至40中任一项所述的化合物或根据权利要求41所述的组合物。
[0510]
43.一种用于使用质谱测定来定量检测分析物的复合物,
[0511]
其中该复合物是由彼此共价连接的该分析物和化合物形成,其中该复合物包含永久电荷,特别是永久净电荷,
[0512]
其中所述复合物具有质量m3和净电荷z3,
[0513]
其中在经由质谱测定的裂解后,该复合物能够形成具有质量m4<m3和净电荷z4<z3的至少一个子离子,
[0514]
其中m3/z3<m4/z4。
[0515]
44.根据方面43所述的复合物,其中m3≥100。
[0516]
45.根据方面43至44所述的复合物,其中z3和z4中的每一者或两者均为永久净电荷。
[0517]
46.根据方面43至45所述的复合物,其中z3和z4中的每一者或两者均为永久正净电荷。
[0518]
47.根据方面43至46所述的复合物,其中z3和z4中的每一者或两者均为永久负净电荷。
[0519]
48.根据方面43至47所述的复合物,其中子离子包含分析物或其片段。
[0520]
49.根据方面43至48所述的复合物,其中复合物是母离子。
[0521]
50.根据方面43至49所述的复合物,其中子离子包含分析物和化合物的片段,其中化合物的片段通过共价键与分析物连接,特别是其中化合物的片段带有一个永久电荷,特别是一个永久正电荷或一个永久负电荷。
[0522]
51.根据方面43至50所述的复合物,其中复合物能够形成另外的子离子,每个子离子包含化合物的片段并且每个子离子具有x>4的mx/zx值,其中另外的子离子的mx/zx值中的每一个小于m3/z3值。
[0523]
52.根据方面43至51所述的复合物,其中z3=2,其中在裂解之后,复合物能够形成z4=1的子离子和另外的子离子,其中另外的子离子具有净电荷z5,其中z5=1,其中子离子或另外的子离子包含分析物或其片段。
[0524]
53.根据方面43至52所述的复合物,其中分析物选自由以下项组成的组:核酸、氨基酸、肽、蛋白质、代谢物、激素、脂肪酸、脂质、碳水化合物、类固醇、酮类固醇、开环甾类化合物、另一分子的某种修饰的分子特征、已被生物体内化的物质、这种物质的代谢物及其组合。
[0525]
54.根据方面43至53所述的复合物,其中复合物包含两个永久正电荷,它们通过接头l1彼此隔开。
[0526]
55.根据方面43至54所述的复合物,其包含至少三个单元z1、z2、q和任选的另外单
元l1,其中所述单元彼此共价连接,
[0527]
其中:
[0528]q′
是反应性单元,其与分析物形成共价键,
[0529]
z1为带电荷的单元,其包含至少一个带永久电荷的部分,特别是带永久正电荷的部分或带永久负电荷的部分,
[0530]
z2为带电荷的单元,其包含至少一个带永久电荷的部分,特别是带永久正电荷的部分或带永久负电荷的部分,并且
[0531]
l1是取代的接头或未取代的接头,特别是通过裂解可裂解的基团,例如mc lafferty裂解部分、逆diels alder裂解部分或脂肪族基团,并且
[0532]
其中复合物的净电荷大于1。
[0533]
56.根据方面43至55所述的复合物,其中所述复合物选自下式2-i至2-xi:
[0534]
(z1-l1-z2-q’)nꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2-i)
[0535]
(q
’‑
z1-l1-z2)nꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2-ii)
[0536]
(z1-z2-q’)nꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2-iii)
[0537]
(z1-(l1-z2)
m-(l2-zo)
k-q’)nꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2-iv)
[0538]
(z1-(l3-z2)
m-(l2-zo)
k-q’)nꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2-v)
[0539]
((z1)
m-l1-z2-(l2/l3)
k-zo)
n-q
‘ꢀꢀꢀꢀꢀꢀꢀ
(2-vi)
[0540][0541]
其中分析物与q
′
共价键合,
[0542]
z1为带电荷的单元,其包含至少一个带永久电荷的部分,特别是带永久正电荷的部分或带永久负电荷的部分,
[0543]
l1为取代或未取代的接头,特别是经由裂解可切割的基团,例如mc lafferty裂解部分、逆diels alder裂解部分或脂肪族基团,
[0544]
z2为带电荷的单元,其包含至少一个带永久电荷的部分,特别是带永久正电荷的部分或带永久负电荷的部分,
[0545]
zo是带电荷的单元,特别是包含带正电荷或带负电荷或带中性电荷的单元,
[0546]
z3是带多倍电荷的单元,特别是带多倍电荷的金属单元,
[0547]
l3是取代或未取代的接头,特别是通过裂解不可裂解的基团,例如苄基或重氮基,
[0548]
lig1是带多倍电荷的金属复合物结合配体,尤其依赖于结合常数logkb>5,
[0549]
l2是取代的或未取代的接头,特别是l2是l1或l2是通过裂解可裂解的基团,
[0550]
lig2是带多倍电荷的金属复合物结合配体,尤其依赖于结合常数:1≤logkb≤5,
[0551]
m>0,k>0和n≥1,优选地n>1。n>1可能意指n>+1,例如+2、+3、+4、+5、+6等,且/或可能意指n>-1,例如-2、-3、-4、-5、-6等。
[0552]
57.根据权利要求1至40中任一项所述的化合物用于所述分析物的质谱测定的用途,优选地,其中所述质谱测定包括串联质谱测定,特别是三重四极质谱测定。
[0553]
58.根据方面57所述的用途,其中与具有的一次性永久净电荷最大值等于或小于1的实例性复合物或实例性化合物的质谱相比,根据方面1至40中任一项所述的化合物或根据方面43至56中任一项所述的复合物的质谱的信噪比较低。
[0554]
59.一种用于分析物的质谱测定的方法,其包括以下步骤:
[0555]
(a)使所述分析物与根据方面1至40中任一项所定义的化合物反应,
[0556]
从而形成根据方面43至56中任一项所定义的复合物,
[0557]
(b)对来自步骤(a)的该复合物进行质谱分析。
[0558]
60.根据方面59所述的方法,其中步骤(b)包括:
[0559]
(i)使复合物的离子进入质谱分析的第一级,从而根据复合物的的质荷(m/z)比对其离子进行表征,
[0560]
(ii)使复合物离子裂解,从而释放出第一实体,特别是低分子量实体,并且生成复合物的子离子,其中复合物的子离子在其m/z比上不同于复合物离子,以及
[0561]
(iii)使复合物的子离子进入质谱分析的第二级,从而根据复合物的子离子的m/z比对复合物的子离子进行表征,并且/或者
[0562]
其中(ii)可进一步包括复合物离子的另一种裂解,从而释放出不同于第一实体的第二实体,并且生成复合物的第二子离子,并且
[0563]
其中(iii)可进一步包括使复合物的第一子离子和第二子离子进入质谱分析的第二级,从而根据复合物的第一子离子和第二子离子的m/z比对复合物的第一子离子和第二子离子进行表征,
[0564]
其中所述第一子离子和/或所述第二子离子的所述m/z比大于所述复合物的离子的m/z比。
[0565]
61.根据方面59或60所述的方法,其中步骤(a)之前的进一步步骤(a
′
)包括:
[0566]
(a’)对复合物的离子或化合物的离子进行抗衡离子的离子交换,其中特别是强配位阴离子,例如三氟乙酸根,作为抗衡离子被氯离子、溴离子或弱配位抗衡离子交换。
[0567]
62.根据前述方面中任一项所述的化合物或方法,其中所述裂解为一步式过程。
[0568]
实例
[0569]
提供以下实施例以说明本发明,但不限制受权利要求书保护的本发明。
[0570]
图1说明了带两倍电荷的标记分析物相对于前体的带一倍电荷的分析物及其裂解的示意性质谱。在这种情况下,带两倍电荷的复合物(母离子)裂解成两个子离子。第一子离子是包含标记物碎片和分析物分子的带一倍电荷的分子,并且具有的m/z值大于带两倍电荷的复合物的m3/z3值。第二子离子是带一倍电荷的标记物碎片,并且具有的m/z值小于m3/
z3。带两倍电荷的标记分析物导致ms信号增强。与此相反,已知的带一倍电荷的复合物仅裂解成带一倍电荷的子离子,其中子离子的m/z值小于已知的带一倍电荷的复合物的m/z值。已知的带一倍电荷的复合物不会裂解成具有m/z值大于已知带一倍电荷的复合物的m3/z3值的子离子。与带两倍电荷的复合物相比,已知的带一倍电荷的复合物没有显示出这种裂解模式、ms信号增强或更好的信噪比。
[0571]
通过在分析物分子的一个反应性部分上安装一个带有一个标记物的永久电荷,在msms过程之后,裂解特性将从高质量前体离子变为低质量量化离子。如果在离子化过程或化学衍生化后产生一个电荷(永久或作为假分子离子(m
+
h;m
+
na等)),则出现这种裂解模式。特别是,小分子(高达约2000da)显示出小碎片从高m/z值转移到较低m/z值的这种裂解模式。由于来自不需要的离子(例如基质或共洗脱/同量异位化合物)的假阳性信号,导致与目标分子具有相似的裂解模式(参见图5)。这是由于在msms过程期间中信号相似,且因此会干扰所需分析物的定量信号。少量的临床相关分析物在esi(电喷雾离子化)过程后以带两倍电荷形式作为假分子离子产生。这类分子主要由肽组成,例如tyr-met-arg-phe-nh2,或相关物质,例如万古霉素。这些分子上的电荷来自(在正离子模式下)双质子化过程,该过程取决于调节离子化的相应离子源参数。
[0572]
图2示出ms谱图的示意图(强度%与m/z的关系):它描述了比较化合物的裂解行为,该化合物带一倍电荷,且具有+/-0.5道尔顿窗口(窗口在两条虚线之间表示)。分离能力为r=2000的典型质谱仪可以分离500m/z和+-0,5da的同量异位素,这是质谱仪在msms模式下的典型分离。如果使用这种分辨能力来提高分离前体分子的选择性,天然含有的同位素不会进入msms的碰撞过程,因为如果将一个电荷加到离子化的分子上,则第一个同位素将是+0,5da。对于大约2000m/z的较高质量分子,在前体分子分离后,第一个同位素峰进入碰撞池。大多数临床相关的小分子分析物低于2000da。因此,天然存在的同位素的强度会在裂解过程期间丢失。对于含有chnos的分子,在约500da的质量下,这高达约30%的强度。
[0573]
图3示出ms谱图的示意图(强度%与m/z的关系):它描述了本发明的化合物或复合物的裂解行为,该化合物或复合物带两倍电荷且具有两个+/-0.5道尔顿窗口(窗口在两条虚线之间表示)。
[0574]
与带一倍电荷的分子相比,带两倍电荷的(以及相应的带多倍电荷的)分子是有利的(参见图2)。在质谱仪中设定固定的隔离是由于第一天然含有的同位素将被一个带+1da的电荷和两个带+0,5da的电荷分离成单同位素峰的效应。因此约30%以上的离子可用于另外msms过程。
[0575]
图4a至图4e示出带两倍电荷的复合物(分析物:雌二醇或其衍生物;化合物:带两倍永久正电荷的化合物,与标记物6缀合的雌二醇,标记物6也称为rha256)的lloq(定量下限)。使用永久正标记物,可以实现分析物与分析物-化合物的更好信噪比,这与增强的检测限直接相关,因此与相应的增强因子相关。
[0576]
图5a至图5c示出使用带一倍电荷的分子(rha139f2(图5a)和rha171f2(图5b))与带两倍电荷的分子(与标记物6缀合的雌二醇(图5c))相比的跃迁的空白样品的背景噪声。从较低m/z前体或较低m/z化合物到较高m/z量化离子(子离子)的不寻常裂解途径可显著降低背景噪声。与类似的未衍生化的工作流程(雌二醇天然检测限约5ng/ml正离子模式和约30pg/ml负离子模式)相比,得到的0.4pg/ml检测限显示了标记的检测限增强。与标记物6缀
合的雌二醇的质谱的背景噪声优于rha139f2和rha171f2质谱的背景噪声。rha139f2、rha171f2和与标记物6缀合的雌二醇的结构是:
[0577]
与标记物6缀合的雌二醇
[0578]
rha139f2
[0579]
rha171f2
[0580]
通过带两倍永久电荷的分子或复合物的裂解,两个永久安装的电荷在裂解后分布在含有离子的标记物信息与含有离子的分析物信息之间。这两种离子至少会以相当的强度出现而不会丢失离子,且因此可以很好地用作定性离子和定量离子。
[0581]
通过使用这一概念(很少用于所有干扰物质),msms过程的选择性得以增强,并且背景离子得以消除。(参见图4和图5)。
[0582]
图6示出带两倍正电荷的复合物(分析物-标记物6-复合物)的质谱图。该复合物包含作为目标分析物的雌二醇或其衍生物,以及作为带两倍永久正电荷的化合物的与标记物6缀合的雌二醇。未裂解的复合物具有的m3/z3值为256.16(母离子)。包含雌二醇和化合物片段的带一倍永久正电荷的子离子具有的m/z值为349.20,高于母离子的m3/z3值。各自包含化合物片段的另外两个子离子具有的m/z值分别为198.09和104.05。
[0583]
如果在一个标记物内使用多个正电荷和一个负电荷(反之亦然)的概念,并且在msms过程后分离相反的电荷(根据前体的所得电荷),则分析物的定量可以在与用于前体分离的离子化模式不同的离子化模式下进行。这可以通过在正离子化模式与负离子化模式之间快速切换来完成。
[0584]
此处描述的能够安装多个永久电荷(x-倍正电荷、y-倍负电荷或(x-y)-倍正电荷和负电荷作为净电荷)的标记物显示出裂解为一个或多个碎片的行为,并且在裂解后带有标记部分和分析物分子离子部分的信息。因此,导致分析物的ms信号增强,这例如对于低丰度的分析物是重要的。
[0585]
图7示出峰“分裂”的示意图:它描述色谱系统将因分析物分子衍生化反应产生的
不同异构体彼此分离的能力。
[0586]
图8示出确定与未标记分析物相比,标记分析物的增强因子的工作流程示意图。
[0587]
图9a和图9b示出tfa对带两倍电荷的电衍生物/化合物的信号猝灭效应的检测。
[0588]
图9a示出在500pg/ml不含tfa的情况下,作为睾酮的衍生剂/化合物的标记物15相应的msms跃迁(带两倍电荷的分子离子跃迁至带单一电荷的碎片)。
[0589]
rha330=标记物15
[0590][0591]
图9b示出在500pg/ml且添加tfa的情况下,作为睾酮的衍生剂/化合物的标记物15相应的msms跃迁(带两倍电荷的分子离子跃迁至带单一电荷的碎片)。
[0592]
tfa的添加或存在使带两倍电荷的离子猝灭,与不含tfa的系统相比,这导致信号显著降低。
[0593]
如下制备包含作为化合物的标记物15和作为分析物的睾酮的带有tfa或不含tfa的复合物:
[0594]
使用标记物15对睾酮进行分析衍生化
[0595]
在甲醇中制备500ng/ml的睾酮溶液(s1)。加入与溶液(s1)相比,含有稀释在甲醇中的过量衍生化试剂/标记物15(摩尔比>1000)的溶液(s2),并且用冰乙酸(20%v/v)使该溶液酸化。将溶液s1和s2混合得到溶液s3,并在65℃下保持2h,然后是在室温下保持12h和用甲醇稀释的步骤以达到500pg/ml的浓度,总体积为1ml。
[0596]
在其代谢溶液中如此制备的分子在溶液(s3-a)和(s3-b)中以1∶1(v/v)分裂。溶液s3-b中添加了40μl水/tfa,而s3-a中仅添加了40μl水。
[0597]
两种溶液均在esi阳性全扫描模式下测量,使用质量显示m/z=302,71da,这对应于睾酮的带两倍电荷的衍生物。
[0598]
如图9a所示(使用溶液s3-a的m/z=302,7da的esi-ms;使用溶液s3-b的上层色谱图和m/z=302,7da的esi-ms;下层色谱图),使用s3-b得到的色谱图峰高明显低于使用s3-a所得到的峰高。通过添加强配位阴离子(如tfa)可以观察到双重变化峰的猝灭,这会抑制双重变化的分子离子,且因此会导致出现假分子离子[m+tfa]+,这对于定量分析来说是不利的。
[0599]
色谱和ms参数
[0600]
极性es+
[0601]
校准静态2
[0602]
软传输模式禁用
[0603]
毛细管(kv)3.003.14
[0604]
锥体(v)50.00144.92
[0605]
源偏移(v)30.0
[0606]
源温度(℃)140140
[0607]
脱溶剂温度(℃)350350
[0608]
锥孔气流速(l/hr)150149
[0609]
脱溶剂气流速(l/hr)1000990
[0610]
碰撞气流速(ml/min)0.150.14
[0611]
雾化器气流速(巴)7.006.52
[0612]
lm1分辨率3.0
[0613]
hm1分辨率15.0
[0614]
离子能量1-0.2
[0615]
ms模式碰撞能量4.00
[0616]
msms模式碰撞能量2.00
[0617]
ms模式入口1.00
[0618]
ms模式出口1.00
[0619]
气体接通ms模式入口1.00
[0620]
气体接通ms模式出口1.00
[0621]
气体接通msms模式入口1.00
[0622]
气体接通msms模式出口1.00
[0623]
气体关闭ms模式入口30.00
[0624]
气体关闭ms模式出口30.00
[0625]
气体关闭msms模式入口30.00
[0626]
气体关闭msms模式出口30.00
[0627]
扫描波ms模式入口1.00
[0628]
扫描波ms模式出口1.00
[0629]
扫描波msms模式入口1.00
[0630]
扫描波msms模式出口1.00
[0631]
lm2分辨率3.0
[0632]
hm2分辨率15.0
[0633]
离子能量20.2
[0634]
增益1.00
[0635]
乘法器513.80
[0636]
有效库容c
[0637]
锥形能量斜坡:禁用
[0638]
探针温度斜坡:禁用
[0639]
碰撞能量斜坡:禁用
[0640]
仪器参数-功能2:
[0641]
参数文件-e:\regulatedprojects\esi-derivatization_pda.pro\acqudb\cz20mrz2019-testo-label-general_tuning.ipr
[0642]
极性es+
[0643]
校准静态2
[0644]
软传输模式禁用
[0645]
毛细管(kv)3.003.14
[0646]
锥体(v)50.00144.92
[0647]
源偏移(v)30.0
[0648]
源温度(℃)140140
[0649]
脱溶剂温度(℃)350350
[0650]
锥孔气流速(l/hr)150149
[0651]
脱溶剂气流速(l/hr)1000990
[0652]
碰撞气流速(ml/min)0.150.14
[0653]
雾化器气流速(巴)7.006.52
[0654]
lm1分辨率3.0
[0655]
hm1分辨率15.0
[0656]
离子能量1-0.2
[0657]
ms模式碰撞能量4.00
[0658]
msms模式碰撞能量2.00
[0659]
ms模式入口1.00
[0660]
ms模式出口1.00
[0661]
气体接通ms模式入口1.00
[0662]
气体接通ms模式出口1.00
[0663]
气体接通msms模式入口1.00
[0664]
气体接通msms模式出口1.00
[0665]
气体关闭ms模式入口30.00
[0666]
气体关闭ms模式出口30.00
[0667]
气体关闭msms模式入口30.00
[0668]
气体关闭msms模式出口30.00
[0669]
扫描波ms模式入口1.00
[0670]
扫描波ms模式出口1.00
[0671]
扫描波msms模式入口1.00
[0672]
扫描波msms模式出口1.00
[0673]
lm2分辨率3.0
[0674]
hm2分辨率15.0
[0675]
离子能量20.2
[0676]
增益1.00
[0677]
乘法器513.80
[0678]
有效库容c
[0679]
锥形能量斜坡:禁用
[0680]
探针温度斜坡:禁用
[0681]
碰撞能量斜坡:禁用
[0682]
工程师设置:
[0683]
ms1低质量位置673
[0684]
ms1高质量位置335
[0685]
ms1低质量分辨率215
[0686]
ms1高质量分辨率2152
[0687]
ms1分辨率线性531
[0688]
ms1高质量直流平衡0.07
[0689]
ms1直流极性阴性
[0690]
ms2低质量位置672
[0691]
ms2高质量位置291
[0692]
ms2低质量分辨率219
[0693]
ms2高质量分辨率2162
[0694]
ms2分辨率线性528
[0695]
ms2高质量直流平衡0.50
[0696]
ms2直流极性阴性
[0697]
扫描间延迟:
[0698]
自动模式
[0699]
ms扫描间延迟(秒)0.003
[0700]
极性/模式切换扫描间延迟(秒)0.020
[0701]
增强的扫描间延迟(秒)0.020
[0702]
通道间延迟-见表格
[0703]
ms1延迟表:
[0704]
r延迟
[0705]
<=1.2500.001
[0706]
<=4.0000.002
[0707]
<=10.0000.003
[0708]
<=20.0000.004
[0709]
>20.0000.005
[0710]
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
运行方法参数
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
[0711]
watersacquitysds
[0712]
运行时间:6.50min
[0713]
注释:
[0714]
溶剂选择a:a2
[0715]
溶剂选择b:b1
[0716]
低压限:0.000bar
[0717]
高压范围:1034.200bar
[0718]
溶剂名称a:水+nh4ac+0.1%甲酸
[0719]
溶剂名称b:meoh+nh4ac+0.1%甲酸
[0720]
开关1:无变化
[0721]
开关2:无变化
[0722]
开关3:无变化
[0723]
密封垫清洗:5.0min
[0724]
出图1:系统压力
[0725]
出图2:%b
[0726]
系统压力数据通道:是
[0727]
流速数据通道:否
[0728]
%a数据通道:否
[0729]
%b数据通道:是
[0730]
初级a压力数据通道:否
[0731]
蓄能器a压力数据通道:否
[0732]
初级b压力数据通道:否
[0733]
蓄能器b压力数据通道:否
[0734]
脱气器压力数据通道:否
[0735]
[梯度表]
[0736]
时间(min)流速%a%b曲线
[0737]
1.初始0.400 60.0 40.0初始
[0738]
2.0.50 0.400 60.0 40.06
[0739]
3.3.00 0.400 10.0 90.06
[0740]
4.5.00 0.400 10.0 90.06
[0741]
5.5.10 0.400 60.0 40.06
[0742]
6.6.50 0.400 60.0 40.06
[0743]
运行事件:是
[0744]
梯度开始(相对于注射):0ul
[0745]
二维重复:否
[0746]
waters acquity pda
[0747]
运行时间:6.50min
[0748]
pda检测器类型:uplc lg 500nm
[0749]
灯:开
[0750]
采样素率:10个点/秒
[0751]
滤波时间常数:0.2000秒
[0752]
曝光时间:自动毫秒
[0753]
插值二阶滤波器区域:否
[0754]
使用uv阻挡滤波器:否
[0755]
3d通道...
[0756]
范围:200-400
[0757]
分辨率:2.4nm
[0758]
初始开关1:无变化
[0759]
初始开关2:无变化
[0760]
waters acquity ftn autosampler
[0761]
运行时间:6.50min
[0762]
注释:
[0763]
加载之前:禁用
[0764]
离线循环:自动最小值
[0765]
清洗溶剂名称:acn:水
[0766]
注射前清洗时间:15.0秒
[0767]
注射后清洗时间:15.0秒
[0768]
清洗溶剂名称:acn:水
[0769]
稀释度:禁用
[0770]
稀释体积:0ul
[0771]
延迟时间:0min
[0772]
稀释针放置:自动mm
[0773]
目标柱温:40.0c
[0774]
柱温报警带:禁用
[0775]
目标样品温度:6.0c
[0776]
样品温度报警信号:禁用
[0777]
注射器抽出率:自动
[0778]
针置管:0.5mm
[0779]
吸气前气隙:自动
[0780]
吸气后气隙:自动
[0781]
柱温数据通道:否
[0782]
室温数据通道:是
[0783]
样品温度数据通道:是
[0784]
样品管理器温度数据通道:否
[0785]
样品压力数据通道:否
[0786]
预热器温度数据通道:否
[0787]
密封力数据通道:否
[0788]
未启用注射模式:否
[0789]
自动添加混合冲程循环:自动
[0790]
自动添加混合冲程体积:自动ul
[0791]
主动预热器:使用控制台配置
[0792]
运行事件:否
[0793]
样品运行进样参数
[0794]
进样体积(u1)-5.00
[0795]
函数1
[0796]
函数中的扫描:738
[0797]
循环时间(秒):自动
[0798]
扫描间延迟(秒):自动
[0799]
通道间延迟(秒):自动
[0800]
跨度(da):0.500
[0801]
开始和结束时间(分钟):0.000至5.000
[0802]
离子化模式:es+
[0803]
数据类型:增强型sir或mrm
[0804]
功能类型:1通道的mrm
[0805]
通道反应停留(秒)锥电压柱能量延迟(秒)化合物
[0806]
1:289.25>108.78 0.200 调谐 25.0 自动 睾酮
[0807]
函数2
[0808]
函数中的扫描:737
[0809]
循环时间(秒):自动
[0810]
扫描间延迟(秒):自动
[0811]
通道间延迟(秒):自动
[0812]
跨度(da):0.500
[0813]
开始和结束时间(分钟):0.000至5.000
[0814]
离子化模式:es+
[0815]
数据类型:增强型sir或mrm
[0816]
功能类型:1通道的mrm
[0817]
通道反应停留(秒)锥电压柱能量延迟(秒)
[0818]
化合物式|质量
[0819]
1:624.40>203.00 0.200 调谐 40.0 自动 dma041 ce40 420.2
[0820]
函数3
[0821]
函数中的扫描:3901
[0822]
功能类型:二极管阵列
[0823]
波长范围(nm):200至400
[0824]
使用din en iso 32645中描述的程序,从线性校准曲线中获得各自的检测限。增强因子的计算可基于标记的分析物(例如睾酮)检测限(lod)与未衍生化分析物(例如睾酮)lod的比较。原理工作流程在图8中示出。
[0825]
图10a至图10d示出分析物-标记物17-复合物在不同裂解能量(5v至25v)下的裂解模式。
[0826]
图10d示出复合物在5v下的裂解模式。m3/z3值为261的母离子裂解成m4/z4值为462的第一子离子。示出其他离子,例如m/z值为635的tfa加合物和m/z值为453的第二子离子。通过将裂解能量从5v增加到25v(图10a到图10d),第一子离子的强度增加,而tfa加合物和母离子的强度降低。可以检测到裂解能量的最佳性能。技术人员熟知如何选择裂解能量的最佳性能,例如通过使用计算机(软件或手册)。优化的裂解能量可以通过常规测量进行调谐。
[0827]
图11示出分析物-标记物15-复合物的裂解模式。
[0828]
该复合物由彼此共价连接的分析物睾酮和化合物标记物15形成。复合物(母离子)包含两个永久电荷,并且具有的m3/z3比为291。复合物裂解成至少四个子离子,每个子离子的m/z比大于母离子的m/z比(m/z:302、328、510和524)。这些子离子的可能结构在图11中示
出。检测到m/z比小于m3/z3的其他子离子。
[0829]
此处描述的能够安装两个永久电荷的标记物显示了裂解为一个或多个片段的行为,并承载了部分标记和裂解后分析物分子离子部分的信息。因此,导致分析物的ms信号增强,这例如对于低丰度的分析物是重要的。
[0830]
一般合成方案1:
[0831][0832]
t=反应官能团q的前体
[0833]
r1和r2可以独立地选自由以下项组成的组:
[0834]
r1=甲氧基、乙氧基、丙氧基、丁氧基、戊氧基、己氧基、环丙氧基、环丁氧基、环戊氧基、环己氧基、苯氧基、甲基硫氧基、乙基硫氧基、丙基硫氧基、苯硫氧基、酰基、甲酰基、甲氧基羰基、乙氧基羰基、丙氧基羰基、丁氧基羰基、苄氧基羰基、苄氧基、乙酰氧基、氟、氯、溴、碘、羟基、苯基、苄基、甲基、乙基、丙基、丁基、戊基、己基、环丙基、环丁基、环戊基、环己基、芳基、杂芳基。
[0835]
r2=亚甲基、亚乙基、亚丙基、亚丁基、亚戊基、亚己基、芳基、杂芳基。
[0836]
反应条件:
[0837]
a=烷基化步骤,不同的溶剂和温度:
[0838]
b=甲基化步骤,不同的溶剂,mei;
[0839]
c=t在q中的变换:例如:n2h4、meoh或socl2、dcm或碘苯二乙酸酯、meoh
[0840]
溶剂和/或温度的选择取决于所产生产物的性质。如何选择适当的溶剂和/或温度是技术人员众所周知的。
[0841]
一般合成方案烷基化步骤a:
[0842]
将甲酯试剂(4.35mmol)溶解在15ml溶剂中并且加入乙二胺试剂(10.95mmol)。将反应混合物在(室温或70℃)搅拌(2-10h),然后在真空中浓缩。将粗产物与dmf(3x15ml)共蒸发并重新溶解在20ml乙腈和10ml乙酸乙酯的混合物中。将溶液在-20℃下储存16h以沉淀季铵盐。除去上清液并将所得固体在真空中干燥。
[0843]
一般合成方案甲基化步骤b:
[0844]
将粗物质(步骤a)溶解在溶剂中的混合物中并加入甲基碘(7.5mmol)。将所得混合物在室温搅拌16h,然后在真空中干燥。接下来,将粗制双季铵盐与乙腈/甲醇(2/1,2x30ml)共蒸发。
[0845]
一般合成方案步骤c:
[0846]
将粗物质(步骤b)溶解在乙腈/甲醇中并加入水合肼(15mmol)。将所得混合物在室温搅拌4h,然后在真空中干燥。通过制备型rp-hplc纯化所获得的粗产物,以得到结晶固体状所需产物。通过使用甲酸活化的阴离子交换树脂(lewatit-mp-62游离碱聚合物)实现tfa盐最终转化为相应的甲酸盐。
[0847][0848]
一般合成方案2:
[0849]
t=反应官能团q的前体
[0850]
r1和r2可以独立地选自由以下项组成的组:
[0851]
r1=甲氧基、乙氧基、丙氧基、丁氧基、戊氧基、己氧基、环丙氧基、环丁氧基、环戊氧基、环己氧基、苯氧基、甲基硫氧基、乙基硫氧基、丙基硫氧基、苯硫氧基、酰基、甲酰基、甲氧基羰基、乙氧基羰基、丙氧基羰基、丁氧基羰基、苄氧基羰基、苄氧基、乙酰氧基、氟、氯、溴、碘、羟基、苯基、苄基、甲基、乙基、丙基、丁基、戊基、己基、环丙基、环丁基、环戊基、环己基、芳基、杂芳基。
[0852]
r2=亚甲基、亚乙基、亚丙基、亚丁基、亚戊基、亚己基、芳基、杂芳基。
[0853]
反应条件:
[0854]
a=烷基化步骤,不同的溶剂和温度
[0855]
b=t在q中的变换:例如:n2h4、meoh或socl2、dcm或碘苯二乙酸酯、meoh
[0856]
一般合成方案烷基化步骤a:
[0857]
将吡啶试剂(0.50mmol)和(溴甲基)三甲基铵试剂(0.60mmol)溶解在1ml无水dmf中。将反应混合物在(室温(r.t)或70℃)搅拌(24-36h)。将溶剂在真空下去除,并且通过制备型hplc纯化残余物。收集纯级分并在真空下浓缩,得到固体产物。
[0858]
一般合成方案步骤b:
[0859]
将ptad-py试剂(0.029mmol)溶解在meoh(500μl)中。将碘苯二乙酸酯(0.033mmol)在meoh(500μl)中的溶液添加到第一溶液中。将反应混合物在室温搅拌15分钟。将溶剂在真空下除去,并且残余物不经进一步纯化直接使用。
[0860][0861]
一般合成方案3:
[0862]
r1和r2可以独立地选自由以下项组成的组:
[0863]
r1=甲氧基、乙氧基、丙氧基、丁氧基、戊氧基、己氧基、环丙氧基、环丁氧基、环戊氧基、环己氧基、苯氧基、甲基硫氧基、乙基硫氧基、丙基硫氧基、苯硫氧基、酰基、甲酰基、甲氧基羰基、乙氧基羰基、丙氧基羰基、丁氧基羰基、苄氧基羰基、苄氧基、乙酰氧基、氟、氯、溴、碘、羟基、苯基、苄基、甲基、乙基、丙基、丁基、戊基、己基、环丙基、环丁基、环戊基、环己基、芳基、杂芳基。
[0864]
r2=亚甲基、亚乙基、亚丙基、亚丁基、亚戊基、亚己基、芳基、杂芳基。
[0865]
反应条件:
[0866]
a=烷基化步骤,不同的溶剂和温度
[0867]
一般合成方案烷基化步骤a:
[0868]
将2-氟吡啶试剂(0.36mmol)和(溴甲基)三甲基铵试剂(0.46mmol)溶解在1ml无水dmf中。将反应混合物在(室温或90℃)搅拌(24-48h)。将溶剂在真空下去除,并且通过制备型hplc纯化残余物。收集纯级分并在真空下浓缩,得到无色油状产物。
[0869][0870]
一般合成方案4:
[0871]
t=反应官能团q的前体
[0872]
r1和r2可以独立地选自由以下项组成的组:
[0873]
r1=亚甲基、亚乙基、亚丙基、亚丁基、亚戊基、亚己基、芳基、杂芳基。
[0874]
r2=亚甲基、亚乙基、亚丙基、亚丁基、亚戊基、亚己基、芳基、杂芳基。
[0875]
反应条件:
[0876]
a=烷基化步骤,不同的溶剂和温度
[0877]
b=甲基化步骤,不同的溶剂,mei;
[0878]
c=t在q中的变换:例如:n2h4、meoh或socl2、dcm或碘苯二乙酸酯、meoh
[0879]
实例1:标记物13
[0880][0881]
标记物13的合成
[0882]
[4-[2-(氮杂鎓基氨基)-2-氧代-乙基]苯基]甲基-二甲基-[2-(三甲基铵基)乙基]铵;2,2,2-三氟乙酸酯的合成
[0883][0884]
将溴甲基苯乙酸(4.35mmol)溶解在15ml甲醇中。加入三甲基氯硅烷(0.87mmol),并且将反应在室温搅拌2h。将反应混合物在真空中浓缩并将残余物与甲醇(2x15ml)共蒸发。将粗甲酯溶解在15ml乙腈中并加入四甲基乙二胺(10.95mmol)。将反应混合物在70℃搅拌5h且然后在真空中浓缩。将粗产物与dmf(3x15ml)共蒸发并重新溶解在20ml乙腈和10ml
乙酸乙酯的混合物中。将溶液在-20℃下储存16h以沉淀季铵盐。除去上清液并将所得固体在真空中干燥。将粗物质溶解在乙腈/甲醇(2/1,30ml)的混合物中并加入甲基碘(7.5mmol)。将所得混合物在室温搅拌16h,然后在真空中干燥。接下来,将粗双季铵盐与乙腈/甲醇(2/1,2x30ml)共蒸发,溶解在乙腈/甲醇(1/4,40ml)中,并加入水合肼(15mmol)。将所得混合物在室温搅拌4h,然后在真空中干燥。通过制备型rp-hplc纯化所获得的粗产物,以得到结晶固体状所需产物(经4步得到16%)。通过使用甲酸活化的阴离子交换树脂(lewatit-mp-62游离碱聚合物)实现tfa-盐最终转化为相应的甲酸盐。
[0885]
hplc-ms(m/z)[m
2+
+tfa]
+
计算值407.5,实测值407.3
[0886]
标记物13-分析物衍生物(复合物)的制备和通过ms对其进行的分析
[0887][0888]
将标记物13(120mg,190μmol)和睾酮(100mg,350μmol,1.8eq)溶解在5ml acn/meoh/acoh(10/90+5vol%)中,并且在室温下搅拌混合物。16h后,将反应混合物在真空中浓缩,并且对粗产物进行hplc纯化(triart c18 20x250mm,线性梯度:20%至100%b在30分钟内;a=水;b=acn)。冻干得到所需缀合物。
[0889]
hplc-ms(m/z)[m2+fa]
+
计算值609.9,实测值609.8
[0890]
实例2:标记物14
[0891][0892]
标记物14的合成
[0893]
[4-[[4-(3,5-二氧代-1,2,4-三唑烷-4-基)吡啶-1-鎓-1-基]甲基]苯基]甲基-三甲基-三氟乙酸铵的合成:
[0894][0895]
将4-(吡啶-4-基)-1,2,4-三唑烷-3,5-二酮(0.50mmol)和4-(溴甲基)苄基三甲基溴化铵(0.60mmol)[如先前在polym.chem.2014,5,1180-1190中所报告来合成]溶解在1ml干燥的dmf中。将反应混合物在70℃搅拌36小时。将溶剂在真空下除去并通过制备型hplc纯化残余物。收集纯级分并在真空下浓缩,得到固体产物(78mg,24%产率)。
[0896]
hplc方法c-18柱:
[0897]
0min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[0898]
0-20min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[0899]
20-60min:70%h2o0.1%tfa,30%ch3cn0.1%tfa;
[0900]
60-64min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[0901]
64-74min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[0902]
74-79min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[0903]
79-90min:60%h2o0.1%tfa;40%ch3cn0.1%tfa。
[0904]1h nmr(400mhz,甲醇-d4)δppm3.10(s,9h)4.55(s,2h)5.85(s,2h)7.61-7.70(m,4h)8.85-8.89(m,2h)9.01-9.06(m,2h)。
[0905]
hplc-ms(m/z)[m]
2+
计算值170.59,实测值170.79。
[0906]
标记物14-分析物衍生物(复合物)的制备和通过ms对其进行的分析
[0907][0908]
将25-羟基维生素d一水合物(0.024mmol)和[4-[[4-(3,5-二氧代-1,2,4-三唑烷-4-基)吡啶-1-鎓-1-基]甲基]苯基]甲基三甲基三氟乙酸铵(0.029mmol)溶解在meoh(500μl)中。将碘苯二乙酸酯(0.033mmol)在meoh(500μl)中的溶液添加到第一溶液中。将反应混合物在室温搅拌15分钟。观察到维生素d完全转化为相应的产物。将溶剂在真空下去除,并且通过制备型hplc纯化残余物。离子交换后得到氯盐形式的产物。
[0909]
hplc方法c-18柱:
[0910]
0min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[0911]
0-20min:5%h2o0.1%tfa,95%ch3cn0.1%tfa;
[0912]
20-40min:5%h2o0.1%tfa;95%ch3cn0.1%tfa;
[0913]
40-45min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[0914]
45-50min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[0915]
50-55min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[0916]
55-65min:60%h2o0.1%tfa;40%ch3cn0.1%tfa。
[0917]1h nmr(400mhz,甲醇-d4)δppm0.46(s,2h)0.59(s,1h)0.90-0.98(m,4h)1.14(s,3h)1.15(s,3h)1.25-1.47(m,10h)1.58-2.30(m,12h)2.37-2.46(m,1h)2.97-3.86(m,1h)3.12(s,9h)3.82-4.02(m,2h)4.15-4.26(m,1h)4.57(s,2h)4.76-4.82(m,1h)5.10-5.17(n,1h)5.87(s,2h)7.59-7.73(m,4h)8.78-8.90(m,2h)9.02-9.16(m,2h)。
[0918]
hplc-ms(m/z)[m]
2+
计算值376.75,实测值370.06。
[0919]
实例3:标记物15
[0920]
标记物15的合成
[0921]
步骤1:[4-[[3-(2-甲氧基-2-氧乙基)吡啶-1-鎓-1-基]甲基]苯基]甲基三甲基-双三氟乙酸铵的合成:
[0922][0923]
将2-(3-吡啶基)乙酸甲酯(0.161mmol)和3-溴丙基(三甲基)溴化铵(0.146mmol)的混合物溶解在无水dmf(1ml)中。在70℃搅拌溶液20h。除去溶剂并在制备型hplc上进行纯化,得到30.8mg无色油状所需产物。
[0924]
hplc方法c-18柱:
[0925]
0min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[0926]
0-40min:90%h2o0.1%tfa,10%ch3cn0.1%tfa;
[0927]
40-44min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[0928]
44-52min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[0929]
52-54min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[0930]
54-59min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[0931]
59-60min:60%h2o0.1%tfa;40%ch3cn0.1%tfa。
[0932]1h nmr(400mhz,甲醇-d4)δppm3.10(s,9h)3.73(s,3h)4.02(s,2h)4.55(s,2h)5.92(s,2h)7.58-7.72(m,4h)8.10(dd,j=7.97,6.21hz,1h)8.57(d,j=8.16hz,1h)9.02(d,j=6.15hz,1h)9.11(s,1h)。
[0933]
13
c nmr(150mhz,甲醇-d4)δppm36.13(1c),51.67(1c)51.76(3c),63.60(1c),68.28(1c),127.80(1c),129.33(1c),129.36(2c),133.73(2c),135.95(1c),136.75(1c),143.14(1c),145.41(1c),147.30(1c),169.97(1c)。
[0934]
hplc-ms(m/z)[m+tfa]
+
计算值427.18,实测值427.61。
[0935]
步骤2:[4-[[3-[2-(氮杂鎓基氨基)-2-氧乙基]吡啶-1-鎓-1-基]甲基]苯基]甲基-三氟乙酸三甲铵的合成:
[0936][0937]
将[4-[[3-(2-甲氧基-2-氧乙基)吡啶-1-鎓-1-基]甲基]苯基]甲基三甲基-双三氟乙酸铵(0.057mmol)溶解在干燥的meoh(1ml)中,并且加入水合肼(0.617mmol)。将溶液在50℃搅拌3h。然后使溶液冷却至室温,且将溶剂在真空中除去,并且将粗混合物经制备型hplc纯化,得到21.6mg无色油状所需产物。
[0938]
hplc方法c-18柱:
[0939]
0min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[0940]
0-40min:90%h2o0.1%tfa,10%ch3cn0.1%tfa;
[0941]
40-44min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[0942]
44-52min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[0943]
52-54min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[0944]
54-59min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[0945]
59-60min:60%h2o0.1%tfa;40%ch3cn0.1%tfa。
[0946]1h nmr(400mhz,甲醇-d4)δppm3.10(s,9h)3.98(s,2h)4.55(s,2h)5.92(s,2h)7.60-7.69(m,4h)8.10(dd,j=7.97,6.21hz,1h)8.57(d,j=8.03hz,1h)9.02(d,j=6.15hz,1h)9.14(s,1h)。
[0947]
13
c nmr(150mhz,甲醇-d4)δppm35.50(1c),51.77(3c),63.61(1c),68.26(1c),127.84(1c),129.32(1c),129.39(2c),133.72(2c),135.89(1c),136.35(1c),143.25(1c),145.37(1c),147.16(1c),167.93(1c)。
[0948]
该化合物也可以作为不同类型的盐获得。
[0949]
实例4:标记物16
[0950][0951]
标记物16的合成
[0952]
[4-[[4-(二甲基氨基)-2-氟-吡啶-1-鎓-1-基]甲基]苯基]甲基-三甲基-三氟乙
酸铵的合成:
[0953][0954]
将2-氟-n,n-二甲基吡啶-4-胺(0.36mmol)和4-(溴甲基)苄基三甲基溴化铵(0.46mmol)[如先前在polym.chem.2014,5,1180-1190中所报告来合成]溶解在1ml干燥的dmf中。将反应混合物在90℃搅拌48小时。将溶剂在真空下除去并通过制备型hplc纯化残余物。收集纯级分并在真空下浓缩,得到66mg(35%产率)无色油状产物。
[0955]
hplc方法c-18柱:
[0956]
0min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[0957]
0-60min:70%h2o0.1%tfa,30%ch3cn0.1%tfa;
[0958]
60-64min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[0959]
64-74min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[0960]
74-79min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[0961]
79-90min:60%h2o0.1%tfa;40%ch3cn0.1%tfa。
[0962]1h nmr(400mhz,乙腈-d3)δppm3.04(s,9h)3.18(s,3h)3.23(s,3h)4.50(s,2h)5.41(d,j=2.01hz,2h)6.69(dd,j=9.29,2.89hz,1h)6.87(dd,j=7.72,2.82hz,1h)7.48(d,j=8.03hz,2h)7.54-7.65(m,2h)8.07(dd,j=7.78,6.15hz,1h)。
[0963]
19
f nmr(376mhz,乙腈-d3)δppm-90.63(dd,j=8.94,6.56hz,1f)-75.66(s,1f)。
[0964]
hplc-ms(m/z)[m]
2+
计算值151.60,实测值151.77。
[0965]
标记物16-分析物衍生物(复合物)的制备和通过ms对其进行的分析
[0966]
雌二醇缀合物的合成:
[0967][0968]
将雌二醇(0.09mmol)和[4-[[4-(二甲基氨基)-2-氟-吡啶-1-鎓-1-基]甲基]苯基]甲基-三甲基-三氟乙酸铵(0.11mmol)溶解在ch3cn(1ml)中。然后加入dipea(0.14mmol)并将反应混合物在室温搅拌30分钟。将溶剂在真空下除去并通过制备型hplc纯化残余物。收集纯级分并冻干以获得白色固体状产物。
[0969]
hplc方法c-18柱:
[0970]
0min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[0971]
0-60min:50%h2o0.1%tfa,50%ch3cn0.1%tfa;
[0972]
60-64min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[0973]
64-74min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[0974]
74-79min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[0975]
79-90min:60%h2o0.1%tfa;40%ch3cn0.1%tfa。
[0976]1h nmr(400mhz,甲醇-d4)δppm0.77(s,3h)1.15-1.59(m,7h)1.62-1.77(m,1h)1.86-2.10(m,4h)2.19-2.30(m,1h)2.30-2.40(m,1h)2.81-2.87(m,2h)2.96(s,3h)3.09(s,9h)3.23(s,3h)3.66(t,j=8.60hz,1h)4.53(s,2h)5.54(s,2h)5.85(d,j=2.76hz,1h)6.79-6.85(m,2h)6.87(dd,j=7.78,2.76hz,1h)7.40(d,j=8.41hz,1h)7.52(d,j=8.16hz,2h)7.61(d,j=8.28hz,2h)8.19(d,j=7.78hz,1h)。
[0977]
hplc-ms(n/z)[m]
2+
计算值277.69,实测值278.05。
[0978]
该化合物也可以作为不同类型的盐获得。
[0979]
标记物16b:其他合成的缀合物:
[0980][0981]
收率:21.0mg无色固体。
[0982]
hplc方法c-18柱:
[0983]
0min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[0984]
0-60min:30%h2o0.1%tfa,70%ch3cn0.1%tfa;
[0985]
60-64min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[0986]
64-80min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[0987]
80-83min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[0988]
83-89min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[0989]
89-90min:60%h2o0.1%tfa;40%ch3cn0.1%tfa。
[0990]1h nmr(400mhz,甲醇-d4)δppm0.78(s,3h)1.16-1.61(m,7h)1.64-1.88(m,1h)1.80-2.12(m,4h)2.21-2.31(m,1h)2.38(br s,1h)2.87(br s,2h)3.12(s,9h)3.67(t,j=8.53hz,1h)4.60(s,2h)5.94(s,2h)6.90-7.00(m,2h)7.24(d,j=8.66hz,1h)7.43-7.53(m,1h)7.62-7.79(m,5h)8.44(t,j=8.09hz,1h)8.93(d,j=6.27hz,1h)。
[0991]
hplc-ms(m/z)[m]
2+
计算值256.17,实测值256.69。
[0992]
实例5:标记物17
[0993][0994]
标记物17的合成
[0995]
步骤1:3-[3-(2-甲氧基-2-氧乙基)吡啶-1-鎓-1-基]丙基三甲基双三氟乙酸铵的合成:
[0996][0997]
将2-(3-吡啶基)乙酸甲酯(1.610mmol)和3-溴丙基(三甲基)溴化铵(1.628mmol)的混合物溶解在无水dmf(1ml)中。在100℃搅拌溶液18h。除去溶剂并在制备型hplc上进行纯化,得到292.6mg黑色油状所需产物。
[0998]
hplc方法c-18柱:
[0999]
0min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[1000]
0-60min:70%h2o0.1%tfa,30%ch3cn0.1%tfa;
[1001]
60-64min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[1002]
64-80min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[1003]
80-83min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[1004]
83-89min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[1005]
89-90min:60%h2o0.1%tfa;40%ch3cn0.1%tfa。
[1006]1h nmr(400mhz,甲醇-d4)δppm1.95-2.02(m,2h)3.22(s,3h)3.60-3.64(m,2h)3.75(s,3h)4.05-4.08(m,2h)4.81(s,2h)8.13(dd,j=6.15,7.93hz,1h)8.60(d,j=8.10hz,1h)9.07(d,j=6.29hz,1h)9.18(s,1h)。
[1007]
13
c nmr(101mhz,甲醇-d4)δppm24.83(1c)36.33(1c)51.73(1c)52.62(1c)52.66(1c)52.70(1c)57.82(1c)62.35(1c)127.69(1c)136.55(1c)143.24(1c)145.34(1c)147.31(1c)170.02(1c)。
[1008]
步骤2:3-[3-[2-(氮杂鎓基氨基)-2-氧乙基]吡啶-1-鎓-1-基]丙基三甲基-三氟乙酸铵的合成:
[1009][1010]
将3-[3-(2-甲氧基-2-氧乙基)吡啶-1-鎓-1-基]丙基三甲基铵双三氟乙酸盐(0.205mmol)溶解在干燥的meoh(2ml)中并加入水合肼(2.058mmol)。将溶液在0℃搅拌4h。将溶剂在真空中除去,并且将粗混合物经制备型hplc纯化,得到66.9mg淡褐色固体状所需产物。
[1011]
hplc方法c-18柱:
[1012]
0min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[1013]
0-30min:90%h2o0.1%tfa,10%ch3cn0.1%tfa;
[1014]
30-34min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[1015]
34-50min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[1016]
50-53min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[1017]
53-59min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[1018]
59-60min:60%h2o0.1%tfa;40%ch3cn0.1%tfa。
[1019]1h nmr(400mhz,甲醇-d4)δppm2.60-2.69(m,2h)3.21(s,3h)3.58-3.64(m,2h)3.94-3.97(m,2h)4.82(s,2h)8.12(dd,j=6.20,7.99hz,1h)8.58(d,j=8.28hz,1h)9.05(d,j=5.82hz,1h)9.21(s,1h)。
[1020]
标记物17-分析物衍生物(复合物)的制备和通过ms对其进行的分析
[1021]
睾酮缀合物的合成:
[1022][1023]
将3-[3-[2-(氮杂鎓基氨基)-2-氧乙基]吡啶-1-鎓-1-基]丙基三甲基-三氟乙酸铵(0.113mmol)和睾酮(0.104mmol)溶解在meoh(1ml)中并在室温搅拌2.5d。在真空中除去溶剂后,将粗混合物通过制备型hplc纯化,得到15.9mg无色固体。
[1024]
hplc方法c-18柱:
[1025]
0min:100%h2o,0%ch3cn;
[1026]
0-45min:5%h2o,95%ch3cn;
[1027]
45-49min:5%h2o;95%ch3cn;
[1028]
49-50min:40%h2o;60%ch3cn;
[1029]
50-55min:40%h2o;60%ch3cn;
[1030]
55-60min:40%h2o;60%ch3cn.
[1031]
hplc-ms(m/z)[m
2+
+tfa]
+
计算值635.38,实测值635.56
[1032]
该化合物也可以作为不同类型的盐获得。
[1033]
18的合成:
[1034][1035]
将4-(吡啶-4-基)-1,2,4-三唑烷-3,5-二酮(0.18mmol)和1,4-双(溴甲基)-2-甲氧基苯[先前报告于j.am.chem.soc.1996,118,4271中](0.18mmol)溶解在3ml干燥的dmf中。将反应混合物在室温(r.t.)在周末期间搅拌。然后加入tma溶液(0.35mmol)并将混合物在室温搅拌30分钟。将溶剂在真空下除去并通过制备型hplc纯化粗品。收集纯级分并在真空下浓缩。将残余物溶解在稀释的hcl(aq)中并冻干(重复2次)。以两种异构体的混合物形式获得白色固体状产物(比率~7∶3,来自nmr)(17%产率)。
[1036]
hplc方法c-18柱:
[1037]
0min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[1038]
0-10min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[1039]
10-60min:70%h2o0.1%tfa,30%ch3cn0.1%tfa;
[1040]
60-64min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[1041]
64-74min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[1042]
74-79min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[1043]
79-90min:60%h2o0.1%tfa;40%ch3cn0.1%tfa。
[1044]
主要异构体:1h nmr(400mhz,甲醇-d4)δppm3.13(s,9h)3.91(s,3h)4.54(s,2h)5.77(s,2h)7.23-7.31(m,2h)7.70(d,j=8.28hz,1h)8.76-8.84(m,2h)8.95-9.02(m,2h)。
[1045]
次要异构体:1h nmr(400mhz,甲醇-d4)δppm3.10(s,9h)3.96(s,3h)4.54(s,2h)5.82(s,2h)7.18(dd,j=7.84,1.69hz,1h)7.36(d,j=1.51hz,1h)7.56(d,j=7.78hz,1h)8.84-8.93(m,2h)9.02-9.09(m,2h)。
[1046]
hplc-ms(m/z)[m]
2+
计算值185.60,实测值185.78。
[1047]
用标记物18衍生的维生素d的合成:
[1048][1049]
将25-羟基维生素d一水合物(0.019mmol)和标记物18(0.020mmol)溶解在meoh(500μl)中。将碘苯二乙酸酯(0.023mmol)在meoh中的溶液添加到第一溶液中。将反应混合物在室温搅拌15分钟。观察到维生素d完全转化为相应的产物。将溶剂在真空下去除,并且通过制备型hplc纯化粗品。收集纯级分并在真空下浓缩。将残余物溶解在稀释的hcl(aq)中并冻干(重复2次)。获得白色固体状产物。
[1050]
hplc方法c-18柱:
[1051]
0min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[1052]
0-20min:5%h2o0.1%tfa,95%ch3cn0.1%tfa;
[1053]
20-40min:5%h2o0.1%tfa;95%ch3cn0.1%tfa;
[1054]
40-45min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[1055]
45-50min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[1056]
50-55min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[1057]
55-65min:60%h2o0.1%tfa;40%ch3cn0.1%tfa。
[1058]
hplc-ms(m/z)[m]
2+
计算值384.8,实测值385.05。
[1059]
标记物19的合成:
[1060][1061]
将2-氟-n,n-二甲基吡啶-4-胺(0.18mmol)和1,4-双(溴甲基)-2-甲氧基苯[先前报告于j.am.chem.soc.1996,118,4271中](0.18mmol)溶解在3ml干燥的dmf中。将反应混合物在室温在周末期间搅拌。然后加入tma溶液(0.36mmol)并将混合物在室温搅拌2h。将溶剂在真空下除去并通过制备型hplc纯化残余物。收集纯级分并在真空下浓缩,得到无色油状产物,其为两种异构体的混合物(比率~7∶3,来自nmr)(14%产率)。
[1062]
hplc方法c-18柱:
[1063]
0min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[1064]
0-60min:70%h2o0.1%tfa,30%ch3cn0.1%tfa;
[1065]
60-64min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[1066]
64-74min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[1067]
74-79min:60%h2o0.1%tfa;40%ch3cn0.1%tfa;
[1068]
79-90min:60%h2o0.1%tfa;40%ch3cn0.1%tfa。
[1069]
主要异构体:1h nmr(400mhz,乙腈-d3)δppm3.05(s,9h)3.16(s,3h)3.21(s,3h)
3.87(s,3h)4.46(s,2h)5.29(d,j=1.63hz,2h)6.63(dd,j=9.41,2.89hz,1h)6.77(dd,j=7.78,2.89hz,1h)7.16(dd,j=7.72,1.44hz,1h)7.19(d,j=1.13hz,1h)7.47(dd,j=7.78,1.00hz,1h)7.92(dd,j=7.78,6.15hz,1h)。
[1070]
次要异构体:1h nmr(400mhz,乙腈-d3)δppm3.04(s,9h)3.16(s,3h)3.21(s,3h)3.87(s,3h)4.43(s,2h)5.28(d,j=1.63hz,2h)6.62(br dd,j=9.29,2.89hz,1h)6.76(br dd,j=7.72,2.82hz,1h)7.08-7.22(m,2h)7.42-7.50(m,1h)7.91(br dd,j=7.78,6.02hz,1h)。
[1071]
19
f nmr(376mhz,乙腈-d3)δppm-75.39,-90.11。
[1072]
hplc-ms(m/z)[m+tfa]
+
计算值446.21,实测值446.39。
[1073]
与标记物19缀合的雌二醇的合成:
[1074][1075]
将雌二醇(0.022mmol)和标记物19(0.026mmol)溶解在ch3cn(1ml)中。然后加入k2co3(0.066mmol)并将反应混合物在室温搅拌2h。将溶剂在真空下去除,并且通过制备型hplc纯化残余物。收集纯级分并在真空下浓缩。将残余物溶解在稀释的hcl(aq)中并冻干(重复2次)。以两种异构体的混合物形式获得白色固体状产物(比率~7∶3,来自nmr)。
[1076]
hplc方法c-18柱:
[1077]
0min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[1078]
0-60min:50%h2o0.1%tfa,50%ch3cn0.1%tfa;
[1079]
60-64min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[1080]
64-74min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[1081]
74-79min:60%h2o0.1%tfa;40%ch3cn0.1%tfa。
[1082]
主要异构体:1h nmr(400mhz,甲醇-d4)δppm0.78(s,3h)1.16-1.59(m,8h)1.63-1.79(m,1h)1.87-2.10(m,3h)2.19-2.29(m,1h)2.32-2.40(m,1h)2.83-2.85(m,2h)2.94(br s,3h)3.12(s,9h)3.21(br s,3h)3.67(t,j=8.66hz,1h)3.94(s,3h)4.52(s,2h)5.46(s,2h)5.82(d,j=2.76hz,1h)6.77-6.83(m,3h)7.16(dd,j=7.65,1.51hz,1h)7.24(d,j=1.25hz,1h)7.41(br d,j=8.03hz,1h)7.44(d,j=7.78hz,1h)8.14(d,j=7.91hz,1h)。
[1083]
次要异构体:1h nmr(400mhz,甲醇-d4)δppm0.78(s,3h)1.16-1.59(m,8h)1.63-1.79(m,1h)1.87-2.10(m,3h)2.19-2.29(m,1h)2.32-2.40(m,1h)2.83-2.85(m,2h)2.97(br s,3h)3.08(s,3h)3.23(br s,1h)3.67(t,j=8.66hz,1h)3.88(s,3h)4.52(s,2h)5.52(s,2h)5.88(br d,j=2.76hz,1h)6.83-6.89(m,1h)7.20-7.22(m,1h)7.41(br d,j=8.03hz,1h)7.51(br d,j=7.78hz,1h)8.21(br d,j=7.78hz,1h)。
[1084]
hplc-ms(m/z)[m]
2+
计算值292.7,实测值293.04。
[1085]
标记物20的合成:
[1086][1087]
将2-氟-n,n-二甲基吡啶-4-胺(0.78mmol)和(3-溴丙基)三甲基溴化铵(0.94mmol)溶解在1ml干燥的dmf中。将反应混合物在70℃搅拌过周末。将溶剂在真空下除去并通过制备型hplc纯化残余物。收集纯级分并在真空下浓缩,得到无色油状产物(46%产率)。
[1088]
hplc方法c-18柱:
[1089]
0min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[1090]
0-60min:70%h2o0.1%tfa,30%ch3cn0.1%tfa;
[1091]
60-64min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[1092]
64-74min:2%h2o0.1%tfa;98%ch3cn0.1%tfa。
[1093]1h nmr(400mhz,d2o)δppm2.18-2.35(m,2h)3.03(s,9h)3.08(s,3h)3.13(s,3h)3.31-3.39(m,2h)4.10-4.21(m,2h)6.59(dd,j=9.35,2.82hz,1h)6.74(dd,j=7.78,2.76hz,1h)7.77(dd,j=7.72,6.09hz,1h)。
[1094]
19
f nmr(376mhz,d2o)δppm-91.38
‑‑
91.27,-75.63。
[1095]
13
c nmr(101mhz,氧化氘)δppm23.01(1c)25.37(1c)39.94(1c)47.81(1c)53.03(3c)62.73(1c)91.04(1c)91.31(1c)106.32(1c)139.45(1c)159.87(1c)。
[1096]
hplc-ms(m/z)[m]
2+
计算值120.60,实测值120.59。
[1097]
与标记物20缀合的雌二醇的合成:
[1098][1099]
将雌二醇(0.073mmol)和标记物20(0.11mmol)溶解在ch3cn(1ml)中。然后加入k2co3(0.22mmol)并将反应混合物在室温搅拌2h。将溶剂在真空下去除,并且通过制备型hplc纯化残余物。收集纯级分并在真空下浓缩。将残余物溶解在稀释的hcl(aq)中并冻干(重复2次)。获得白色固体状产物。
[1100]
hplc方法c-18柱:
[1101]
0min:100%h2o0.1%tfa,0%ch3cn0.1%tfa;
[1102]
0-60min:50%h2o0.1%tfa,50%ch3cn0.1%tfa;
[1103]
60-64min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[1104]
64-74min:2%h2o0.1%tfa;98%ch3cn0.1%tfa;
[1105]
74-79min:60%h2o0.1%tfa;40%ch3cn0.1%tfa。
[1106]1h nmr(400mhz,甲醇-d4)δppm0.79(s,3h)1.22-1.55(m,8h)1.64-1.80(m,1h)1.85-2.12(m,3h)2.20-2.34(m,1h)2.34-2.49(m,3h)2.91(br dd,j=8.60,4.08hz,2h)2.96(s,3h)3.18(s,9h)3.22(s,3h)3.49-3.55(m,2h)3.68(t,j=8.60hz,1h)4.37(t,j=7.28hz,2h)5.84(d,j=2.76hz,1h)6.84(dd,j=7.65,2.76hz,1h)7.06-7.10(m,2h)7.49(d,j=8.41hz,1h)8.03(d,j=7.65hz,1h)。
[1107]
hplc-ms(m/z)[m]
2+
计算值246.68,实测值247.00。
[1108]
该专利申请请求欧洲专利申请20175802.6的优先权,其中该欧洲专利申请的内容通过引用并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1