一种检测克百威的试纸条及方法与流程
1.本发明涉及一种检测克百威的试纸条及方法,具体涉及一种用于检测克百威的胶体金试纸条,其特别适用于蔬菜、水果等植物源性食品中克百威的检测。
背景技术:
2.克百威,又名呋喃丹、虫螨威,属氨基甲酸酯类农药,为内吸性广谱型杀虫、杀螨剂,具有触杀和胃毒的作用。其作用机制与有机磷类似,为抑制乙酰胆碱酯酶的活性,依靠抑制剂和酶活性区间的亲和力形成抑制剂络合物,从而破坏正常的神经冲动传导,引起异常兴奋、痉挛、麻痹及死亡等症状,可用于防治水稻、花生、甘蔗、棉花等作物的大部分害虫,主要为内吸杀虫作用。
3.克百威与其他氨基甲酸酯类杀虫剂所不同的是,其与乙酰胆碱酯酶的结合是不可逆的,因此克百威毒性高,一旦暴露与环境中,残留时间较长,对鸟类、蜜蜂和水生动物如鱼类具有高度毒性。美国环境保护署(epa)将其列为剧毒类农药,2006年,epa认为克百威的使用存在较高的生态与职业风险,且由于克百威在马铃薯、甜玉米和葫芦上的广泛使用而大大提高了饮食风险;2008年,又重新对其进行了风险评估;2009年12月31日起全部取消了克百威的残留值,即克百威为禁用农药,我国国家标准gb 2763《食品安全国家标准食品中农药最大残留限量》也规定了蔬菜、水果中克百威的最大残留限量为0.02mg/kg。
4.目前,检测克百威主要采用高效液相色谱法、液相色谱-质谱联用法、气相色谱-质谱联用法等分析方法,这些方法均须在实验室条件下操作,样品前处理繁琐费时,还需配备昂贵的仪器设备,检测成本较高、耗时长、操作复杂,在实际应用过程中有很大的限制性,难以满足大量样品和现场样品快速检测的需要。因此,开发一种简单快速、适用于食品中克百威检测的胶体金试纸条,可满足大量样品现场筛选和监控,能够更好地满足我国食品监管部门等开展检测工作。
技术实现要素:
5.本发明的目的在于提供一种能够检测植物源性食品中克百威的胶体金试纸条,并且提供一种高效、准确、简便、适于现场监控和大量样本筛查的检测方法。
6.本发明所提供的检测克百威的试纸条,包括样品吸收垫、结合物释放垫、反应膜、吸水垫和底板;所述反应膜上具有包被有克百威半抗原-载体蛋白偶联物的检测线和包被有羊抗鼠抗抗体的质控线;所述结合物释放垫上喷涂有克百威单克隆抗体-胶体金标记物。
7.所述克百威单克隆抗体是以克百威半抗原-载体蛋白偶联物作为免疫原制备获得。
8.所述克百威半抗原-载体蛋白偶联物由克百威半抗原与载体蛋白偶联得到,所述载体蛋白为牛血清白蛋白、卵清白蛋白、血蓝蛋白、甲状腺蛋白或人血清白蛋白,所述克百威半抗原是以2-n-丁氨基丙酸为起始原料,经过硫化、氯化后再与3-羟基克百威反应得到的,其分子结构式为:
[0009][0010]
所述样品吸收垫、结合物释放垫、反应膜、吸水垫依次粘贴在底板上,所述结合物释放垫1/3~1/2被覆盖于样品吸收垫下。
[0011]
所述底板为pvc底板或其他硬质不吸水的材料;所述样品吸收垫为聚酯纤维或玻璃纤维材质;所述结合物释放垫为聚酯纤维素膜或玻璃纤维素膜;所述吸水垫为吸水滤纸;所述反应膜为硝酸纤维素膜或醋酸纤维素膜。
[0012]
本发明的另一个目的是提供一种制备上述试纸条的方法,其包括步骤:
[0013]
1)制备喷涂有克百威单克隆抗体-胶体金标记物的结合物释放垫;
[0014]
2)制备具有包被有克百威半抗原-载体蛋白偶联物的检测线和包被有羊抗鼠抗抗体的质控线的反应膜;
[0015]
3)将1)和2)制备好的结合物释放垫、反应膜与样品吸收垫、吸水垫和底板组装成试纸条。
[0016]
具体地说,步骤包括:
[0017]
1)以2-n-丁氨基丙酸为起始原料,经过硫化、氯化后再与3-羟基克百威反应,制备克百威半抗原;
[0018]
2)将克百威半抗原与载体蛋白偶联,制备克百威半抗原-载体蛋白偶联物;
[0019]
3)用克百威半抗原-载体蛋白偶联物免疫小鼠,将小鼠脾细胞和小鼠骨髓瘤细胞通过融合、筛选,得到分泌克百威单克隆抗体的杂交瘤细胞株;
[0020]
4)提取小鼠igg免疫健康山羊,得到羊抗鼠抗抗体;
[0021]
5)分别将克百威半抗原-载体蛋白偶联物和羊抗鼠抗抗体包被于反应膜的检测线(t)和质控线(c)上;
[0022]
6)用柠檬酸三钠与氯金酸反应制备胶体金;
[0023]
7)将制备的克百威单克隆抗体加入到制备的胶体金中,得到克百威单克隆抗体-胶体金标记物;
[0024]
8)将克百威单克隆抗体-胶体金标记物喷涂在结合物释放垫上,37℃烘干2h后取出,置于干燥环境中保存备用;
[0025]
9)将样品吸收垫用含1%牛血清白蛋白、ph为7.2的0.02mol/l磷酸盐缓冲液浸泡2h,37℃烘干2h备用;
[0026]
10)在底板上按顺序粘贴上样品吸收垫、结合物释放垫、反应膜、吸水垫,结合物释放垫从起始端有1/3区域被样品吸收垫覆盖。最后切成3.95mm宽的小条,装在特制的塑料制
卡壳中,以铝箔袋密封,4~30℃条件下保存12个月。
[0027]
本发明的另一个目的是提供一种应用上述试纸条检测植物源性食品中克百威的方法,它包括步骤:
[0028]
(1)样品前处理;
[0029]
(2)用试纸条进行检测;
[0030]
(3)分析检测结果。
[0031]
本发明的克百威快速检测试纸条采用高度特异性的抗体抗原反应及免疫层析分析技术,将克百威单克隆抗体-胶体金标记物固定于结合物释放垫上,样品中的克百威在流动过程中与结合物释放垫上的克百威单克隆抗体-胶体金标记物结合,形成克百威-抗体-胶体金标记物。样本中的克百威与反应膜检测线上的克百威半抗原-载体蛋白偶联物竞争结合克百威单克隆抗体-胶体金标记物,根据检测线红色条带深浅来判断待测样品液中是否含有克百威。
[0032]
检测时,样品经处理后滴入试纸条卡孔内,当克百威在样品中的浓度低于检测限或为零时,单克隆抗体-胶体金标记物在层析过程中会与固定在反应膜上的克百威半抗原-载体蛋白偶联物结合,在检测线(t)和质控线(c)上各出现一条红色条带,且t线显色比c线显色深或与c线显色一致;如果克百威在样品中的浓度等于或高于检测限,单克隆抗体-胶体金标记物会与克百威全部结合,从而在t线处因为竞争反应不会与克百威半抗原-载体蛋白偶联物结合而不出现红色条带或比c线显色浅。如图3所示。
[0033]
阴性:当质控线(c)显示出红色条带,检测线(t)同时也显示出红色条带,且(t)线颜色接近或深于(c)线时,判为阴性。
[0034]
阳性:当质控线(c)显示出红色条带,而检测线(t)不显色或(t)线颜色浅于(c)线时,判为阳性。
[0035]
无效:当质控线(c)不显示出红色条带,则无论检测线(t)显示出红色条带与否,该试纸条均判为无效。
[0036]
本发明的试纸条具有灵敏度高、特异性强、成本低、操作简单、检测时间短、适合各种单位使用、储存简单、保质期长的优点。用本发明试纸条检测克百威的方法简便、快速、直观、准确、适用范围广、成本低、易推广使用。
附图说明
[0037]
图1为克百威半抗原合成图。
[0038]
图2为试纸条剖面结构示意图,图中:1、样品吸收垫;2、结合物释放垫;3、反应膜;4、吸水垫;5、检测线;6、质控线;7、底板。
[0039]
图3为试纸条检测结果判定图。
具体实施方式
[0040]
下面结合具体的实施例来进一步阐述本发明。应理解,这些实施例仅用于说明本发明,而不用来限制本发明的范围。
[0041]
实施例1检测克百威的试纸条的制备
[0042]
该试纸条的制备方法主要包括以下步骤:
[0043]
1)制备喷涂有克百威单克隆抗体-胶体金标记物的结合物释放垫;
[0044]
2)制备具有包被有克百威半抗原-载体蛋白偶联物的检测线和包被有羊抗鼠抗抗体的质控线的反应膜;
[0045]
3)将1)和2)制备好的结合物释放垫、反应膜与样品吸收垫、吸水垫和底板组装成试纸条。
[0046]
下面分步详细叙述:
[0047]
1、克百威半抗原的合成(合成路线见附图1)
[0048]
取2-n-丁氨基丙酸1.31g,加1,2-二氯乙烷100ml溶解,加三乙胺5ml,搅拌,冷却到5℃,加一氯化硫0.87g,0~5℃反应2h,加水50ml,充分搅拌,静置,分去水相,下层母液加无水硫酸钠干燥,过滤除去固体硫酸钠,冷却到5℃;加硫酰氯1.43g,反应4h;加入3-羟基克百威3.6g,加三乙胺5ml,0~5℃反应4h,补加1,2-二氯乙烷100ml,加水100ml,充分搅拌,静置,分去水相,有机相旋蒸,蒸干,得到红色油状物,上硅胶柱,用体积比为10:1的二氯甲烷-甲醇混合溶液洗脱分离,得到克百威半抗原3.7g,收率92.5%。
[0049]
2、免疫原的制备
[0050]
取克百威半抗原15mg,加1ml n,n-二甲基甲酰胺(dmf)溶解澄清,加n-羟基丁二酰亚胺(nhs)9.8mg、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)11mg,充分溶解混匀,室温反应2h,得到半抗原活化液a液;取牛血清白蛋白(bsa)50mg,加0.1mol/l ph 9.5的cb缓冲液6ml溶解,得到b液;将a液逐滴滴加到b液中,室温反应4h,停止反应,用0.02mol/l pbs透析纯化3天,每天换液3次,离心分装,得到克百威半抗原-bsa偶联物,即为免疫原。
[0051]
3、包被原的制备
[0052]
取克百威半抗原9mg,加1ml dmf溶解澄清,加nhs 6.1mg、edc 8.1mg,充分溶解混匀,室温反应2h,得到半抗原活化液a液;取卵清白蛋白(ova)50mg,加0.1mol/l ph 9.5的cb缓冲液6ml溶解,得到b液;将a液逐滴滴加到b液中,室温反应4h,停止反应,用0.02mol/l pbs透析纯化3天,每天换液3次,离心分装,得到克百威半抗原-ova偶联物,即为包被原。
[0053]
4、克百威单克隆抗体的制备
[0054]
(1)动物免疫
[0055]
将步骤2得到的免疫原注入balb/c小鼠体内,免疫剂量为150μg/只,使其产生抗血清。
[0056]
(2)细胞融合和克隆化
[0057]
取免疫balb/c小鼠脾细胞,按8:1(数量配比)比例与sp2/0骨髓瘤细胞融合,采用间接竞争elisa测定细胞上清液,筛选阳性孔。利用有限稀释法对阳性孔进行克隆化,直到得到稳定分泌单克隆抗体的杂交瘤细胞株。
[0058]
(3)细胞冻存和复苏
[0059]
将杂交瘤细胞用冻存液制成1
×
106个/ml的细胞悬液,在液氮中长期保存。复苏时取出冻存管,立即放入37℃水浴中速融,离心去除冻存液后,移入培养瓶内培养。
[0060]
(4)单克隆抗体的制备与纯化
[0061]
增量培养法:将杂交瘤细胞置于细胞培养基中,在37℃条件下进行培养,用辛酸-饱和硫酸铵法将得到的培养液进行纯化,得到单克隆抗体,-20℃保存。
[0062]
所述细胞培养基为向rpmi1640培养基中添加小牛血清和碳酸氢钠,使小牛血清在
细胞培养基中的终浓度为20%(质量分数),使碳酸氢钠在细胞培养基中的终浓度为0.2%(质量分数);所述细胞培养基的ph为7.4。
[0063]
5、羊抗鼠抗抗体的制备
[0064]
以羊作为免疫动物,以鼠源抗体为免疫原对无病原体羊进行免疫,得到羊抗鼠抗抗体。
[0065]
6、克百威单克隆抗体-胶体金标记物的制备
[0066]
(1)胶体金的制备
[0067]
用双蒸去离子水将1%氯金酸稀释成0.01%(质量分数),取100ml置于锥形瓶中,用恒温电磁搅拌器加热至沸腾,在持续高温、持续搅拌下加入1.5ml 1%柠檬酸三钠,继续匀速搅拌加热至溶液呈透亮的红色时停止,冷却至室温后用去离子水恢复到原体积,4℃保存。制备好的胶体金外观纯净、透亮、无沉淀和漂浮物,在日光下观察颜色为酒红色。
[0068]
(2)克百威单克隆抗体-胶体金标记物的制备
[0069]
在磁力搅拌下,用0.2mol/l碳酸钾溶液调胶体金的ph值至7.2,按每毫升胶体金溶液中加入5~50μg抗体的标准向胶体金溶液中加入上述克百威单克隆抗体,继续搅拌混匀30min;静置10min后加入10%bsa,使其在胶体金溶液中的终浓度为1%,静置10min。12000r/min、4℃离心40min,弃上清液,沉淀用复溶缓冲液洗涤两次,用体积为初始胶体金体积1/10的复溶缓冲液将沉淀重悬,置4℃备用。
[0070]
复溶缓冲液:含bsa的质量分数为0.1%~0.5%、蔗糖的质量分数2%~4%、ph 7.2的0.02mol/l磷酸盐缓冲液。
[0071]
7、结合物释放垫的制备
[0072]
将结合物释放垫浸泡于含0.5%bsa、5%蔗糖、ph 7.4的0.02mol/l磷酸盐缓冲液中,均匀浸湿2h,37℃烘干备用。用bio dot划膜仪将制备好的克百威单克隆抗体-胶体金标记物均匀喷涂在结合物释放垫上,每1cm结合物释放垫喷涂0.01ml克百威单克隆抗体-胶体金标记物后,置于37℃环境(湿度<20%)中2h后取出,置于干燥环境(湿度<20%)中保存备用。
[0073]
8、样品吸收垫的制备
[0074]
将样品吸收垫用含1%bsa、ph为7.2的0.02mol/l磷酸盐缓冲液浸泡2h,37℃烘干2h备用。
[0075]
9、反应膜的制备
[0076]
将克百威半抗原-ova偶联物包被到反应膜上构成检测线,将羊抗鼠抗抗体包被在反应膜上构成质控线。
[0077]
包被过程:用0.01mol/l、ph 7.2的磷酸缓冲液将克百威半抗原-ova偶联物稀释到1mg/ml,用bio dot划膜仪将其包被于硝酸纤维素膜上的检测线(t线),包被量为1.0μl/cm;用0.01mol/l、ph 7.2的磷酸盐缓冲液将羊抗鼠抗抗体稀释到200μg/ml,用bio dot划膜仪将其包被于硝酸纤维素膜上的质控线(c线),包被量为1.0μl/cm。将包被好的反应膜置于37℃条件下干燥16h,备用。
[0078]
10、试纸条的组装
[0079]
根据附图2所示试纸条剖面结构,将样品吸收垫(1)、结合物释放垫(2)、反应膜(3)、吸水垫(4)依次按顺序粘贴在pvc底板(7)上;结合物释放垫从起始端有1/3区域被样品
吸收垫覆盖,结合物释放垫的末端与反应膜的始端相连,反应膜的末端与吸水垫的始端相连,样品吸收垫的始端与pvc底板的始端对齐,吸水垫的末端与pvc底板的末端对齐;所述反应膜上有检测线(5)和质控线(6),检测线(t线)和质控线(c线)均为与所述试纸条的长相垂直的条状带;检测线位于靠近结合物释放垫的末端的一侧;质控线位于远离结合物释放垫的末端的一侧;将试纸条用机器切成3.95mm宽的小条,装在特制的塑料制卡壳中,以铝箔袋密封,4~30℃的环境中贮存,有效期12个月。
[0080]
实施例2植物源性食品中克百威的检测
[0081]
1、样品前处理
[0082]
取新鲜样品擦去泥土,剪碎成小于1cm见方的碎片;称取(2.00
±
0.05)g样品至15ml聚苯乙烯离心管中,加入6ml 0.02mol/l、ph 7.4的pbs缓冲液,盖上盖子,手动上下振荡1min,静置1min,上层液体即为待测样品液。
[0083]
2、用试纸条检测
[0084]
用微量移液器吸取待测样品液100μl垂直滴于加样孔中;液体流动开始计时,反应10min,判定结果。
[0085]
3、分析检测结果
[0086]
阴性(-):t线显色比c线显色深或与c线显色一致,表示样品中克百威浓度低于检测限,如图3a、3b。
[0087]
阳性(+):t线显色比c线显色浅或t线不显色,表示样品中克百威浓度等于或高于检测限,如图3c、3d。
[0088]
无效:未出现c线,表明不正确的操作过程或试纸条已变质失效,如图3e、3f。
[0089]
实施例3样品检测实例
[0090]
1、检测限试验
[0091]
取空白抱子甘蓝、豇豆、大白菜、苹果、梨、橘样本,在其中分别添加克百威至终浓度为0.01mg/kg、0.02mg/kg、0.04mg/kg,取试纸条进行检测,每个样本重复测定三次。
[0092]
用试纸条检测抱子甘蓝、豇豆、大白菜、苹果、梨、橘样本时,当其中无克百威和其添加浓度为0.01mg/kg时,试纸条上显示出t线显色比c线显色深或与c线显色一致,呈阴性;当其中克百威添加浓度为0.02mg/kg、0.04mg/kg时,试纸条上显示出t线显色比c线显色浅或t线不显色,呈阳性,表明本试纸条对植物源性食品中克百威的检测限为0.02mg/kg。
[0093]
2、假阳性率、假阴性率试验
[0094]
取空白抱子甘蓝、豇豆、大白菜、苹果、梨、橘样本及添加克百威至终浓度为0.02mg/kg的阳性抱子甘蓝、豇豆、大白菜、苹果、梨、橘样本各20份,用3个批次生产的试纸条分别进行检测,计算其阴阳性率。
[0095]
结果表明:用3个批次生产的试纸条检测阳性样本时,结果全为阳性,可知阳性符合率为100%,假阴性率为0;检测阴性样本时,结果全为阴性,可知阴性符合率为100%,假阳性率为0。说明本发明的检测克百威的试纸条可以对植物源性食品中克百威进行快速检测。
[0096]
3、特异性试验
[0097]
用本试纸条检测10mg/kg涕灭威、灭多威、甲萘威、异丙威、仲丁威、速灭威等其他氨基甲酸酯类农药时,试纸条上显示出t线显色比c线显色深或与c线显色一致,呈阴性,说
明本试纸条对这些药物无交叉反应。
[0098]
4、与仪器方法比对试验
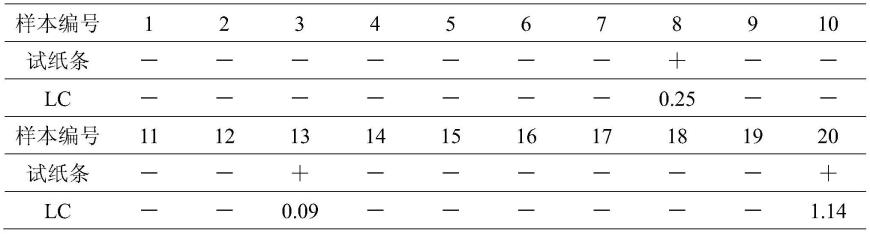
[0099]
取抱子甘蓝、豇豆、大白菜、苹果、梨、橘样本各20份,编号1-20号,使用本试纸条与仪器检测方法进行对比检测,仪器方法参照:“ny/t 761-2008蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定”(检出限为0.01mg/kg),本试纸条抱子甘蓝、豇豆、大白菜、苹果、梨、橘样本中克百威含量低于0.02mg/kg,视为未检出,用“-”表示,高于0.02mg/kg的样品仪器方法用实际结果表示,试纸条检测结果用“+”表示,结果见下表。
[0100]
表1抱子甘蓝样本试纸条与仪器方法检测结果比较(mg/kg)
[0101][0102]
表2豇豆样本试纸条与仪器方法检测结果比较(mg/kg)
[0103][0104]
表3大白菜样本试纸条与仪器方法检测结果比较(mg/kg)
[0105][0106][0107]
表4苹果样本试纸条与仪器方法检测结果比较(mg/kg)
[0108]
[0109]
表5梨样本试纸条与仪器方法检测结果比较(mg/kg)
[0110][0111]
表6橘样本试纸条与仪器方法检测结果比较(mg/kg)
[0112][0113]
由上表可知,试纸条检测结果与仪器检测结果相吻合。
[0114]
尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1