硫辛酰化修饰位点的定量化学蛋白质组学方法
1.本技术涉及化学蛋白质组领域,尤其涉及硫辛酰化修饰位点的定量化学蛋白质组学方法。
背景技术:
2.硫辛酰化修饰是一种通过酰胺键将硫辛酸共价连接到蛋白质赖氨酸残基上的翻译后修饰(posttranslational modification,简称ptm),它是核心代谢途径(例如丙酮酸脱氢酶复合物、酮戊二酸脱氢酶复合物和支链酮酸脱氢酶复合物)中几种蛋白质复合物的活性中心,其作为关键的辅因子发挥着重要的催化作用。其中,丙酮酸脱氢酶复合物(pdh)是一种多功能酶复合物,其二氢硫辛酰胺转乙酰酶(e2)亚基上的硫辛酸中的两个硫原子通过氧化还原循环在二硫键与巯基之间相互转换,完成酰基转移、电子传递等催化过程,实现催化丙酮酸转化为乙酰辅酶a,至此将糖酵解过程与三羧酸循环联系起来。pdh的失调会导致人类产生代谢紊乱、癌症、和阿尔茨海默病等疾病。因此,推进对硫辛酰化修饰调节的理解对于研究这些疾病的潜在的分子机制具有重要的意义。
3.硫辛酰化修饰在进化上高度保守,在大肠杆菌和哺乳动物蛋白质组中分别只发现了3和5个硫辛酰化修饰蛋白(5和6个硫辛酰化修饰位点)。早期工作主要通过结构和生化的方法,如蛋白质免疫印迹、核磁共振图谱、氨基酸测序等对单个蛋白的硫辛酰化修饰进行研究。
4.而最新的基于质谱的方式也提供了研究不同细胞类型、组织和生物环境中特定赖氨酸残基的硫辛酰化修饰状态的手段。2019年kajimura课题组整合抗硫辛酰化修饰抗体免疫沉淀方法和质谱的方法,对小鼠肩胛间棕色脂肪组织中的硫辛酰化修饰蛋白质进行鉴定。然而,由于抗体有限的结合,其亲和力不足以在严格的变性和洗涤条件下一直存在,并无法实现对所有的硫辛酰化修饰蛋白进行鉴定。在2021年,xing chen课题组整合基于碘乙酰胺辅助脂酸环辛炔连接(ilcl)的标记和质谱的方法,实现对大肠杆菌和小鼠细胞系中所有硫辛酰化修饰蛋白质进行鉴定。然而,该技术并未发展成为能够对硫辛酰化修饰位点进行鉴定的方法。而2014年,cristea课题组通过靶向质谱的分析技术选择性反应监测准确地检测和量化不同生物样品中的硫辛酰化修饰水平,从而实现在体外和体内测量去硫辛酰化酶sirt4的活性。靶向蛋白质质谱的分析已经成功地用于检测人类中的丙酮酸脱氢酶复合物中硫辛酰化修饰位点的定量。然而,目前所有技术均无法在蛋白质组水平上对所有的硫辛酰化修饰进行定量。因此,到目前为止,仍然缺乏一种特异性地用于全局分析蛋白质组中硫辛酰化修饰位点的定量方法。
技术实现要素:
5.为了特异性地定量蛋白质组中所有的硫辛酰化修饰位点,本技术提供硫辛酰化修饰位点的定量化学蛋白质组学方法,通过采用含醛基与炔基的探针对生物样品的蛋白质组中硫辛酰化修饰进行化学选择性标记;再利用定量化学蛋白质组学技术,对化学选择性标
记后的位点进行定量分析,可实现对生物样品中所有的硫辛酰化修饰位点的鉴定与定量;从而为研究硫辛酰化修饰对蛋白质结构和功能的影响提供分析工具,有利于推进硫辛酰化修饰对于相关疾病的分子机制的研究。
6.在一方面本技术提供一种硫辛酰化修饰位点的定量化学蛋白质组学方法,包括:
7.采用含醛基与炔基的探针对生物样品的蛋白质组进行硫辛酰化修饰的化学选择性标记;通过定量化学蛋白质组学技术,对化学选择性标记后的位点进行定量分析。
8.在一个实施方案中,所述生物样品包括:所述生物样品包括:大肠杆菌、酵母细胞、人源细胞系、人组织样本、人体器官、小鼠细胞系、小鼠组织样本、小鼠器官、果蝇细胞系、斑马鱼细胞系或线虫细胞系。
9.在一个实施方案中,所述生物样品还包括:动物的体液(如尿、血、唾液、胆汁、胃液、淋巴液及生物体的其他分泌液等)、毛发、肌肉和一些组织器官(如胸腺、胰腺、肝、肺、脑、胃、肾等)以及各种微生物。
10.在一个实施方案中,所述含醛基与炔基的探针的结构为:
[0011][0012]
n=1-9,n为整数。
[0013]
在一个实施方案中,所述含醛基与炔基的探针为炔基丁醛探针(butyraldehyde probe,简称bap),其结构为:
[0014][0015]
在一个实施方案中,合成炔基丁醛探针的步骤包括:依次加入二氯甲烷、戴斯马丁(dess-martin periodinane)试剂,在冰浴中搅拌,使其完全冷却;加入5-己炔-1-醇,之后搅拌、冷却、超滤、旋蒸,用5:1的环己烷:乙醚进行柱色谱法纯化得到炔基丁醛探针。
[0016]
在一个实施方案中,所述合成炔基丁醛探针的步骤包括:在圆底烧瓶中加入10-30ml的二氯甲烷,之后再加入1.2-3.2g的dess-martin periodinane试剂,在冰浴中搅拌5-15min,使其完全冷却。之后用恒压注射器加入0.3-0.7ml的5-己炔-1-醇。之后搅拌过夜。第二天在冰上进行冷却。用超滤在砂芯漏斗,其中覆盖一层硅胶,中过滤掉多余的dess-mart in periodinane,2-8℃进行旋蒸,去掉多余的溶剂,之后用5:1的环己烷:乙醚进行柱色谱法纯化,最终得到的炔基丁醛探针。
[0017]
在一个实施方案中,所述定量分析包括生物样品预处理和质谱分析,所述生物样品预处理步骤包括:对化学选择性标记后的蛋白进行点击化学反应,沉淀蛋白,链霉亲和素珠富集和烷基化,酶切,二甲基化定量步骤,酸切。
[0018]
在一个实施方案中,所述点击化学反应步骤包括:将蛋白沉淀复溶到sds的pbs(溶有sds的pbs溶液)溶液中,加入酸切富集标签(dialkoxydiphenylsilane,简称dadps),cuso4,tbta三[(1-苄基-1h-1,2,3-三唑-4-基)甲基]胺和tcep(三(2-羧乙基)膦)在室温下进行点击化学反应。
[0019]
在一个实施方案中,沉淀蛋白步骤包括:在反应体系中加入甲醇、氯仿和去离子
水,室温离心沉淀蛋白,用冷甲醇洗2次沉淀。
[0020]
在一个实施方案中,链霉亲和素珠富集步骤包括:将蛋白沉淀复溶在的sds的pbs中,加到链霉亲和素珠中,最终的体系为0.2%sds的pbs,在29℃下进行富集,之后离心,弃去上清。分别用的pbs洗涤链霉亲和素珠三次,再用去离子水洗涤三次去除sds与非特异性吸附蛋白。
[0021]
在一个实施方案中,烷基化步骤包括:将链霉亲和素珠转移到screw-top eppendorf管中,加入urea的pbs(溶有尿素的pbs)。之后加入dtt(二硫苏糖醇)在37℃反应。加入iaa(碘乙酰胺)在35℃反应,使得dtt打开的二硫键全部反应上iaa,以防止再次结合形成二硫键。
[0022]
另外需要说明的是,关于本技术涉及的探针只要其具有能与硫辛酸反应的官能团以及用于铜催化的点击化学反应的基团,碳数在一定的范围(包括苯环)内都属于本技术探针合成的构思,都在本技术的保护范围内。
[0023]
在一个实施方案中,当生物样品为大肠杆菌时,对odo2蛋白(二氢硫辛酰胺琥珀酰转移酶(dihydrolipoyllysine succinyltransferase(escherichia coli),简称odo2)、gcsh蛋白(甘氨酸裂解系统h蛋白glycine cleavage system h protein,简称gcsh)位点进行定量分析中预处理的酶切步骤包括:
[0024]
使用溶解于碳酸氢铵溶液的v8蛋白酶(glu-c蛋白酶)进行酶切。
[0025]
在一个实施方案中,当生物样品为大肠杆菌时,对大肠杆菌中odp2蛋白(大肠杆菌氢硫辛酰胺乙酰转移酶dihydrolipoyllysine acetyltransferase(escherichia coli),简称odp2)的三个位点进行定量分析中预处理的酶切步骤包括:
[0026]
加入溶解于磷酸盐缓冲溶液的胰蛋白酶进行酶切。在酸切步骤之后,再次使用溶解于碳酸氢铵溶液的v8蛋白酶进行酶切。
[0027]
在一个实施方案中,对探针修饰后的大肠杆菌预处理步骤包括:
[0028]
获取冻存的大肠杆菌,加入sds的abs溶液中,超声裂解细胞;其中,abs溶液的配方为:将20.55ml 0.2m磷酸氢二钠和79.45ml 0.1m的柠檬酸混合,得到100ml ph=3的酸性缓冲溶液(acid buffer solution,简称abs);离心,取上清,调整上清蛋白浓度;将上清蛋白分为三组,其中两组上清蛋白为bap组,加入tcep反应后,加入bap探针;另一组上清蛋白为dmso组,加入tcep反应后,加入等量的dmso作为对照;依次进行沉淀、点击化学反应、链霉亲和素珠富集和烷基化和酶切等。
[0029]
如果对大肠杆菌中odo2、gcsh的硫辛酰化修饰进行定量,则所述酶切的步骤为:向体系中加入溶于碳酸氢铵溶液的v8蛋白酶,酶切完全之后,依次用碳酸氢铵、去离子水进行洗涤;之后进行二甲基化定量步骤和酸切步骤。
[0030]
如果对大肠杆菌中odp2的三个硫辛酰化修饰进行定量,则所述酶切的步骤为:向体系中加入溶有尿素(urea)、pbs、cacl2的溶液,以及胰蛋白酶,酶切完全,依次用碳酸氢铵、去离子水进行洗涤;之后进行二甲基化定量步骤和酸切步骤。再次进行二次酶切:加入溶于碳酸氢铵溶液的v8蛋白酶进行酶切。
[0031]
二甲基化定量步骤:当样品数为3时,将三组蛋白样品按照轻标、中标和重标进行标识;在轻标样品中,加入hcho和nabh3cn;在中标样品中,加入dcdo和nabh3cn;在重标样品中,加入d
13
cdo和nabd3cn,将三组样品分别依次用teab(三乙基碳酸氢铵)、去离子水进行洗
涤,链霉亲和素珠按1:1:1进行混合,再进行洗涤。
[0032]
当样品数为2时,将三组蛋白样品按照轻标和重标进行标识;在轻标样品中,加入hcho和nabh3cn;在重标样品中,加入d
13
cdo和nabh3cn,将三组样品分别依次用teab、去离子水进行洗涤,链霉亲和素珠按1:1进行混合,再进行洗涤。
[0033]
酸切的步骤:加入甲酸-质谱水进行酸切,酸切完全后将酸切的上清液进行合并,旋干保存,进行质谱分析。
[0034]
在一个实施方案中,当生物样本为人源细胞系时,对人源细胞系中所有的位点进行定量分析中预处理的酶切步骤包括:
[0035]
加入溶解于磷酸盐缓冲溶液的胰蛋白酶和v8蛋白酶同时进行酶切。
[0036]
在一个实施方案中,在人源细胞系中所有的硫辛酰化修饰位点进行定量分析中预处理的步骤包括:
[0037]
获取冻存的人源细胞系,加入sds的abs溶液中,超声裂解细胞;离心,取上清,调整上清蛋白浓度;依次加入tcep、bap探针反应,待反应完全,依次进行沉淀、点击化学反应、链霉亲和素珠富集和烷基化和酶切等;向体系中加入溶有urea的pbs溶液、胰蛋白酶进行酶切,依次用pbs、去离子水进行洗涤,向体系中加入含有urea的碳酸氢铵溶液,再加入v8蛋白酶酶进行酶切,依次用碳酸氢铵、去离子水进行洗涤,加2%甲酸-质谱水进行酸切,所用酸切富集标签为cy58;将酸切的上清液进行合并,旋干保存,进行质谱分析。
[0038]
在一个实施方案中,当生物样本为人源细胞系时,在酸切步骤中使用cy58酸性可切割标签进行切割,所述cy58结构式如下:
[0039][0040]
在一个实施方案中,cy58还可用以下结构式的酸性可切割标签代替,其可代表“带有额外带正电基团的酸性可切割标签”在硫辛酰化修饰之中的应用,结构如下所示:
[0041][0042]
其中x代表带有正电的官能团,其中x包括但不限于伯、仲、叔脂肪胺中的氮原子,氮-氮双取代脒基中的亚氨氮原子、四氮取代胍基中的亚氨氮原子、至少含一个未取代氢原子的脒基氮原子、至少含一个未取代氢原子的胍基氮原子等。
[0043]
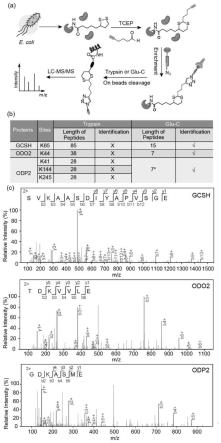
在一个实施方案中,cy58的合成步骤如下:
[0044][0045]
在一方面,所述的硫辛酰化修饰位点的定量化学蛋白质组学方法中所述的化合物cy56,cy57,cy58,结构式如下:
[0046][0047]
在一个实施方案中,当所述生物样品为大肠杆菌时,所述硫辛酰化修饰位点的定量化学蛋白质组学方法可鉴定和定量出大肠杆菌蛋白质组中五个硫辛酰化修饰位点;或,
[0048]
当所述生物样品为人类蛋白质组样品时,所述硫辛酰化修饰位点的定量化学蛋白质组学方法可鉴定和定量出人源细胞系蛋白质组中六个硫辛酰化修饰位点。
[0049]
需要说明的是本技术涉及的温度条件(比如-80℃、-20℃、4℃、20℃等),都是范围温度值,只要该温度能达到本技术涉及的实验目的比如冻存、融化等,任何此类范围温度值皆落入本技术的保护范围。
[0050]
本技术涉及的离心条件(比如转速、时间、温度等),其只要能达到本技术涉及的离心目的,都只是本技术涉及离心条件的简单变换,都属于本技术的保护范围。
[0051]
在一个实施方案中,本技术涉及的洗涤试剂,不仅限于pbs或去离子水,也可为其它洗涤试剂。
[0052]
在一个实施方案中,预处理后的生物样品需进行质谱分析,质谱采用lc-ms/ms,lc-ms/ms数据分析采用prolucid,并设置了半胱氨酸残基上的固定修饰和甲硫氨酸残基的可变修饰。
[0053]
在一个实施方案中,预处理后的生物样品需进行质谱分析,质谱采用lc-ms/ms,
lc-ms/ms数据分析采用prolucid,并设置了半胱氨酸残基上的固定修饰为+57.0215da和甲硫氨酸残基的可变修饰+15.9949da;
[0054]
在鉴定牛血清白蛋白(bsa)和大肠杆菌中硫辛酰化修饰可变修饰时:赖氨酸上增加411.20132da,在鉴定人源细胞系中的硫辛酰化修饰可变修饰时:赖氨酸上增加511.26508da。
附图说明
[0055]
为了更清楚地说明本技术的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0056]
图1为在小分子反应模型中测试bap的反应性,(a)硫辛酸(la)在ph=3的酸性缓冲体系中与bap反应,形成连接产物la-bap,在反应之前,加入tcep以还原la中的二硫键;(b)la和bap之间反应的lc-ms分析,在270nm处测量la和la-bap的吸光度;(c)la-bap质谱显示产物的理论分子量为285.1;保留时间(retention time)。
[0057]
图2为用炔基丁醛探针(bap)对纯化蛋白进行硫辛酰化修饰的化学选择性标记;(a)bap捕获硫辛酰化修饰的反应方案;(b)bap标记硫辛酰化修饰牛血清白蛋白(bsa)的实验流程。bsa与nhs-la反应形成硫辛酰化修饰的bsa,用bap标记,可以通过凝胶内荧光成像或通过lc-ms/ms分析;(c)凝胶电泳后bap标记的bsa的荧光成像和考马斯蓝染色;(d)展示其中一张经典的ms/ms谱图:lsqk*fpl的ms/ms谱图,相应的b和y离子被标记;凝胶荧光成像(rho),考马斯亮蓝(cbb),相对强度(relative intensity),质核比(m/z)。
[0058]
图3为鉴定大肠杆菌蛋白质组中的硫辛酰化修饰位点;(a)使用基于质谱的串联正交蛋白水解策略鉴定硫辛酰化修饰位点的示意图;(b)使用胰蛋白酶或glu-c鉴定大肠杆菌蛋白质组中硫辛酰化修饰的结果比较,*表示odp2中的三个硫辛酰化修饰位点在glu-c消化后产生相同的硫辛酰化修饰肽;(c)glu-c酶切后大肠杆菌三个硫辛酰化修饰肽的ms/ms谱图;相应的b和y离子被标记。
[0059]
图4为通过二甲基化评估发展的质谱方法对硫辛酰化修饰的定量准确性;(a)基于质谱的硫辛酰化位点分析与二甲基标记相结合的流程图;(b)gcsh、odo2和odp2中提取的一级色谱图和硫辛酰化肽的定量比率,odp2中三个硫辛酰化修饰肽在glu-c酶切后具有相同的序列;(c)三次实验重复的大肠杆菌蛋白质组中硫辛酰化修饰位点的定量准确性,(d)提取的一级色谱图和odp2中三个硫辛酰化修饰位点下游特征肽的定量比率,可用作“替代肽”以定量odp2中各个位点的硫辛酰化修饰水平;在(b)和(d)中,蛋白质名称和肽序列显示在顶部,定量比率(r
l/m
和r
h/m
)显示在下面;(e)来自三次实验的大肠杆菌蛋白质组中odp2的硫辛酰化位点的定量准确性。
[0060]
图5为odp2中三个硫辛酰化修饰位点的定量分析;(a)使用串联酶切流程,基于odp2下游特征序列区分和定量odp2中三个进化上保守的硫辛酰化修饰位点的工作流程,胰蛋白酶消化后,肽n末端和赖氨酸的ε-氨基通过还原二甲基化进行同位素标记,随后的glu-c酶切将特征的“替代肽”释放,利用odp2中每个硫辛酰化修饰位点下游的肽段进行定量;(b)通过对野生型和odp2突变株之间的硫辛酰化修饰进行二甲基化定量,来探索odp2中三个硫辛酰化修饰位点调控的工作流程,突变菌株包括odp2敲除(δodp2)的菌株与单个突变
体(k41r、k144r、k245r)或它们的成对组合(双突变体)的odp2外源表达的菌株;(c)在odp2敲除或硫辛酰化修饰赖氨酸的单突变或双突变后odp2中三个位点中每一个硫辛酰化修饰水平的定量,进行三次生物学重复。
[0061]
图6为大肠杆菌中硫辛酰化合酶遗传扰动后硫辛酰化修饰的定量;(a)图为大肠杆菌中蛋白质硫辛酰化修饰的生物合成途径,包括从头合成途径和直接合成途径,关键的硫辛酰合酶有颜色,包括lipa、lipb和lpla;(b)在常规lb培养基中敲除单个或双个不同硫辛酰化合酶后五个已知的硫辛酰化修饰位点水平的定量;(c)在以葡萄糖为唯一碳源的条件培养基中敲除单个不同的硫辛酰合酶后五个已知硫辛酰化修饰位点水平的定量;在(b)和(c)中,热图颜色深浅对应于敲除和野生型菌株之间的量化比率。
[0062]
图7为人类蛋白质组中硫辛酰化修饰位点的定量分析;(a)所有六种硫辛酰化修饰肽的序列以及使用dadps与cy58进行鉴定的结果比较;(b)dadps和cy58的结构;(c)用于在敲除硫辛酰合酶lias后定量人类癌细胞系中硫辛酰化修饰水平变化的工作流程;(d)通过sirna敲低lias后,人类细胞中六个已知硫辛酰化修饰位点水平的定量;(e)使用azide-2k-peg质量标签,检测由蛋白质硫辛酰化修饰引起的内源性gcsh的质量转移,虚线和实线箭头分别表示未修饰和带有硫辛酰化修饰的蛋白质;(f)基于有无质量转移gcsh的免疫印迹方法定量k562和hepg2细胞中gcsh的硫辛酰化修饰化学计量。
[0063]
图8为化合物cy56化学表征,(a)1h nmr图谱;(b)
13
c nmr图谱;(c)傅里叶变换高分辨质谱。
[0064]
图9为化合物cy57化学表征,(a)1h nmr图谱;(b)
13
c nmr图谱;(c)傅里叶变换高分辨质谱。
[0065]
图10为化合物cy58化学表征,(a)1h nmr图谱;(b)
13
c nmr图谱;(c)傅里叶变换高分辨质谱。
具体实施方式
[0066]
下面将详细地对实施例进行说明,其示例表示在附图中。下面的描述涉及附图时,除非另有表示,不同附图中的相同数字表示相同或相似的要素。以下实施例中描述的实施方式并不代表与本技术相一致的所有实施方式。仅是与权利要求书中所详述的、本技术的一些方面相一致的系统和方法的示例。
[0067]
实施例1:开发用于化学选择性标记硫辛酰化修饰的炔基丁醛探针
[0068]
本技术实施例首先设计并合成了一个炔基丁醛探针,它包含一个与硫辛酸(lipoic acid,简称la)反应的醛基和一个用于铜催化的点击化学反应的生物正交炔烃基团(参见图1中a)。首先申请人在小分子模型中,在酸性条件下评估了bap与la的反应性。lc-ms分析检测到预期产物la-bap(参见图1中b),其对应的分子量为286da(参见图1中c)。
[0069]
bap的合成步骤如下:
[0070]
在50ml的圆底烧瓶中加入20ml的二氯甲烷,之后再加入2.2g的dess-martin periodinane试剂,在冰浴中搅拌10min,使其完全冷却。之后用恒压注射器加入0.56ml的5-己炔-1-醇。之后搅拌过夜。第二天在冰上进行冷却。用超滤在砂芯漏斗,其中覆盖一层硅胶过滤掉多余的dess-martin periodinane,4℃进行旋蒸,去掉多余的溶剂。之后用5:1的环己烷:乙醚进行柱色谱法纯化。最终得到的bap的量为350mg,理论产率为92%。1h nmr
(400mhz,chloroform-d)δ9.81(s,1h),2.64-2.60(m,2h),2.30-2.26(m,2h),1.99(t,j=2.6hz,1h),1.86(p,j=7.0hz,2h)。
[0071]
实施例2:用炔基丁醛探针对纯化蛋白进行硫辛酰化修饰的化学选择性标记
[0072]
本技术实施例测试了bap对纯蛋白质上的硫辛酰化修饰进行标记。通过合成了硫辛酸的n-羟基琥珀酰亚胺酯(nhs-la)(参见图2中a),并将其与牛血清白蛋白(bsa)一起孵育以生成硫辛酰化修饰bsa(la-bsa),通过凝胶荧光标记(参见图2中b)。在存在2mm bap的情况下,仅在la-bsa样品中检测到荧光信号,而在阴性对照中未检测到(参见图2中c)。
[0073]
为了进一步证实bap和la-bsa之间的反应,申请人进一步制备了质谱样品,并通过液相色谱-串联ms(lc-ms/ms)进行分析,成功地鉴定到所有的硫辛酰化修饰位点(参见图2中d)。总之,这些结果表明bap可以化学选择性地标记小分子和纯化蛋白质中的硫辛酰化修饰。
[0074]
nhs-la的合成步骤如下:
[0075]
将硫辛酸(206mg,1mmol)和n-羟基琥珀酰亚胺(115mg,1mmol)溶解于25ml thf中。将用5ml thf稀释n
’‑
二异丙基碳二亚胺(0.15ml,1mmol),然后逐滴添加到反应混合物中,反应在室温下搅拌过夜。二异丙基脲在反应过程中从溶液中析出,并通过过滤去除。滤液通过旋转蒸发器在真空下浓缩,获得黄色固体,称重为5.5g,最终得到的理论产率为93%产率。(400mhz,chloroform-d)δ3.60-3.57(m,1h),3.24-3.07(m,2h),2.84(s,4h),2.63(t,j=7.4hz,2h),2.51-2.44(m,1h),1.97-1.89(m,1h),1.85-1.67(m,4h),1.61-1.54(m,2h)。
[0076]
实施例3:鉴定大肠杆菌蛋白质组中的硫辛酰化修饰位点
[0077]
本技术实施例进一步利用bap在大肠杆菌蛋白质组中鉴定硫辛酰化修饰位点。在大肠杆菌中的三种硫辛酰化修饰蛋白中有五个已知的硫辛酰化修饰位点,其中二氢硫辛酰胺乙酰转移酶(dihydrolipoyllysine acetyltransferase(escherichia coli),简称odp2)中有三个,二氢硫辛酰胺琥珀酰转移酶(dihydrolipoyllysine succinyltransferase(escherichia coli),简称odo2)中有一个,甘氨酸裂解系统h蛋白(glycine cleavage system h protein,简称gcsh)中有一个。基于串联正交蛋白质水解的活性蛋白质分析技术(tandem orthogonal proteolysis
–
activity-based protein profiling,简称top-abpp),所述top-abpp技术可参考以下两篇参考文献:文献1:speers,a.e.&cravatt,b.f.a tandem orthogonal proteolysis strategy for high-content chemical proteomics.j am chem soc 127,10018-10019(2005)。文献2:weerapana,e.,speers,a.e.&cravatt,b.f.tandem orthogonal proteolysis-activity-based protein profiling(top-abpp)-a general method for mapping sites of probe modification in proteomes.nat protoc 2,1414-1425(2007)。
[0078]
top-abpp采用标准的化学蛋白质组学流程(参见图3中a),当用蛋白质组学常规使用的胰蛋白酶trypsin进行酶切时无法鉴定这些硫辛酰化修饰肽的序列。这主要存在以下技术困难:
①
经过胰蛋白酶trypsin酶切产生的硫辛酰化修饰的肽段长度太长而无法通过常规lc-ms/ms识别。
②
硫辛酰化修饰位点的赖氨酸两侧有多个天冬氨酸(d)和谷氨酸(e),这将进一步降低硫辛酰化修饰肽段在正离子模式下的质谱分析。
[0079]
为了克服这个技术难点,申请人利用glu-c可以水解d和e羧基端的肽键的特性,进一步在标准化学蛋白质组流程中用glu-c代替trypsin。最终在成功鉴定了来自大肠杆菌中
三种底物蛋白中所有硫辛酰化修饰肽(参见图3中b),这一结果得到了ms/ms谱图(参见图3中c)的支持。
[0080]
实施例4:大肠杆菌蛋白质组中硫辛酰化的位点特异性定量流程建立
[0081]
在建立识别大肠杆菌中已知硫辛酰化位点的工作流程后,本技术实施例评判该流程的定量准确性。选择还原二甲基化作为定量标记方法,将大肠杆菌裂解物均等分为三份,其中两份用20mm bap标记,一份用dmso处理(参见图4中a)。三个样品按照top-abpp工作流程,glu-c消化后的硫辛酰化肽分别用轻、中和重二甲基化试剂(对于dmso、bap和bap处理的样品)进行同位素标记。将二甲基化肽用于lc-ms/ms分析,定量结果显示,对于来自三种硫辛酰化蛋白质所有硫辛酰化肽的比值,平均中标/重标比接近1,这证实了定量的准确性。而几乎已经检测不到轻标组的信号,这证实了该方法的特异性。(参见图4中b和图4中c)。
[0082]
与gcsh和odo2中硫辛酰化修饰肽具有独特序列的不同,odp2中的三个硫辛酰化位点在glu-c切割后具有完全相同的序列。为了区分odp2中的这三个硫辛酰化位点,本技术实施例修改了流程,利用硫辛酰化的下游特征序列进行定量。
[0083]
更具体地做了一部分改进:在bap标记并通过与dadps进行了铜催化的点击反应之后,富集的odp2首先被trypsin酶切,然后用glu-c串联酶切,从而释放出三个硫辛酰化位点的c端侧下游的特征序列(参见图5中a),然后将这些“替代”的肽段进行二甲基化定量。结果表明通过“替代”的肽段,odp2中这三个硫辛酰化修饰位点可以被成功区分和准确定量,其平均中标/重标比接近1,这证实了定量的准确性(参见图4中d和图4中e)。最终,大肠杆菌中所有五个已知的硫辛酰化修饰位点都可以被该技术区分鉴定与定量。
[0084]
对大肠杆菌中odo2、gcsh的硫辛酰化修饰进行定量步骤:
[0085]
取出-80℃冰箱冻存的k12大肠杆菌,加入1.2%sds的abs溶液中,超声裂解细胞。其中abs溶液的配方为:将20.55ml的0.2m na2hpo4和79.45ml的0.1m的柠檬酸混合,可以得到100ml ph=3的酸性缓冲溶液(acid buffer solution,简称abs)。在20℃条件下20000g离心1h。
[0086]
探针反应:一共有三组蛋白样品:两组蛋白质样品(bap组)加入10mm的tcep反应30min之后,加入20mm的bap探针。在37℃下反应12h。另一组蛋白质组溶液(dmso组)加入10mm的tcep反应30min之后,加入等量的dmso作为对照。进行后续的沉淀,点击化学反应,链霉亲和素珠富集和烷基化步骤。酶切的步骤:向体系中加入100μl溶有1m urea的100mm碳酸氢铵溶液,再加入4μg v8蛋白酶,在37℃下酶切12h。12h之后,用1ml的100mm碳酸氢铵进行洗涤三遍,再用1ml的去离子水洗涤三遍。
[0087]
二甲基化定量步骤:将本技术实施例中上述的三组蛋白样品按照轻标,中标和重标进行标识。在轻标样品中,每100μl的teab中加入8μl 4%的轻标甲醛(hcho)和8μl0.6m nabh3cn;在中标样品中,每100μl的teab中加入8μl 4%的中标甲醛(dcdo)和8μl 0.6m nabh3cn;重标样品中,每100μl的teab中加入8μl 4%的重标甲醛(d
13
cdo)和8μl 0.6m nabd3cn,在25℃反应2h。2h后,将三组样品分别用teab进行洗涤两遍,再用去离子水进行洗涤两遍,链霉亲和素珠按1:1:1进行混合,再用去离子水洗两次。
[0088]
酸切:加入200μl的2%甲酸-质谱水进行酸切1h,重复两遍。将酸切的上清液进行合并,旋干之后,样品保存在-20℃,进行质谱分析。
[0089]
所有本技术实施例出现的后续的沉淀,点击化学反应,链霉亲和素珠富集和烷基
化步骤如下所示:
[0090]
点击化学反应步骤:将蛋白沉淀复溶到0.4%sds的pbs溶液中。然后加入100μm酸切富集标签dadps,1mm的cuso4,100μm tbta和1mm tcep在室温下进行点击化学反应1h。
[0091]
沉淀蛋白步骤:在反应体系中加入400μl甲醇、100μl氯仿和300μl的去离子水,10000g室温离心10min沉淀蛋白,用-80℃的冷甲醇洗2次沉淀。
[0092]
链霉亲和素珠富集步骤:将蛋白沉淀复溶在1ml 1.2%的sds的pbs中,加到5ml pbs的链霉亲和素珠中,使得最终的体系为0.2%sds的pbs,在29℃下进行富集4h。4h之后,1700g离心3min,弃去上清。之后分别用5ml的pbs洗涤链霉亲和素珠三次,再用5ml的去离子水洗涤三次去除sds与非特异性吸附蛋白。
[0093]
烷基化步骤:将链霉亲和素珠转移到1.5ml的screw-top eppendorf管中,加入500μl 6m urea的pbs。之后加入10mm dtt在37℃反应30min。再加入20mm iaa在35℃反应30min,使得dtt打开的二硫键全部反应上iaa,以防止再次结合形成二硫键。
[0094]
对大肠杆菌中odp2的三个硫辛酰化修饰进行定量的步骤
[0095]
取出-80℃冰箱冻存的k12大肠杆菌,加入1.2%sds的abs溶液,超声裂解细胞。在20℃条件下20000g离心1h,取上清,用蛋白定量试剂盒测定蛋白浓度,并最终调整到8mg/ml。一共有三组蛋白样品:两组蛋白质样品(bap组)加入10mm的tcep反应30min之后,加入20mm的bap探针。在37℃下反应12h。另一组蛋白质组溶液(dmso组)加入10mm的tcep反应30min之后,加入等量的dmso作为对照。进行后续的沉淀,点击化学反应,链霉亲和素珠富集和烷基化步骤。
[0096]
酶切的步骤:向体系中加入200μl 1m urea的pbs,2μg胰蛋白酶trypsin酶以及2μl 100mm的cacl2溶液,在37℃下酶切16h。16h之后,用1ml的100mm碳酸氢铵进行洗涤三遍,再用1ml的去离子水洗涤三遍。
[0097]
二甲基化的步骤:将三组蛋白样品按照轻标、中标和重标进行标识;在轻标样品中,加入hcho和nabh3cn;在中标样品中,加入dcdo和nabh3cn;在重标样品中,加入d
13
cdo和nabd3cn,反应完全,将三组样品分别依次用teab、去离子水进行洗涤,链霉亲和素珠按1:1:1进行混合,再进行洗涤。
[0098]
酸切的步骤:加入甲酸-质谱水进行酸切,酸切完全后将所有的样品进行合并。
[0099]
二次酶切的步骤:旋干之后的样品,加入20μl 100mm碳酸氢铵,加入4μg内切蛋白酶v8蛋白酶,在37℃下酶切12h之后,再进行酸切,酸切之后旋干样品,进行质谱分析。
[0100]
实施例5:odp2中三个硫辛酰化修饰位点之间存在部分补偿机制的发现
[0101]
odp2在不同物种中硫辛酰化修饰结构域数量从1到3不等(例如,大肠杆菌中3个,人类中2个)。先前的研究表明,通过基因工程减少硫辛酰结构域的数量会减缓大肠杆菌在含有不同碳源(例如葡萄糖、乳酸、琥珀酸、乙酸)的基本培养基中的生长。另一方面,有研究表明一个硫辛酰结构域足以使odp2在体外行使催化活性。而另外一个有趣的问题是,不知odp2中三个硫辛酰化修饰位点是否相互依赖或独立调节。
[0102]
为了探索上述科学问题,申请人从k12菌株中敲除内源odp2(δodp2)并外源表达野生型(“wt-odp2”)和突变型odp2。突变型odp2包括三个硫辛酰化修饰赖氨酸k41,k144和k245分别突变成r的单突变和它们的成对组合中的双突变组合菌株(分别命名为“k41r-odp2”、“k144r-odp2”、“k245r-odp2”、“k41r/k144r-odp2”、“k41r/k245r-odp2”和“k144r/
k245r-odp2”菌株)氨基酸编号遵从kabat编号。“kabat编号”是指kabat等描述的编号系统,其内容记载于美国卫生和公共服务部,“sequence of proteins of immunological interest”(1983)。
[0103]
然后,通过已建立的硫辛酰化修饰的定量方法比较了野生型和突变菌株之间odp2中每一个的硫辛酰化修饰位点的水平(参见图5中b)。如图5中c所示,结果表明,单个突变体中突变位点的硫辛酰化修饰消失了,同时不影响其余两个位点的硫辛酰化修饰水平。相比之下,双突变体中,除了两个突变位点硫辛酰化修饰消失之外,剩余未突变的位点意外地增加了硫辛酰化修饰。这些结果表明odp2中这三个硫辛酰化修饰位点之间存在部分补偿机制。
[0104]
对大肠杆菌中odp2的三个硫辛酰化修饰进行定量的步骤:
[0105]
所有的步骤与实施例4里的“对大肠杆菌中odp2的三个硫辛酰化修饰进行定量”步骤大致相同。唯一不同的地方在于二甲基化定量步骤。其中轻标的样品分别为“k41r-odp2”、“k144r-odp2”、“k245r-odp2”、“k41r/k144r-odp2”、“k41r/k245r-odp2”和“k144r/k245r-odp2”,重标的样品为“wt-odp2”。将两组蛋白样品按照轻标和重标进行标识;在轻标样品中,加入hcho和nabh3cn;在重标样品中,加入hcho和nabd3cn,反应完全,将两组样品分别依次用teab、去离子水进行洗涤,链霉亲和素珠按1:1进行混合,再进行洗涤。其余的步骤与实施例4里完全一致。
[0106]
实施例6:探索大肠杆菌中硫辛酰合酶的功能
[0107]
硫辛酰化修饰的生物合成途径包含三种独立的硫辛酰化合酶,包括从头合成途径中的辛酸转移酶(octanoyltransferase,简称lipb和硫辛酰化合成酶(lipoyl synthase,简称lipa)以及直接合途径中的硫辛酸蛋白连接酶a(lipoate-protein ligase a,简称lpla)。lipb催化辛酰基基团从辛酰基-acp转移到底物蛋白,然后由lipa在从头合成途径中将硫原子插入到辛酸中,形成硫辛酰化修饰。相反,lpla在直接途径中单独起作用,通过硫辛酰-amp中间体催化硫辛酸向底物蛋白的转移(参见图6中a)。为了评估每种硫辛酰合酶对硫辛酰化修饰的影响,申请人在wt-k12的基础上,构建了相应的敲除菌株(δlipb、δlipa和δlpla),并进行了已建立的硫辛酰化修饰的定量方法,比较敲除和野生型菌株之间每个已知底物位点的硫辛酰化修饰水平。
[0108]
如图6中b所示,敲除lpla不会对硫辛酰化修饰产生显着影响。相反,敲除lipa中所有底物位点的硫辛酰化修饰消失了。这些结果表明,虽然这两种途径在细菌中并行运作,但从头合成途径似乎在硫辛酰化修饰生物合成方面比直接合成途径更重要。
[0109]
尽管lipb和lipa已知在从头合成途径中以串联方式起作用,但lipb的敲除仅部分影响所有底物上的硫辛酰化修饰。这些数据引发了一种猜测,即细菌中可能存在另一种途径,可以绕过lipb的功能并直接产生辛酰化蛋白质。有文献报道,硫辛酰化修饰途径中的lpla可以在体外以atp为底物催化辛酸向底物蛋白的转移,并且在培养基中补充辛酸可能导致lipa和lipb的突变的菌株中硫辛酸结构域的辛酰化。
[0110]
为了进一步测试lpla作为辛酰基转移酶在从头合成途径中的贡献,申请人进一步构建了lipb和lpla的双敲除菌株(δlipb-lpla),旨在阻断所有产生辛酰化蛋白的可能的途径。如图6中b所示,定量结果表明,在双敲除菌株中,所有底物位点的硫辛酰化修饰均被消除,这也支持了lpla可以在从头合成途径中替代lipb作为辛酰基转移酶的功能的观点。
[0111]
鉴于辛酸可以被lipb和lpla在从头合成途径中利用,申请人接下来评估辛酸是否可能对这两种辛酸转移酶产生影响。在以葡萄糖为唯一碳源的培养基中培养野生型和突变型菌株,根据代谢组学分析,发现大肠杆菌在这个营养条件下,辛酸水平显着降低。如图6中c所示,通过化学蛋白质组学对硫辛酰化修饰的定量显示,与之前的结果一致的是,在以葡萄糖为唯一碳源的培养基中,敲除lipa使得底物硫辛酰化修饰完全消失,而敲除lpla很少扰动硫辛酰化修饰。但在此条件下,与完全营养条件不同的是,lipb敲除导致所有位点的硫辛酰化修饰完全丧失。此外,补充外源辛酸可以恢复δlipb菌株中的硫辛酰化修饰。这些数据共同表明,从头合成途径在维持细菌中正常的硫辛酰化修饰水平方面起着主导作用。当lipb缺失时,lpla可以充当辛酰基转移酶,但前提是环境中辛酸供应充足。
[0112]
对大肠杆菌中odo2、gcsh的三个硫辛酰化修饰进行定量的步骤:
[0113]
所有的步骤与实施例4里的“对大肠杆菌中odo2、gcsh的硫辛酰化修饰进行定量”步骤大致相同。唯一不同的地方在于二甲基化定量步骤。其中轻标的样品分别为“δlipb”、“δlipa”、“δlpla”和“δlipb-lpla”,重标的样品为“wt-k12”。将两组蛋白样品按照轻标和重标进行标识;在轻标样品中,加入hcho和nabh3cn;在重标样品中,加入hcho和nabd3cn,反应完全,将两组样品分别依次用teab、去离子水进行洗涤,链霉亲和素珠按1:1进行混合,再进行洗涤。其余的步骤与实施例4里完全一致。
[0114]
对大肠杆菌中odp2的三个硫辛酰化修饰进行定量的步骤:
[0115]
所有的步骤与实施例4里的“对大肠杆菌中odp2的三个硫辛酰化修饰进行定量”步骤大致相同。唯一不同的地方在于二甲基化定量步骤。其中轻标的样品分别为“δlipb”、“δlipa”、“δlpla”和“δlipb-lpla”,重标的样品为“wt-k12”。将两组蛋白样品按照轻标和重标进行标识;在轻标样品中,加入hcho和nabh3cn;在重标样品中,加入hcho和nabd3cn,反应完全,将两组样品分别依次用teab、去离子水进行洗涤,链霉亲和素珠按1:1进行混合,再进行洗涤。其余的步骤与实施例4里完全一致。
[0116]
实施例7:人类蛋白质组中硫辛酰化修饰的位点特异性定量
[0117]
人类蛋白质组中的五种蛋白质中六个已知的硫辛酰化修饰位点。其中,4个在大肠杆菌中有对应的对应位点,包括2个在二氢硫辛酰赖氨酸乙酰转移酶(dihydrolipoyllysine acetyltransferase(mammalian cells),简称dlat)蛋白(odp2的同源蛋白),1个在二氢硫辛酰赖氨酸琥珀酰转移酶(dihydrolipoyllysine succinyltransferase(mammalian cells),简称dlst)蛋白(odo2的同源蛋白),1个在gcsh蛋白。与大肠杆菌不同的是,在人类蛋白质组中,有两个额外的硫辛酰化修饰位点,其中一个是在丙酮酸脱氢酶蛋白x组分(pyruvate dehydrogenase protein x,简称pdhx)中,另一个在支链α-酮酸脱氢酶复合物的硫辛酰胺酰基转移酶(lipoamide acyltransferase,简称dbt)中。
[0118]
当应用与大肠杆菌相同的top-abpp采用标准的化学蛋白质组学流程来分析人类细胞裂解物中的硫辛酰化修饰位点时,该方法只能鉴定到gcsh中的k107位点(参见图5中a)。申请人发现,人类蛋白质组中大多数含有硫辛酰化修饰位点的肽段序列中含有两个酸性氨基酸,这可能会影响正离子模式下lc-ms/ms分析的检测灵敏度。
[0119]
为了研究是否通过引入更多带正电荷的部分,例如氨基,可以有效地抵消酸性羧基并提高硫辛酰化修饰肽的电离效率。因此,申请人通过生物素-聚乙二醇-n-羟基琥珀酰
亚胺酯(biotin-peg-nhs)和fmoc-lys-n3分4步设计并合成了基于dadps的变体酸可切割标签,并命名为cy58(参见图7中b),其在被甲酸裂解后,相比于dadps带有额外的氨基。
[0120]
如图7中a所示,当cy58被引入工作流程以替代dadps时,人类蛋白质组中的所有六个硫辛酰化修饰位点能够被很好地鉴定出来。然后,申请人通过rnai技术敲低了人类细胞中硫辛酰化合酶lias的水平,并定量评估了其遗传扰动将如何影响底物蛋白上的硫辛酰化修饰水平(参见图7中c)。首先申请人通过实时逆转录聚合酶链反应(qpcr)证实了mrna水平的降低。如图7中d所示,化学蛋白质组学定量结果表明,在敲低lias后,dlat、dlst、dbt和gcsh中五个已知硫辛酰化位点的修饰水平降低。遗憾的是,在这些实验中pdhx中的k95硫辛酰化修饰位点没有被量化,可能是由于其低修饰化学计量。
[0121]
鉴于bap可以选择性地标记蛋白质组中的内源性硫辛酰化修饰,它可以与可解析的质量标签策略兼容,可以用来监测底物蛋白上的硫辛酰化修饰化学计量。作为概念验证实验,申请人应用了bap探针和具有分子量约为2,000da(azide-2k-peg)的叠氮化物-peg质量标签,并通过sds/page解决了内源性gcsh上的蛋白化学计量。在用bap处理来自k562和hepg2细胞的裂解物标记硫辛酰化修饰后,通过铜催化的点击化学反应将叠氮化物-2k-peg质量标签与硫辛酰化修饰蛋白质结合,并通过使用基于抗gcsh抗体的免疫印迹分析样品。结果显示gcsh有明显的条带位移,这是质量标签标记的硫辛酰化修饰(参见图7中e)。基于条带强度,gcsh上的硫辛酰化修饰化学计量分别测量出k562细胞中gcsh硫辛酰化修饰的化学计量为62%,而hepg2细胞中gcsh硫辛酰化修饰的化学计量的30%(参见图7中f)。硫辛酰化修饰化学计量中细胞类型特异性差异的原因仍有待研究。
[0122]
人源细胞系中对硫辛酰化修饰进行定量步骤:
[0123]
取出-80℃冰箱冻存的人源细胞系,加入1.2%sds的abs溶液中,超声裂解细胞。在20℃条件下20000g离心1h,取上清,用蛋白定量试剂盒测定蛋白浓度,并最终调整到10mg/ml。加入10mm的tcep反应30min之后,加入20mm的bap。在37℃下反应12h。与之前在大肠杆菌中所用不同的是,这里所用酸切富集标签为cy58。进行后续的沉淀,点击化学反应,链霉亲和素珠富集和烷基化步骤。
[0124]
在酶切之前,向体系中加入200μl 1m urea的pbs,再加入2μg trypsin酶在37℃下酶切16h。16h之后,用1ml的pbs进行洗涤三遍,再用1ml的去离子水洗涤三遍。向体系中加入100μl溶有1m urea的100mm碳酸氢铵溶液,再加入2μg v8蛋白酶在37℃酶切12h。12h之后,用1ml的100mm碳酸氢铵进行洗涤三遍,再用1ml的去离子水洗涤三遍。
[0125]
二甲基化定量,步骤如下:其中轻标的样品分别为“silias”,重标的样品为“si-negativecontrol”。将两组蛋白样品按照轻标和重标进行标识;在轻标样品中,加入hcho和nabh3cn;在重标样品中,加入hcho和nabd3cn,反应完全,将两组样品分别依次用teab、去离子水进行洗涤,链霉亲和素珠按1:1进行混合,再进行洗涤。加入200μl的2%甲酸-质谱水进行酸切1h,重复两遍。将酸切的上清液进行合并,旋干之后,样品保存在-20℃,进行质谱分析。
[0126]
实施例8:cy58的合成步骤
[0127]
cy58的合成步骤:
[0128][0129]
cy58标签的合成路线和最终产物的nmr(核磁共振)和ms(质谱)确认见“化合物合成和表征”。试剂和条件:(a)et3n,dcm,0℃至室温,12小时;(b)dcc、hobt、dcm、rt、5小时;(c)ph2sicl2,吡啶,室温,12小时,然后是cy56,室温,24小时;(d)哌啶,0℃至室温,5小时。
[0130]
①
cy53的化学合成
[0131]
向化合物cy51(500mg,0.85mmol)在ch2cl2(5ml)中的溶液中加入cy52(77mg,0.87mmol),然后加入et3n(121μl,0.87mmol)。减压蒸发溶剂并将残余物吸收在ch2cl2中并通过硅胶色谱法用ch2cl2:meoh=15:1至5:1纯化,得到cy53(330mg,产率69%)。
[0132]1h nmr(400mhz,chloroform-d)δ7.18(s,1h),6.99(s,1h),6.33(s,1h),5.39(s,1h),4.52(dd,j=7.5,4.8hz,1h),4.33(dd,j=7.4,4.8hz,1h),3.76(t,j=5.8hz,2h),3.65(d,j=3.2hz,12h),3.57(t,j=4.9hz,2h),3.44(d,j=4.5hz,2h),3.27(d,j=5.9hz,2h),3.15(q,j=7.2hz,1h),2.91(dd,j=12.8,4.8hz,1h),2.73(d,j=18.4hz,1h),2.52(t,j=5.8hz,2h),2.24(t,j=7.4hz,3h),1.70(dt,j=13.8,6.5hz,4h),1.43(dt,j=14.5,7.4hz,2h),1.21(s,6h).
13
c nmr(101mhz,chloroform-d)δ173.56,172.32,155.17,70.70,70.40,70.22,70.02,69.97,67.51,61.83,60.19,55.58,50.80,50.31,40.54,39.18,37.05,35.79,28.16,28.06,27.11,27.08,25.62.hrms(esi):calcd for c
25h47
n4o8s[m+h]
+
563.31091,found 563.31071。
[0133]
②
cy56的化学合成
[0134]
将cy55(500mg,1.27mmol)、1-羟基-苯并三唑水合物(hobt)(193mg,1.27mmol)和ch2cl2(25ml)加入烧瓶中。将白色悬浮液冷却至0℃。然后将dcc作为固体添加到悬浮液中。将反应混合物在0℃搅拌30分钟。然后加入cy54(140μl,1.52mmol)。使反应混合物升温至室温并搅拌过夜。通过漏斗过滤反应混合物。有机层用饱和溶液洗涤。加入nahco3(15ml)和盐水(20ml
×
2)。有机层用na2so4干燥,过滤并真空浓缩。通过柱色谱法纯化(ch2cl2:meoh=20:1然后10:1)提供白色固体产物(360mg,产率61.3%)。参见图8,1h nmr(400mhz,chloroform-d)δ7.76(d,j=7.4hz,2h),7.57(d,j=7.2hz,2h),7.35(dt,j=37.7,7.1hz,4h),6.72(s,1h),5.64(d,j=7.7hz,1h),4.50
–
4.31(m,2h),4.24
–
4.03(m,2h),3.61(s,2h),3.26(s,4h),2.40(s,1h),2.00(s,3h),1.82(s,1h),1.57(s,7h).
13
c nmr(101mhz,chloroform-d)δ171.65,156.38,143.70,141.30,127.79,127.11,124.98,120.03,67.06,
62.19,54.85,51.14,47.10,39.34,32.19,29.64,28.47,26.02,22.72.hrms(esi):calcd for c
25h32
n5o4[m+h]
+
466.24488,found466.24483。
[0135]
③
cy57的化学合成
[0136]
在冰浴下在15mlch2cl2中加入ph2sicl2(1.42ml,3.95mmol,5eq)和et3n(0.83ml,10.37mmol,13eq)。逐滴加入在1.5ml ch2cl2中的化合物cy53(443mg,0.79mmol,1eq)。然后使反应混合物升温至室温。12小时后,加入cy56(4.46克,9.32毫摩尔,12.2当量)并搅拌24小时。溶液用ch2cl2萃取,有机层用盐水(20ml
×
3)洗涤。将溶剂用na2so4干燥并在低于30℃的真空中浓缩。通过柱色谱法(meoh:ch2cl2=0:1至1:5)纯化,得到产物cy57,为白色固体(320mg,34%)。参见图9,1h nmr(400mhz,chloroform-d)δ7.75(d,j=7.5hz,2h),7.60(t,j=6.5hz,5h),7.44
–
7.26(m,13h),6.95(s,1h),6.80(s,1h),6.65(t,j=5.7hz,1h),6.30(s,1h),5.96(d,j=8.4hz,1h),5.54(s,1h),4.45
–
4.33(m,2h),4.20(m,2h),3.77
–
3.49(m,22h),3.42
–
3.20(m,8h),3.12
–
3.06(m,1h),2.83(dd,j=12.8,4.9hz,1h),2.67(d,j=12.7hz,1h),2.44(t,j=5.9hz,3h),2.17(t,j=7.4hz,2h),1.39(dd,j=12.8,5.6hz,5h),1.24(d,j=8.5hz,11h).
13
c nmr(151mhz,chloroform-d)δ173.73,172.43,171.69,171.21,164.06,156.34,143.73,141.29,135.82,134.41,129.95,127.74,127.11,125.05,120.01,70.76,70.34,70.16,69.97,69.88,67.50,67.03,62.16,61.87,60.21,55.62,54.83,51.15,50.27,47.11,40.46,39.32,39.15,36.96,35.69,32.24,29.70,29.66,28.47,28.19,28.04,27.05,25.97,25.52,22.70.hrms(esi):calcd for c
62h86
n9o
12
ssi[m+h]
+
1208.58804,found 1208.58837。
[0137]
④
cy58的化学合成
[0138]
在冰浴下将cy57(320mg,0.26mmol)加入6ml ch2cl2中,并滴加20%哌啶(267μl,2.93mmol)。使反应升温至室温。tlc检测反应结束后,溶液用ch2cl2萃取,有机层用盐水(20ml
×
3)洗涤。真空浓缩溶剂并通过快速色谱法(ch2cl2:meoh=1:0至5:1)纯化产物,得到产物cy58,为淡黄色固体(260mg)。参见图10,1h nmr(600mhz,chloroform-d)δ7.55(d,j=7.3hz,4h),7.51(s,1h),7.35(t,j=7.2hz,2h),7.30(t,j=7.3hz,4h),7.20(s,1h),6.96(s,1h),6.57(s,1h),6.25(s,1h),5.39(s,1h),4.42
–
4.35(m,1h),4.25
–
4.17(m,1h),3.67(dd,j=14.0,7.7hz,5h),3.59
–
3.45(m,17h),3.41(s,2h),3.37
–
3.32(m,2h),3.25(d,j=5.9hz,2h),3.22
–
3.15(m,5h),3.05(q,j=6.9hz,1h),2.80(dd,j=12.7,4.7hz,2h),2.64(d,j=12.8hz,2h),2.38(t,j=6.0hz,3h),2.15(t,j=7.3hz,2h),1.77(dp,j=15.5,5.5hz,3h),1.61(s,3h),1.18(s,15h).
13
c nmr(151mhz,chloroform-d)δ172.76,172.48,170.33,162.75,133.82,133.24,129.23,126.87,74.72,69.37,69.35,69.31,69.19,68.94,66.37,61.82,60.81,59.12,54.57,53.72,50.17,49.44,39.51,38.09,37.85,36.01,34.70,32.98,28.68,27.63,27.07,27.01,26.62,24.99,24.53,21.84,21.68,13.11.hrms(esi):calcd for c
47h76
n8o
10
ssi[m+h]
+
986.51996,found986.51929。
[0139]
实施例9:大肠杆菌和人源细胞中硫辛酰化修饰的质谱分析及数据处理
[0140]
在本技术实施例中,都使用thermo fisher公司的q-exact ive plus质谱对本工作的质谱样品进行采集。分析色谱柱内径为75μm内装有1.9μm c18(封端十八烷基硅胶)填料,所用的分析色谱柱的长度为15cm。上样色谱柱内径为100μm内装有5μm c18填料,所用的上样色谱柱的长度为3cm。上样过程的液相流速为3μl/min。洗脱时流速为0.3μl/min。使用
的液相梯度为166min的梯度。具体的色谱梯度设置参见表1,质谱参数参见表2。
[0141]
表-1-166min的色谱梯度
[0142][0143]
表-2-质谱参数设置
[0144][0145][0146]
general setting(常规设置),full ms(完全质谱),dd-ms/dd-sim(二级质谱/选择离子监测),retentiontime(保留时间),run time(运行时间),polarity(极性),default charge(默认设置电荷),resolut ion(分辨率),agc(自动增益),maximum it(最强离子注入时间),scan range(扫描范围),loop count(循环计数),isolation window(隔离窗口),(n)ce/stepped nce(平均碎裂能量),fixed first mass(固定第一质量),minimum agc(最小自动增益),dynamic exclus(动态排除时间)。
[0147]
质谱分析时,所用的液相的流动相,a相是0.1%甲酸水,b相是80%乙腈/水(0.1%甲酸)。lc-ms/ms数据分析使用的是prolucid,并设置了半胱氨酸残基上的固定修饰(+
57.0215da)和甲硫氨酸残基的可变修饰(+15.9949da)。在鉴定bsa和大肠杆菌中硫辛酰化修饰可变修饰是:赖氨酸上增加411.20132da。在鉴定哺乳动物细胞中的硫辛酰化修饰可变修饰是:赖氨酸上增加511.26508da。
[0148]
本技术提供的实施例之间的相似部分相互参见即可,以上提供的具体实施方式只是本技术总的构思下的几个示例,并不构成本技术保护范围的限定。对于本领域的技术人员而言,在不付出创造性劳动的前提下依据本技术方案所扩展出的任何其他实施方式都属于本技术的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1