一种炒鸡内金标准汤剂质量检测方法与流程
1.本发明涉及中药材质量控制技术领域,具体涉及一种炒鸡内金标准汤剂质量检测方法。
背景技术:
2.现代药物需要具有稳定均一、安全和有效的三大特性,中成药在这几个方面难以比拟西药,因此,更需要采用多种手段进行检测,保证检测结果的可靠性和稳定性。鸡内金为脊椎动物雉科家鸡的砂囊角质内膜,炒鸡内金为取净鸡内金,照清炒或烫法炒至鼓起,性味甘平,主治健胃消食,涩精止遗,用于食积不消,呕吐泻痢,小儿疳积,遗尿,遗精。目前,关于炒鸡内金的标准汤剂还未形成一个系统的质量检测方法,仅采用现有的检测手段来检测炒鸡内金汤剂是不够全面的,无法达到中药配方颗粒质量控制要求。因此,建立一种用于药材质量控制的炒鸡内金标准汤剂质量检测方法是十分必要的。
技术实现要素:
3.本发明的目的就是要解决现有技术的不足,提供一种炒鸡内金标准汤剂质量检测方法,以更好的控制炒鸡内金汤剂的质量,表征药物质量,提高药物稳定性。
4.为达到上述目的,本发明的技术方案是这样实现的:
5.本发明提供一种炒鸡内金标准汤剂质量检测方法,包括如下检测方法,
6.通过对炒鸡内金标准汤剂的性状、干浸膏出膏率、薄层鉴别、浸出物、特征图谱及鸟苷含量测定,将标准汤剂含量标准限定为每1g含鸟苷为0.2-1.1mg,其中,干浸膏出膏率测定采用煎煮法进行测定;薄层鉴别采用照薄层色谱法进行鉴别;浸出物采用热浸法测定;特征图谱及鸟苷含量测定均采用液相色谱法测定;
7.采用液相色谱法测定特征图谱包括:进行液相色谱仪分析,以鸡内金对照药材制成的溶液作为参照物溶液b,以鸟苷对照品制成的溶液作为对照品溶液b,以炒鸡内金标准汤剂样品制成的溶液作为供试品溶液b,分别精密吸取参照物溶液b、对照品溶液b和供试品溶液b,分别注入液相色谱仪,测定,即得;其中,采用的色谱条件为,色谱柱:岛津shim-pack gist c18-aq(4.6mmx250mm,5um);流动相:以乙腈为流动相a,以0.1%磷酸溶液为流动相b,按表a的规定进行梯度洗脱;
8.表a梯度洗脱程序
9.[0010][0011]
流速:0.8ml/min;柱温:30℃;进样量:10μl;检测波长:254nm。
[0012]
在其中一实施例中,所述煎煮法包括:取炒鸡内金饮片加水浸泡30-40min,煎煮两次,第一次煎煮时长为30-40min,第二次煎煮时长为25-30min,进行固液分离,浓缩干燥,制得炒鸡内金标准汤剂干膏粉。
[0013]
在其中一实施例中,所述照薄层色谱法包括如下步骤:
[0014]
(1)制备供试品溶液a:取炒鸡内金标准汤剂样品1g,加乙醇20ml,超声处理30min,放冷,滤过,滤液蒸干,残渣加2:1的乙酸乙酯-乙醇的混合溶液1ml使溶解,制得供试品溶液a;
[0015]
(2)制备对照药材溶液a:取鸡内金对照药材2g,加水100ml,煎煮并保持微沸1h,放冷,滤过,滤液蒸干,放冷,残渣加乙醇20ml使溶解,超声处理30min,放冷,滤过,滤液蒸干,残渣加2:1的乙酸乙酯-乙醇的混合溶液1ml使溶解,制得对照品溶液a;
[0016]
(3)进行薄层色谱分析:薄层色谱条件为,薄层板:硅胶g薄层板;点样量:吸取10μl供试品溶液a、5μl对照药材溶液a;展开剂:体积比为10:2:1的三氯甲烷-乙酸乙酯-甲醇溶液;预饱和30min,展距11cm;检视:于紫外光灯365nm下检视。
[0017]
在其中一实施例中,所述热浸法以乙醇为溶剂,采用醇溶性浸出物测定法项下的热浸法测定浸出物范围。
[0018]
在其中一实施例中,采用液相色谱法测定特征图谱还包括如下步骤:
[0019]
(1)制备参照物溶液b:取鸡内金对照药材0.3g,加入10%乙醇25ml,回流30min,放冷,摇匀,滤过,取续滤液,作为参照物溶液b;
[0020]
(2)制备对照品溶液b:取鸟苷对照品适量,精密称定,加50%甲醇溶解,制得浓度为10ug/ml的对照品溶液b;
[0021]
(3)制备供试品溶液b:取炒鸡内金标准汤剂样品0.3g,精密称定,置具塞锥形瓶中,加入精密称定的10%乙醇25ml,密塞,称定重量,超声处理30min,放冷,再称定重量,用10%乙醇补足减失重量,摇匀,滤过,取续滤液作为供试品溶液b。
[0022]
在其中一实施例中,采用液相色谱法测定鸟苷含量包括:进行液相色谱仪分析,以鸟苷对照品制成的溶液作为对照品溶液c,以炒鸡内金标准汤剂样品制成的溶液作为供试品溶液c,分别精密吸取对照品溶液c和供试品溶液c,分别注入液相色谱仪,测定,即得;其中,采用的色谱条件为,色谱柱:岛津shim-pack gist c18-aq(4.6mmx250mm,5um);流动相:以乙腈为流动相a,以0.1%磷酸溶液为流动相b,按规定进行梯度洗脱;流速:0.8ml/min;柱温:30℃;进样量:10μl;检测波长:254nm。
[0023]
在其中一实施例中,采用液相色谱法测定鸟苷含量还包括如下步骤:
[0024]
(1)制备对照品溶液:取鸟苷对照品适量,精密称定,加50%甲醇制成含鸟苷的浓度为10ug/ml的溶液,作为对照品溶液c;
[0025]
(2)制备供试品溶液:取炒鸡内金标准汤剂样品约0.3g,精密称定,置具塞锥形瓶
中,精密加入10%乙醇25ml,密塞,称定重量,超声30min,放冷,再称定重量,用10%乙醇补足减失重量,摇匀,滤过,取续滤液作为供试品溶液c。
[0026]
与现有技术相比,本发明的有益效果是:
[0027]
(1)通过对炒鸡内金标准汤剂的性状、干浸膏出膏率、薄层鉴别、浸出物、特征图谱及鸟苷含量测定进行研究,通过多方面测量,来评定炒鸡内金标准汤剂的质量,为产品的质量稳定奠定坚实的基础,能够建立炒鸡内金汤剂可行的质量标准,实现炒鸡内金标准汤剂质量的有效控制,并且,采用本技术的色谱条件进行液相分析,可以得到分离度更好更清晰的色谱图。
[0028]
(2)炒鸡内金饮片煎煮制得炒鸡内金饮片标准汤剂,鸟苷平均含量为0.64mg/g,测得含量范围为0.420~0.861mg/g,sd(标准差)为0.142,按均值
±
3sd来算,鸟苷含量允许范围为0.21~1.07mg/g,故拟定本标准汤剂的鸟苷含量范围为:0.2mg/g~1.1mg/g;鸟苷平均转移率为84.14%,转移率范围为61.72%~95.11%,sd为9.56,依据《中药配方颗粒质量控制与标准制定技术要求》,鸟苷含量转移率允许范围按转移率均值的70%~130%计算,为58.9~109.4%,按照
±
3sd来算,为55.5~112.8%,故拟定本标准汤剂的鸟苷含量转移率范围为:55.5~100%,结果表明,本发明多个批次标准汤剂中鸟苷含量及其转移率均在允许范围之内,因此本发明可为炒鸡内金配方颗粒质量标准研究提供参考依据。
附图说明
[0029]
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0030]
图1为本发明一实施例中炒鸡内金饮片标准汤剂照薄层色谱法的点样量考察tlc图谱;其中,1组的对照药材溶液进样量为3μl,2组的对照药材溶液进样量为5μl,3组的对照药材溶液进样量为10μl,4组的供试品溶液进样量为3μl,5组的供试品溶液进样量为5μl,6组的供试品溶液进样量为10μl。
[0031]
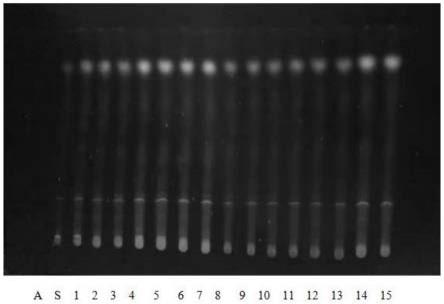
图2为本发明一实施例中炒鸡内金饮片15批次标准汤剂薄层图谱;其中,a组图谱为阴性对照样品薄层图谱,s组为鸡内金对照药材溶液薄层图谱,1~15组为炒鸡内金供试品15批次标准汤剂薄层图谱,15批次为220301pt、220302pt、220303pt、y220204pt~y2202015pt。
[0032]
图3为炒鸡内金饮片标准汤剂照薄层色谱法的检测波长考察中不同检测波长对比图;其中,s1的检测波长为230nm,s2的检测波长为210nm,s3的检测波长为254nm。
[0033]
图4为炒鸡内金饮片标准汤剂照薄层色谱法的柱温考察中不同柱温对比图;其中,s1的柱温为30℃,s2的柱温为35℃,s3的柱温为25℃。
[0034]
图5为炒鸡内金饮片标准汤剂照薄层色谱法的流速考察中不同流速对比图;其中,s1的流速为0.8ml/min,s2的流速为0.6ml/min,s3的流速为1.0ml/min。
[0035]
图6为炒鸡内金饮片标准汤剂照薄层色谱法的洗脱梯度考察中梯度1、梯度2、梯度3的特征图。
[0036]
图7为本发明提取方法考察中不同提取方法对比图;其中,s1为回流提取供试品溶
液特征图谱;s2为超声提取供试品溶液特征图谱。
[0037]
图8为本发明提取时间考察中不同提取时间对比图;其中,s1为超声提取40min供试品溶液特征图谱;s2为超声提取20min供试品溶液特征图谱;s3为超声提取30min供试品溶液特征图谱。
[0038]
图9为本发明提取溶剂考察中不同提取溶剂对比图;其中,s1为30%乙醇提取制备的供试品溶液特征图谱;s2为60%甲醇提取制备的供试品溶液特征图谱;s3为10%乙醇提取制备的供试品溶液特征图谱。
[0039]
图10为本发明样品提取溶剂量考察中不同溶剂量对比图;其中,s1为溶剂量35ml的供试品溶液特征图谱;s2为溶剂量25ml的供试品溶液特征图谱;s3为溶剂量15ml的供试品溶液特征图谱。
[0040]
图11为本发明专属性考察中空白溶剂对比图;其中,s1为对照品溶液特征图谱;s2为供试品溶液特征图谱,s3为空白溶剂(10%乙醇)特征图谱。
[0041]
图12为本发明重复性试验共有峰叠加特征图谱;其中,s1为重复性1下的供试品溶液共有峰叠加特征图谱;s2为重复性2下的供试品溶液共有峰叠加特征图谱;s3为重复性3下的供试品溶液共有峰叠加特征图谱;s4为重复性4下的供试品溶液共有峰叠加特征图谱;s5为重复性5下的供试品溶液共有峰叠加特征图谱;s6为重复性6下的供试品溶液共有峰叠加特征图谱。
[0042]
图13为本发明精密度试验共有峰叠加特征图谱;其中,s1为精密度1下的供试品溶液共有峰叠加特征图谱;s2为精密度2下的供试品溶液共有峰叠加特征图谱;s3为精密度3下的供试品溶液共有峰叠加特征图谱;s4为精密度4下的供试品溶液共有峰叠加特征图谱;s5为精密度5下的供试品溶液共有峰叠加特征图谱;s6为精密度6下的供试品溶液共有峰叠加特征图谱。
[0043]
图14为本发明稳定性试验共有峰叠加特征图谱;其中,s1为于0h测定的供试品溶液共有峰叠加特征图谱;s2为于2h测定的供试品溶液共有峰叠加特征图谱;s3为于4h测定的供试品溶液共有峰叠加特征图谱;s4为于8h测定的供试品溶液共有峰叠加特征图谱;s5为于12h测定的供试品溶液共有峰叠加特征图谱;s6为于24h测定的供试品溶液共有峰叠加特征图谱。
[0044]
图15为本发明不同色谱柱考察的特征图谱;其中,s1为批号pf-78的色谱柱,s2为批号pf-63的色谱柱。
[0045]
图16为本发明标准汤剂特征图谱测定中鸟苷对照品图谱。
[0046]
图17为本发明标准汤剂特征图谱测定中炒鸡内金对照药材图谱。
[0047]
图18为本发明标准汤剂特征图谱测定中鸡内金对照药材图谱
[0048]
图19为本发明标准汤剂特征图谱测定中15批鸡内金中药药材叠加图谱;其中,s1(4)-s15(4)分别表示220201-220215这15批鸡内金中药药材叠加图谱。
[0049]
图20为本发明标准汤剂特征图谱测定中15批鸡内金中药材共有峰图谱。
[0050]
图21为本发明标准汤剂特征图谱测定中15批炒鸡内金中药饮片叠加图谱;其中,s1(4)-s15(4)分别表示y220301-y220315这15批炒鸡内金中药饮片叠加图谱。
[0051]
图22为本发明标准汤剂特征图谱测定中15批炒鸡内金中药饮片共有峰图谱。
[0052]
图23为本发明标准汤剂特征图谱测定中15批炒鸡内金标准汤剂叠加图谱;其中,
s1(4)-s15(4)表示t220201-t220215这15批炒鸡内金标准汤剂叠加图谱。
[0053]
图24为本发明标准汤剂特征图谱测定中15批炒鸡内金标准汤剂拟合图。
[0054]
图25为本发明线性范围试验中鸟苷对照品不同浓度线性考察图。
[0055]
图26为本发明标准汤剂鸟苷含量特征图谱测定中专属性考察对比图;其中,s1为对照品溶液特征图谱;s2为供试品溶液特征图谱,s3为空白溶剂(10%乙醇)特征图谱。
具体实施方式
[0056]
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明进一步详细说明。
[0057]
本发明提供一种炒鸡内金标准汤剂质量检测方法,包括如下检测方法,通过对炒鸡内金标准汤剂的性状、干浸膏出膏率、薄层鉴别、浸出物、特征图谱及鸟苷含量测定,将标准汤剂含量标准限定为每1g含鸟苷为0.2~1.1mg,其中,干浸膏出膏率测定采用煎煮法进行测定;薄层鉴别采用照薄层色谱法进行鉴别;浸出物采用热浸法测定;特征图谱及鸟苷含量测定均采用液相色谱法测定。
[0058]
本实施例中:
[0059]
制备炒鸡内金标准汤剂:参照《医疗机构中药煎药室管理规范》(国中医药管理局[2009]3号)中的煎煮法,取15批次炒鸡内金饮片加水至没过药材约4-5cm,浸泡30-40min,煎煮两次,第一次煎煮时长为30-40min,第二次煎煮时长为25-30min,趁热进行固液分离,合并滤液,浓缩干燥,制得15批次炒鸡内金标准汤剂干膏粉。
[0060]
1.干浸膏出膏率测试
[0061]
取15批次炒鸡内金饮片,按以上制法制得15批次标准汤剂干膏粉,以干膏粉计算干浸膏得率(见表1),并计算平均得率为3.63%,按照标准限度允许范围(均值70%~130%)计算,出膏率允许范围为2.54%~4.72%,拟定炒鸡内金饮片标准汤剂出膏率允许范围为2.5%~4.5%。
[0062]
表1:出膏率
[0063][0064]
上述结果表明,15批次标准汤剂出膏率为3.2%~4.3%,均符合拟定限度范围2.5%~4.5%。
[0065]
2.性状考察
[0066]
根据15批次炒鸡内金标准汤剂的实物性状特征,描述为淡黄色至黄色的粉末;气微腥,味苦。
[0067]
3.薄层鉴别
[0068]
本产品为单味饮片炒鸡内金的干燥提取物,参考《中药配方颗粒薄层色谱彩色图集》第二辑炒鸡内金配方颗粒“薄层鉴别”项下的方法,用鸡内金对照药材作对照,建立了本品薄层鉴别方法,经15批次样品试验,供试品斑点清晰,阴性对照样品无干扰,故拟定为本品[鉴别]项。试验方法和结果如下:
[0069]
3.1方法摸索、点样量考察、检视方法考察
[0070]
试验方法照薄层色谱法(中国药典2020年版四部通则0502)试验
[0071]
供试品溶液制备:取本品粉末1g,加乙醇20ml,超声处理30min,放冷,滤过,滤液置蒸干,残渣加乙酸乙酯-乙醇(2:1)的混合溶液1ml使溶解,作为供试品溶液。
[0072]
对照药材溶液制备:取鸡内金对照药材2g,加水100ml,煎煮并保持微沸1小时,放冷,滤过,滤液蒸干,放冷,残渣加乙醇20ml使溶解,同法(超声处理30min,放冷,滤过,滤液蒸干,残渣加2:1的乙酸乙酯-乙醇的混合溶液1ml使溶解)制成对照药材溶液。
[0073]
薄层色谱条件:薄层板:硅胶g薄层板;点样量:吸取供试品溶液、对照药材溶液3μl、5μl、10μl;展开剂:三氯甲烷-乙酸乙酯-甲醇(10:2:1);预饱和30min,展距11cm;检视:于紫外光灯(365nm)下检视。
[0074]
结果:供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点,炒鸡内金方法摸索、点样量考察tlc图谱见图1,点样量考察中,供试品溶液10μl、对照药材溶液5μl的出点效果最好,确定供试品点样量为10μl、对照药材点样量为5μl。
[0075]
3.2标准汤剂薄层鉴别
[0076]
试验方法:照薄层色谱法(中国药典2020年版四部通则0502)试验
[0077]
供试品溶液制备:取本品粉末1g,加乙醇20ml,超声处理30min,放冷,滤过,滤液置蒸干,残渣加乙酸乙酯-乙醇(2:1)的混合溶液1ml使溶解,作为供试品溶液。
[0078]
对照药材溶液制备:取鸡内金对照药材2g,加水100ml,煎煮并保持微沸1小时,放冷,滤过,滤液蒸干,残渣加乙醇20ml使溶解,同法制成对照药材溶液。
[0079]
薄层色谱条件:薄层板:硅胶g薄层板;点样量:吸取供试品溶液10μl,对照药材溶液5μl;展开剂:三氯甲烷-乙酸乙酯-甲醇(10:2:1);预饱和30min,展距11cm,检视:于紫外光灯(365nm)下检视。
[0080]
实验情况:供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点,15批次标准汤剂tlc图谱见图2。
[0081]
4.浸出物测定
[0082]
取15批次标准汤剂,以乙醇为溶剂,照醇溶性浸出物测定法(中国药典2020年版通则2201)项下的热浸法测定,结果详见表2。
[0083]
表2:浸出物测定结果
[0084][0085][0086]
上述结果表明,15批次标准汤剂浸出物均值为69.46%,参考标准限度允许范围(均值70%~130%)的下限,拟定本品醇溶性浸出物不得少于48.5%。15批次标准汤剂测定结果均符合拟定限度要求。
[0087]
5.特征图谱测试
[0088]
5.1仪器、试剂与试药
[0089]
(1)仪器:高效液相色谱仪(lc-2030plus(e01-625)岛津(日本));色谱柱岛津shim-pack gist c18-aq(4.6mmx250mm,5um)编号pf-63;恒温水浴锅(hmtd-7000,北京市永
光明医疗仪器有限公司);超声波清洗器(kq-300de,昆山市超声仪器有限公司);万分之一天平(px224zh,奥豪斯仪器有限公司);百万分之一天平(awu220d,日本岛津有限公司)。
[0090]
(2)试剂:乙醇(天津市致远化学试剂有限公司)、甲醇(天津市科密欧化学试剂有限公司)色谱纯;、乙腈(天津市科密欧化学试剂有限公司)为色谱纯,磷酸(天津市恒兴化学试剂制造有限公司),水为超纯水(实验室自制)。
[0091]
(3)对照品:鸟苷(批号:111977-201501,含量:93.60%,中国食品药品检定研究院)、鸡内金对照药材(批号:121153-202003,中国食品药品检定研究院)、炒鸡内金对照药材(批号:dst200919-039,成都乐美天医药科技有限公司)。
[0092]
5.2试验方法
[0093]
5.2.1色谱条件的确定
[0094]
(1)最佳吸收波长的确定
[0095]
基于方法的色谱条件结合dad检测器对炒鸡内金标准汤剂样品进行最大吸收光谱扫描,扫描波长200-400nm,样品在200-300nm附近有较强、较多的吸收,故选取检测波长210nm、230nm、254nm进行研究,确定最佳吸收波长。
[0096]
取炒鸡内金标准汤剂适量,研细,取约0.3g,精密称定,置具塞锥形瓶中,精密加入10%乙醇25ml,密塞,称定重量,超声30min,放冷,再称定重量,用10%乙醇补足减失重量,摇匀,滤过,取续滤液,即得。
[0097]
色谱条件:色谱柱:岛津shim-pack gist c18-aq(4.6mmx250mm,5μm);流动相:以乙腈为流动相a,以0.1%磷酸溶液为流动相b,按表3中的规定进行梯度洗脱;流速:每分钟1.0ml;柱温:25℃;检测波长:210、254、230nm。
[0098]
表3:
[0099]
时间(min)流动相a(%)流动相b(%)0~60
→
0100
→
1006~260
→
2100
→
9826~462
→
298
→
9846~502
→
9598
→
550~5595
→
05
→
10055~650
→
0100
→
100
[0100]
结果显示,通过对比3种检测波长色谱图,如图3所示,选取254nm作为检测波长时,各特征峰响应值较大,基线平稳,干扰较小,故选取254nm作为检测波长。
[0101]
(2)柱温的考察
[0102]
本次实验选取25℃、30℃、35℃3种柱温进行比较,选择合适柱温。
[0103]
取炒鸡内金标准汤剂适量,研细,取约0.3g,精密称定,置具塞锥形瓶中,精密加入10%乙醇25ml,密塞,称定重量,超声30min,放冷,再称定重量,用10%乙醇补足减失重量,摇匀,滤过,取续滤液,即得。
[0104]
色谱条件:色谱柱:岛津shim-pack gist c18-aq(4.6mmx250mm,5μm);流动相:以乙腈为流动相a,以0.1%磷酸溶液为流动相b,按表4中的规定进行梯度洗脱;流速:每分钟1.0ml;柱温:25℃、30℃、35℃;检测波长:254nm。
[0105]
表4:
[0106]
时间(min)流动相a(%)流动相b(%)0~60
→
0100
→
1006~260
→
2100
→
9826~462
→
298
→
9846~502
→
9598
→
550~5595
→
05
→
10055~650
→
0100
→
100
[0107]
结果显示,通过对比3种不同柱温的色谱图,如图4所示,3种流动相的色谱峰信息及峰形差异不大,选取30℃作为柱温时,峰分离度较好,故选取30℃作为柱温。
[0108]
(3)流速的考察
[0109]
本次实验选取0.6ml/min、0.8ml/min、1.0ml/min3种流速进行比较,选择合适流速。
[0110]
取炒鸡内金标准汤剂适量,研细,取约0.3g,精密称定,置具塞锥形瓶中,精密加入10%乙醇25ml,密塞,称定重量,超声30min,放冷,再称定重量,用10%乙醇补足减失重量,摇匀,滤过,取续滤液,即得。
[0111]
色谱条件:色谱柱:岛津shim-pack gist c18-aq(4.6mmx250mm,5μm);流动相:以乙腈为流动相a,以0.1%磷酸溶液为流动相b,按表5中的规定进行梯度洗脱;流速:每分钟0.6ml、0.8ml、1.0ml;柱温:30℃;检测波长:254nm。
[0112]
表5:
[0113]
时间(min)流动相a(%)流动相b(%)0~60
→
0100
→
1006~260
→
2100
→
9826~462
→
298
→
9846~502
→
9598
→
550~5595
→
05
→
10055~650
→
0100
→
100
[0114]
结果显示,通过对比3种不同流速的色谱图,如图5所示,3种流动相的色谱峰信息及峰形差异不大,选取0.8ml/min作为流速时,峰分离度较好,故选取0.8ml/min作为流速。
[0115]
(4)梯度优化
[0116]
对炒鸡内金标准汤剂特征图谱的洗脱梯度进行优化,确定最优梯度。
[0117]
取炒鸡内金标准汤剂适量,研细,取约0.3g,精密称定,置具塞锥形瓶中,精密加入10%乙醇25ml,密塞,称定重量,超声30min,放冷,再称定重量,用10%乙醇补足减失重量,摇匀,滤过,取续滤液,即得。
[0118]
色谱条件:色谱柱:岛津shim-pack gist c18-aq(4.6mmx250mm,5μm);流动相:以乙腈为流动相a,以0.1%磷酸溶液为流动相b,按表6、表7、表8中的规定进行梯度洗脱;流速:每分钟1.0ml;柱温:30℃;检测波长:254nm。
[0119]
表6:梯度1
[0120]
时间(min)流动相a(%)流动相b(%)
0~202
→
598
→
9520~255
→
2095
→
8025~3020
→
2080
→
8030~5020
→
3080
→
7050~5530
→
9570
→
555~6095
→
35
→
9760~703
→
397
→
97
[0121]
表7:梯度2
[0122]
时间(min)流动相a(%)流动相b(%)0~150
→
3100
→
9715~252
→
498
→
9625~304
→
696
→
9430~326
→
2094
→
8032~4220
→
2580
→
7542~4725
→
9575
→
547~5395
→
05
→
10053~630
→
0100
→
100
[0123]
表8:梯度3
[0124]
时间(min)流动相a(%)流动相b(%)0~60
→
0100
→
1006~260
→
2100
→
9826~462
→
298
→
9846~502
→
9598
→
550~5595
→
05
→
100
[0125]
参见图6,结果显示,通过对炒鸡内金标准汤剂特征图谱的洗脱梯度进行优化,最终确定分离度较好、峰形信息较多的梯度3作为炒鸡内金标准汤剂特征图谱的洗脱梯度。
[0126]
5.2.2色谱条件
[0127]
色谱条件:色谱柱:岛津shim-pack gist c18-aq(4.6mmx250mm,5um),编号pf-63;流动相:以乙腈为流动相a,以0.1%磷酸溶液为流动相b,按表9中的规定进行梯度洗脱;流速:每分钟0.8ml;柱温:30℃;检测波长:254nm。
[0128]
表9:
[0129]
时间(min)流动相a(%)流动相b(%)0~60
→
0100
→
1006~260
→
2100
→
9826~462
→
298
→
9846~502
→
9598
→
550~5595
→
05
→
10055~650
→
0100
→
100
[0130]
5.2.3制备参照物溶液和对照品溶液:取0.3g对照药材,加入10%乙醇25ml,回流30min,放冷,摇匀,滤过,取续滤液,即制得参照物溶液;另取鸟苷对照品适量,精密称定,加50%甲醇制成每1ml含鸟苷10ug的溶液,摇匀,即制得对照品溶液。
[0131]
5.2.4制备供试品溶液:取本品炒鸡内金标准汤剂样品粉末约0.3g,精密称定,置具塞锥形瓶中,精密加入10%乙醇25ml,密塞,称定重量,超声30min,放冷,再称定重量,用10%乙醇补足减失重量,摇匀,滤过,取续滤液,即得。
[0132]
5.2.5测定法:分别精密吸取对照品溶液和供试品溶液各10μl,注入液相色谱仪,测定,即得。
[0133]
5.3供试品溶液前处理方法考察
[0134]
5.3.1提取方法的考察:分别以不同的提取方法制备供试品溶液,包括加热回流和超声处理,按上述5.2试验方法进行测定。结果表明,如图7和表10所示,两种提取方式分离度都较高,超声处理“总峰面积/取样量”与加热回流差异不大,考虑实验简捷性,故选择样品提取方式为超声处理。
[0135]
表10:
[0136][0137]
5.3.2提取时间的考察:分别以不同的超声提取时间制备供试品溶液,按上述5.2试验方法进行测定。结果表明,如图8和表11所示,主峰个数一致,样品提取完全,不同的提取时间,峰面积之间有差异,以比较时间左右相比,选择中间值,故确定以30分钟为提取时间。
[0138]
表11:
[0139][0140]
5.3.3提取溶剂的考察:分别以不同提取溶剂制备供试品溶液,按5.2试验方法进行测定。结果表明,如图9和表12所示,提取溶剂为高浓度甲醇时,提取不完全,故排除。鸟苷化合物为极性大物质,故10%乙醇更容易提取,故确定以10%乙醇为提取溶剂。
[0141]
表12:不同提取溶剂考察结果
[0142]
[0143][0144]
5.3.4提取溶剂量考察:分别以不同样品溶剂量(15ml、25ml、35ml)超声处理制备供试品溶液,按5.2试验方法进行测定。结果表明,如图10和表13所示,主峰个数一致,溶剂量之间,含量均在0.64-0.68之间,rsd为3.13%,因为取15ml、25ml、35ml溶剂量的考察,差异较小,故确定提取样品溶剂量为25ml。
[0145]
表13:不同提取溶剂量考察结果
[0146][0147]
综上所述,确定供试品溶液制备方法的主要参数如下:取本品粉末炒鸡内金标准汤剂样品约0.3g,精密称定,置具塞锥形瓶中,精密加入10%乙醇25ml,密塞,称定重量,超声30min,放冷,再称定重量,用10%乙醇补足减失重量,摇匀,滤过,取续滤液,即得。
[0148]
5.4特征图谱分析方法验证
[0149]
5.4.1专属性考察:取供试品用溶剂10%乙醇10ul,按以上5.2项下色谱条件进行测定。试验表明,如图11所示,空白溶剂无干扰。
[0150]
5.4.2重复性试验:取同批样品约0.3g,共6份,按5.2色谱条件进行测定,结果显示,6份供试品特征图谱中有4个共有峰,采用“中药色谱指纹图相似度评价系统(2012版)”,对指定的4个共有特征峰进行相似度评价,相对保留时间及保留时间的rsd均在合格范围内(详见表14、15及图12),表明该方法重现性良好。
[0151]
表14:重复性试验特征图谱相对保留时间
[0152]
峰号s1s2s3s4s5s6rsd(%)10.4010.4010.4010.4010.4010.4010.0020.6440.6440.6440.6440.6440.6440.003(s)1111110.0041.0561.0561.0561.0561.0561.0560.00
[0153]
表15:重复性试验特征图谱相对峰面积
[0154][0155]
[0156]
5.4.3精密度试验:取一批样品约0.3g,按5.2色谱条件进行测定,连续进样6针测定,峰形、峰数基本一致,并采用“中药色谱指纹图相似度评价系统(2012版)”,对指定的4个共有特征峰进行相似度的评价,相对保留时间及保留时间的rsd均在合格范围内(详见表16、17以及图13),表明该方法精密度良好。
[0157]
表16:精密度试验特征图谱相对保留时间
[0158]
峰号s1s2s3s4s5s6rsd(%)10.40.4010.40.3980.40.40.2520.6430.6440.6440.6410.6430.6430.173(s)1111110.0041.0571.0571.0571.0561.0561.0560.05
[0159]
表17:精密度试验特征图谱相对峰面积
[0160]
峰号s1s2s3s4s5s6rsd(%)12.4272.4182.4162.4062.3992.4010.4520.9300.9280.9330.9250.9230.9240.403(s)1.0001.0001.0001.0001.0001.0000.0040.8200.8100.8030.7900.8030.8061.24
[0161]
5.4.4稳定性试验:取同批样品约0.3g,按5.2色谱条件进行测定,分别于0h、2h、4h、8h、12h、24h进样测定,特征图谱的峰形、峰数基本稳定,并采用“中药色谱指纹图相似度评价系统(2012版)”,对指定的4个共有特征峰进行相似度评价,相对保留时间及保留时间的rsd均在合格范围内(详见表18、19及图14),表明供试品溶液在24小时内较稳定。
[0162]
表18:稳定性试验特征图谱相对保留时间
[0163]
峰号02h4h8h12h24hrsd(%)10.40.40.40.40.4010.3990.1420.6430.6440.6430.6430.6440.6410.163(s)1111110.0041.0571.0571.0561.0561.0561.0560.04
[0164]
表19:稳定性试验特征图谱相对峰面积
[0165][0166][0167]
5.4.5耐用性考察
[0168]
(1)不同色谱柱的考察
[0169]
在方法优化的过程中发现,不同型号的色谱柱对炒鸡内金标准汤剂特征图谱的分
离度影响较大,因此选择了岛津shim-pack gist c18-aq(4.6mmx250mm,5um)色谱柱。为保证该方法使用同一型号色谱柱的重现性,比较了同型号的2根色谱柱对耐用性的影响,分别是shim-pack gist c18-aq(4.6mmx250mm,5um)pf-78、shim-pack gist c18-aq
[0170]
(4.6mmx250mm,5um)pf-63,如图15和表20、21所示。
[0171]
表20:不同色谱柱考察特征图谱相对保留时间
[0172]
峰号pf-78pf-63rsd(%)10.3880.3920.72520.6280.6340.6723(s)110.00041.0581.0570.067
[0173]
表21:不同柱温考察特征图谱相对峰面积
[0174]
峰号pf-78pf-63rsd(%)11.8901.7047.30821.1041.0910.8823(s)1.0001.0000.00041.2421.2360.377
[0175]
(2)不同柱温的考察
[0176]
取“色谱柱耐用性考察”项下的供试品溶液,除了柱温分别改为28℃、30℃、32℃外,其余色谱条件不变,进样分析。以鸟苷为参照峰s,计算各特征峰与s峰的相对保留时间及相对峰面积,并计算rsd值,见表22、23,结果显示相对保留时间均小于3%,说明柱温的影响较小,不同柱温耐用性较好。
[0177]
表22:不同柱温考察特征图谱相对保留时间
[0178]
峰号28℃30℃32℃rsd(%)10.3890.3980.3871.49720.6380.6460.6311.1763(s)1110.00041.0591.061.060.054
[0179]
表23:不同柱温考察特征图谱相对峰面积
[0180]
峰号28℃30℃32℃rsd(%)12.8202.7652.8171.09721.5401.5081.5441.2613(s)1.0001.0001.0000.00041.9691.7841.7546.338
[0181]
该特征图谱方法经专属性,精密度,重复性和稳定性验证,均符合规定,经耐用性考察,相对保留时间较稳定。
[0182]
5.5标准汤剂特征图谱表征分析
[0183]
5.5.1标准汤剂特征图谱测定
[0184]
照上述拟定的特征图谱分析方法,测定15批炒鸡内金标准汤剂及其制备使用的15
批次中药饮片特征图谱,结果显示,标准汤剂及其制备使用的中药饮片特征色谱图中有4个共有峰,并应与对照药材参照物色谱中的4个特征峰保留时间相对应,其中与鸟苷对照品参照物相对应的峰为峰2,共有峰特征图谱详见图16至24。
[0185]
5.5.2特征色谱图相对保留时间评价
[0186]
采用“中药色谱指纹图相似度评价系统(2012版)”,对选定的4个共有特征峰进行相似度的评价,结果显示,15批炒鸡内金饮片标准汤剂特征色谱图相似度均在0.9以上,表明本标准汤剂质量相对稳定。以鸟苷参照物峰相对应的峰(3)为s峰,计算共有峰与s峰的相对保留时间,其相对保留时间及范围详见表24。
[0187]
表24:15批标准汤剂共有峰相对保留时间
[0188][0189]
综上所述,采用高效液相色谱法建立的标准汤剂特征图谱测定方法,按照《中国药典》2020年版四部“分析方法验证指导原则(通则9101)”对建立的方法进行了精密度、重复性、稳定性验证,且符合要求。采用“中药色谱指纹图相似度评价系统(2012版)”对15批标准汤剂样品的特征图谱进行相似度评价,标定了4个共有特征峰,其中峰3为鸟苷。以鸟苷参照物相对应的峰为s峰,计算另3个特征峰相对保留时间,以15批次样品峰相对保留时间均值拟定为规定值分别为:0.41(峰1)、0.65(峰2)、1.06(峰4),考虑试验操作、仪器、试剂等多因素误差,其相对保留时间允许范围拟定为
±
10%。
[0190]
6.含量测定
[0191]
6.1试验方法
[0192]
炒鸡内金配方颗粒选择鸟苷作为含测成分。
[0193]
色谱条件:色谱柱:色谱柱:岛津shim-pack gist c18-aq(4.6mmx250mm,5um)63;流动相:以乙腈为流动相a,以0.1%磷酸溶液为流动相b,按表25中的规定进行梯度洗脱;流速:每分钟0.8ml;柱温:30℃;检测波长:254nm。
[0194]
表25:
[0195]
时间(min)流动相a(%)流动相b(%)0~60
→
0100
→
1006~260
→
2100
→
9826~462
→
298
→
9846~502
→
9598
→
550~5595
→
05
→
10055~650
→
0100
→
100
[0196]
制备对照品溶液:取鸟苷对照品适量,精密称定,加50%甲醇制成每1ml含鸟苷10ug的溶液,摇匀,即得。
[0197]
制备供试品溶液:取本品粉末,约0.3g,精密称定,置具塞锥形瓶中,精密加入10%乙醇25ml,密塞,称定重量,超声30min,放冷,再称定重量,用10%乙醇补足减失重量,摇匀,滤过,取续滤液,即得。
[0198]
测定法:分别精密吸取对照品溶液、供试品溶液各10μl,注入液相色谱仪,测定,即得。
[0199]
6.2供试品溶液前处理方法考察
[0200]
6.2.1提取方法的考察:分别以不同的提取方法制备供试品溶液,按上述6.1试验方法进行测定。结果表明,回流的样品含量与超声的样品含量差异不大,rsd为1.31%(详见表26),故选择样品提取方式为超声处理。
[0201]
表26:不同提取方法对比
[0202][0203]
6.2.2提取时间的考察:分别以不同的提取时间制备供试品溶液,按上述6.1试验方法进行测定。结果表明,提取时间之间有差异(详见表27),rsd为6.42%,故选择样品时间为30分钟。
[0204]
表27:不同提取时间对比
[0205][0206]
6.2.3提取溶剂的考察:分别以不同提取溶剂制备供试品溶液,按上述6.1试验方法进行测定。结果表明,提取溶剂为10%乙醇时,鸟苷含量高(详见表28),rsd为0.5%,实验中,提取溶剂含水量高,峰形好,故确定以10%乙醇为提取溶剂。
[0207]
表28:不同提取溶剂对比
[0208][0209]
6.2.4提取样品溶剂量考察:分别以不同溶剂量(15ml、25ml、35ml)制备供试品溶液,按上述6.1试验方法进行测定。结果表明,低溶剂量至高溶剂均能提取完成样品,考虑实验选择简捷,空间(详见表29),故确定溶剂量为25ml。
[0210]
表29:不同溶剂量对比
[0211][0212]
6.2.5供试品溶液制备方法的确定
[0213]
综上所述,确定供试品溶液制备方法的主要参数如下:取本品粉末,约0.3g,精密称定,置具塞锥形瓶中,精密加入10%乙醇25ml,密塞,称定重量,超声30min,放冷,再称定重量,用10%乙醇补足减失重量,摇匀,滤过,取续滤液,即得。
[0214]
6.3含量测定方法学验证
[0215]
6.3.1重复性试验:取同批次标准汤剂样品约0.3g,共6份,按上述6.1试验方法进行测定,测得样品中鸟苷含量平均值分别为0.640434mg/g,rsd值为0.75%,试验表明该方法重现性良好(详见表30)。
[0216]
表30:
[0217][0218]
6.3.2精密度试验:取6.1所示的供试品溶液,连续进样6针,照上述6.1试验方法测定其峰面积,计算样品中鸟苷峰面积的rsd值为0.31%,表明仪器精密度良好(详见表31)。
[0219]
表31:
[0220][0221]
6.3.3稳定性试验:取一批标准汤剂样品约0.3g,按上述6.1试验方法,分别于0h、2h、4h、8h、12h、24h进样,测定其峰面积,计算其峰面积的rsd值为0.41%,试验表明供试品溶液在24小时内较稳定(详见表32)。
[0222]
表32:
[0223]
6.3.4线性范围试验:取鸟苷对照品溶液(浓度为0.02148mg/ml),分别5ml至10ml容量瓶,浓度0.01074mg/ml;取0.00537mg/ml的溶液5ml至10ml容量瓶,浓度0.002685mg/ml,依次类推;浓度0.0013425mg/ml;浓度0.00013425mg/ml,按6.1项下色谱条件进行测定,以鸟苷峰面积为纵坐标,进样量为横坐标,绘制标准曲线,并进行线性回归
[0224]
其回归方程为:y=32592917.7812x-2926.7258,r2=1.0000,可知鸟苷在0.00013425mg/ml~0.02148mg/ml范围内与其峰面积具有良好的线性关系(详见表33和图25)。
[0225]
表33:鸟苷线性关系考察结果
[0226]
供试液峰面积浓度线性16974460.02148线性23479550.01074线性31702750.00537线性4823110.002685线性5413170.0013425线性639470.00013425
[0227]
6.3.5加样回收率试验:精密称取样品(鸟苷含量为0.65043mg/g)约0.3g共6份,各加入已知浓度的鸟苷对照品溶液(0.02148mg/ml)3ml,按6.1项下方法制备供试品溶液,并按6.1项下色谱条件进行测定,计算鸟苷平均加样回收率为92.8411659%,rsd为4.59%(详见表34)。
[0228]
表34:鸟苷加样回收率试验结果
[0229][0230]
6.3.6专属性考察:按以上“6.1”项下色谱条件进行测定。试验表明:空白溶剂无干扰,详见图26,该方法专属性良好。
[0231]
6.3.7耐用性考察
[0232]
(1)不同色谱柱的考察
[0233]
比较了同厂家和不同批次的2根色谱柱(4.6mmx250mm,5μm)(分别岛津gist aq-c18(pf-78),岛津gist aq-c18(pf-63))对含量测定的影响。见表35,测定的含量rsd值为0.0002%,小于3.0%,表明该分析方法在同一型号不同批次的色谱柱耐用性良好。
[0234]
表35:
[0235][0236]
(2)不同柱温的考察
[0237]
取“不同色谱柱考察”项下供试品溶液,除柱温考察25℃、30℃、35℃调整外,其他色谱条件不变,计算含量及rsd值。见表36,测得含量rsd值为0.87%,小于3.0%,说明该方法对柱温的较小变动耐用性良好。
[0238]
表36:
[0239][0240]
(3)不同流速的考察
[0241]
取“不同色谱柱考察”项下供试品溶液,除流速考察0.6ml/min、0.8ml/min、1.0ml/min调整外,其他色谱条件不变,计算含量及rsd值。结果见表37,测定的含量rsd值为3.95%,小于5.0%,表明该方法对流速的较小变动耐用性良好。
[0242]
表37:
[0243][0244]
综上,鸟苷分离度和色谱峰纯度均符合定量要求,整个分析方法经专属性、精密度、重复性、稳定性、加样回收及耐药性考察,结果均符合要求,说明建立的方法能很好的用于鸟苷的含量测定。
[0245]
6.4标准汤剂及中药材含量测定
[0246]
炒鸡内金药材经产地初加工成段片,经炮制后加工成炒鸡内金饮片。
[0247]
6.4.1按照上述拟定的含量分析方法,测定15批炒鸡内金标准汤剂及其制备使用的15批次炒鸡内金饮片及药材的鸟苷含量,结果详见表38、39、40。
[0248]
表38:15批鸡内金药材测定结果
[0249][0250]
表39:15批炒鸡内金饮片测定结果
[0251][0252][0253]
表40:15批炒鸡内金标准汤剂鸟苷测定结果
[0254][0255]
6.4.1鸟苷含量转移率:依据标准汤剂方法学研究确定的检测方法,对15批标准汤剂及其制备使用的中药饮片测定结果,计算鸟苷含量转移率,掌握其量质传递情况,为制定物料内控标准及其表征参数允许范围提供依据。炒鸡内金饮片标准汤剂由炒鸡内金饮片加水煎煮2次,滤液浓缩、冷冻干燥制得。其鸟苷含量转移率详见表41。
[0256]
表41:15批炒鸡内金标准汤剂鸟苷含量转移率
[0257][0258]
[0259]
由以上数据可知,炒鸡内金饮片依方案煎煮制得炒鸡内金饮片标准汤剂,本品鸟苷平均转移率为84.14%,测得转移率范围为61.72%-95.11%,sd为9.56。依据《中药配方颗粒质量控制与标准制定技术要求》,鸟苷含量转移率允许范围按转移率均值的70%~130%计算,为58.9~109.4%;按照
±
3sd来算,为55.5~112.8%。故拟定本标准汤剂的鸟苷含量转移率范围为:55.5~100%。结果表明,15批次标准汤剂中鸟苷转移率均在
±
3sd允许范围之内。
[0260]
本品标准汤剂中鸟苷平均含量为0.64mg/g,测得含量范围为0.420mg/g~0.861mg/g,sd为0.142;按均值
±
3sd计算,鸟苷含量允许范围为0.21mg/g~1.07mg/g。故拟定本标准汤剂的鸟苷含量范围为:0.2mg/g~1.1mg/g。结果表明,15批次标准汤剂中鸟苷及其转移率均在允许范围之内,可为炒鸡内金配方颗粒质量研究提供参考依据。
[0261]
本发明提供的炒鸡内金标准汤剂质量检测方法,通过对炒鸡内金标准汤剂的性状、干浸膏出膏率、薄层鉴别、浸出物、特征图谱及鸟苷含量测定进行研究,通过多方面测量,来评定炒鸡内金标准汤剂的质量,为产品的质量稳定奠定坚实的基础,能够建立炒鸡内金汤剂可行的质量标准,实现炒鸡内金标准汤剂质量的有效控制,并且,采用本技术的色谱条件进行液相分析,可以得到分离度更好更清晰的色谱图;炒鸡内金饮片煎煮制得炒鸡内金饮片标准汤剂,鸟苷平均含量为0.64mg/g,测得含量范围为0.420~0.861mg/g,sd(标准差)为0.142,按均值
±
3sd来算,鸟苷含量允许范围为0.21~1.07mg/g,故拟定本标准汤剂的鸟苷含量范围为:0.2mg/g~1.1mg/g;鸟苷平均转移率为84.14%,转移率范围为61.72%~95.11%,sd为9.56,依据《中药配方颗粒质量控制与标准制定技术要求》,鸟苷含量转移率允许范围按转移率均值的70%~130%计算,为58.9~109.4%,按照
±
3sd来算,为55.5~112.8%,故拟定本标准汤剂的鸟苷含量转移率范围为:55.5~100%,结果表明,本发明多个批次标准汤剂中鸟苷含量及其转移率均在允许范围之内,因此本发明可为炒鸡内金配方颗粒质量标准研究提供参考依据。
[0262]
所述领域技术人员应当理解:以上任何实施例的讨论仅为示例性的,并非旨在暗示本发明的范围(包括权利要求)被限于这些例子;在本发明的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,步骤可以以任意顺序实现,并存在如上所述的本发明的不同方面的许多其它变化,为了简明它们没有在细节中提供。
[0263]
本发明的实施例旨在涵盖落入所附权利要求的宽泛范围之内的所有这样的替换、修改和变型。因此,凡在本发明的精神和原则之内,所做的任何省略、修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1