一种基于红细胞-碳纳米管杂化体生物传感器的制备方法和应用
1.本发明属于生物无机化学及生物传感器技术领域,具体涉及一种能够同时定量检测多巴胺和尿酸的基于红细胞-碳纳米管杂化体生物传感器的制备方法和应用。
背景技术:
2.多巴胺(da)和尿酸(ua)是存在于人体内的具有重要生物学研究价值的电化学活性分子。其中,da是一种重要的儿茶酚胺类神经递质,在中枢神经、外周神经、心血管和内分泌系统发挥着重要的作用。帕金森病、抑郁症和药物成瘾等疾病都与人体中多巴胺分泌异常有关。ua是一种天然抗氧化剂,它在人体体液浓度水平的异常会引起高尿酸血症、痛风、白血病和肺炎等疾病。da和ua作为嘌呤代谢的主要产物,普遍共存于中枢神经系统的细胞外液和血清中。因此,开发一种生物相容性好、高选择性和高灵敏度且可以同时检测多巴胺和尿酸浓度水平的检测方法,对一些疾病的分析应用和诊断研究具有重要意义。
3.da和ua结构相似且氧化还原电位比较接近,对它们进行同时检测是一个巨大的挑战。传统多巴胺和尿酸的检测技术包括高效液相色谱法、分光光度法、荧光法、毛细管电泳法、化学发光法及液相色谱-质谱分析法等。然而,这些方法预处理操作步骤复杂、耗时且对所需设备要求较高。与上述方法相比,以电化学技术为基础的生物传感器具有响应快、操作简单、成本低和灵敏度高等优点,是一种极具吸引力和竞争力的检测方法。多种纳米材料已被报道用于定量检测da和ua,如碳纳米材料、金属纳米材料、聚合物纳米材料等,虽然基于这些材料的电化学传感器已成功实现da和ua氧化电位的分离,但面临材料制备步骤繁琐、成本高、生物毒性、检测范围窄、灵敏度低等技术挑战,为进一步实现体内da和ua的实时检测形成障碍。鉴于以上技术不足,开发一种生物相容性好、选择性高、检测下限低且可以同时检测da和ua的测定方法具有重要的研究意义。
4.红细胞(rbc)是人体中数量最多的细胞类型,由于其固有的电催化性能和生物相容性而备受关注。但其低催化活性以及易溶血性限制了以红细胞为基础的应用。纳米材料具有大比表面积、高电导率和催化活性等优点,用纳米材料合成红细胞的外骨骼,将红细胞的天然的生物学功能与纳米材料的理化性质相结合,是提高红细胞稳定性和催化活性的有效策略。碳纳米管是一种电化学活性物质,具有大比表面积、高稳定性、优异的电子导电性和机械性能,可能是实现这一目的的最佳候选纳米材料。因此,利用碳纳米管作为保护壳层不仅能够保护红细胞,提高其稳定性;还可以利用红细胞生物学功能与碳纳米管的理化特性设计合成以红细胞为基础的生物传感器,目前尚没有该方面的相关报道。
技术实现要素:
5.本发明解决的技术问题是提供了一种具有较好生物相容性、高选择性和高灵敏度的基于红细胞-碳纳米管杂化体(rbc@cnts)生物传感器的制备方法,该方法首先合成rbc@cnts杂化体,并将该rbc@cnts杂化体修饰的电极构建生物传感器,用于同时定量检测多巴
胺和尿酸浓度。
6.本发明为解决上述技术问题采用如下技术方案,一种基于红细胞-碳纳米管杂化体生物传感器的制备方法,其特征在于:所述生物传感器由参比电极、对电极及红细胞-碳纳米管杂化体修饰后的工作电极组成,其中修饰后的工作电极由碳布电极及涂覆于碳布电极表面的红细胞-碳纳米管杂化体组成,该红细胞-碳纳米管杂化体以红细胞为基质,通过将超声分散均匀后的碳纳米管与红细胞混合得到红细胞膜表面包覆有碳纳米管人造壳层的红细胞-碳纳米管杂化体。
7.进一步限定,所述对电极为铂片电极,参比电极为ag/agcl电极。
8.进一步限定,所述红细胞-碳纳米管杂化体的具体制备过程为:步骤s1,将碳布电极进行表面预处理;步骤s2,从动物血或人血中离心洗涤去除上层血浆得到天然红细胞,再用4wt%戊二醛溶液固定天然红细胞,随后依次用生理盐水和去离子水反复多次洗涤得到固定红细胞a;步骤s3:将碳纳米管加入超纯水中并超声分散得到溶液b;步骤s4:在室温条件下,将步骤s2得到的固定红细胞a悬浮分散于步骤s3得到的溶液b中,再置于恒温振荡器中进行反应,然后离心收集沉淀,并用超纯水离心洗涤除去未反应的前驱体,最终得到红细胞-碳纳米管杂化体。
9.进一步限定,步骤s1中所述碳布电极表面预处理的具体过程为:将碳布电极依次在丙酮和乙醇中超声处理30min以去除表面杂质,干燥后再将碳布电极浸入浓硫酸和浓硝酸的混合酸溶液中处理,然后用超纯水反复冲洗碳布电极直至冲洗液呈中性,干燥后得到表面预处理的碳布电极。
10.进一步限定,步骤s2中所述动物血为猪血、羊血、兔血或牛血中的一种或多种。
11.进一步限定,步骤s3中所述碳纳米管为多壁碳纳米管、羧基化多壁碳纳米管、羟基化碳纳米管或氨基化碳纳米管中的一种或多种。
12.进一步限定,步骤s2-s5的具体过程为:将500μl 3%比容的天然红细胞固定后水洗得到固定红细胞a;将2mg碳纳米管加入1ml超纯水,置于冰水浴中超声分散得到溶液b;将固定红细胞a悬浮分散于溶液b中,再置于恒温振荡器中以110转/分的转速反应24h,然后离心收集沉淀,并用超纯水离心洗涤三次以除去过量的碳纳米管前体,最后用超纯水重新恢复成3%比容的rbc@cnts杂化体悬液,于4℃保存备用;将30μl 3%比容的rbc@cnts杂化体悬液滴加到预处理后的碳布电极表面,于室温自然晾干后得到基于红细胞-碳纳米管杂化体修饰的工作电极。
13.本发明所述的基于红细胞-碳纳米管杂化体生物传感器在定量检测多巴胺和尿酸中的应用。
14.进一步限定,所述基于红细胞-碳纳米管杂化体生物传感器采用标准的三电极体系检测多巴胺和尿酸的浓度,即以红细胞-碳纳米管杂化体修饰的碳布电极为工作电极,ag/agcl为参比电极,铂片(1cm2)为对电极,电解液为0.1m、ph=7.4的pbs缓冲液,所有电化学测试均是在氮气饱和的pbs缓冲液中进行。
15.进一步限定,所述基于红细胞-碳纳米管杂化体生物传感器采用差分脉冲伏安法(dpv)检测电化学响应电流,根据电化学响应电流与多巴胺浓度的线性关系以及电化学响
应电流与尿酸浓度的线性关系计算得到该红细胞-碳纳米管杂化体生物传感器对多巴胺和尿酸的检测下限,其中多巴胺的线性检测范围为4-400μm,检测下限为0.10μm;尿酸的线性检测范围为2-500μm,检测下限为0.69μm,且该基于红细胞-碳纳米管杂化体生物传感器用于定量检测多巴胺和尿酸具有良好的选择性、抗干扰能力、重现性及稳定性。
16.本发明与现有技术相比具有以下优点和有益效果:1. 本发明以红细胞为支撑材料,合成红细胞-碳纳米管杂化体,合成过程绿色无污染。
17.2. 本发明以所合成的红细胞-碳纳米管杂化体为催化剂所制得的生物传感器可以同时检测多巴胺和尿酸的浓度水平,且对多巴胺和尿酸具有较宽的检测范围和较低的检测下限,同时表现出较好的选择性、重现性、稳定性以及较强的抗干扰能力。
18.3. 本发明制得的基于红细胞-碳纳米管杂化体生物传感器具有较好的电化学传感性能,其中多巴胺的线性检测范围为4-400μm,检测下限为0.10μm;尿酸的线性检测范围为2-500μm,检测下限为0.69μm;相比于传统传感器具有明显的优势,有望进一步实现监测体内多巴胺和尿酸浓度。
附图说明
19.图1是实施例1制得的rbc@mwcnts杂化体的fesem图。
20.图2是实施例1制得的rbc@mwcnts杂化体的tem图。
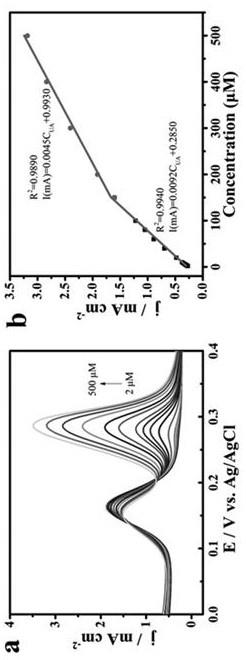
21.图3是实施例1制得的rbc@mwcnts杂化体修饰的工作电极在含50μm da的0.1m pbs(ph=7.4)缓冲液中不同浓度的ua的dpv图(a)以及相对应的线性曲线图(b)。
22.图4是实施例1制得的rbc@mwcnts杂化体修饰的工作电极在含100μm ua的0.1m pbs(ph=7.4)缓冲液中不同浓度的da响应图(a)以及对应的线性曲线图(b)。
23.图5是实施例1制得的rbc@mwcnts杂化体修饰的工作电极对ua的选择性检测图。
24.图6是实施例1制得的rbc@mwcnts杂化体修饰的工作电极对da的选择性检测图。
25.图7中(a)是一支实施例1制得的rbc@mwcnts杂化体修饰的工作电极在含有100μm da和200μm ua的0.1m pbs缓冲溶液中间隔一定时间八次dpv测试曲线图;(b)是五支实施例1制得的rbc@mwcnts杂化体修饰的工作电极在含有100μm da和200μm ua的0.1m pbs缓冲溶液中的dpv图。
26.图8是实施例1制得的rbc@mwcnts杂化体修饰的工作电极长期稳定性测试柱状图。
具体实施方式
27.以下通过实施例对本发明的上述内容做进一步详细说明,但不应该将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容实现的技术均属于本发明的范围。
28.实施例1碳布电极的预处理将商用碳布(cc)依次在丙酮和乙醇中超声处理30min,自然晾干后,再将碳布浸入浓硫酸和浓硝酸的混合酸溶液中(浓硫酸:浓硝酸=3:1,v/v)处理24h,然后将碳布上的混合酸用去超纯水反复多次冲洗直至冲洗液呈中性,干燥后得到表面预处理后的碳布电极。
29.制备rbc@mwcnts杂化体从猪血全血中离心洗涤去除上层血浆并用生理盐水洗涤三次得到压积天然红细胞,然后用4wt%戊二醛溶液固定天然红细胞,随后依次用生理盐水和超纯水离心洗涤多次得到固定红细胞a;准确称取2mg多壁碳纳米管(multiwalled carbon nanotubes,mwcnts)并加入1ml超纯水,置于冰水浴中超声分散1h得到溶液b;将固定红细胞a悬浮分散于溶液b中,再置于恒温振荡器以110转/分的转速反应24h,反应结束后离心收集沉淀物,并用超纯水离心洗涤三次以出去过量的mwcnts前体,最后用超纯水重新恢复成3%比容的rbc@mwcnts杂化体悬液,于4℃保存备用。
30.图1是本实施例制得的rbc@mwcnts杂化体的fesem图,从图中可以看出rbc@mwcnts杂化体呈现双凹圆盘形,其表面比较粗糙,细胞表面均匀覆盖了一层碳纳米管,表明cnts人造壳层在红细胞表面成功形成。图2是本实施例制得的rbc@mwcnts杂化体的tem图,从图中可以看到红细胞膜表面包覆了一层碳纳米管形成的人造壳层,该壳层厚度大约为300nm。
31.制备rbc@mwcnts杂化体修饰的工作电极将30μl 3%比容的rbc@mwcnts杂化体悬液滴加到预处理后碳布电极表面,于室温自然晾干后得到基于rbc@mwcnts杂化体修饰的工作电极。
32.电化学测试将上述得到的基于rbc@mwcnts杂化体修饰的工作电极与对电极、参比电极组成三电极体系(铂片为对电极,ag/agcl为参比电极),然后在室温条件下进行电化学测试,电解液为0.1m的磷酸盐缓冲溶液,测试之前先通n
2 30min,然后采用差分脉冲伏安法(dpv),进行测试。测试过程中,待稳定后滴加不同浓度的多巴胺或尿酸溶液。
33.图3是本实施例制得的rbc@mwcnts杂化体修饰工作电极在含50μm da的0.1m pbs(ph=7.4)缓冲液中不同浓度ua的dpv图以及相对应的线性曲线图,从图中可以看出,在2~500μm范围内,尿酸(ua)电流的响应随ua浓度的增加而线性增加,在ua浓度为2-150μm,回归方程为i(ma)=0.0092c
ua
+0.2850(r2=0.9940),在ua浓度为150-500μm,回归方程为i(ma)=0.0045c
ua
+0.9930(r2=0.9890),使用检测限计算公式lod=3s/b(其中s代表空白的标准偏差,b是浓度对峰值电流的线性方程的斜率)计算得到ua的检测下限(lod)约为0.69μm。
34.图4是本实施例制得的rbc@mwcnts杂化体修饰工作电极在含100μm ua的0.1m pbs(ph=7.4)缓冲液中不同浓度da的dpv图以及相对应的线性曲线图,从图中可以看出,在4~400μm范围内,多巴胺(da)电流的响应随da浓度的增加而线性增加,在da浓度为4-150μm,回归方程为i(ma)=0.022c
da
+0.384(r2=0.9899),在da浓度为150-400μm,回归方程为i(ma)=0.0098c
da
+2.051(r2=0.9845),使用检测限计算公式lod=3s/b(其中s代表空白的标准偏差,b是浓度对峰值电流的线性方程的斜率)计算得到da的检测下限(lod)约为0.10μm。
35.图5是本实施例制得的rbc@mwcnts杂化体修饰工作电极对尿酸的选择性检测图,这是通过在含有200μm ua的pbs缓冲液中添加0.9mm kcl、nacl、k2co3和0.5mm aa、l-cys、glu、gsh、sucrose进行的,电化学测试结果表明,这些物质不会对ua的测定造成明显的干扰,表明基于rbc@mwcnts杂化体生物传感器对ua具有良好的选择性和抗干扰能力。
36.图6是本实施例制得的rbc@mwcnts杂化体修饰工作电极对多巴胺的选择性检测图,这是通过在含有100μm da的pbs缓冲液中添加0.9mm kcl、nacl、k2co3和0.5mm aa、l-cys、glu、gsh、sucrose进行的,电化学测试结果表明,这些物质不会对da的测定造成明显的
干扰,表明基于rbc@mwcnts杂化体生物传感器对da具有良好的选择性和抗干扰能力。
37.图7是本实施例制得的rbc@mwcnts杂化体修饰工作电极的重现性测定。图7(a)是同一支rbc@mwcnts杂化体修饰的工作电极在含有100μm da和200μm ua的0.1m pbs缓冲溶液中间隔一定时间八次dpv测试曲线图。从图中可以看出,da和ua的峰值电流强度没有发生明显的变化,通过8次测定结果计算da和ua的相对标准偏差(rsd)分别为1.29%和0.89%。图7(b)是平行制备的5支rbc@mwcnts杂化体修饰的工作电极,在含有100μm da和200μm ua的0.1m磷酸盐缓冲溶液中所作dpv测试图,从图中可以看出5次测定的da和ua的响应电流值基本相同,没有发现明显的电流衰减,根据da和ua的5次电流值计算的相对标准偏差(rsd)分别为0.23%和0.82%。综上两种测试表明rbc@mwcnts杂化体修饰工作电极对da和ua的检测具有良好的重现性。
38.图8是本实施例制得的rbc@mwcnts杂化体修饰工作电极的长期稳定性测试柱状图,从图中可以看出rbc@mwcnts杂化体修饰工作电极在冰箱存放10天后,da和ua的峰值信号仍能分别保持其初始值的93.6%和91.4%,表明rbc@mwcnts杂化体修饰工作电极对da和ua的检测具有良好的稳定性。
39.实施例2碳布电极的预处理,其具体步骤同实施例1。
40.制备rbc@mwcnts-cooh杂化体从羊血全血中离心洗涤去除上层血浆并用生理盐水洗涤三次得到压积天然红细胞,然后用4wt%戊二醛溶液固定天然红细胞,随后依次用生理盐水和超纯水离心洗涤多次得到固定红细胞a;准确称取2mg羧基化多壁碳纳米管并加入1ml超纯水,置于冰水浴中超声分散1h得到溶液b;将固定红细胞a悬浮分散于溶液b中,再置于恒温振荡器以110转/分的转速反应24h,反应结束后离心收集沉淀,并用超纯水离心洗涤三次以出去过量的mwcnts-cooh前体,最后用超纯水重新恢复成3%比容的rbc@mwcnts-cooh杂化体悬液,于4℃保存备用。
41.制备rbc@mwcnts-cooh杂化体修饰的工作电极,其具体步骤同实施例1。
42.生物传感测试,其具体步骤同实施例1,所制备的基于rbc@mwcnts-cooh杂化体修饰的工作电极对多巴胺的检出下限为0.10μm,对ua的检测下限约为0.69μm,且具有良好的选择性、重现性和稳定性。
43.实施例3碳布电极的预处理,其具体步骤同实施例1。
44.制备rbc@mwcnts-nh2杂化体从兔血全血中离心洗涤去除上层血浆并用生理盐水洗涤三次得到压积天然红细胞,然后用4wt%戊二醛溶液固定天然红细胞,随后依次用生理盐水和超纯水离心洗涤多次得到固定红细胞a;准确称取2mg氨基化多壁碳纳米管并加入1ml超纯水,置于冰水浴中超声分散1h得到溶液b;将固定红细胞a悬浮分散于溶液b中,再置于恒温振荡器以110转/分的转速反应24h,反应结束后离心收集沉淀,并用超纯水离心洗涤三次以出去过量的mwcnts-nh2前体,最后用超纯水重新恢复成3%比容的rbc@mwcnts-nh2杂化体悬液,于4℃保存备用。
45.制备rbc@mwcnts-nh2杂化体修饰的工作电极,其具体步骤同实施例1。
46.生物传感测试,其具体步骤同实施例1,所制备的基于rbc@mwcnts-nh2杂化体修饰
的工作电极对多巴胺的检出下限为0.10μm,对ua的检测下限约为0.69μm,且具有良好的选择性、重现性和稳定性。
47.实施例4碳布电极的预处理,其具体步骤同实施例1。
48.制备rbc@mwcnts-oh杂化体从人血全血中离心洗涤去除上层血浆并用生理盐水洗涤三次得到压积天然红细胞,然后用4wt%戊二醛溶液固定天然红细胞,随后依次用生理盐水和超纯水离心洗涤多次得到固定红细胞a;准确称取2mg羟基化多壁碳纳米管并加入1ml超纯水,置于冰水浴中超声分散1h得到溶液b;将固定红细胞a悬浮分散于溶液b中,再置于恒温振荡器以110转/分的转速反应24h,反应结束后离心收集红细胞,并用超纯水离心洗涤三次以出去过量的mwcnts-oh前体,最后用超纯水重新恢复成3%比容的rbc@mwcnts-oh杂化体悬液,于4℃保存备用。
49.制备rbc@mwcnts-oh杂化体修饰的工作电极,其具体步骤同实施例1。
50.生物传感测试,其具体步骤同实施例1,所制备的基于rbc@mwcnts-oh杂化体修饰的工作电极对多巴胺的检出下限为0.10μm,对ua的检测下限约为0.69μm,且具有良好的选择性、重现性和稳定性。
51.以上实施例描述了本发明的基本原理、主要特征及优点,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入本发明保护的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1