溶瘤单纯疱疹病毒VP5蛋白与人白细胞抗原E的互作方法及应用与流程
溶瘤单纯疱疹病毒vp5蛋白与人白细胞抗原e的互作方法及应用
技术领域
1.该发明专利申请涉及生物技术,具体溶瘤单纯疱疹病毒vp5蛋白与人白细胞抗原e的互作方法及应用,据此可以筛查疾病、减少肿瘤细胞、也可相应构建点突变动物模型用于医学研究。
背景技术:
2.溶瘤病毒进入靶细胞后,利用病毒的复制能力,可以破坏靶细胞。当溶瘤病毒病毒基因组传递到易感的靶细胞中,通过篡改细胞的生物合成机制以制造后代病毒。这些后代病毒会传播到相邻细胞中,从而导致组织被破坏的特征性模式。这会激发先天性和适应性免疫反应(细胞和体液),从而抵抗感染并保护宿主免于将来再暴露于同一病毒。从一个药理学的角度来看,病毒基因组可以看作是一类新的组织破坏性药物,而病毒颗粒可以看作是一种纳米级的核酸传递载体。
3.单纯疱疹病毒是最常用的溶瘤病毒载体之一,利用其庞大的基因组可进行基因改造,从而提高它的溶瘤活性。溶瘤单纯疱疹病毒(ohsv)通常是通过删除icp34.5来构建的,它可以有效地传递各种转基因来协助破坏肿瘤细胞。其中,i型单纯疱疹病毒(hsv-1)因其选择性裂解肿瘤细胞的能力在实验和临床研究中广泛使用。
4.ohsv2是在单纯疱疹病毒株ⅱ型(hsv2)标准毒株hg52的基础上,敲除了icp34.5基因(infected cell protein 34.5)和icp47基因(infected cell protein 47),插入编码人粒细胞巨噬细胞集落刺激因子(human granulocyte macrophage colony stimulating factor,hgm-csf)的表达序列的新型溶瘤病毒。
5.对于单纯疱疹病毒株ⅱ型(hsv2),其中敲除的icp34.5是一种神经毒性因子,可以抑制i型干扰素(ifn)反应,拮抗非分裂细胞内的pkr信号通路,icp34.5基因的敲除提高了肿瘤细胞的选择性,防止神经元的感染。icp47可以阻断tap(与抗原加工相关的转运体)的功能,从而阻止了受感染细胞向cd8
+
t细胞呈递抗原,icp47的敲除诱导了us11启动子的早期激活,增加溶瘤病毒治疗活性,还使健康细胞和肿瘤细胞都呈递病毒抗原,抑制健康组织的感染,免疫介导破坏肿瘤细胞,选择性繁殖溶瘤病毒。hgm-csf可以促进树突状细胞的积累和成熟,改善肿瘤抗原呈递并刺激强大的t细胞反应。
6.同时有研究表明,hsv-2的溶瘤作用可能优于hsv-1,hsv-2的结构域可以激活ras/mek/mapk途径并提高病毒繁殖效率。hsv-2可以选择性感染肿瘤细胞并形成合胞体,比hsv-1产生更好的抗肿瘤免疫反应。与hsv-1溶瘤病毒相比,hsv-2溶瘤病毒fuson-h2以较低的感染复数(moi)更有效地杀死mda-mb-435人乳腺癌细胞,从而产生了更多的无肿瘤小鼠。其能释放出更多的合胞体,从而使树突状细胞(dc)更有效地工作,并导致更强大的抗原交叉呈递。icp10pk缺失的ohsv-2病毒dpk通过直接溶瘤功能和诱导程序性细胞死亡途径引起癌细胞死亡。ohsv2的溶瘤作用与具有相同moi的ohsv1的溶瘤作用相同,删除了icp34.5和icp47基因的新型hsv-2溶瘤病毒,在4t1模型中充分展示了治疗潜力以及对免疫应答的诱导作
用。
7.主要组织相容性复合体(major histocompatibility complex,mhc)是一组与免疫应答密切相关的基因群。人的mhc称为人类白细胞抗原(humanleucocyte antigens,hla)基因复合体,可分为hla
ꢀⅰ
、hla
ꢀⅱ
、hla
ꢀⅲ
类;基因通常分为两类:经典类(ⅰa类)以及非经典类(ⅰb类),在肿瘤细胞表面hla
ꢀⅰ
a类分子的表达通常下调甚至丢失,从而逃避细胞毒性t淋巴细胞(ctl)对其的识别和特异性杀伤,理论上nk细胞可以杀伤缺乏hla
ꢀⅰ
a分子的肿瘤细胞,但这些肿瘤细胞也可以逃避nk细胞的攻击,这种现象可能与肿瘤细胞表面hla i b分子的表达有关。
8.人类白细胞抗原e(hla-e)是功能和作用途径较为明确的hla
ꢀⅰ
b类分子,具有组织分布狭窄,但细胞表面表达较低的特征,几乎在所有成人细胞表面低水平表达。但已有多项研究证实了hla-e在许多类型的人类肿瘤细胞的表面过表达。hla-e是cd94/nkg2a的主要配体,该受体在来自外周血的超过50%的cd56
bright
或cd56
dim nk细胞和cd8+t细胞的一些子集上表达,是一种抑制性受体。它们的结合会抑制cd8+ctl细胞和nk细胞对肿瘤细胞的细胞溶解活性。因此,hla-e在肿瘤细胞上的过表达是肿瘤免疫逃逸的重要机制之一。
9.前期研究发现,uv-ohsv2的处理可以使bgc823、lovo和u87mg细胞上的hla-e上调表达,且nk细胞联合uv-ohsv2/hla-e抗体能够增强nk细胞抗肿瘤能力。hla-e为肿瘤细胞表面抑制性免疫检查点分子,研究ohsv2通过何种蛋白上调肿瘤细胞上hla-e的表达非常重要,这与ohsv2的治疗效果相关。
10.遗憾的是,由于对溶瘤病毒缺乏系统全面的研究,国内外仍然无法明确溶瘤病毒与癌细胞的作用机理,因此,需要进一步研究ii型溶瘤单纯疱疹病毒与肿瘤细胞之间的作用机理,以及基于该作用机理做制备得到的检测分子、质粒,在此前提下,进一步发掘ii型溶瘤单纯疱疹病毒在靶向药物中的重要应用方向。
技术实现要素:
11.本发明发现了溶瘤单纯疱疹病毒上的vp5蛋白能够与肿瘤细胞的hla-e互作,能够影响肿瘤细胞表面抑制性免疫检查分子hla-e,进而能够提高nk细胞和/或cd8+ctl细胞,其中vp5蛋白是由ul19基因片段表达。
12.第一方面,本发明提供了一种uv-ohsv2感染肿瘤细胞的方法,所述的感染肿瘤细胞的方法能够上调肿瘤细胞表面抑制性免疫检查分子hla-e。
13.在一些实施例中,所述的肿瘤细胞为bgc823、lovo、u87-mg细胞。
14.第二方面,本发明提供了一种hla-e-gst质粒的构建方法,利用该方法可制备hla-e-gst质粒。
15.在一些实施例中,利用uv-ohsv2与肿瘤细胞系孵育,使用gst pull down的方法叼取病毒表面与hla-e相互作用的病毒蛋白的基因;
16.在一些实施例中,质粒的构建方法中以pgex-6p-1为质粒载体,插入基因为hla-e,酶切位点为ecori,not i,构建hla-e-gst质粒。
17.第三方面,本发明提供了一种flag-hla-e质粒的构建方法,利用该方法可制备flag-hla-e质粒。在一些实施例中,所述的flag-hla-e质粒的构建使用质粒载体为pcmv-n-flag,插入基因为hla-e,酶切位点ecor
ꢀⅰꢀ
xho
ꢀⅰ
。
18.第四方面,本公开提供了一种ha-hla-e质粒的构建方法,利用该方法可制备ha-hla-e质粒。
19.在一些实施例中,所述的ha-hla-e质粒的构建使用的质粒载体为pcmv-n-ha,插入基因为hla-e,酶切位点为ecor
ꢀⅰ
。
20.第五方面,本公开提供了一种flag-ul19质粒的构建方法,利用该方法可制备flag-ul19质粒。
21.在一些实施例中,所述的flag-ul19质粒的构建使用质粒载体为pcdna3.1-3ha,插入基因为ul19(4125bp),酶切位位点xba1 bamh1。
22.第六方面,本公开提供了一种ha-ul19质粒的构建方法,利用该方法可制备ha-ul19质粒。
23.在一些实施例中,所述的ha-ul19质粒的构建使用质粒载体为p3xflag-cmv,插入基因为ul19(4125bp),酶切位点为hind3 bamh1。
24.第七方面,本发明提供了利用hla-e-gst质粒制备融合蛋白的方法;
25.在一些实施例中,将hla-e-gst质粒转化de3感受态,接种于lb液体培养基(含10-200mg/l amp),摇菌。然后加入iptg,低温诱导表达。离心收集菌体,超声破碎,离心后的上清使用gst标签蛋白纯化试剂盒进行纯化。
26.第八方面,本发明提供了一种减少肿瘤细胞免疫逃逸的方法;
27.在一些实施例中,所述的减少肿瘤细胞免疫逃逸的方法是利用肿瘤细胞表面人类白细胞抗原e(hla-e)过表达过程中,hla-e和ul19表达的vp5蛋白互作,减少hla-e与cd94/nkg2a的结合,提高抑制cd8
+
ctl细胞和nk细胞对肿瘤细胞的细胞溶解活性。
28.在一些实施例中,所述的vp5蛋白是由含有ul19基因片段的质粒、溶瘤单纯疱疹病毒表达得到。
29.在一些实施例中,所述的溶瘤单纯疱疹病毒为ii型溶瘤单纯疱疹病毒,所述的ii型溶瘤单纯疱疹病毒的vp5蛋白与人白细胞抗原e的互作,进而能够减少hla-e与cd94/nkg2a的结合,提高抑制cd8
+
ctl细胞和nk细胞对肿瘤细胞的细胞溶解活性。
30.第九方面,本发明提供了一种利用nk细胞或cn8+ctl细胞杀灭肿瘤细胞的方法;
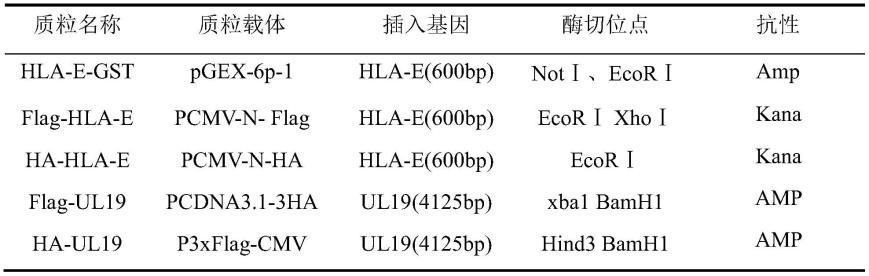
31.在一些实施例中,所述的利用nk细胞或cn8+ctl细胞杀灭肿瘤细胞的方法,在肿瘤细胞中注入含有能够表达vp5蛋白的质粒或病毒;
32.所述的质粒为flag-ul19质粒或ha-ul19质粒;
33.所述的病毒为溶瘤单纯疱疹病毒,优选的为ii型溶瘤单纯疱疹病毒,优选的为紫外灭活的ii型溶瘤单纯疱疹病毒(uv-ohsv2);
34.所述的肿瘤细胞为bgc823、lovo、u87-mg细胞。
35.第十方面,本发明提供了一种nk细胞杀伤肿瘤细胞的方法;
36.在一些实施例中,使用能够表达vp5蛋白的基因片段的质粒或病毒;
37.所述的质粒为flag-ul19质粒或ha-ul19质粒;
38.所述的病毒为溶瘤单纯疱疹病毒,优选的为ii型溶瘤单纯疱疹病毒,优选的为紫外灭活的ii型溶瘤单纯疱疹病毒(uv-ohsv2);
39.所述的肿瘤细胞为bgc823、lovo、u87-mg细胞。
40.本文中,“核酸”的类型不受特别限制,可以是任何包含与突变体的编码基因相对
应的脱氧核糖核苷酸和/或核糖核苷酸的聚合物,包括但不限于dna、rna或cdna。所述核酸,本领域技术人员应当理解,实际包括互补双链的任意一条,或者两条。为了方便,在本说明书和权利要求书中,虽然多数情况下只给出了一条链,但实际上也公开了与之互补的另一条链。本领域技术人员还可以理解,利用一条链可以检测另一条链,反之亦然。
41.本文中,“生物样品”的类型并不受特别限制,只要从该生物样品中能够提取到反映生物样品是否存在突变的核酸样本即可。根据本发明的实施例,生物样品可以为选自人体血液、皮肤、皮下组织的至少一种,优选外周血。由此,可以方便地进行取样和检测,从而能够进一步提高筛选易患cpvt的生物样品的效率。根据本发明的实施例,这里所使用的术语“核酸样本”应做广义理解,其可以是任何能够反映生物样品中是否存在突变的样本,例如可以是从生物样品中直接提取的全基因组dna,也可以是该全基因组中包含致病基因编码序列的一部分,可以是从生物样品中提取的总rna,也可以是从生物样品中提取的mrna。
42.有益效果
43.本发明发现了溶瘤单纯疱疹病毒vp5蛋白与人白细胞抗原e互作,利用该溶瘤单纯疱疹病毒衣壳蛋白能够减少hla-e与cd94/nkg2a的结合,提高抑制cd8
+
ctl细胞和nk细胞对肿瘤细胞的细胞溶解活性。该方法用于可以筛查疾病、减少肿瘤细胞、也可相应构建点突变动物模型用于医学研究。
附图说明
44.以下,结合附图来详细说明本发明的具体内容:
45.图1:uv-ohsv2上调bgc823、lovo、u87mg细胞hla-e表达量;
46.图2:图(a)pgex-6p-1双酶切核酸电泳图(b)hla-e基因pcr产物核酸电泳图(c)hla-e-gst融合蛋白western blot检测图;
47.图3:测试例1western blot验证结果;
48.图4:测试例2考马斯亮蓝染色及western blot验证结果;
49.图5:测试例4激光共聚焦实验测试结果;
50.图6:测试例5免疫共沉淀测试结果;
51.图7:uv-ohsv2刺激nk细胞后体外杀伤bgc823肿瘤细胞;
52.图8:nk92对bgc823细胞在不同时间不同效靶比的杀伤率;
53.图9:uv-ohsv2刺激nk92后对bgc823细胞的杀伤率;
54.图10:nk92对bgc823细胞实时的杀伤;
55.图11:uv-ohsv2刺激nk92细胞后体内杀伤bgc823肿瘤细胞。
具体实施方式
56.下面结合具体实施例来进一步描述本发明,以下实施例仅是范例性的,并不对本发明的应用范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
57.实施例1
58.验证溶瘤单纯疱疹病毒上调对肿瘤细胞表面抑制性免疫检查点分子hla-e。
59.使用uv-ohsv2以不同的moi分别感染bgc823、lovo、u87-mg细胞,感染24h后收样,提取rna并通过荧光定量技术检测细胞hla-e分子在mrna水平的表达量。同时将bgc823、lovo和u87mg细胞与uv-ohsv2(moi=1)孵育24h,通过流式细胞仪用抗hla-e的抗体检测了hla-e在蛋白水平的变化,具体的结果参见图1。
60.从图1的测试结果可以看出ii型单纯疱疹病毒上调肿瘤细胞表面抑制性免疫检查点分子hla-e。
61.实施例2
62.质粒构建及融合蛋白表达。
63.构建hla-e-gst、flag-hla-e、ha-hla-e、flag-ul19、ha-ul19质粒,hla-e(600bp)在bgc823细胞基因组扩增,ul19(4125bp)在ohsv2基因组扩增,与目的基因大小相符。质粒相关信息如表1,质粒载体进行双酶切后与插入基因片段重组、转化、挑单克隆,再进行核酸电泳鉴定,出现hla-e、ul19阳性结果的菌株外送测序。测序结果与ncbi上hla-e和ul19序列进行比对。
64.表1质粒构建信息
[0065][0066]
flag-hla-e、ha-hla-e、flag-ul19、ha-ul19序列比对成功的质粒进行293t转染24-48h后,弃培养上清,pbs清洗2次后,rapi裂解液裂解30min,离心取上清,加sds-page备用。
[0067]
其中,构建hla-e-gst质粒,通过western blot的方法用anti-hla-e单抗作为一抗检验hla-e蛋白的表达,如图2。
[0068]
实施例3
[0069]
本实施例用于制备hla-e-gst融合蛋白。
[0070]
将hla-e-gst质粒转化de3感受态,以1:100接种于lb液体培养基(含100mg/l amp),37℃摇菌。然后加入iptg,20℃低温诱导表达过夜。接下来4℃离心收集菌体,超声破碎15min,4℃离心后的上清使用gst标签蛋白纯化试剂盒进行纯化。
[0071]
测试例1
[0072]
本测试例用于测试hla-e-gst(图d)、flag-hla-e(图a)、ha-hla-e(图a)、flag-ul19(图c)、ha-ul19(图b)质粒是否构建成功,能够表达hla-e-gst、flag-hla-e、ha-hla-e、flag-ul19、ha-ul19融合蛋白。制备例1质粒转染后的样品和制备例2诱导表达的样品,用anti-ha、anti-flag抗体及anti-hla-e抗体进行western blot验证,结果显示,条带与目的条带相符,证实,质粒构建成功,具体的结果如图3。
[0073]
测试例2
[0074]
本测试例用于测试hla-e-gst融合蛋白是否能够用gst标签蛋白纯化试剂盒进行纯化。
[0075]
由制备例2,hla-e-gst质粒转化de3感受态后,进行低温诱导表达、破碎及纯化,用考马斯亮蓝染色及western blot验证。结果显示,可纯化出较纯的hla-e-gst融合蛋白如图4。
[0076]
如图4的测试结果,可以看到hla-e-gst融合蛋白能够用gst标签蛋白纯化,并且的能够用于gst pull down研究,与高滴度的ohsv2进行孵育,叼取病毒表面与hla-e-gst互相作用的蛋白,并进行质谱分析。
[0077]
测试例3
[0078]
将ohsv2孵育,得到高滴度的ohsv2,gst pull down的方法叼取病毒表面衣蛋白,由实施例3中纯化出的hla-e-gst融合蛋白,银染,切下目的条带外送进行质谱分析,测试结果见下表。
[0079]
表2质谱测试结果表
[0080][0081]
从质谱分析的结果显示,与hla-e-gst互作的蛋白为病毒主要vp5蛋白,进一步的验证了ohsv2的衣壳蛋白可以与hla-e互作,为后续的杀灭肿瘤细胞提高理论支撑。
[0082]
测试例4
[0083]
激光共聚焦实验
[0084]
由实施例2中制备得到的质粒,对flag-hla-e、ha-hla-e、flag-ul19、ha-ul19质粒,hla-e和ul19质粒1:1共转染293t细胞24h后,4%多聚甲醛固定,免疫荧光染色、染核后在激光共聚焦显微镜下观察,结果显示,hla-e和ul19表达的vp5无论带何种免疫荧光标签,荧光均在细胞质中分布,在荧光叠加后,可以观察到他们在细胞质中的共定位,观察的结果见图5,共聚焦实验结果证实,hla-e与ul19表达的vp5蛋白互作。
[0085]
测试例5
[0086]
免疫共沉淀
[0087]
激光共聚焦技术已证实hla-e与ul19互作,为了进一步验证hla-e与ul19互作,进行免疫共沉淀验证。将构建完成的ha-ul19和flag-hla-e转染293t细胞至10mm培养皿中培养40-48h,np40裂解液,加磁珠过夜,进行western blot验证。如图6所示,共转组有目的条带,免疫共沉淀结果证实,hla-e与ul19表达的vp5蛋白互作。
[0088]
实施例4
[0089]
原代的nk细胞,并与uv-ohsv2共孵育,按分组并应用实时细胞分析系统进行监测,结果如图7所示,于黑色箭头所示之处加入uv-ohsv2处理与未处理的nk细胞与bgc823细胞共孵育,在实验总共检测的108个小时中可见未处理的nk细胞对bgc823肿瘤细胞存在一定的杀伤,同时uv-ohsv2刺激后的nk细胞较之于未刺激的nk细胞存在更显著的杀伤能力。
[0090]
实施例5
[0091]
uv-ohsv2刺激nk92细胞后体外杀伤bgc823肿瘤细胞。
[0092]
用bgc823细胞铺板后,nk92细胞以及uv-ohsv2刺激后的nk92细胞针对人胃癌细胞系bgc823的杀伤情况。如图8所示,杀伤4h效果比6h更显著,因此选取共孵育4h为后期实验的固定条件。
[0093]
图9中所示,uv-ohsv2刺激nk92细胞后,所设置的各组不同效靶比的杀伤率均有显著的上升。
[0094]
其中当效靶比为e:t=5:1时,nk92+uv-ohsv2组的杀伤率与nk92组的杀伤率有极显著差异;
[0095]
且当效靶比为e:t=10:1时,nk92+uv-ohsv2组的杀伤率与nk92组的杀伤率有显著差异,更高的效靶比能带来针对bgc823胃癌细胞更显著的杀伤。
[0096]
同时确定了uv-ohsv2病毒的制剂缓冲液对nk92的细胞毒性影响并未产生统计学差异,因此排除制剂缓冲液对靶细胞的杀伤,实验所示的杀伤来自于效应细胞的影响。
[0097]
同时,为了监测nk92对bgc823细胞实时的杀伤情况,应用了实时细胞分析系统,结果如图10所示,可以看出uv-ohsv2刺激后的nk92细胞展现了更强的杀伤能力,uv-ohsv2刺激组较之于nk92未刺激组有极显著的差异。
[0098]
实施例6
[0099]
uv-ohsv2刺激nk92细胞后体内杀伤bgc823肿瘤细胞。为了验证nk92细胞是否能在体内发挥与体外相似的杀伤能力,应用到了裸鼠模型,nk92细胞及uv-ohsv2刺激12h后的nk92细胞作为实验组,同时设置了注射pbs的对照组;将效应细胞与肿瘤细胞同时给裸鼠皮下接种。注射后的第六天对照组裸鼠皮下可见肿瘤,其后每隔三天对裸鼠皮下的肿瘤进行测量与记录,结果如图11所示,裸鼠肿瘤生长的趋势图中,注射了uv-ohsv2共孵育后的nk92细胞与bgc823细胞,其组别肿瘤体积和pbs对照组相比,有极显著的差异。
[0100]
上述实施方式为本发明的优先实施方式,但本发明不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
[0101]
另外,需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
[0102]
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1