基于MXene纳米材料的乙基葡萄糖醛酸苷电化学生物传感器及其制备方法和检测方法
基于mxene纳米材料的乙基葡萄糖醛酸苷电化学生物传感器及其制备方法和检测方法
技术领域
1.本发明涉及免疫电化学生物传感器技术领域,具体涉及一种基于mxene纳米材料的乙基葡萄糖醛酸苷电化学生物传感器及其制备方法和检测方法。
背景技术:
2.乙醇非氧化代谢物(non-oxidative metabolomics ofethanol)是乙醇进入人体后通过非氧化代谢途径生成的代谢产物,因其半衰期和稳定性较乙醇及其氧化代谢物更长,所以在检测是否饮酒、推断饮酒时间、推断饮酒后死亡时间、鉴别生前饮酒与尸体分解产生乙醇等方面有着广阔的研究前景。目前乙基葡萄糖醛酸苷检测策略,包括固相萃取(spe)
‑ꢀ
气相色谱-质谱(gc-ms)、液相色谱-串联质谱(lc-ms/ms)、气相色谱-串联质谱 (gc-ms/ms)、免疫试剂盒等。然而,有些技术需要用d5标记乙基葡萄糖醛酸苷(ethylglucuronide,etg),这对操作者的健康和环境有害。其他技术需要昂贵的或大型的仪器,或复杂的操作步骤,或长时间检测时间或熟练人员,因此极大地限制了它们在乙基葡萄糖醛酸苷快速检测中的应用。电化学生物传感器以操作简单、省时、成本低、小型化、灵敏度高、选择性高等优点引起了广泛的关注和快速发展。到目前为止,电化学技术已经应用许多领域。因此,开发简单、便携、低成本且能定量检测乙基葡萄糖醛酸苷的方法具有重要意义。
3.纳米技术的出现为通过信号放大策略检测生物分子开辟了新的途径。2011年美国德雷塞尔大学的研究者们首次报道了mxene材料
‑‑
二维过渡金属碳化物、氮化物或碳氮化物,是由层状陶瓷材料max相刻蚀去除a元素后得到的一类新型二维纳米材料。此命名既体现出该材料来源于max相,又突出其具有类石墨烯(graphene)的二维片层结构的特征。mxene的化学式可表示为mn+1xntx,其中m代表前过渡金属元素(sc、ti、v、 cr、zr、nb、mo等),x代表c或/和n元素,tx代表表面端基(—o、—oh、—f等)。由于max相组成和结构的多样性,由其衍生的mxene材料也成为二维材料中最为庞大的一个家族,理论预测有100多种,目前已合成的有40多种。mxene纳米材料因其较大的比表面积和优良的物理化学性能,在电催化、光学、电化学等多个领域得到了广泛的研究和应用。有研究表明,mxene具有较强的还原能力,可以在没有还原剂和稳定剂的情况下还原金属纳米颗粒。
4.金纳米粒子是一种稳定的纳米材料,拥有很好的生物相容性,它可以与很多生物分子共轭结合并且不改变这些分子的性质和活性。aunps-mxene纳米复合材料和mxene/ag 复合材料,具有良好的导电性、电催化活性及很好的生物相容性。电化学生物传感器是科研中最常用的检测方法之一,具有选择性好、灵敏度高、操作简单的优点。目前,基于电化学技术的生物传感器已经实现了多种生物标物的检测,电化学生物传感器越来越成为一种可靠的生物检测平台。
技术实现要素:
5.本发明的目的是针对现有技术中etg检测存在的上述技术问题,提供一种基于
mxene 纳米材料的乙基葡萄糖醛酸苷电化学生物传感器,利用etg与etg-bsa竞争结合来定量检测乙基葡萄糖醛酸苷,经实验验证,检测结果准确可靠。基于此,本发明保护如下技术方案:
6.一种基于mxene纳米材料的乙基葡萄糖醛酸苷电化学生物传感器的制备方法,是将 aunps-nb4c3tx复合物通过桥联剂壳聚糖固定在电极表面,然后将组氨酸标记的重组蛋白g结合在金纳米颗粒表面,将etg抗体通过组氨酸标记的重组蛋白g固定在电极表面;包括如下步骤:
7.s1、aunps-nb4c3tx/壳聚糖溶液的制备:取aunps-nb4c3tx复合材料分散于壳聚糖溶液中,储存备用;
8.s2、aunps-nb4c3tx的固定:取步骤s1制备的aunps
‑‑
nb4c3tx/壳聚糖溶液包被电极,晾干;
9.s3、his-pg与aunps-nb4c3tx的结合:取his-pg溶液包被经aunps-nb4c3tx修饰的电极;
10.s4、继续在电极上包被etg抗体,然后用封闭液封闭电极表面的非特异性结合位点。
11.所述aunps-nb4c3tx复合材料的制备方法为:取mxene纳米材料nb4c3tx加入去离子水中,分散均匀,然后加入haucl4溶液,充分反应后,离心、洗涤,分离上清液和沉淀物,沉淀物即为aunps-nb4c3tx复合材料。
12.aunps-nb4c3tx复合材料的制备方法中,nb4c3tx的浓度为0.5-2mg/ml,优选0.5-1.5 mg/ml或0.8-1.5mg/ml或1mg/ml。
13.在上述技术方案中,所述etg抗体为单克隆抗体,所述封闭液为牛血清白蛋白,所述电极为金电极或玻碳电极。
14.在上述传感器的制备方法技术方案中,步骤s3中his-pg溶液的浓度为15-25μg/ml,优选为17-23μg/ml或19-21μg/ml。
15.在上述传感器的制备方法技术方案中,
16.步骤s4中包被etg抗体时的抗体孵育时间为2-4h,优选2.5-3.5h或3h;
17.etg抗体的浓度为15-25μg/ml,优选为17-23μg/ml或19-21μg/ml。
18.上述任一项所述的制备方法制备得到的乙基葡萄糖醛酸苷电化学生物传感器。
19.一种乙基葡萄糖醛酸苷的检测方法,是采用前述的乙基葡萄糖醛酸苷电化学生物传感器进行检测。
20.所述的检测方法,是基于etg与etg-bsa竞争结合etg抗体进行检测,每份含有etg 的待检样品与已知浓度的etg-bsa溶液混合后采用上述的乙基葡萄糖醛酸苷电化学生物传感器进行检测,包括如下步骤:
21.1)建立标准曲线方程:配制不同浓度梯度的etg标准溶液,将etg标准溶液与 etg-bsa溶液混合后滴加到电极表面,室温下充分反应,采用电化学阻抗测试法测量相应的阻抗信号;根据etg浓度与阻抗信号之间的相互关系建立标准曲线方程;
22.2)将待测样品溶液与etg-bsa溶液混合后滴加到电极表面,室温下充分反应,采用电化学阻抗测试法检测阻抗信号;
23.3)将步骤2)得到的阻抗信号代入步骤1)的标准曲线方程计算得出待测样品溶液
中etg 的浓度含量。
24.优选地,
25.所述步骤1)中etg标准溶液的浓度为0.005ng/ml~520ug/ml,优选0.01ng/ml ~500ug/ml,优选etg标准溶液的不同浓度梯度为0.01ng/ml、1ng/ml、10ng/ml、100ng/ml、 1ug/ml、10ug/ml、100ug/ml、500ug/ml;
26.步骤1)、2)中etg-bsa的浓度为3-7ug/ml,优选4-6ug/ml;etg标准溶液或待测样品溶液与etg-bsa溶液等体积混合;
27.步骤1)、2)中etg/etg-bsa混合溶液与抗体的孵育时间为40~60分钟,优选40~50 分钟或45分钟;
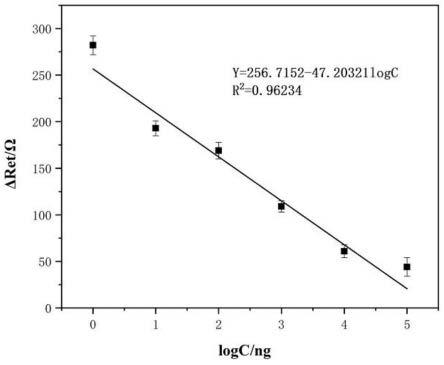
28.标准曲线回归方程为y=256.7152-47.20321logc(ng/ml),相关系数为0.96234,检测限0.11ng/ml,检测范围为1ng/ml-100ug/ml,y代表阻抗值,logc代表etg浓度的对数。
29.本发明传感器的检测原理如下:
30.将aunps-nb4c3tx复合物通过桥联剂壳聚糖固定在电极表面。利用组氨酸标记的重组蛋白g(his-pg)牢固地结合在金纳米颗粒表面,形成定向层,为抗体在金电极表面定向固定做准备。将etg抗体通过组氨酸标记的重组蛋白g固定在电极表面,etg抗体是通过片段结晶区(fc)与his-pg特异性结合,迫使etg抗体将其抗原结合位点暴露在环境中,从而提高抗原ag和抗体ab之间的识别能力。
31.etg是小分子化合物,仅有一个抗原表位,无法用双抗体夹心法负载信号分子对其进行电化学测量。且由于分子量较小,抗体与抗原的特异性结合对电子传输能力的影响不大,使得电流信号变化不大,无法实现对etg电化学方法检测的生物传感器的构建。etg-bsa 有效弥补了分子量较小这一缺点,乙基葡萄糖醛酸苷抗体可以同时识别etg和etg-bsa,当etg和etg-bsa竞争结合在电极表面时,显著提高了不同浓度etg检测时的电流强度变化,这种检测方式有助于扩大检测范围,最后对电极的电化学阻抗谱(eis)信号进行了测试、分析定量结果,从而建立对乙基葡萄糖醛酸苷无标记的电化学定量检测方法。
32.本发明的有益效果是:
33.本发明的免疫电化学生物传感器,能够实现对样品的快速、灵敏、特异性检测,具有低的检测限(0.11ng/ml)和宽的检测范围(1ng/ml-100ug/ml),且制备方法简单,制备成本低,便携,其具有优良的稳定性和重复性,具有很好的市场应用前景。
34.本发明的简单的、无标记的基于电化学阻抗法的乙基葡萄糖醛酸苷定量检测方法,操作简单,结果准确可靠,采用etg与etg-bsa竞争结合抗体的方法提高了检测灵敏度。
附图说明
35.图1是纳米复合材料aunps-nb4c3tx的扫描电镜图。
36.图2是etg生物传感器逐层组装的电化学阻抗谱。
37.图3是etg生物传感器逐层组装的循环伏安图谱。
38.图4是mxene-nb4c3tx复合金纳米颗粒后的esd图。
39.图5是不同浓度etg的奈奎斯特图。
40.图6是不同浓度mxene-nb4c3tx对检测信号的影响。
41.图7是抗体的结合时间对检测信号的影响。
42.图8是不同浓度etg-bsa对检测信号的影响。
43.图9是etg-bsa的结合时间对检测信号的影响。
44.图10是本发明传感器的特异性试验。
45.图11是在不同浓度的待检etg水平下传感策略的重复性试验。
46.图12是传感策略的稳定性试验。
47.图13是不同浓度etg的响应信号。
具体实施方式
48.下面结合实施例对本发明作进一步说明,但并不因此而限制本发明。
49.下述实施例中的实验方法,如无特别说明,均为常规方法;所用生物、化学试剂,如无特殊说明,均为本领域常规试剂,均可商购获得。
50.主要试剂来源:
51.碳化铌(nb4c3tx)mxene多层纳米片(cas号:12069-94-2):品牌为先丰纳米 (xfnano);
52.etg-bsa(bsa修饰的etg抗原):etbylgucuronide(etg)-bsaantigen,eastcoastbio (usa),规格-1mg,货号laoo7;
53.etg抗体:ethylglucuronide(etg)antibod,eastcoast bio(usa),规格1mg货号, hm128;
54.组氨酸标记的重组蛋白g(his-pg):recombinantproteina/ghis,品牌:生工(中国),货号c610042-0001。
55.实施例1制备本发明的etg免疫电化学生物传感器
56.按照如下步骤操作:
57.(1)aunps-nb4c3tx的制备
58.首先,将1mg mxene-nb4c3tx加入5ml去离子水中,超声20min,使其均匀分散在水中。然后在搅拌条件下滴注加入1ml新鲜制备的四氯金酸(haucl4)水溶液(20 mmol/l),充分反应5分钟后,离心洗涤3次,分离上清液和沉淀物。最后将沉淀物分散于1ml的0.5%壳聚糖溶液(0.05g壳聚糖溶解于10ml 1%冰醋酸)中,并置于棕色瓶 4℃储存。
59.纳米复合材料aunps-nb4c3tx的成功合成对本发明的传感器的制备起着至关重要的作用,采用扫描电子显微镜、电化学阻抗谱和eds能谱对制备的aunps-nb4c3tx进行了形态学表征,如图1、图4所示,纳米复合材料aunps-nb4c3tx扫描电子显微镜结果显示,金纳米颗粒已成功复合到mxene-nb4c3tx纳米材料上。
60.(2)免疫电化学生物传感器的制备
61.①
aunps-nb4c3tx的固定:取步骤(1)中制备的包含壳聚糖的aunps-nb4c3tx(1 mg/ml)的溶液10μl滴加在金盘电极表面,并在室温下自然干燥。
62.采用电化学阻抗谱及电化学循环伏安数据对合成的纳米复合材料aunps-nb4c3tx进行表征:在一个标准的三电极系统中进行了电化学实验,在含有5mm[fe(cn)6]
3-/4-和0.1 m氯化钾的工作溶液(10mm pbs,ph 7.4)中进行循环伏安法(cv)和电化学阻抗谱 (eis)分析。在扫描速率为0.1v/s的情况下,在-0.2v到0.6v的电位范围内进行cv 扫描。eis在1
×
10-1
至1
×
105hz的频率范围和50mv的振幅下进行。
100ng/ml、1ug/ml、10ug/ml、100ug/ml、500ug/ml)模拟待测液,利用实施例1制备的传感器分别进行了检测:将etg溶液与5ug/ml etg-bsa按照体积比1﹕1混合后取10μl 混合液滴加到电极表面,室温下(rt,25
±
2℃)反应45分钟,测量相应的阻抗信号。检测结果(图5)从a
→
h依次为:0.01ng/ml、1ng/ml、10ng/ml、100ng/ml、1ug/ml、10ug/ml、 100ug/ml、500ug/ml。通过逐层组装,电化学阻抗值逐渐变化,其变化与cv法一致,进一步证明了本发明的免疫传感器用于检测乙基葡萄糖醛酸苷准确可靠。
[0072]
二、不同实验条件和实验参数的优化实验
[0073]
按照实施例1中的etg免疫电化学生物传感器的制备方法进行不同实验条件和实验参数的对比实验。
[0074]
1、纳米材料的浓度
[0075]
纳米材料的浓度在传感器检测性能方面起着重要的作用,因为纳米材料浓度过高,导电性就较低,相应的产生信号就比较高,而如果纳米材料浓度过低,结合在金电极的纳米材料就比较少,导电性同样会较低,因此对纳米材料的浓度进行研究尤为必要。
[0076]
本实施例对不同浓度的纳米材料nb4c3tx进行了比较,分别采用了浓度为0.1、0.5、 1、5、10mg/ml的nb4c3tx制备传感器,如图6所示,随着纳米材料的浓度的增加,阻抗信号急剧减少,当浓度在1mg/ml时阻抗最低,导电性最好,超过或低于此浓度导电性降低,因此1mg/ml为最佳纳米材料的浓度。
[0077]
2、抗体孵育时间
[0078]
对实施例1中的“抗体与his-pg/aunps-nb4c3tx的结合”步骤中的抗体孵育时间进行比较,分别设置孵育时间1、2、3、4小时进行实验。
[0079]
抗体孵育时间对信号产生的影响如图7所示,从图7中可以看出,孵育时间在起初3 小时呈上升趋势,当孵育时间达到3小时后,信号达到最大并处于稳定状态,所以我们选择抗体最佳孵育时间为3小时。
[0080]
3、etg-bsa与etg抗体结合的浓度
[0081]
取不同浓度的etg-bsa与包被了etg抗体的电极进行孵育,etg-bsa浓度为:5ng/ml、 50ng/ml、500ng/ml、5ug/ml、50ug/ml。
[0082]
etg-bsa与抗体结合的浓度对信号产生的影响如图8所示。结合浓度5ng/ml-50ug/ml,从图中可以看出,在结合浓度在5ng/ml-5ug/ml范围内信号呈上升趋势,当结合浓度达到 5ug/ml时,信号达到最大并处于稳定状态,所以我们选择etg-bsa与抗体结合的最佳结合浓度为5ug/ml。
[0083]
4、etg-bsa与etg抗体结合的时间
[0084]
将10μl 5ug/ml etg-bsa滴加到包被了etg抗体的电极表面,室温下(rt,25
±
2℃) 反应,设置了不同反应时间:30分钟、45分钟、60分钟、90分钟。
[0085]
etg-bsa与etg抗体结合的时间对信号产生的影响如附图9所示。从图9中可以看出,孵育时间在起初45分钟呈上升趋势,当孵育时间达到45分钟时,信号达到最大并处于稳定状态,所以我们选择etg-bsa与抗体的最佳结合时间为45分钟。
[0086]
5、传感器的特异性实验、重复性和稳定性
[0087]
本实施例对本发明的传感策略的特异性进行了试验,结果如图10所示,从a-e分别为:a(etg+5ugetg-bsa)、b(pbs+5ugetg-bsa)、c(methylβ-d-glucuronide+5ugetg-bsa)、 d
(1-propylβ-dglucuronide+5ugetg-bsa)、e(1-butylβ-d-glucuronide+5ugetg-bsa)、 f(1-butylβ-d-glucuronide+5ugetg-bsa)、g(tert-butylβ-d-glucuronide+5ugetg-bsa),与 a(etg+5ugetg-bsa)相比其它各组都呈现出了较高的阻抗信号,且阻抗信号较为接近,这表明了该传感策略的优秀特异性。
[0088]
对该传感策略的重复性进行了试验,方法如下:取三个浓度水平的etg待检样品 (1ng/l,1ug/l,100ug/l),每个浓度测三次,并计算相对标准偏差。测试结果如图11 所示,以上三个浓度水平的etg待检样品相对标准偏差分别为1.8%,1.6%,1%。结果表明该传感策略具有良好的重复性。
[0089]
对该传感器的稳定性进行了试验:取实施例1制备好的传感器4℃下放置不同时间后用于etg检测,取装配好的传感器与待测液-etg-bsa混合液在常温条件下孵育45分钟,测量其电化学参数。如图12所示,试验结果表明,当在4℃下储存时,本发明的免疫电化学生物传感器储存2周后其检测性能依然良好。
[0090]
6、传感器的灵敏性
[0091]
为了评估本发明的传感策略对靶标的分析性能,我们用一系列不同浓度的etg对本策略进行了研究。根据0.01ng/ml到100ug/ml不同浓度的靶etg检测到的结果,如图13 所示,从图13中可以看出,随着etg浓度的增加,信号也跟着增加,当etg浓度在1ng/ml 到100ug/ml范围时,信号的增加与etg浓度的对数有比较好的线性关系,其回归方程为 y=256.7152-47.20321logc(ng/ml),相关系数为0.96234,检测限0.11ng/ml,检测范围为1ng/ml-100ug/ml,y代表阻抗值,logc代表etg的浓度。
[0092]
实施例3检测方法
[0093]
利用实施例1构建的传感器进行待测样品检测,按照如下步骤操作:
[0094]
1)建立标准曲线方程:配制不同浓度梯度的etg标准溶液,将etg标准溶液与5ug/ml 的etg-bsa溶液等体积混合后滴加到电极表面,室温下孵育45分钟充分反应,采用电化学阻抗测试法测量相应的阻抗信号;根据etg浓度与阻抗信号之间的相互关系建立标准曲线方程;etg标准溶液的不同浓度梯度为0.01ng/ml、1ng/ml、10ng/ml、100ng/ml、1ug/ml、 10ug/ml、100ug/ml、500ug/ml。标准曲线回归方程为y=256.7152-47.20321logc(ng/ml),相关系数为0.96234,检测限0.11ng/ml,检测范围为1ng/ml-100ug/ml,y代表阻抗值,logc 代表etg浓度的对数。
[0095]
2)将待测样品溶液与5ug/ml的etg-bsa溶液等体积混合后滴加到电极表面,室温下孵育45分钟充分反应,采用电化学阻抗测试法检测阻抗信号;
[0096]
3)将步骤2)得到的阻抗信号代入步骤1)的标准曲线方程计算得出待测样品溶液中etg 的浓度含量。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1