用于评价超分子水凝胶载体的性能的方法
1.本发明涉及超高分子材料的表征检测,具体地涉及用于评价超分子水凝胶载体的性能的方法。
背景技术:
2.近年来,水凝胶在细胞三维培养、控制药物缓释等方面有着越来越多的应用。传统的细胞培养方法多为贴壁培养,但细胞的这种生长方式仅为二维生长,有异于细胞正常在体内的三维生长。因此,细胞的贴壁培养不能完全模拟细胞在体内环境中所表现出的生物特性。可采用水凝胶作为细胞三维生长的支架,因为水凝胶质地柔软,且疏松多孔,利于细胞在胶中伸展,同时培养基也可以渗入胶中,为细胞特供营养。同时,细胞的生长、分化还会受到微环境的调控,现有研究表明,体内细胞基质微环境、蛋白质构象,甚至是器官分布等多呈手性对称结构。应用具有手性微结构水凝胶作为细胞支架,可以选择性调控干细胞,达到促进成骨等作用。此外,水凝胶还可以作为药物缓释的基质。药物缓释与普通给药相比,具有给药频率减少、患处长时间处于有效药物浓度的优点。水凝胶可以通过氢键、共价键等形式结合药物,并缓慢的释放,达到较为理想的效果。
3.水凝胶分为高分子水凝胶和超分子水凝胶,前者是通过化学交联的水凝胶;后者是凝胶因子以非共价键结合包裹溶剂形成的凝胶,又称为超分子水凝胶。超分子水凝胶具有优异的动态响应性,即通过外部刺激可控制三维网络的形成与解离,实现由宏观静态的凝胶转变为具有流动态的溶胶状态。因此,在生物医疗、食品、化妆等领域具有广泛应用。但是超分子水凝胶的机械性能比较弱,没有普通高分子水凝胶机械性能强。因此,在溶胀度检测的过程中会有一部分胶体流失而产生一定损耗,影响检测结果。
4.目前对于高分子材料的溶胀度检测方法多为直接检测测定材料吸收溶剂后的体积,再与原始体积相比较。但体积法较为复杂,若测量仪器精度不够容易产生较大的误差。另一种方法是直接测定溶胀前后的质量,但对于水凝胶这种多孔材料来说,较大的孔隙会容纳较多溶剂,不能较为准确地测定凝胶分子对溶剂的吸附。此外,苯丙氨酸类水凝胶质地较软,若采用常规方法将凝胶放在筛网或纱布上,很容易从网孔中漏出,增大实验损耗。并且,直接将水凝胶放入溶剂中检测会增大水凝胶溶解的可能。综上,目前还没有任何检测超分子凝胶溶胀度的手段关注到水凝胶的损失问题。
5.背景技术中的信息仅仅在于说明本发明的总体背景,不应视为承认或以任何形式暗示这些信息构成本领域一般技术人员所公知的现有技术。
技术实现要素:
6.为解决现有技术中的至少部分技术问题,本发明提供用于评价超分子水凝胶载体的性能的方法,该方法能够避免测量过程中凝胶的损耗,提高溶胀测量的准确性,从而能够更好的评价水凝胶载体的性能。具体地,本发明包括以下内容。
7.本发明的第一方面,提供一种用于评价超分子水凝胶载体的性能的方法,其包括
以下步骤:(1) 准备相同质量的第一过滤网和第二过滤网,取超分子水凝胶置于第一过滤网内得到盛胶过滤网,烘干所述盛胶过滤网和所述第二过滤网后称重,分别计为w1和w0,其中所述过滤网的网孔大小根据超分子水凝胶的弹性模量确定,所述超分子水凝胶具有由凝胶因子以非共价键结合形成的包裹溶剂的三维网络结构;(2) 将所述烘干后的盛胶过滤网置于去离子水中,并在不同时间点取出称重,计为w2;(3) 由公式sr=(w2-w0)/(w1-w0)计算溶胀度,并绘制溶胀度随时间变化的曲线;和(4) 根据所述曲线的特征评价超分子水凝胶载体的性能。
8.在某些实施方案中,根据本发明所述的用于评价超分子水凝胶载体的性能的方法,其中,所述超分子水凝胶为由苯丙氨酸类凝胶因子形成的超分子水凝胶,其弹性模量在2-4.5kpa范围内。
9.在某些实施方案中,根据本发明所述的用于评价超分子水凝胶载体的性能的方法,其中,所述第一过滤网和所述第二过滤网的孔径为100
µ
m以下。
10.在某些实施方案中,根据本发明所述的用于评价超分子水凝胶载体的性能的方法,其中,所述超分子水凝的制备包括:使凝胶因子溶于二甲基亚砜得到溶液,然后将所述溶液加入细胞培养液,从而形成水凝胶。
11.在某些实施方案中,根据本发明所述的用于评价超分子水凝胶载体的性能的方法,其中,所述细胞培养液为无血清dmem高糖细胞培养液。
12.在某些实施方案中,根据本发明所述的用于评价超分子水凝胶载体的性能的方法,其中,所述曲线的特征包括溶胀平衡后的溶胀度、溶胀平衡时间和溶胀度峰数量中的至少之一。
13.在某些实施方案中,根据本发明所述的用于评价超分子水凝胶载体的性能的方法,其中,所述载体包括细胞支架或药物缓释基质。
14.在某些实施方案中,根据本发明所述的用于评价超分子水凝胶载体的性能的方法,其中,所述载体的性能包括至少下述之一:a. 是否利于细胞在载体的多孔结构中立体生长的性能;b. 超分子水凝胶载体是否符合所需要求;c. 药物缓释性能;d. 载体内部孔隙率e. 载体内部的分子的交联度;f. 载体的溶胀度和溶胀速度。
15.在某些实施方案中,根据本发明所述的用于评价超分子水凝胶载体的性能的方法,其中,所述凝胶因子为手性化合物。
16.在某些实施方案中,根据本发明所述的用于评价超分子水凝胶载体的性能的方法,其中,所述第一过滤网和所述第二过滤网各自分别为细胞过滤网。
17.本发明的方法能够减少水凝胶在检测过程中的溶解,减少水凝胶从滤网滤掉的几率,提高了检测结果的成功率;能够通过宏观的方法预知载体内凝胶因子的交联度、多孔程
度,从而判断是否利于细胞在多孔结构中立体生长,材料是否是良好的细胞支架;可以通过最后绘制的溶胀度随时间变化曲线来评价例如苯丙氨酸类手性水凝胶制备的成功与否,能通过溶胀曲线评价苯丙氨酸类水凝胶能否作为药物缓释基质;使用检测试剂无毒无害;每个时间点检测材料变化的方法更为简便、快捷。
附图说明
18.图1是苯丙氨酸类手性水凝胶溶胀后的照片。
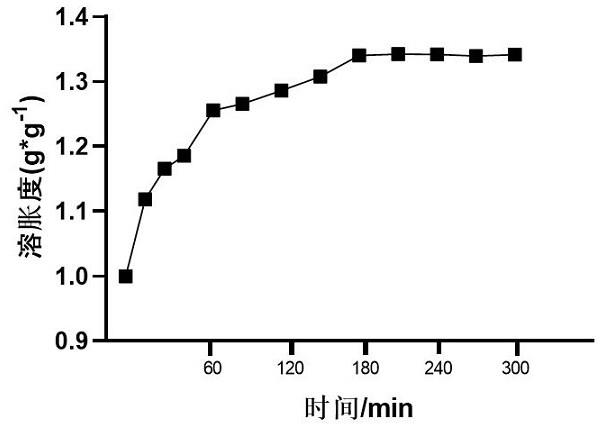
19.图2是实施例1中溶胀比随时间变化的曲线图。
20.图3是实施例2中溶胀比随时间变化的曲线图。
21.图4是实施例3中溶胀比随时间变化的曲线图。
22.图5是比较例1中溶胀比随时间变化的曲线图。
23.图6是比较例2中溶胀比随时间变化的曲线图。
24.图7是比较例3中溶胀比随时间变化的曲线图。
具体实施方式
25.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
26.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为具体公开了该范围的上限和下限以及它们之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
27.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。除非另有说明,否则“%”为基于重量的百分数。
28.本文中,术语“超分子水凝胶”是指凝胶因子在低浓度下使溶剂凝胶化,进而使整个体系形成类似粘弹性液体的超分子凝胶,本文有时简称为“水凝胶”。除非另有说明,否则本文中的水凝胶特指超分子水凝胶。此类超分子凝胶通常通过凝胶因子分子间氢键、π-π键、疏水力和范德华力等非共价键相互作用,在溶剂中自发地聚集、自组装成有序结构,进而使整个体系凝胶化而形成的物理凝胶,具有三维网络结构。
29.本文中,术语“凝胶因子”是指小分子有机化合物,其在溶剂介质中能够聚集、自组装形成延伸的纤维状聚集体。
30.本发明提供用于评价超分子水凝胶载体的性能的方法,本发明有时简称为“本发明的方法”,其基于改进的溶胀度曲线对载体性能进行评价。具体地,本发明的方法至少包括以下步骤:(1) 准备相同质量的第一过滤网和第二过滤网,取超分子水凝胶置于第一过滤网内得到盛胶过滤网,烘干所述盛胶过滤网和所述第二过滤网后称重,分别计为w1和w0,其中
所述过滤网的网孔大小根据超分子水凝胶的弹性模量确定;(2) 将所述烘干后的盛胶过滤网置于去离子水中,并在不同时间点取出称重,计为w2;(3) 由公式sr=(w2-w0)/(w1-w0)计算溶胀度,并绘制溶胀度随时间变化的曲线;和(4) 根据所述曲线的特征评价超分子水凝胶载体的性能。
31.步骤(1)本发明的步骤(1)为获取烘干的过滤网及烘干的水凝胶的步骤。一般而言,包括准备第一过滤网和第二过滤网,取超分子水凝胶置于第一过滤网内得到盛胶过滤网,烘干所述盛胶过滤网和所述第二过滤网后称重,分别计为w1和w0,其中所述过滤网的网孔大小根据超分子水凝胶的弹性模量确定。
32.本发明中,第一过滤网和第二过滤网可以是具有相同质量或尺寸大小的过滤网,也可以是指处于不同条件或用途时的同一过滤网。例如,当用于收集水凝胶时,则称作第一过滤网。当同一过滤网用作对照或参照时,则可称作第二过滤网。因此,本发明的第一过滤网和第二过滤网仅为说明目的,并不一定是指两个单独的过滤网。本发明中,有时可将第一过滤网和第二过滤网统称为过滤网。
33.本发明中,过滤网的材料不限定,其包括天然材料或合成材料,其实例包括但不限于纱布、尼龙等。优选疏水性材料,如尼龙网,从而减少或尽量避免测量误差。
34.本发明的过滤网具有根据超分子水凝胶的弹性模量而确定的网孔大小。由于超分子水凝胶的特殊性质,其吸水后质量变大,每个网格对水凝胶的压力变大,趋向于流体的水凝胶容易从孔径较大的网孔中损失。本发明发现超分子水凝胶虽然质地柔软,但是可根据超分子水凝胶的弹性模量,而不是传统的分子量大小来选择特定的网孔大小,从而有效避免水凝胶的损耗。
35.在某些实施方案中,可通过下述式选择或大致估算过滤网的最大孔径:最大孔径(
µ
m)=弹性模量(kpa)/4
×
100。此外,大致估算是指在确定最大孔径时可以在通过公式得出的孔径值
±
10%范围内选择最大网孔。例如,当超分子水凝胶的弹性模量为4 kpa时,则过滤网的最大孔径=4/4
×
100=100
µ
m。即过滤网的最大孔径为110
µ
m,优选为100
µ
m,或90
µ
m。即最大孔径可以是110
µ
m以下。如果过滤网的孔径过大,则超分子水凝胶倾向于通过网孔而在溶胀度测量时易于使损耗趋于变大。另一方面,过滤网的孔径一般在500nm以上,优选1
µ
m以上,更优选3
µ
m以上,如5
µ
m以上、10
µ
m以上。如果过滤网的孔径过小,则影响过滤网内烘干后的水凝胶的吸水速度。另外,当水凝胶内包含其他成分,如培养基成分或细胞时,则这些其他成分在凝胶吸水时可能引起网孔堵塞,进一步不利地影响吸水速度。
36.在某些实施方案中,本发明的水凝胶为苯丙氨酸类水凝胶,过滤网采用细胞过滤网,其网孔一般为10
µ
m以上。
37.本发明中,适宜的烘干温度和烘烤时间可以更准确反应凝胶分子对溶剂的吸附,也减小实验误差。如果烘干温度或时间超出上述范围,则存在使凝胶结构塌陷的风险。本发明的烘干温度一般为40-90℃,优选50-85℃,例如55℃、60℃、65℃、70℃、75℃和80℃。烘干时间一般为30分钟至4小时,优选1小时至3小时。上述烘干温度和烘烤时间能保证苯丙氨酸类水凝胶中的水分挥发较彻底但是孔隙网状结构不完全塌陷,从而提高检测准确性;如果
孔隙网状结构塌陷不能反映水凝胶的正常结构。
38.本发明的超分子水凝胶不限定,示例性地,其为苯丙氨酸类超分子水凝胶,包括左旋苯丙氨酸类超分子水凝胶或右旋苯丙氨酸类超分子水凝胶。
39.在某些实施方案中,本发明的超分子水凝胶为由细胞培养液制备的水凝胶。示例性的制备方法包括使凝胶因子溶于有机溶剂,如二甲基亚砜得到溶液,然后将所述溶液加入细胞培养液,从而形成水凝胶。细胞培养液不限定,可以是任何已知的细胞培养液,例如dmem高糖细胞培养液等。
40.步骤(2)本发明的步骤(2)为测量烘干凝胶吸水量的步骤,具体包括将所述烘干后的盛胶过滤网置于去离子水中,并在不同时间点取出称重,计为w2。
41.由于溶胀速度不同,不同时间点时溶胀度不同。通过在不同时间点称重,可计算在不同时间点时的吸水量及溶胀性能。
42.在某些实施方案中,将盛有水凝胶的过滤网放入盛有去离子水的大培养皿中,保证水平面没过凝胶,但没有超过滤网上部边缘,由此可以减小凝胶的损失。
43.本发明中,在称重前,优选使用例如吸水纸吸干滤网及凝胶表面水分,可以减少凝胶表面的水分对实验结果的影响。
44.本发明中,不同时间点的选择不限定,可以一定的时间间隔设置检测时间点,时间间隔的长短可自由选择,可以是固定的时间间隔,例如10分钟、20分钟、30分钟,也可以是变化的时间间隔。优选能够体现曲线特征的时间点。
45.步骤(3)本发明的步骤(3)为绘制溶胀度曲线的步骤,其包括由公式sr=(w2-w0)/(w1-w0)计算溶胀度,并绘制溶胀度随时间变化的曲线。溶胀度曲线反应了水凝胶的溶胀特性,例如溶胀平衡后的溶胀度、溶胀平衡时间和溶胀度峰的数量等。曲线的绘制本为领域内的常规手段,可通过已知方法进行绘制,在此不再赘述。
46.步骤(4)本发明的步骤(4)为评价步骤,其包括根据所述曲线的特征评价超分子水凝胶载体的性能。
47.本发明中,通过溶胀度曲线可以直观地得出载体的溶胀度和溶胀速度。此外,本发明的评价优选地包括绘制已知性能的载体的标准曲线的步骤。通过测量已知性能的载体的水凝胶溶胀度得到溶胀曲线,将其作为标准曲线,并将待测载体得到的溶胀曲线与之相比较,可以评价或评估待测载体的性能,例如载体内部孔隙率、载体内部的分子的交联度或者超分子水凝胶载体是否符合所需要求等。
48.不同的载体其评价指标不同,可根据载体类型或用途不同进行评价。本发明的载体类型包括但不限于作为细胞培养的支架、作为药物缓释基质。
49.在某些实施方案中,本发明的载体为细胞支架,并且不同手性的水凝胶具有不同的网络结构。例如,苯丙氨酸类衍生物类水凝胶因子可以以不同的空间构象交联成左、右手性水凝胶的胶束纤维,在以水为溶剂的条件下形成左、右手性多孔隙水凝胶。不同细胞例如巨噬细胞、干细胞可以在水凝胶中立体生长,向不同的方向分化,可以形成有利于成骨或成脂的功能性细胞。通过本发明的方法可得到细胞支架的标准曲线,并将待测细胞支架得到
的溶胀曲线与之相比较,可以评价或评估载体细胞是否适于在载体的多孔结构中立体生长的性能。例如,通过本发明的方法可以得到有利于细胞铺展的细胞支架的溶胀曲线,然后通过将待测细胞支架的溶胀曲线与之相比,可以评价待测细胞支架的细胞铺展性能。
50.在某些实施方案中,本发明的载体为药物缓释基质。通过本发明的方法可得到基质的标准曲线,并将待测药物缓释基质得到的溶胀曲线与之相比较,可以评价或评估药物缓释基质的性能。
51.实施例11、称取右旋凝胶因子(右旋苯丙氨酸)12mg溶于50
µ
l二甲基亚砜溶液,以每孔12.5
µ
l的量置于48孔板底部,铺4孔。每孔用1ml移液枪加入250
µ
l无血清dmem高糖细胞培养液,形成水凝胶。经测其弹性模量为4kpa。
52.2、将四孔右旋凝胶用挖匙挖出,全部置于孔径为100
µ
m的细胞过滤网中,将放有凝胶的滤网和空滤网放入大玻璃皿,同时放入70℃烘箱中,烘烤2.5h。
53.3、称量空滤网质量为w0=1.1227g,有凝胶的滤网质量为w1=1.1708。
54.4、将盛有水凝胶的滤网分别放入盛有去离子水的大培养皿中,保证水平面没过凝胶,但没有超过滤网上部边缘;分别在不同时间点将滤网拿出,吸水纸吸干滤网及凝胶表面水分,测每个时间点质量为w2。
55.5、计算溶胀率sr=(w2-w0)/(w1-w0),绘制溶胀比随时间变化的曲线,如图2所示。
56.实施例21、称取右旋凝胶因子(右旋苯丙氨酸)12mg溶于62.5
µ
l二甲基亚砜溶液,以每孔12.5
µ
l的量置于48孔板底部,铺5孔,每孔用1ml移液枪加入300
µ
l无血清dmem高糖细胞培养液,形成水凝胶。经测其弹性模量为2.2kpa。
57.2、将五孔右旋凝胶用挖匙挖出,全部置于孔径为50
µ
m的细胞过滤网中;将放有凝胶的滤网和空滤网放入大玻璃皿,同时放入65℃烘箱中,烘烤3h。
58.3、称量空滤网质量为w0=1.1291g,有凝胶的滤网质量为w1=1.2068。
59.4、将盛有水凝胶的滤网分别放入盛有去离子水的大培养皿中,保证水平面没过凝胶,但没有超过滤网上部边缘。分别在不同时间点将滤网拿出,吸水纸吸干滤网及凝胶表面水分,测每个时间点质量为w2。
60.5、计算溶胀率sr=(w2-w0)/(w1-w0),绘制溶胀比随时间变化的曲线,如图3所示。
61.实施例31、称取左旋凝胶因子(左旋苯丙氨酸)15mg溶于62.5
µ
l二甲基亚砜溶液,以每孔12.5
µ
l的量置于48孔板底部,铺5孔,每孔用1ml移液枪加入250
µ
l无血清dmem高糖细胞培养液,形成水凝胶。经测其弹性模量为4.1kpa。
62.2、将左旋五孔凝胶用挖匙挖出,全部置于孔径为100
µ
m的细胞过滤网中,将放有凝胶的滤网和空滤网放入大玻璃皿,同时放入80℃烘箱中,烘烤2h。
63.3、称量空滤网质量为w0=1.1284g,有凝胶的滤网质量为w1=1.2443g。
64.4、将盛有水凝胶的滤网分别放入盛有去离子水的大培养皿中,保证水平面没过凝胶,但没有超过滤网上部边缘;分别在不同时间点将滤网拿出,吸水纸吸干滤网及凝胶表面水分,测每个时间点质量为w2。
65.5、计算溶胀率sr=(w2-w0)/(w1-w0),绘制溶胀比随时间变化的曲线,如图4所示。
66.通过实施例1-3的结果可知,左、右手性水凝胶发生溶胀,且随时间而变化。溶胀度随时间变化逐渐升高,最后达到平衡,说明凝胶在溶胀过程中基本没有损耗,而且说明左旋、右旋水凝胶均可在溶液中发生溶胀,且能达到溶胀平衡,因此水凝胶交联度适中,有良好的孔隙率,可以作为搭载药物或者细胞的支架。
67.比较例1称取左旋凝胶因子(左旋苯丙氨酸)15mg溶于62.5
µ
l二甲基亚砜溶液,以每孔12.5
µ
l的量置于48孔板底部,铺5孔;每孔用1ml移液枪加入250
µ
l无血清dmem高糖细胞培养液,形成水凝胶(弹性模量为4kpa);将五孔左旋凝胶用挖匙挖出,全部置于纱布(孔径为1mm左右)中;称量纱布质量为w0=1.1283g,有凝胶的纱布质量为w1=1.2559g,将盛有水凝胶的纱布放入盛有去离子水的大培养皿中。分别在不同时间点将纱布拿出,吸水纸吸干纱布及凝胶表面水分,测每个时间点质量为w2;计算溶胀率sr=(w2-w0)/(w1-w0)。绘制溶胀比随时间变化的曲线,如图5所示。
68.与实施例相比,比较例1凝胶有损耗,且凝胶溶胀程度不大。
69.与实施例相比,比较例1用了孔径更大的纱布,并且没有进行烘干的步骤,从溶胀曲线可以看出,在60min向后的下一个时间点上,溶胀比有明显下降,说明有部分凝胶从纱布孔径中漏出,有一定损耗;此外溶胀曲线很早就接近平衡,缺少正常的溶胀过程,体积变化不大,不能作为评价水凝胶载体性能的方法。
70.比较例2采用体积法测溶胀度。准备10ml量筒,倒入5ml去离子水。称取左旋凝胶因子(左旋苯丙氨酸)15mg溶于62.5
µ
l二甲基亚砜溶液,以每孔12.5
µ
l的量置于48孔板底部,铺5孔;每孔用1ml移液枪加入250
µ
l无血清dmem高糖细胞培养液,形成水凝胶;将五孔左旋凝胶用挖匙挖出,全部置于网袋(100
µ
m尼龙网)中。用细线吊着含水凝胶的网袋放入量筒中,注意水面要没过网袋。记录水面上升刻度为h0。在不同时间观察水面刻度变化为ht。计算溶胀率sr=(ht-5)/(h0-5))。绘制溶胀比随时间变化的曲线,如图6所示。
71.因为测量体积的量筒刻度有限,无法像电子天平一样取得精确的数值,凝胶量较小,吸收水分后的体积变化不足以在量筒刻度上体现,因此溶胀度随时间变化不大,基本看不出差别。因此,体积法测超分子水凝胶溶胀度精确度欠佳。
72.比较例3称取右旋凝胶因子(右旋苯丙氨酸)15mg溶于62.5
µ
l二甲基亚砜溶液,以每孔12.5
µ
l的量置于48孔板底部,铺5孔,每孔用1ml移液枪加入250
µ
l无血清dmem高糖细胞培养液,形成水凝胶(弹性模量为4.1kpa);将右旋五孔凝胶用挖匙挖出,全部置于孔径为100
µ
l的细胞过滤网中,不进行烘干;称量空滤网质量为w0=1.1279g,有凝胶的滤网质量为w1=1.2444g;将盛有水凝胶的滤网放入盛有去离子水的大培养皿中,保证水平面没过凝胶,但没有超过滤网上部边缘;分别在不同时间点将滤网拿出,吸水纸吸干滤网及凝胶表面水分,测每个时间点质量为w2;计算溶胀率sr=(w2-w0)/(w1-w0)。绘制溶胀比随时间变化的曲线,如图7所示。
73.随时间推移,吸水后的水凝胶重量变化不明显。可能原因在于,不经过烘干的水凝胶由于本身存在水分,会阻碍外界水分子完全进入凝胶内部。因此,此例不能作为评价水凝胶载体性能的方法。
74.尽管本发明已经参考示例性实施方案进行了描述,但应理解本发明不限于公开的示例性实施方案。在不背离本发明的范围或精神的情况下,可对本发明说明书的示例性实施方案做多种调整或变化。权利要求的范围应基于最宽的解释以涵盖所有修改和等同结构与功能。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1