绞股蓝皂苷元D含量的测定方法
绞股蓝皂苷元d含量的测定方法
技术领域
1.本发明涉及药品检测技术领域,具体涉及一种绞股蓝皂苷元d含量的测定方法。
背景技术:
2.绞股蓝(学名:gynostemma pentaphyllum(thunb.)makino)葫芦科、绞股蓝属草质攀援植物,性寒、味苦,具有清热解毒、止咳清肺祛痰、养心安神、补气生精之功效,可用于降血压、降血脂、护肝、促进睡眠以及肠胃炎、气管炎、咽喉炎的治疗,并用于多种癌症的抗癌临床治疗。前期研究发现,绞股蓝中的有效成分主要是达玛烷型三萜皂苷类成分,约有180余种三萜皂苷类成分从绞股蓝中被发现(沈子琳et al.,2020;史琳et al.,2017)。有文献报道皂苷类成分口服给药生物利用度低,通常经由胃肠道水解后,以苷元的形式吸收发挥药效(宋玮et al.,2018)。并且已有文献报道绞股蓝皂苷水解后的苷元在抗肿瘤和降血糖等方面表现出较好的活性(史琳et al.,2017)。在对绞股蓝皂苷的水解产物的研究中发现,绞股蓝皂苷元d(gypensapogenin d)是含量最高的一种皂苷元成分,有文献报道绞股蓝皂苷元d具有抗肿瘤的活性(n.li et al.,2012)。然而,在研究中也发现绞股蓝皂苷元d是一种难溶于水的化学成分,这就决定了其口服生物利用度低,局限了其临床治疗效果的发挥。另外,如何对绞股蓝皂苷元d的含量进行测定来确保其质量,也是现有技术亟需解决的。
技术实现要素:
3.本发明针对现有技术的不足,设计一种利用高效液相色谱测定绞股蓝皂苷元d含量的方法。
4.本发明的目的之一是提供绞股蓝皂苷元d含量的测定方法,包括以下步骤:
5.1)将绞股蓝皂苷元d标准品溶于甲醇溶液制成标准品溶液,以所述标准品溶液在下述色谱条件下进行系统适用性试验,校定检测系统;
6.色谱条件:色谱柱的固定相为碳十八烷基硅烷键合硅胶,所述碳十八烷基硅烷键合硅胶的粒径≤5μm;以体积比为80~100%的乙腈-水为流动相进行洗脱,检测波长为260.4nm;
7.2)将待测的含有绞股蓝皂苷元d的溶液溶于甲醇溶液中制成供试品溶液;
8.3)按照步骤1)的色谱条件,取等体积的标准品溶液和供试品溶液注入高效液相色谱仪,测定所述标准品溶液和供试品溶液的峰面积并进行计算,得到所述供试品中绞股蓝皂苷元d的含量。
9.其中,绞股蓝皂苷元d的结构式如下:
[0010][0011]
进一步,所述甲醇溶液为体积比为80%以上的甲醇水溶液或纯甲醇。
[0012]
进一步,所述碳十八烷基硅烷键合硅胶的粒径为5μm、4μm或3.5μm。
[0013]
进一步,所述碳十八烷基硅烷键合硅胶的粒径为5μm。
[0014]
进一步,所述色谱柱的理论塔板数按绞股蓝皂苷元d峰计算不低于3000。
[0015]
进一步,含有绞股蓝皂苷元d的溶液为绞股蓝皂苷元d脂质体。
[0016]
本发明的测定方法不但可用于绞股蓝皂苷元d脂质体中绞股蓝皂苷元d的含量测定,也可用于其它含绞股蓝皂苷元d制剂的检测。
[0017]
本发明的方法包括:配制标准品溶液、供试品溶液,高效液相色谱检测,计算供试品中绞股蓝皂苷元d的含量几个步骤,该方法能特异性检测绞股蓝皂苷元d脂质体中绞股蓝皂苷元d的含量,色谱峰分离良好、无干扰、线性好、精确度高、重复性、回收率、稳定性高。
[0018]
进一步,绞股蓝皂苷元d脂质体中绞股蓝皂苷元d含量的测定方法的具体步骤为:
[0019]
1)取绞股蓝皂苷元d标准品,以甲醇溶液配制成1ml含有0.4mg绞股蓝皂苷元d的标准溶液;在下述色谱条件下进行系统适用性试验,校定检测系统:
[0020]
色谱条件:固定相为碳十八烷基硅烷键合硅胶,所述色谱柱的规格为250
×
4.6mm,碳十八烷基硅烷键合硅胶的粒径为5μm;以乙腈为流动相a,以水为流动相b,以乙腈-水(90:10)等度洗脱;流速:1ml/min;检测波长:260.4nm;进样量:20μl;柱温:30℃。
[0021]
2)取待测的绞股蓝皂苷元d脂质体,以甲醇溶液配制成供试品溶液。
[0022]
3)按照步骤1)的色谱条件,分别将等体积的标准品溶液和供试品溶液,注入高效液相色谱仪,测定标准品溶液及供试品溶液的峰面积,按外标法计算绞股蓝皂苷元d脂质体中绞股蓝皂苷元d的含量。
[0023]
本发明的目的之二时提供绞股蓝皂苷元d脂质体的制备方法,包括称取卵磷脂、胆固醇和绞股蓝皂苷元d,加入适量氯仿-甲醇溶液溶解,于40℃恒温水浴减压旋蒸后,除去有机溶剂,待瓶壁上形成均匀透明的薄膜时,加入磷酸盐缓冲液适量,40℃下常压水合1~1.5h,充分振摇至水合完全,以25%超声功率、超声20min,最终得到绞股蓝皂苷元d脂质体。
[0024]
进一步,绞股蓝皂苷元d:卵磷脂:胆固醇的质量比为1:8:1,卵磷脂优选蛋黄卵磷脂,氯仿-甲醇的体积比为3:1。
[0025]
绞股蓝皂苷元d脂质体的制备方法具体步骤为,准确称量处方量的蛋黄卵磷脂,胆固醇和绞股蓝皂苷元d(药物/蛋黄磷脂/胆固醇比1:8:1),加入适量氯仿-甲醇(v/v=3:1)溶解,置于干燥茄形瓶中,于40℃恒温水浴减压旋蒸后,氮吹10min以完全除去有机溶剂,在瓶壁上形成均匀透明的薄膜,加入ph 7.4的磷酸盐缓冲液适量,40℃下常压水合1~1.5h,充分振摇至水合完全,经探针超声处理,以25%超声功率、超声20min,最终得到绞股蓝皂苷
元d脂质体。
[0026]
本发明的目的之三是提供绞股蓝皂苷元d脂质体在制备α-葡萄糖苷酶抑制剂药物中的应用。
[0027]
脂质体作为一种新型药物载体,具有生物利用度高、生物相容性好、促进转运以及提高药物稳定性等优点。因此,本发明将绞股蓝皂苷元d制备成了脂质体,并建立了绞股蓝皂苷元d脂质体中绞股蓝皂苷元d的含量测定方法,可以控制绞股蓝皂苷元d脂质体的质量。
[0028]
同时本发明还通过分子对接及α-葡萄糖苷酶的抑制试验发现绞股蓝皂苷元d对α-葡萄糖苷酶具有一定的抑制作用。
附图说明
[0029]
图1为绞股蓝皂苷元d脂质体处方考察结果图。
[0030]
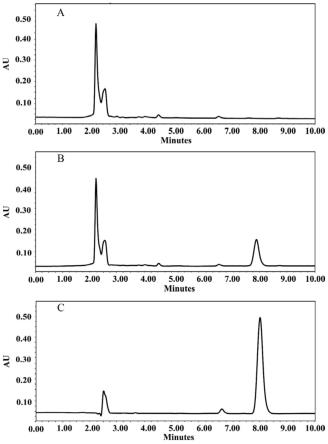
图2为绞股蓝皂苷元d标准品和绞股蓝皂苷元d脂质体样品的hplc色谱图(a:不含绞股蓝皂苷元d空白脂质体;b:绞股蓝皂苷元d空白脂质体样品;c:绞股蓝皂苷元d标准品)。
具体实施方式
[0031]
下面通过具体实施方式进一步详细说明:
[0032]
实施例1绞股蓝皂苷元d脂质体处方优化
[0033]
通过查阅相关文献,发现影响脂质体包封率的主要因素有:药脂比、磷脂/胆固醇比、超声时间、超声功率等。以药物包封率为评价指标,对以上几个指标进行了单因素考察。
[0034]
1)磷脂种类对脂质体包封率影响
[0035]
磷脂是脂质体制备中的主要膜材,在水中能够组成双分子层或者混合后可以形成双分子层结构的磷脂都能够作为制备脂质体的膜材,主要是天然磷脂和合成磷脂。本研究分别使用了大豆卵磷脂和蛋黄卵磷脂,得到其包封率分别为(96.02
±
0.008)%和(98.49
±
0.001)%;可见与大豆卵磷脂相比,蛋黄卵磷脂制备的绞股蓝皂苷元d脂质体包封率较高,因此选择蛋黄卵磷脂制备绞股蓝皂苷元d脂质体。
[0036]
2)探针超声时间对脂质体包封率影响
[0037]
超声时间的考察结果如图1a所示,可见当超声时间在20min时,包封率较高,因此选择超声时间为20min。
[0038]
3)大豆磷脂与药物质量比对脂质体包封率影响
[0039]
药脂比的考察结果如图1b所示,当药脂比为1:8时,包封率较高,因此选择药物:磷脂=1:8制备绞股蓝皂苷元d脂质体。
[0040]
4)大豆磷脂与胆固醇质量比对脂质体包封率影响
[0041]
磷脂与胆固醇质量比的考察结果如图1c所示,当磷脂:胆固醇=8:1时,包封率较高,因此选择磷脂:胆固醇=8:1制备绞股蓝皂苷元d脂质体。
[0042]
根据处方优化结果,采用薄膜分散法制备绞股蓝皂苷元d脂质体,准确称量处方量的卵磷脂,胆固醇和绞股蓝皂苷元d(药物/磷脂/胆固醇比1:8:1),加入适量氯仿-甲醇(v/v=3:1)溶解,置于干燥茄形瓶中,于40℃恒温水浴减压旋蒸后,氮吹10min以完全除去有机溶剂,在瓶壁上形成均匀透明的薄膜,加入ph 7.4的磷酸盐缓冲液适量,40℃下常压水合1~1.5h,充分振摇至水合完全,经探针超声处理,以25%超声功率、超声20min,最终得到绞
股蓝皂苷元d脂质体。
[0043]
实施例2绞股蓝皂苷元d脂质体质量评价
[0044]
精密移取绞股蓝皂苷元d脂质体适量,1500r/min离心10min,弃去上层清液,精密移取适量甲醇超声溶解沉淀,以0.22μm微孔滤膜过滤,置于液相小瓶中,按上述高效液相色谱条件测定游离绞股蓝皂苷元d药量。另外精密量取绞股蓝皂苷元d脂质体混悬液1ml,置10ml量瓶中,加甲醇至刻度,涡旋破乳,以0.22μm微孔滤膜过滤,置于液相小瓶中,按上述高效液相色谱条件测定脂质体中的总药量,计算脂质体的包封率。
[0045]
根据优化处方平行制备三份绞股蓝皂苷元d脂质体,分别测定其包封率、粒径、pdi值和zeta电位,结果如表1所示。激光粒度仪检测绞股蓝皂苷元d脂质体的粒径分布,绞股蓝皂苷元d脂质体的平均粒径199.31
±
1.73nm,pdi值为0.354
±
0.007,表明按优化处方制备的绞股蓝皂苷元d脂质体的粒径大小较均一,分散性好。
[0046]
表1绞股蓝皂苷元d脂质体质量评价(n=3)
[0047][0048]
实施例3方法学考察
[0049]
采用高效液相色谱法按照ich指南进行了绞股蓝皂苷元d脂质体中绞股蓝皂苷元d的含量测定方法的验证。考察了以下特性:专属性、线性、重复性、精密度、稳定性、加样回收率。
[0050]
1)专属性考察:以空白脂质体对照溶液作为空白对照,分别对绞股蓝皂苷元d对照品溶液及供试品溶液按色谱条件进样分析,记录色谱图。结果如图2所示,可见绞股蓝皂苷元d与溶剂成分的分离情况良好,峰形尖锐且阴性对照组也无干扰峰出现,表明该方法专属性良好。
[0051]
2)线性关系考察:分别精密称取绞股蓝皂苷元d对照品4mg置于10ml容量瓶中,加甲醇定容至10ml,得400μg/ml标准品溶液作为储备液,加甲醇稀释成质量浓度为5、10、20、40、60、80、100、200、400μg/ml的标准品溶液;过0.22μm滤膜,根据“2.2.3”项下色谱条件进行测定,以峰面积(y)为纵坐标,绞股蓝皂苷元d质量浓度(x)为横坐标进行线性回归,绘制标准曲线。结果显示绞股蓝皂苷元d对照品的线性方程为y=31219x+10804,r2=0.9999,表明绞股蓝皂苷元d在5μg/ml~400μg/ml范围内呈良好的线性关系。
[0052]
3)重复性考察:精密量取适量绞股蓝皂苷元d脂质体加甲醇稀释破乳,平行制备6份,分别进样分析,考察重复性。重复性考察结果显示rsd为2.30%(n=6),表明该方法重复性良好。
[0053]
4)精密度考察:配制低(5μg/ml)、中(40μg/ml)、高(100μg/ml)三种不同浓度的绞股蓝皂苷元d标准品溶液,将待测样品放入高效液相色谱仪样品盘上,连续进样六次,计算日内精密度,并在3天内每天同一时间进样一次,计算日间精密度。连续进样6次后,测得绞股蓝皂苷元d的rsd值均小于2%,表明仪器精密度良好。
[0054]
5)稳定性考察:精密量取适量同一批制备的绞股蓝皂苷元d脂质体1份,将待测样品放入高效液相色谱仪样品盘上,分别于0、2、4、8、12h进样分析,统计峰面积并计算rsd值,
考察稳定性。12h内样品检测结果rsd值为2.74%,表明绞股蓝皂苷元d脂质体供试液在12h内基本稳定。
[0055]
6)加样回收率考察:精密量取适量同一批制备的绞股蓝皂苷元d脂质体3份,用hplc分别检测样品中药物含量,分别按已知含量的80%,100%,120%三个水平加入绞股蓝皂苷元d对照品,吸取20μl进样检测药物总含量,每组实验平行3次。将所得峰面积值代入标准曲线,计算脂质体样品中药物量及实际测得药物总量,并计算加样回收率,考察结果表明该方法回收率良好。见表2。
[0056]
表2加样回收率结果
[0057][0058]
实施例4绞股蓝皂苷元d对α-葡萄糖苷酶的抑制作用
[0059]
采用微孔板法测定α-葡萄糖苷酶抑制活性(han et al.,2020;liu et al.,2017)。在96孔板中加入50μl的磷酸盐缓冲溶液(phosphate buffer solution,pbs,ph 6.8),50μl样品溶液,10μlα-葡萄糖苷酶溶液(1u/ml,ph6.8磷酸盐缓冲液溶解),振荡混匀,37℃恒温孵育15min,加入40μl 5mmol/l pnpg,混匀,37℃恒温反应15min,加入40μl碳酸钠溶液终止反应,利用酶标仪于波长405nm处测定吸光度值。平行3次,以阿卡波糖为阳性对照。按照公式计算抑制率。
[0060]
抑制率(%)=[1-(a4-a3)/(a2-a1)]
×
100%
[0061]
结果发现绞股蓝皂苷元d对α-葡萄糖苷酶的活性抑制作用较强,进一步研究发现抑制率随着浓度的增大而增大,表现出较强的浓度依赖关系,通过计算,ic50值为1.50mmol/l,结果见表3。
[0062]
表3绞股蓝皂苷元d对α-葡萄糖苷酶的活性抑制作用(n=6)
[0063][0064]
以上所述的仅是本发明的实施例,方案中公知的具体结构及特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明结构的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本技术要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1