石蜡组织切片的制备方法
1.本技术涉及生物组织学技术领域,特别涉及到一种石蜡组织切片的制备方法。
背景技术:
2.石蜡切片是组织学常规制片技术中最为广泛应用的方法。石蜡切片不仅用于观察正常细胞组织的形态结构,也是病理形态学,生物形态学及定性分析细胞结构和变化研究中不可缺少的组成部分。
3.常规的石蜡组织切片方法中,包括取材、固定、洗涤和脱水、透明、浸蜡、包埋、切片与贴片、脱蜡、染色、脱水、透明、封片等步骤。而常规方法对蜡块质量、刀片质量、人员熟练程度具有较高要求,容易造成组织裂片,染色不鲜明,不利于对卵巢、睾丸和胰脏等实质性器官的观察与评判。
技术实现要素:
4.基于此,本技术提供了一种石蜡组织切片的制备方法,该制备方法能有效避免组织龟裂,制得的石蜡组织切片细胞结构完整且染色均匀、清晰。
5.本技术解决上述技术问题的技术方案如下:
6.一种石蜡组织切片的制备方法,包括以下步骤:
7.将组织蜡块预冷;
8.将预冷后的所述组织蜡块的待切面用水湿润;
9.切湿润后的所述组织蜡块,形成具有湿润面的切片;
10.将所述切片以所述湿润面直接与水接触的方式置于水面上以进行展片;
11.将展片结束后的切片依次进行烤片、脱蜡、水化,制备水化后的切片;
12.将水化后的切片在50℃~90℃的柠檬酸钠抗原修复液中加热处理2min~3min,制备经柠檬酸钠抗原修复液处理的切片;
13.将所述经柠檬酸钠抗原修复液处理的切片冷却后用水清洗,制备清洗后的切片;及
14.将所述清洗后的切片染色,制备石蜡组织切片。
15.本技术提供一种石蜡组织切片的制备方法,本方法在切片过程中,通过用水润湿蜡块切面,减少组织连续切片时产生的静电,并利用水的张力,避免组织卷曲,开裂;且,本方法在组织切片染色步骤前,添加柠檬酸钠抗原修复液进行热处理,其具有良好的ph调节及缓冲性能,能有效降低组织染色后,切片龟裂的情况。如此,制得的常规石蜡组织切片细胞结构完整且染色均匀、清晰,便于组织细胞形态变化的观察。
16.在其中一些实施例中,在制备经柠檬酸钠抗原修复液处理的切片的步骤之前还包括:将柠檬酸钠抗原修复液加热至沸腾。
17.在其中一些实施例中,所述预冷的温度为0℃~4℃,所述预冷的时间为20min~30min。
18.在其中一些实施例中,所述将预冷后的所述组织蜡块的待切面水湿润的操作包括:
19.采用水湿润的无尘纸巾或擦镜纸润湿所述组织蜡块的待切面。
20.在其中一些实施例中,采用苏木素-伊红染色法对切片进行染色,其中,苏木素染色液的染色时间为20s~30s。
21.在其中一些实施例中,所述采用苏木素-伊红染色法对切片进行染色的步骤包括:
22.将清洗后的切片置于苏木素染色液中染色20s~30s,制备苏木素染色后的切片;
23.在将所述苏木素染色后的切片漂洗后,浸泡于体积分数为0.1%盐酸酒精中分化3s~5s,制备分化后的切片;
24.将所述分化后的切片置于水中返蓝,制备返蓝后的切片;及
25.将所述返蓝后的切片置于无水乙醇中,再进行伊红染色处理,伊红染液中染色后,再进行漂洗,制得苏木素-伊红染色的切片。
26.在其中一些实施例中,所述制备方法还包括将组织样本依次固定、脱水、透明、浸蜡及包埋以制备组织蜡块的步骤。
27.在其中一些实施例中,将组织样本固定的操作包括:将组织样本浸泡于固定液中固定24h~48h;及
28.将固定后的组织样本冲洗,去除固定液。
29.在其中一些实施例中,所述脱水的操作包括:
30.将固定后的组织样本按照乙醇浓度由低到高的顺序依次浸泡于下述溶液中:体积分数为30%的乙醇溶液、体积分数为50%乙醇溶液、体积分数为75%乙醇溶液、体积分数为80%乙醇溶液、体积分数为95%乙醇溶液、体积分数为95%乙醇溶液,每种乙醇溶液的浸泡时间独立地为1h~2h;及
31.将经体积分数为95%乙醇溶液处理后的组织样本采用无水乙醇浸泡2次,每次浸泡时间为45min~60min。
32.在其中一些实施例中,所述透明的操作包括:
33.将脱水后的组织样本按照透明剂浓度由低到高的顺序依次浸泡于含有透明剂的溶液中,所述透明剂包括二甲苯、苯、氯仿和正丁醇中的一种或多种。
附图说明
34.图1为实施例1~5、对比例1~10的石蜡组织切片染色显微观察图;
35.图2为实施例6~21的石蜡组织切片染色显微观察图;
36.图3为实施例22~37的石蜡组织切片染色显微观察图;
37.图4为实施例38~53的石蜡组织切片染色显微观察图
。
具体实施方式
38.为使本技术的上述目的、特征和优点能够更加明显易懂,下面对本技术的具体实施方式做详细的说明,并给出了本技术的较佳实施例。在下面的描述中阐述了很多具体细节以便于充分理解本技术。但是本技术能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本技术内涵的情况下做类似改进,因此本技术不受下面公开的
具体实施例的限制。
39.除非另有定义,本文所使用的所有的技术和科学术语与属于本技术的技术领域的技术人员通常理解的含义相同。本文中在本技术的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本技术。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。本文所用试剂或仪器未注明生产厂商者,均为可以通过购买获得的常规产品。
40.在传统的病理切片制作过程中,造成组织龟裂,染色模糊不清,细胞结构不清的因素有很多方面,包括来自取材及固定、脱水及透明、浸蜡及包埋、切片、展片与烤片、脱蜡与水化、染色等过程中的任意方面。
41.基于此,本技术的技术人员打破现有技术的禁锢,创造性地采用水润湿组织切面,形成具有湿润面的组织,进行后续切片操作。本技术技术人员进一步为获得组织切片细胞结构完整及染色清晰的切片进行了大量探究,偶然发现:组织切片在柠檬酸钠抗原修复液中进行热处理后,再进行常规组织染色,可有效降低组织染色后,切片龟裂情况,制得的组织切片细胞结构完整且染色均匀、清晰。
42.因此,本技术一实施方式提供了一种石蜡组织切片的制备方法,该制备方法包括步骤(1)~步骤(8):
43.步骤(1)取材及固定:取新鲜的组织样本,并剔除无关组织后放入固定液中固定。
44.步骤(2)脱水及透明:用低浓度到高浓度梯度的乙醇溶液作为脱水剂将步骤(1)中固定后的组织样本依次进行脱水处理,然后依次用低浓度到高浓度梯度的透明剂置换出组织内脱水剂。
45.步骤(3)浸蜡及包埋:将步骤(2)中的组织依次浸泡于三缸石蜡溶液中进行浸蜡处理,向浸蜡后的组织加石蜡进行包埋。
46.步骤(4)切片:将组织蜡块预冷;将预冷后的组织蜡块的待切面采用水湿润;切湿润后的组织蜡块,形成具有湿润面的切片。
47.步骤(5)展片及烤片:将步骤(4)中的切片以湿润面直接与水接触的方式置于水面上以进行展片;再将组织切片置于染色架上于烤箱中进行烤片处理。
48.步骤(6)脱蜡与水化:将步骤(5)中的切片依次置于三缸二甲苯溶液中进行脱蜡处理,再将组织切片浸泡于高浓度到低浓度梯度的乙醇溶液及两缸超纯水中依次进行水化处理。
49.步骤(7)染色:将水化后的切片在50℃~90℃的柠檬酸钠抗原修复液中处理2min~3min,制备经柠檬酸钠抗原修复液处理的切片;将经柠檬酸钠抗原修复液处理的切片冷却后用水清洗,制备清洗后的切片;及将清洗后的切片染色。
50.步骤(8)脱水及透明:将步骤(7)中的组织切片依次浸泡于三缸无水乙醇溶液中,每次脱水处理时间为1min,再将组织切片依次浸泡于两缸二甲苯组织透明剂溶液中,每次透明处理时间为2min。
51.上述石蜡组织切片的制备方法中,包括取材及固定、脱水及透明、浸蜡及包埋、切片、展片与烤片、脱蜡与水化、染色等步骤。一方面,本方法在切片过程中,通过用水润湿蜡块切面,减少组织连续切片时产生的静电,并利用水的张力,避免组织卷曲,开裂;另一方面,由于组织固定、包埋等步骤不当可能会导致蛋白质质变,可能导致组织对染料的拒染,
本方法在组织切片染色步骤前,添加柠檬酸钠抗原修复液进行热处理,柠檬酸钠抗原修复液常用于免疫组化抗原修复中,改变固定液对组织带来的固定效应;此外,其具有良好的ph调节作用,可降低切片表面的ph值,提高苏木素对于细胞核的染色效果。如此,制得的常规石蜡组织切片细胞结构完整且染色均匀、清晰,便于组织细胞形态变化的观察。
52.在其中一些实施例中,步骤(1)中新鲜的组织样本包括但不限于小鼠脾脏、肝脏、胰脏、肺、肾、睾丸、卵巢组织。
53.进一步地,上述组织样品可根据实际所需的观察对象进行选择。
54.在其中一些实施例中,步骤(1)中固定液包括体积分数为4%的多聚甲醛、体积分数为10%的福尔马林、中性甲醛液、福尔马林-酒精-醋酸混合固定液中的至少一种。
55.在其中一些示例中,步骤(1)中固定液的固定时间为24h~48h。可以理解的是,可根据组织块大小调整固定时间。
56.在其中一些实施例中,步骤(1)还包括将固定后的组织样本冲洗以去除固定液的步骤。可选地,固定结束后,将组织在流水中冲洗20min~30min,可以理解,冲洗以去除组织中残留的固定液。
57.在其中一些实施例中,步骤(2)中脱水处理包括将组织样本按照乙醇浓度由低到高的顺序依次浸泡于下述溶液中:体积分数为30%的乙醇溶液、体积分数为50%乙醇溶液、体积分数为75%乙醇溶液、体积分数为80%乙醇溶液、体积分数为95%乙醇溶液、体积分数为95%乙醇溶液,每种乙醇溶液的浸泡时间独立地为1h~2h;及将经体积分数为95%乙醇溶液处理后的组织样本采用无水乙醇浸泡2次,每次浸泡时间为45min~60min。可以理解的是,在其他实施例中,脱水处理过程中的乙醇浓度的选择不限于上述。
58.在其中一些实施例中,步骤(2)中透明的操作包括:将脱水后的组织样本按照透明剂浓度由低到高的顺序依次浸泡于含有透明剂的溶液中,透明剂包括二甲苯、苯、氯仿和正丁醇中的一种或多种。
59.在其中一些具体示例中,步骤(2)中透明剂为二甲苯,其中低浓度到高浓度梯度的二甲苯分别为体积比为1:1的无水乙醇与二甲苯的混合溶剂、二甲苯ⅰ、二甲苯ⅱ,透明处理每次时间为10min~20min。其中,二甲苯中ⅰ、ⅱ只是编号不同的同一物质。
60.可以理解,透明时间可根据组织块大小,调整透明时间,在光照下观察到组织透亮即可。
61.在其中一些实施例中,步骤(3)中浸蜡处理时的石蜡溶液温度为58℃~60℃,每缸浸蜡时间为30min~60min。
62.在其中一些实施例中,步骤(3)中包埋的操作包括:将浸蜡后的组织置于包埋槽中,加入石蜡,将组织置于底槽中央位置,加盖做好标记的包埋盒,浇灌石蜡后,进行冷却、凝固处理;凝固后,将组织蜡块置于-20℃冷冻处理10min~20min,把包埋槽取下,将组织蜡块置于常温或4℃保存。
63.在其中一些实施例中,步骤(4)中预冷的温度为0℃~4℃,预冷的时间为20min~30min。
64.在其中一些具体示例中,步骤(4)中将预冷后的组织蜡块的待切面水湿润的操作包括:
65.采用水湿润的无尘纸巾或擦镜纸润湿组织蜡块的待切面,以在待切面上形成水
渍。可以理解的是,在其他实施例中,将组织蜡块的待切面湿润的方式不限于上述,也不限于采用无纺布或无尘纸巾,还可以是其他方式,只要能让待切面湿润且不损伤和污染待切面即可,例如向待切面喷水。
66.在进行连续切片时,需每切一次,润湿一次待切面。
67.通过将组织块的待切面进行润湿,可减少组织连续切片时产生的静电,并利用水的张力,避免组织卷曲,开裂。
68.在其中一些具体示例中,步骤(5)中用镊子将步骤(4)中的具有水渍的切面朝下,置于清水中展平,然后捞片,转移至清水浴中进行展片处理。
69.可选地,上述步骤(5)中展片处理的清水浴处理温度为48℃~50℃,展片处理时间为5s~15s。
70.在其中一些实施例中,步骤(5)中烤片处理温度为58℃~60℃,时间为1h~2h。
71.在其中一些实施例中,步骤(6)中脱蜡处理时间为10min~15min。
72.在其中一些实施例中,步骤(6)中高浓度到低浓度梯度的乙醇溶液分别为无水乙醇ⅰ、无水乙醇ⅱ、体积分数为95%乙醇、体积分数为80%乙醇、体积分数为75%乙醇,水化处理每次时间为3min~5min。可以理解的是,水化处理中的乙醇溶液中乙醇的含量不限于上述。
73.在一些可选地具体示例中,步骤(7)的柠檬酸钠抗原修复液的温度为50℃、55℃、60℃、65℃、70℃、75℃、80℃、85℃或90℃;柠檬酸钠抗原修复液的处理时间为2min、2.5min、3min。
74.在一些实施例中,步骤(7)中在制备经柠檬酸钠抗原修复液热处理的切片的步骤之前还包括:将柠檬酸钠抗原修复液加热至沸腾。
75.在一些实施例中,步骤(7)中采用的柠檬酸钠抗原修复液由100
×
柠檬酸钠抗原修复液稀释至1
×
柠檬酸钠抗原修复液得到。
76.在一些实施例中,步骤(7)中采用苏木素-伊红染色法对切片进行染色,其中,苏木素染色液的染色时间为20s~30s。
77.可选地,将清洗后的切片置于苏木素染色液中染色20s~30s,制备苏木素染色后的切片;在将苏木素染色后的切片漂洗后,浸泡于体积分数为0.1%盐酸酒精中分化3s~5s,制备分化后的切片;将分化后的切片置于水中返蓝,制备返蓝的切片;及将返蓝的切片置于无水乙醇中,处理时间为30s,再进行伊红染色处理,伊红染液中染色后,在无水乙醇中进行漂洗,制得苏木素-伊红染色的切片。
78.在一些实施例中,步骤(8)之后还包括步骤(9)封片。具体地,封片的步骤包括:将步骤(8)中的载玻片中央滴加中性树胶,加盖盖玻片,置于通风处晾干,得到组织的永久切片。
79.可以理解的是,在其他实施方式中,步骤(1)~(3)可以省略,此时可以直接购买商用的组织蜡块。
80.本技术一实施方式提供了一种组织切片,组织切片采用如上的石蜡组织切片的制备方法制得。
81.该制备方法可用于其他染色,如免疫组织化学和masson染色等,作为染色前的优化预处理步骤,有助于提高切片质量和染色效果,有效避免组织龟裂,在病理诊断中,显微
镜下病灶部分更清晰,进一步提高了诊断的准确性。
82.具体实施例
83.下面将结合具体的实施例对本技术进行了说明,但本技术并不局限于下述实施例,应当理解,所附权利要求概括了本技术的范围,在本技术构思的引导下本领域的技术人员应意识到,对本技术的各实施例所进行的一定的改变,都将被本技术的权利要求书的精神和范围所覆盖。
84.实施例1
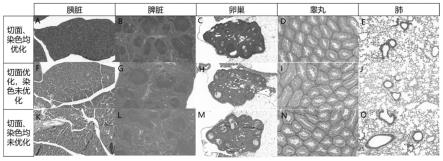
85.(1)取材及固定:取新鲜的小鼠胰脏组织样本,并剔除无关组织,于4%多聚甲醛液中固定24h,固定完成后,将组织流水冲洗30min。
86.(2)脱水及透明:依次将组织浸泡于体积分数分别为30%、50%、75%、80%、95%、95%的乙醇溶液中,每次2h;再将组织浸泡于100%无水乙醇2次,每次45min,进行脱水处理;再依次将组织浸泡于无水乙醇+二甲苯(v:v=1:1)、二甲苯ⅰ、二甲苯ⅱ中,每次10min。
87.(3)浸蜡及包埋:提前融化石蜡,依次将组织浸泡于60℃三缸石蜡溶液ⅰ、ⅱ、ⅲ中,浸泡时间分别为30min,1h和1h;再将浸蜡后的组织置于金属包埋槽中,加入石蜡,用镊子将组织置于底槽中央位置,加盖做好标记的包埋盒,并在包埋盒内浇灌石蜡,移动至冷冻台上凝固。凝固后,将组织蜡块置于-20℃冷冻处理20min,把包埋槽取下,将组织蜡块置于常温保存。
88.(4)切片:提前将组织蜡块于4℃预冷20min,用无尘纸巾蘸取适量室温洁净水,用纸巾一角润湿预冷后的待切面,切湿润后的组织蜡块,形成具有湿润面的切片。
89.(5)展片:用镊子转移组织切片,将具有水渍的切面朝下,置于摊片机清水水面,待切片稍平整后,用载玻片捞片,转移至摊片机50℃清水浴中展片,组织切片平整无褶皱后,捞取组织,黏附于载玻片上,45
°
倾斜放置于烤片机处,温度为37℃,沥干水分。
90.(6)烤片及脱蜡:组织切片置于染色架上于60℃烤箱烤片2h后,置于二甲苯ⅰ、ⅱ、ⅲ中进行脱蜡处理,处理时间分别为10min。
91.(7)水化:将组织切片依次将组织浸泡于无水乙醇ⅰ、无水乙醇ⅱ、体积分数为95%乙醇溶液、体积分数为80%乙醇溶液、体积分数为75%乙醇溶液、超纯水ⅰ和ⅱ,处理时间分别为5min。
92.(8)染色:将1
×
柠檬酸钠抗原修复液厂家1(购于生工生物工程有限公司,型号为e673001-0100)加热5min至沸腾后,再将水化后的组织切片置于柠檬酸钠抗原修复液中,90℃加热2min,自然冷却后,使用超纯水洗涤3次,每次5min,制备清洗后的切片,将清洗后的切片进行染色,染色的操作包括:将清洗后的切片置于苏木素染色液中染色25s,于自来水中漂洗1min;
93.将漂洗后的切片浸泡于体积分数为0.1%盐酸酒精中分化5s;
94.将分化后的切片置于自来水流水中,返蓝10min;
95.将返蓝后的切片置于无水乙醇中,处理时间为30s,再进行伊红染色处理,伊红染液中染色5s,在无水乙醇中进行漂洗,漂洗时间为30s。
96.(9)脱水及透明:将组织切片浸泡于无水乙醇溶液ⅰ、ⅱ、ⅲ中,分别为1min;再将组织切片浸泡于组织透明剂溶液ⅰ、ⅱ中,分别为2min。
97.(10)封片:滴加适量中性树胶,加盖盖玻片,置于通风处晾干。
98.将制得的石蜡组织切片置于光学显微镜下观察,得到的组织图片如图1-a所示。由图1-a可知小鼠胰脏组织未见龟裂,无明显裂缝与过大细胞间隙,染色清晰、鲜明。
99.实施例2~5
100.实施例2~5制备石蜡组织切片的方法与实施例1基本相同,不同之处在于组织样本不同,具体试验条件及对应效果如图1所示,将制得的组织切片于光学显微镜下进行观察,结果如图1中b~e所示,如图1中b~e所示组织切片完整,小鼠组织结构无龟裂现象,无破碎和空洞,染色清晰,鲜明。
101.实施例6~21
102.实施例6~21制备石蜡组织切片的方法与实施例1基本相同,不同之处在于染色步骤不同,柠檬酸钠抗原修复液厂家2为迈新生物技术开发有限公司,型号为mvs-0101,具体试验条件如图2所示,将制得的组织切片于光学显微镜下进行观察,结果如图2中a~p所示,图2中a/e/i/m和b/f/j/n分别是水和pbs进行加热处理得到的切片,可以看出,组织结构出现多处龟裂现象,开裂较多,染色不鲜明;如图2中o~p所示,常温(25℃)状态下,即使使用柠檬酸钠抗原修复液,也不能缓解组织开裂的情况;而不同厂家柠檬酸钠抗原修复液在55℃、65℃、85℃加热处理制得的切片,如图2中c~d、g~h、k~l所示组织切片完整,小鼠胰脏组织未见龟裂,无裂缝与过大细胞间隙,染色清晰、鲜明。
103.实施例22~37
104.实施例22~37制备石蜡组织切片的方法与实施例1基本相同,不同之处在于染色步骤不同,柠檬酸钠抗原修复液厂家2为迈新生物技术开发有限公司,型号为mvs-0101,具体试验条件如图3所示,将制得的组织切片于光学显微镜下进行观察,结果如图3中a~p所示,图中a/e/i/m和b/f/j/n分别是水和pbs进行加热处理得到的切片,可以看出,组织结构出现多处龟裂现象,开裂较多,有破碎和空洞,染色不鲜明;如图3中o~p所示,常温(25℃)状态下,即使使用柠檬酸钠抗原修复液,也不能缓解组织开裂的情况;而不同厂家柠檬酸钠抗原修复液在55℃、65℃、85℃加热处理制得的切片,如图3中c~d、g~h、k~l所示组织切片完整,小鼠卵巢部分组织组织未见龟裂,无明显裂缝与过大细胞间隙,染色清晰、鲜明。
105.实施例38~53
106.实施例38~53制备石蜡组织切片的方法与实施例1基本相同,不同之处在于组织不同,染色步骤不同,柠檬酸钠抗原修复液厂家2为迈新生物技术开发有限公司,型号为mvs-0101,具体试验条件如图4所示,将制得的组织切片于光学显微镜下进行观察,结果如图4中a~p所示,图4中a/e/i/m和b/f/j/n分别是水和pbs进行加热处理得到的切片,可以看出,小鼠睾丸组织组织明显龟裂,裂缝较多,细胞间隙过大,染色不鲜明;如图4中o~p所示,常温(25℃)状态下,即使使用柠檬酸钠抗原修复液,也不能缓解组织开裂的情况;而不同厂家柠檬酸钠抗原修复液在55℃、65℃、85℃加热处理制得的切片,如图4中c~d、g~h、k~l所示组织龟裂少,无明显裂缝与过大细胞间隙,染色清晰、鲜明。
107.对比例1
108.对比例1制备石蜡组织切片的方法与实施例1基本相同,不同之处在于对比例1不进行染色优化。即,对组织样本进行上述步骤处理后,得到水化后的组织切片,再进行切片染色,具体步骤如下:
109.(9)染色:将水化后的切片置于苏木素染色液中染色1min,于自来水中漂洗1min;
110.将漂洗后的切片浸泡于体积分数为0.1%盐酸酒精中分化5s;
111.将分化后的切片置于自来水流水中,返蓝10min;
112.将返蓝后的切片置于无水乙醇中,处理时间为30s,再进行伊红染色处理,伊红染液中染色5s,在无水乙醇中进行漂洗,漂洗时间为30s。
113.将制得的石蜡组织切片置于光学显微镜下观察,得到的组织图片如图1-f所示,图1-f中小鼠胰脏组织明显龟裂,裂缝较多,染色不鲜明。
114.对比例2~5
115.对比例2~5制备石蜡组织切片的方法与对比例1基本相同,不同之处在于组织样本不同,将制得的组织切片于光学显微镜下进行观察,结果如图1中g~j所示,图1中g~j是染色过程中未利用染色柠檬酸钠抗原修复液进行加热处理步骤,可以看出,小鼠组织龟裂,裂缝较多,染色不鲜明。
116.对比例6
117.对比例6制备石蜡组织切片的方法与实施例1基本相同,不同之处在于对比例6不进行切片优化,也不进行染色优化,具体步骤如下:
118.(4)切片:将包埋得到的蜡块直接进行切片处理。
119.(9)染色:将水化后的切片置于苏木素染色液中染色1min,于自来水中漂洗1min;
120.将漂洗后的切片浸泡于体积分数为0.1%盐酸酒精中分化5s;
121.将分化后的切片置于自来水流水中,返蓝10min;
122.将返蓝后的切片置于无水乙醇中,处理时间为30s,再进行伊红染色处理,伊红染液中染色5s,在无水乙醇中进行漂洗,漂洗时间为30s。
123.将制得的石蜡组织切片置于光学显微镜下观察,得到的组织图片如图1-k所示,图1-k中小鼠胰脏部分组织褶皱折叠,组织龟裂,裂缝较多,染色不鲜明。
124.对比例7~10
125.对比例7~10制备石蜡组织切片的方法与对比例6基本相同,不同之处在于组织样本不同,将制得的组织切片于光学显微镜下进行观察,结果如图1中l~o所示,图1中l~o是切面未进行润湿处理,未进行染色柠檬酸钠抗原修复液进行加热处理步骤,可以看出,小鼠部分组织褶皱折叠,组织龟裂,裂缝较多,细胞间隙过大,染色不鲜明。
126.综合图示结果可知:相对于对比例的组织切片的制备方法,本技术的石蜡组织切片的制备方法制得的组织切片结构清晰完整,染色鲜明,未见组织龟裂。
127.以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
128.以上所述实施例仅表达了本技术的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对申请专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本技术构思的前提下,还可以做出若干变形和改进,这些都属于本技术的保护范围。因此,本技术专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1