Leptin/Sirt5对BMP9诱导间充质干细胞成骨分化的影响
本发明属于生物细胞,具体的说是leptin/sirt5对bmp9诱导间充质干细胞成骨分化的影响。
背景技术:
1、bmp9是骨形态发生蛋白(bmp)家族的一员,在间充质干细胞(mscs)中bmp9比bmp7或bmp2具有更大的成骨诱导潜能。bmp9可通过经典bmp/smad通路和非经典bmp/smad通路促进mscs成骨分化,如wnt/β-catenin和pi3k/akt信号通路。其中,wnt/β-catenin信号对成骨至关重要可在干细胞分化的早期被激活,但在成骨细胞成熟阶段被抑制[4]。wnt/β-catenin活性可受多种因素调控,如wnt配体、wnt抑制因子1(wif1)、dickkopf 1(dkk1)、骨硬化蛋白(sost)等。此外,β-catenin还可以通过翻译后修饰进行调节,如β-catenin的磷酸化和乙酰化。在诱导前体细胞向成骨细胞分化时,bmp9可激活wnt/β-catenin信号通路。但bmp9如何激活wnt/β-catenin信号尚未完全阐明。
2、瘦素(leptin)是由167个氨基酸组成的多肽,主要表达于白色脂肪组织、骨髓等组织。这种多肽最初是在遗传肥胖的大鼠身上发现的,leptin在血浆中与其受体结合调节摄食和能量平衡,在调节体内能量代谢中发挥关键作用[8,9]。先前的研究表明,高水平的葡萄糖或leptin通过促进丙二酰辅酶a的分泌来抑制糖酵解过程,丙二酰辅酶a是葡萄糖代谢的负反馈调节因子,通过促进糖酵解途径的关键调节因子丙二酰化来实现。在骨重建过程中,瘦素可以通过抑制成骨细胞增殖或通过增加nf-κb受体活化因子配体的表达来促进破骨细胞的吸收,从而调节骨形成与骨吸收之间的平衡。瘦素还通过下调c-myc和cyclin d1[14]的表达抑制成骨细胞增殖。然而,其机制尚不明确。糖酵解是成骨分化过程中的主要能量来源,同时研究发现成骨关键通路wnt/β-catenin可通过肝癌相关巨噬细胞激活糖酵解,促进上皮-间充质转化。瘦素可以通过促进丙二酰辅酶a的分泌来调节糖酵解过程。因此,瘦素可能通过修饰某些关键的成骨调节因子参与调控bmp9的成骨潜能。
3、sirt5是一种nad+依赖性蛋白脱酰基酶,定位于细胞质和线粒体,参与调节多种代谢途径。sirt5可以通过去除靶点赖氨酸残基上的丙二酰化来调节糖酵解途径。丙二酰辅酶a是丙二酰化化合物的供体,可由丙二酰辅酶a脱羧酶代谢。丙二酰辅酶a通过促进关键靶点的丙二酰化来发挥代谢的负反馈调节作用。相反,sirt5通过去甲基化恢复这些靶点的活性,从而正向调节代谢。sirt5作为赖氨酸丙二酰化的全局调节因子,通过与丙二酰辅酶a维持内环境稳态在多种疾病中发挥重要作用。然而,sirt5在成骨分化中的作用尚不清楚。
4、为了证明了瘦素对bmp9诱导的mscs成骨分化的影响,并探讨wnt/β-catenin和sirt5是否参与这一过程,为此,本发明提供leptin/sirt5对bmp9诱导间充质干细胞成骨分化的影响。
技术实现思路
1、为了弥补现有技术的不足,解决上述至少一个问题,本发明提出的leptin/sirt5对bmp9诱导间充质干细胞成骨分化的影响。
2、本发明解决其技术问题所采用的技术方案是:本发明所述的leptin/sirt5对bmp9诱导间充质干细胞成骨分化的影响,该方法步骤如下所示:
3、s1:选用细胞培养,并对细胞进行重组腺病毒;
4、s2:建立大鼠去卵巢(ovx)模型,并通过elisa法测量大鼠血清;
5、s3:提取选用细胞的 rna,同时对cdna制备,并对pcr、蛋白和westernblot检测,同时对碱性磷酸酶(alp)活性测定;
6、s4:小鼠颅骨缺损模型建立;
7、s5:液相色谱-串联质谱分析;
8、s6:共聚焦分析和免疫沉淀法,并记录统计数据。
9、优选的,所述s1的具体方法步骤如下所示:
10、选用细胞为贴壁培养的细胞hek293、c3h10t1/2、3t3-l1和mc3t3-e1,同时将细胞在含有10%fbs、100 u/ml青霉素和100 μg/ml链霉素的杜尔贝科dmem(high glucose)培养基中培养,并置于37℃、5% co2孵育箱中培养;并通过用adeasy系统表达leptin或leptinsirna寡核苷酸的重组病毒,将重组腺病毒在hek293细胞中包装,这些细胞被命名为adbmp9、adleptin和adsileptin;用绿色荧光蛋白(gfp)标记adbmp9和adleptin,用红色荧光蛋白(rfp)标记adsileptin;只表达单体rfp (adrfp)或gfp (adgfp)的腺病毒作为载体对照。
11、优选的,所述s2的具体方法步骤如下所示:
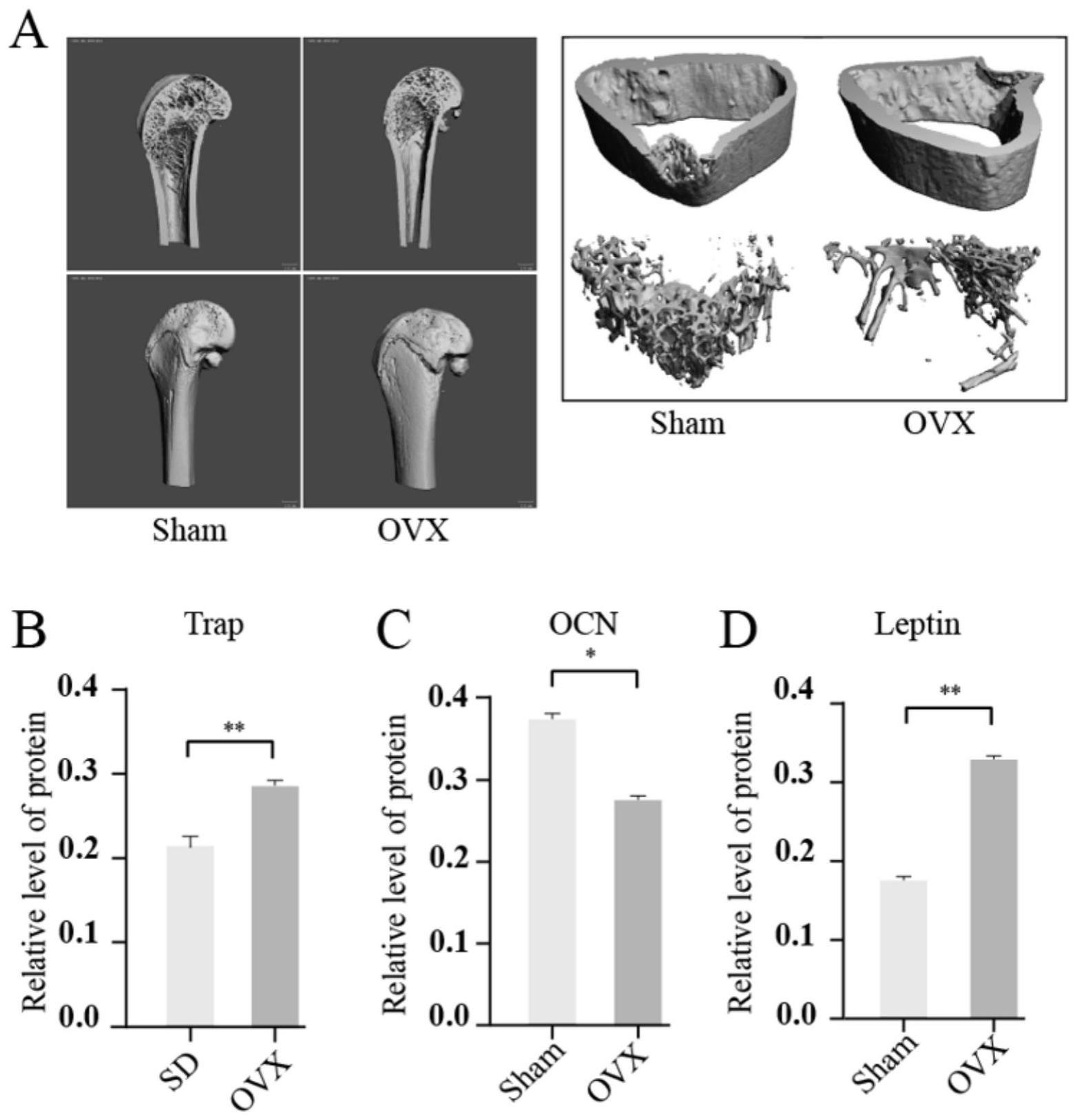
12、a1:选取雌性10只sd大鼠,随机分为ova组和sham组,将ova组采用水合氯醛(4mg /kg)腹腔麻醉,俯卧位固定在手术台上,进行消毒,皮肤被放置在左大腿根部的上边缘,在背部中线处0.5 cm处开0.5 cm切口,用镊子沿腰大肌提起脂肪团的表面肌层,沿外侧边缘被切去约0.5 cm以找到左侧卵巢,摘除卵巢后,用5-0丝线结扎输卵管,右侧卵巢也通过同样的程序被切除;
13、a2:采用elisa法测定ovx大鼠血清抗酒石酸酸性磷酸酶(tracp)、骨钙素(ocn)和leptin水平,用分光光度计(varioskan 3020, thermo scientific)在450 nm处测量吸光度。
14、优选的,所述s3中提取选用细胞的 rna,同时对cdna制备的步骤如下所示:
15、b1:选用细胞经不同因素处理后,于24h、48后结束培养,弃培养基,用预冷的pbs清洗细胞两次,放置于冰上加入400μl trizol裂解10min,用无酶枪头反复吹打,收集细胞裂解液于1.5mlep管中,然后在ep管中加入200μl氯仿,缓慢颠倒混匀20秒,置于冰上等待5min, 4℃低温超速离心12000g,10min;
16、b2:取出ep管,用无酶枪头小心吸取上层液体大约400μl于另一ep管中,加入等体积异丙醇,颠倒混匀后静止10min,低温超速离心12000g,10min;
17、b3:弃上清液,加入75%乙醇(depc水配置)500μl,轻轻颠倒混匀3次,4℃低温离心7500g,5min,重复一次;
18、b4:缓慢匀速的将乙醇倒出,随后将空离20s,弃上清液,加入20μl depc水,测rna浓度;
19、b5:逆转录,取5μl总rna,2μl reaction buffer(5x), 0.5μl oligo(dt) primer,0.5μl primer script rt enzyme mix ⅰ,2μl random hexamer primer(100μm),总共10μl的体系,pcr反应程序:先在 37℃下,加热15min,在缓慢将温度升至85 37℃,,保持5s,倒入ddh2o定容至100μl,放置于-20℃保存。
20、优选的,所述s3中对pcr、蛋白和western blot检测,同时对碱性磷酸酶(alp)活性测定的方法步骤如下所示:
21、c1:取出3μl的cdna与6μl sybr green和引物的混合物混匀, 配成9μl的pcr体系,放置实时荧光定量pcr仪中,反应程序:95℃、3min, 95℃、20s,66℃、10s, 循环3次;95℃ 、10s,55℃、 15s,70℃、1s,总共循环39次,65℃-95℃溶解分析,目的基因mrna水平与β-actin的表达矫正归一化;
22、c2:将细胞接种于中,按照实验设计用试剂处理,在结束时间点,丢弃培养液,用冷磷酸盐缓冲盐水(pbs)冲洗细胞,将6孔板置于冰上,每孔加入300 μl的放射免疫沉淀(ripa)裂解缓冲液(qs0006, saimike, china chongqing)5分钟,将裂解液收集到1.5 mlep管中,4℃离心10分钟(12000 g),再将上清转移到新的1.5 ml ep管中,加入75 μl的加载缓冲液;
23、c3:混合物煮沸10分钟使其变性,用十二烷基硫酸钠聚丙烯酰胺凝胶分离蛋白,转移到pvdf膜上,用5%牛血清白蛋白阻塞90分钟,然后用tris缓冲盐水和tween 20(tbst)冲洗膜3次,与一抗在4℃孵育过夜,再用tbst冲洗膜3次,并用辣根过氧化物酶(hrp)偶联二抗体孵育,数据由chemiscope6200凝胶成像仪收集,使用imagej软件对数据进行量化;
24、c4:将细胞接种于24孔板中,按照实验设计用试剂处理,5或7天后,按照碱性磷酸酶试剂盒的说明进行组织化学染色,再用pbs轻轻清洗盘子并风干,用显微镜拍摄图像,用imagej软件对平板进行扫描和量化。
25、优选的,所述s4的具体方法步骤如下所示:
26、d1:将小鼠头盖骨手术部位的毛发拔掉,用一个直径3毫米的环钻小心翼翼地在头盖骨上钻了一个洞,然后根据实验设计,用adgfp、adbmp9、adbmp9+adleptin或adsileptin、adbmp9+adleptin+adβ-catenin、adbmp9+adsileptin+adsiβ-catenin预处理c3h10t1/2细胞填充孔;
27、d2:8周后,所有小鼠安乐死,取出颅骨并用福尔马林固定,用于后续影像学评估;
28、d3:采用vivact 40μ-ct系统对颅骨缺损修复标本进行扫描,对原始数据进行进一步分析,并利用μ-ct 516.1软件进行三维重建。
29、优选的,所述s5的具体方法步骤如下所示:
30、e1:将富集的赖氨酸-丙二酰化多肽溶于溶剂a(0.1%fa,2%acn)中,加载到自制的反相预柱(75μm id×4 cm长,5μm粒径)上,溶剂b(0.1%甲酸,98%乙腈)在开始的26分钟内梯度从6%增加到23%,8分钟从23增加到35%,3分钟内增加到80%,然后在最后3分钟保持在80%;在easy-nlc 1000 uplc系统中,所有的梯度变化都是在恒定流速为400 nl/min的情况下进行的
31、e2:样品被置于nanospray电离源中,随后在q exactivetmplus系统(thermoscientific)中进行串联质谱(ms/ms),并在线结合超高效液相色谱,然后在参数为2.0 kv的电喷雾电压和350~1800 m/z的全扫描范围和在70000分辨率下,在orbitrap (thermoscientific)中检测到完整的肽,然后选择多肽进行ms/ms,使用归一化碰撞能量值设置为28,在orbitrap中以17500分辨率检测片段,一个依赖于数据的过程在一次ms扫描和20次ms/ms扫描之间交替,使用15.0 s动态排除。。
32、优选的,所述s6中共聚焦分析的方法步骤如下所示:
33、f1:将c3h10t1/2细胞置于激光共聚焦细胞培养皿中,分别用adgfp、adbmp9、adleptin、adsileptin、adbmp9和adleptin、adbmp9和adsileptin、sisirt5或adbmp9和sisirt5处理,24 h后,用冷pbs(4℃)洗涤细胞,4%多聚甲醛固定15 min, pbs洗涤,0.3%triton x-100处理20 min,再用冷pbs洗涤,4℃山羊血清阻塞1小时。
34、f2:细胞与抗β-catenin一抗4℃孵育过夜,细胞用冷pbs洗涤2次,用dylight 594标记的荧光二抗孵育30分钟,用冷pbs洗涤2次,最后用二氨基苯基吲哚(dapi)孵育细胞5min,然后用冷pbs洗涤两次,图像采用共聚焦显微镜拍摄。
35、优选的,所述s6中免疫沉淀法的方法步骤如下所示:
36、g1:细胞接种于6孔板中,按实验设计处理,30小时后,用pbs(4℃)清洗细胞,用ripa裂解缓冲液处理细胞,其中含有蛋白酶和磷酸酶抑制剂;
37、g2:蛋白g磁珠先用ripa裂解缓冲液进行预处理,随后裂解液用这些磁珠进行处理,防止蛋白与磁珠非特异性结合,裂解物与β-catenin、赖氨酸丙二酰化、sirt5或兔igg抗体在4℃孵育过夜,然后与蛋白g磁珠孵育;
38、g3:用ripa裂解缓冲液仔细洗涤磁珠,收集的ripa裂解缓冲液煮沸10分钟,将磁珠粒中洗脱出的蛋白质变形,最后对样品进行标准western blot检测。
39、本发明的有益效果如下:
40、1.本发明所述的leptin/sirt5对bmp9诱导间充质干细胞成骨分化的影响,在c3h10t1/2细胞中,外源性敲低leptin的表达可以增强bmp9所诱导的runx2、opn、 alp活性和基质矿化水平,而过表达leptin则抑制。实验结果发现,leptin敲低可以促进β-catenin的蛋白水平,并且对p-β-catenin没有影响。通过使用adsiβ-catenin病毒与adsileptin及adbmp9联合使用处理细胞时,沉默leptin对bmp9诱导runx2和alp活性的增加作用可被部分逆转。在体内实验结果显示,leptin敲低可以增强bmp9诱导颅骨缺损的面积和骨密度。通过质谱分析发现β-cateni可能存在赖氨酸丙二酰化修饰,同时这种修饰是由leptin通过sirt5,是赖氨酸丙二酰化全局调控因子,来调控。
- 还没有人留言评论。精彩留言会获得点赞!