一种α-s1酪蛋白磷酸化程度检测方法、样品缓冲液及其应用与流程
本发明涉及蛋白检测,具体地说,涉及一种α-s1酪蛋白磷酸化程度检测方法、样品缓冲液及其应用。
背景技术:
1、酪蛋白是一种富含磷酸基团的蛋白质,它在乳制品中起着重要的作用。酪蛋白经过磷酸化修饰后能够影响其溶解性、电荷和结构等多个方面的性质,从而进一步影响其在乳制品生产和细胞生物学研究中的作用。其中,αs1酪蛋白是一种特殊的酪蛋白,它是磷酸化最为常见的酪蛋白之一。αs1酪蛋白磷酸化是指在该蛋白的后翻译修饰过程中,通过激酶催化将磷酸基团添加到丝氨酸、苏氨酸等特定氨基酸上的化学反应。多个区域的αs1酪蛋白含有类似的磷酸化位点,例如在4、5、6、7位置都有丝氨酸残基,这些位点的磷酸化已被证明会影响不同的αs1酪蛋白性质。
2、αs1酪蛋白的磷酸化可以影响其溶解性质。通过添加磷酸基团,酪蛋白的电荷分布发生改变,从而改善其与水分子的相互作用,提高其水溶性。同时,αs1酪蛋白磷酸化也可以促进蛋白质聚集和凝固,类似于在乳酸菌发酵生产酸奶和乳酪等过程中发挥的作用。
3、此外,αs1酪蛋白的磷酸化还可以影响其在细胞生物学中的作用。通过磷酸基团介导的蛋白质相互作用,αs1酪蛋白的磷酸化能够参与细胞信号传递、基因表达、细胞周期调控等许多生物学过程,从而影响了细胞内各个方面的功能和稳态。
4、不同的αs1酪蛋白磷酸化位点,通过引起酪蛋白结构的不同变化而具有不同的功能影响。例如,4位丝氨酸磷酸化可增大酪蛋白分子与亲水溶剂间的接触面积,从而增加其溶解度和稳定性;而磷酸化5和6位置的丝氨酸则具有抗氧化性质,这可能与磷酸化后的酪蛋白具有更好的电子供体/受体特性有关。
5、一般来说,蛋白质的磷酸化和去磷酸化可以调节蛋白质功能的几乎所有方面,例如它的生物活性、稳定性和在protein-protein(蛋白质-蛋白质)相互作用中的起始作用。特别是在酪蛋白中,磷酸化是稳定酪粒体中钙磷酸盐纳米团簇和酪粒体内部结构的关键因素之一。这种独特的微粒结构使得奶可以向新生儿输送大量的钙和磷,而不会增加乳腺生物钙化的风险。酪蛋白的磷酸化状态在不同类型的酪蛋白中有很大的差异。尽管αs1-cn、αs2-cn、β-cn和κ-cn都是磷蛋白质,它们携带的磷酸化基团数(n×p)差异却很大,从κ-cn上的1p至3p,到β-cn上的4p至5p,到αs1-cn上的8p至9p,再到αs2-cn上的10p至13p。引起酪蛋白磷酸化状态差异的原因以及对酪粒体内部结构的影响尚不清楚,可能因酪蛋白类型而异。
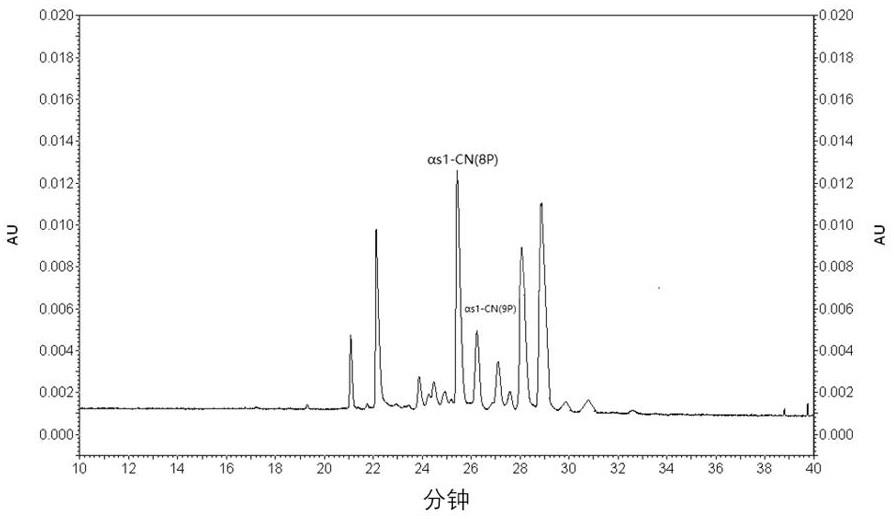
6、αs1-cn的磷酸化差异特别引人关注,因为总αs1-cn在牛奶的总酪蛋白质量分数中占40%以上,并且它有2种常见的磷酸化状态:αs1-cn-8p和αs1-cn-9p。αs1-cn-9p第56位丝氨酸残基包括信号肽的位置上有一个额外的磷酸化残基,之前被称为αs0-cn。αs1-cn-8p质量分数比αs1-cn-9p质量分数高3倍。
7、磷酸化程度差异意味着,酪蛋白胶体团簇对于钙、镁等金属离子的耐受程度不同从而对蛋白质的结构和功能产生影响,例如,磷酸基团数量的差异可能影响蛋白质的热稳定性和溶解性。在食品工业中,这两种不同磷酸基团数量的αs1-cn有不同的应用方向,例如,9磷酸基团的αs1-cn更适合作为乳制品中的乳粉的原料,而8磷酸基团的αs1-cn更适合作为乳酪中的乳蛋白原料。牦牛乳中两种αs1-cn含量相同比例接近于1,而在荷斯坦牛乳中8磷酸基团的αs1-cn含量比9磷酸基团αs1-cn高2.79倍。更高的αs1-cn-9比例使得牦牛乳拥有更好的热稳定性。α-s1酪蛋白磷酸化程度的检测可应用于产品物理性能的评价等方面。
8、现有技术中已有以红外吸收光谱法进行酪蛋白磷酸化程度检测的方案,但此方法前处理时间长,需要真空膜透析一昼夜,且冷冻干燥一昼夜且红外吸收光谱法存在吸收峰模糊,且定性能力差等问题。
9、现有技术中还有以液相色谱-质谱联用方法(lc-ms)进行酪蛋白磷酸化程度检测的方案,为目前最常用的方法。此方法技术思路总体为:使用sds凝胶电泳或尿素凝胶电泳作分离不同磷酸化程度的酪蛋白,后使用lc-ms法检测分离得到的样品,根据碎片分子量之间的差异判断蛋白质的磷酸化程度。但此方法存在以下问题:1、此方法需要进行分离和检测两个步骤,步骤繁琐;2、此方法检测耗时长,其中涉及到sds-page需要约8小时、urea-page需要约14小时、lc-ms 需要约数小时。3、此方法检测前处理方法复杂,分离得到的每一种不同磷酸化程度的酪蛋白均需独立的前处理;4、涉及lc-ms检测,成本高。
10、高效毛细管电泳技术(high performance-capillary electrophoresis,hpce)是一种极具前景的分离分析技术,已经在分析化学和生物学领域得到了广泛应用。它采用毛细管作为电泳管道,利用电场对样品进行分离。相比传统的溶胶电泳,高效毛细管电泳具有分离速度快、分离效率高、自动化程度高、重复性好等优点。高效毛细管电泳技术的工作原理是将溶液内的样品注入毛细管中,同时在毛细管两端施加电势差,使样品在电场作用下向毛细管两极移动,不同成分的物质因其电荷、大小、形状等特性而分离,最终通过检测器检测并记录出每个成分分离的峰值。毛细管电泳所用的石英毛细管柱,在ph>3情况下,其内表面带负电,和溶液接触时形成一双电层。在高电压作用下,双电层中的水合阳离子引起流体整体朝负极方向移动的现象叫电渗。电渗迁移指在电场作用下溶液相对于带电管壁移动的现象。特殊结构的熔合硅毛细管管壁通常在水溶液中带负电荷,在电压作用下溶液整体向负极移动,形成电渗流。带电微粒在毛细管内实际移动的速度为电泳流和电渗流的矢量和。不同分子所带电荷性质、多少不同,形状、大小各异。一定电解质及ph的缓冲液或其它溶液内,受电场作用,样本中各组分按一定速度迁移,从而形成电泳。电泳迁移速度(v)可用下式表示:v=ue,其中e为电场强度(e=v/l, v 为电压,l为毛细管总长度)。u为电泳淌度。
11、根据其分离样本的原理设计不同主要分为以下几种类型:①毛细管区带电泳(capillary zone electrophoresis,cze);②毛细管等速电泳(capillarychromatography,citp);③毛细管胶速电动色谱(miceller electrokinetic capillarychromatography,mecc);④毛细管凝胶电泳(capillary gelelectrophoresis,cge);⑤毛细管等电聚焦(capillary isoelectric focusing,cief)。有望开发为可实现酪蛋白不同磷酸化程度检测的新方法。
技术实现思路
1、本发明的目的之一在于提供一种快速高效、简洁精准、经济成本较低的检测α-s1酪蛋白磷酸化程度的方法。
2、为了实现该目的,本发明的技术方案如下:
3、本发明提供一种α-s1酪蛋白磷酸化程度检测方法,其先对待测样品进行前处理,之后再采用毛细管区带电泳技术进行检测;所述前处理包括:
4、(1)将所述待测样品升温至40-60 ℃,50-55℃保温条件下进行超声处理,超声功率为100-200 w,超声处理时间为20-40 min,获得预处理后的待测样品;
5、(2)将所述预处理后的待测样品温度降至3.8-4.2℃,与3.8-4.2℃的样品缓冲液a混合,获得待测样品第一混合液;所述样品缓冲液a与预处理后的待测样品的体积比为1:(2.8-3.2);
6、所述样品缓冲液a包括:50-200 mmol/l 三羟甲基氨基甲烷(tris),0.1-2 mol/l一价盐和/或二价盐,5-10 mmol/l 二硫苏糖醇(dtt)和1-10 mol/l edta钠盐,ph为7.8-8.2;
7、(3)将所述待测样品第一混合液的温度调整至22-27℃,与样品缓冲液b混合,所述样品缓冲液b与预处理后的待测样品的体积比为1:(0.8-1.2);
8、所述样品缓冲液b包括:50-200 mmol/l 三羟甲基氨基甲烷,0.1-1mmol/l 辛酸钠和0.1-0.5 ‰(w/w)分散剂,ph为7.8-8.2。
9、本发明针对αs1-cn中两种不同磷酸化程度的磷蛋白质分离问题,进行了大量研究,发现现有可检测牛乳中不同酪蛋白的方式,并无法实现不同磷酸化程度的酪蛋白的分离检测,不利于不同性质酪蛋白产品的细化、开发。为此,本发明进行了进一步检测方式的摸索,最终成功获得了本发明的可有效实现αs1-cn中两种不同磷酸化程度的磷蛋白质的快速高效分离的方法,使用此方法可准确实现对分别携带8个磷酸化基团和9个磷酸化基团的α-s1酪蛋白的定量检测。
10、本发明创新地先采用两种特定缓冲液对含有α-s1酪蛋白的待测样品进行依次处理,之后再进行毛细管区带电泳,进而实现了本发明效果。
11、具体地,αs1-酪蛋白的两种酪蛋白亚型(不同磷酸化程度)之间差距极小,仅相差一个磷酸基团,因此很难实现有效完全分离检测,本发明为满足检测需求,先采用了特定一价盐和/或二价盐结合dtt及edta钠盐的组合方式,以既实现酪蛋白胶束的充分解离,充分释放不同磷酸化的αs1-酪蛋白,又保护两种αs1-酪蛋白的磷酸基团不被破坏,从而既保证了两种αs1-酪蛋白的有效分离检测,又保证了检测定量的准确性。
12、在研究时,本发明发现常规分离不同酪蛋白的方式中,所使用的dtt虽然可以使蛋白质中二硫键还原,阻止蛋白质中半胱氨酸之间形成分子内或分子间二硫键,edta钠盐可螯合酪蛋白胶束解离时进入体系中的金属离子,从而有助于酪蛋白的解离,但两者配合并无法很好地平衡不同磷酸化的αs1-酪蛋白的充分释放,以及后续毛细管区带电泳所需的检测离子环境,为此,本发明通过不断摸索特别发现在解离蛋白质时,配合dtt和edta钠盐,再加入特定含量的一价盐和/或二价盐后,可既通过盐析效应辅助酪蛋白胶束的解离,又可平衡edta钠盐螯合离子的速率,从而控制酪蛋白胶束释放不同磷酸化的αs1-酪蛋白的进程,实现对磷酸基团的保护作用,避免过度螯合金属离子带来的负面效果(过强的解离效果往往可能导致酪蛋白亚型二、三级结构被破坏,从而使得无法实现对目标磷酸基团的检测)。而且,特定含量一价盐和/或二价盐的加入,还可为后续毛细管区带电泳检测时提供必要的离子环境,从而保证检测的有效进行。
13、本发明以样品缓冲溶液a实现蛋白胶束的解离,但既需要保证酪蛋白胶束充分解离,又需要保证解离进程处于理想状态,产生最佳的解离效果,还需要同时与后续样品缓冲液b的组分配合形成样品检测溶液后,可获得与电泳缓冲液尽量接近的离子浓度(样品缓冲液和电泳缓冲液离子浓度相近可以避免检测过程中因离子浓度差导致的电位差而产生的误差),并保证样品检测溶液与电泳缓冲液接触混合后,不影响检测最优ph值范围(ph 2-3),才能保证毛细管区带电泳的检测效果。因此,配合摸索出可同时兼顾上述效果的方案并不容易,本发明通过不断调整样品缓冲溶液a的组分选择、各组分浓度,并配合样品缓冲液b的组分选配和施用比例等综合因素,最终摸索出本发明的一价盐和/或二价盐以及dtt和edta钠盐共同以特定组合配合的方案,保证了检测效果的实现。
14、本发明还特别在待测样品处理时,于酪蛋白胶束解离后,添加了以样品缓冲液b处理的步骤,该缓冲液中特别包含了辛酸钠,其羧酸集团可以与酪蛋白亚型表面的氨基酸残基形成氢键和离子键,通过辛酸钠较好的亲脂性能够降低蛋白质的溶解度,防止酪蛋白亚型发生聚集沉淀,从而提高了其稳定性。且在本发明中,辛酸钠的烷基长度适宜,其中的烷基-r可以在蛋白质之间形成特定的空间位阻,配合分散剂可使得样品在检测过程中具有适中的分散性,帮助形成理想的检测结果。若烷基链长度过短,则会导致亲脂效应不明显且在本发明体系中所能形成的空间位阻较小,无法提供适宜的分散性,影响检测结果。烷基长度过长则会导致在有限的空间内酪蛋白亚型过于分散,使得检测结果出现检测时间延长,出峰拖尾等情况,从而影响检测的准确性。
15、如上所述,本发明中样品缓冲液a的目的在于酪蛋白胶束解离,样品缓冲液b其目的在于解离后各酪蛋白亚型之间的分散。但是在最后进样检测之前,两种缓冲液是混合在一起相互作用的,它们共同提供了毛细管区带电泳检测时样品溶液的离子环境和ph值,因此样品缓冲液b的组分选择也需考量与样品缓冲液a配合后的效果。而且,两种缓冲添混合后还会影响最终进样之前样品的浓度,从而影响样品缓冲液b组分分散效果的发挥,因此本发明在研发时还对此情况进行了考量,最终才获得了可兼顾前处理和检测的不同需求的方案。
16、此外,本发明在研发时还发现,采用本发明缓冲溶液处理样品后,检测时吸收峰之间的独立性仍有待提高,故在多方摸索后,发现在样品预处理阶段特别设置特定超声处理步骤后,可对样品中整体的酪蛋白胶束粒径产生特定影响,改变胶束在体系中的状态,从而增加了胶束与后续药品接触的位点,使本发明体系解离胶束的效率和效果得到提升。
17、缓冲液的浓度和能够检测酪蛋白的浓度有关系,本发明的方法可实现酪蛋白浓度10%以下的样品中α-s1酪蛋白磷酸化程度的准确检测,应用范围广泛。
18、本发明的α-s1酪蛋白磷酸化程度检测方法中,所述一价盐为钠盐和/或钾盐;所述二价盐为钙盐和/或镁盐;优选所述一价盐为氯化钠,所述二价盐为氯化钙;由于α-s1酪蛋白磷酸化程度的检测多应用于动物奶的检测,故本发明优选采用氯化钠、氯化钙这类动物奶中原本存在的盐,以避免额外在乳体系中引入原本不存在的成分,从而有利于保持体系的稳定性。
19、所述edta钠盐为edta-2na和/或edta-4na;
20、所述分散剂为羟丙基甲基纤维素、羟丙基乙基纤维素、聚丙烯酰胺中的一种或多种;
21、和/或,所述样品缓冲液a和所述样品缓冲液b的ph值由盐酸调整获得,优选盐酸的浓度为3.5-4.5 mol/l。
22、优选,本发明的α-s1酪蛋白磷酸化程度检测方法中,所述样品缓冲液a包括:100mmol/l 三羟甲基氨基甲烷,0.5 mol/l nacl,5 mmol/l 二硫苏糖醇和4 mol/l edta-4na,ph为8;所述样品缓冲液a与预处理后的待测样品的体积比为1:3;
23、所述样品缓冲液b包括:100 mmol/l 三羟甲基氨基甲烷,0.5mmol/l 辛酸钠和0.1‰(w/w)羟丙基甲基纤维素,ph为8;所述样品缓冲液b与预处理后的待测样品的体积比为1:1。
24、本发明的α-s1酪蛋白磷酸化程度检测方法中,所述待测样品为含有α-s1酪蛋白的液体物质;如,动物乳、调味乳等含有乳汁成分且其中α-s1酪蛋白未变性的液体。
25、若所述待测样品为含有脂肪的乳制品,则在所述待测样品进行超声处理前还包括低温离心的步骤,所述低温离心后取下层待测样品液体进行后续操作;优选,所述低温离心的条件为:3.8-4.2℃,离心转速3000-5000 rpm,离心时间20-40 min。
26、低温离心可防止乳制品中的脂肪分解,有助于去除乳制品中的脂肪,还有利于酪蛋白的分散。
27、本发明的α-s1酪蛋白磷酸化程度检测方法中,所述预处理后的待测样品与所述样品缓冲液a混合后,保温60-120 min;所述待测样品第一混合液与所述样品缓冲液b混合后,稳定30-60 min;
28、和/或,步骤(1)中,将所述待测样品升温至55 ℃,55℃保温条件下进行超声处理,超声功率为180 w,超声处理时间为30 min。
29、本发明的α-s1酪蛋白磷酸化程度检测方法中,采用毛细管区带电泳技术进行检测时,电泳缓冲液包括:edta-2na和/或edta-4na 1-10 mol/l,磷酸二氢钠 10-100 mmol/l,ph为2-3,ph值由磷酸调整获得,更优选磷酸的浓度为4.5-5.5 mol/l。
30、本发明的α-s1酪蛋白磷酸化程度检测方法中,采用毛细管区带电泳技术进行检测时,毛细管为无涂层的石英玻璃管;毛细管参数为内径50 μm,外径375μm,柱长60 cm,有效长度50 cm;毛细管区带电泳技术参数为:检测温度25℃,电压23-30 kv,检测器为紫外检测器,检测波长为214 nm;进样压力为0.5 psi,进样时间为10 s。
31、本发明的α-s1酪蛋白磷酸化程度检测方法中,毛细管可采用常规活化方式,如:使用0.1 mol/l naoh,进样压力 20-60 psi,冲洗5-10 min;使用超纯水,进样压力20-60psi,冲洗5-10 min。
32、本发明另提供一种检测α-s1酪蛋白磷酸化程度的样品缓冲液,其包括:样品缓冲液a和/或样品缓冲液b,所述样品缓冲液a、样品缓冲液b如上所述。
33、本发明还提供上述α-s1酪蛋白磷酸化程度检测方法或样品缓冲液在定量检测两种不同磷酸化程度的α-s1酪蛋白中的应用,所述两种不同磷酸化程度的α-s1酪蛋白分别携带8个磷酸化基团和9个磷酸化基团。
34、本发明再提供上述α-s1酪蛋白磷酸化程度检测方法或样品缓冲液在乳制品质量控制中的应用。
35、本发明的有益效果至少在于:
36、本发明使用毛细管区带电泳技术(cze)作为检测α-s1酪蛋白不同磷酸化程度的方法,只需要对待测样品进行一次前处理后进样即可进行检测,操作简便、效率高,可有效分离携带8个磷酸化基团和9个磷酸化基团α-s1酪蛋白,实现两者的准确定量检测,可应用于相关产品的质量控制中。
- 还没有人留言评论。精彩留言会获得点赞!