一种茶叶中α-淀粉酶抑制剂的高通量筛选方法
本发明属于茶叶中活性成分筛选,更具体地说,涉及一种茶叶中α-淀粉酶抑制剂的高通量筛选新方法。
背景技术:
1、糖尿病是一种因胰岛素作用障碍或分泌不足而导致的代谢性疾病,以持续性血糖升高和尿糖为特征,并伴随多系统、多脏器并发症的发生。近年来,随着社会的发展和人们生活方式的改变,糖尿病发病率在全球范围内呈现逐年增长的趋势,严重威胁着人类的健康。食物中的碳水化合物是血糖的主要来源,经口腔摄入后,碳水化合物经α-淀粉酶作用分解为双糖,进一步分解为单糖才能被人体吸收利用。α-淀粉酶抑制剂是治疗ⅱ型糖尿病的常用药物,因此从天然植物中筛选α-淀粉酶抑制剂具有重要的意义。
2、茶叶是仅次于水的世界第一大饮料,具有令人愉悦的风味品质,并具有多种保健功效。流行病学调查表明,茶叶的消费量与糖尿病及其并发症的风险呈现负相关,近年来体内外实验也显示茶叶在预防和缓解糖尿病及其并发症方面具有积极的作用。然而由于茶叶是一个复杂的混合物,目前关于茶叶中具有降血糖作用的化合物尚不明确,阻碍了茶叶来源的降血糖保健品和降血糖药物的开发,因此急需开发能够从茶叶复杂的混合物溶液中高通量筛选具有降血糖功效化合物的新方法。
技术实现思路
1、针对现有技术中存在的问题,本发明设计的目的在于提供一种茶叶中α-淀粉酶抑制剂的高通量筛选新方法。该方法将“α-淀粉酶-茶叶化合物”相互作用和基于液相色谱-质谱的代谢组学方法结合起来,用来高通量筛选茶叶中具有抑制α-淀粉酶活性的化合物,具体通过以下技术方案加以实现:
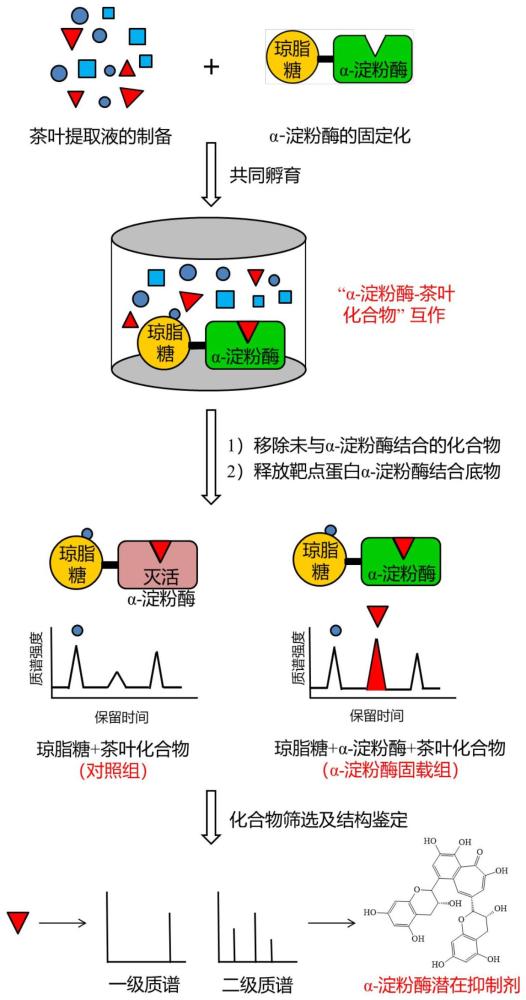
2、一种茶叶中α-淀粉酶抑制剂的高通量筛选方法,包括以下步骤:1)茶叶提取液的制备;2)α-淀粉酶的固定化;3)茶叶提取液与固定化的α-淀粉酶进行共同孵育;4)移除未与α-淀粉酶结合的化合物;5)释放靶点蛋白α-淀粉酶结合底物;6)化合物筛选及结构鉴定;7)化合物抑制α-淀粉酶活性测定。
3、进一步地,步骤1)中,茶叶提取液的制备方法为:取茶粉置于100℃沸水中进行水浸提30min,收集浸提液即为茶叶提取液。
4、进一步地,步骤2)中,α-淀粉酶的固定化的步骤为:
5、2-1)将α-淀粉酶溶解于含0.1m碳酸氢钠和0.5m氯化钠,ph 8.3的亲和缓冲液中,使其浓度为2.0mg酶/ml,然后在25℃下与cnbr活化的琼脂糖混合,得膨胀的凝胶混合物,其中,α-淀粉酶与亲和缓冲液的料液比mg:μl为1:500,α-淀粉酶与cnbr活化的琼脂糖的质量比为1:50;
6、2-2)将凝胶混合物于室温下以600rpm的转速涡旋1小时,以确保酶和琼脂糖完全结合;
7、2-3)待蛋白质偶联后,加入0.1m,ph 8.0的tris-hcl缓冲液,继续在室温下以600rpm的转速涡旋1小时,以封锁凝胶上固定的反应位点;其中tris-hcl缓冲液的加入量是亲和缓冲液体积的3倍;
8、2-4)静置10分钟后,吸出与tris-hcl缓冲液等体积的上清液,再加入相同体积的0.1m,ph 8.3,含0.5m氯化钠的乙酸钠缓冲液,继续在室温下以600rpm的转速涡旋10分钟;
9、2-5)静置10分钟后,吸出与tris-hcl缓冲液等体积的上清液,再加入相同体积的0.1m,ph 8.3的tris-hcl缓冲液,继续在室温下以600rpm的转速涡旋10分钟;
10、2-6)静置10分钟,吸出同体积的上清液,下层为琼脂糖凝胶固定的α-淀粉酶,即为α-淀粉酶固载组,同时设置对照组,对照组利用灭活的α-淀粉酶以同样的方式进行制备。
11、进一步地,步骤3)中,茶叶提取液与固定化的α-淀粉酶共同孵育的步骤为:将茶叶提取液和琼脂糖凝胶固定的α-淀粉酶混合,在37℃下以600rpm的转速涡旋20分钟使其孵育,其中,茶叶提取液与琼脂糖凝胶固定的α-淀粉酶的料液比为10:1。
12、进一步地,步骤4)中,移除未与α-淀粉酶结合的化合物的方法为:孵育结束后,静置10分钟,吸出与茶叶提取液相同体积的上清液,再用相同体积的ph 6.8的磷酸盐缓冲液洗涤上述固定化α-淀粉酶的琼脂糖凝胶,洗涤次数为2-6次,以除去未与琼脂糖凝胶结合的茶叶化合物。
13、进一步地,步骤5)中,释放靶点蛋白α-淀粉酶结合底物的方法为:用55%甲醇水溶液,ph 3.3的解析液处理琼脂糖凝胶,以释放捕获的潜在α-淀粉酶抑制剂,然后收集释放的馏分在真空冷冻浓缩仪中进行浓缩,对照组以同样的方式收集洗脱液,其中,解析液的使用量为每次吸出上清液体积的一半。
14、进一步地,步骤6)中化合物筛选及结构鉴定具体为:将步骤5)收集的馏分复溶于10%甲醇水溶液并进行高分辨液质联用分析,筛选出α-淀粉酶组溶液中比对照组溶液中比值>1.5,student’s t-检验p<0.05的化合物,并根据化合物的精确分子量与二级质谱信息进行结构鉴定。上述高分辨液质联用分析所用仪器为uhplc-q-exactive;液相色谱条件为:waters hss t3色谱柱,100×2.1mm,1.8μm,流动相a为0.1%的甲酸溶液,流动相b为含0.1%甲酸的乙腈溶液,流动相梯度设置如下:0分钟,2% b;0.5分钟,2% b;10分钟,15%b;18分钟,40% b;20分钟,90% b;20.9分钟,90% b;21分钟,2%b;25分钟,2%b;流速0.4毫升/分钟,进样量3微升;质谱条件为:采用电喷雾离子源,离子化模式为正离子,毛细管电压为3.5kv,毛细管温度设置为300℃,辅助气温度和流速分别设置为350℃和10升/分钟,扫描范围为质荷比m/z100-1000。
15、进一步地,步骤7)中化合物抑制α-淀粉酶活性测定方法为:对步骤6)筛选出来的化合物,通过购买标样或者从茶叶中分离纯化制备化合物单体,配制成不同浓度的母液,首先吸取0.1ml不同浓度的化合物溶液和0.05mlα-淀粉酶溶液于2ml离心管中,在25℃的水浴锅中孵育10分钟,其次加入0.2ml淀粉溶液后继续在25℃的水浴锅中孵育10分钟,接着再加入0.4ml dns试剂充分混匀,在100℃水浴锅中孵育10分钟,最后再吸取0.1ml反应液至96孔培养板中,用酶标仪在540nm处测量其吸光值,化合物对α-淀粉酶活性的抑制率由以下公式计算:
16、
17、式中acontrol、acontrolblack、asample、asampleblack分别代表α-淀粉酶和缓冲液、缓冲液、化合物和α-淀粉酶以及化合物的吸光值。
18、本发明通过直接利用茶叶提取液与α-淀粉酶进行孵育,筛选具有α-淀粉酶抑制能力的活性化合物,无需预先的茶叶中化合物单体的分离纯化步骤,极大地节省了工作量;同时在筛选具有α-淀粉酶抑制能力的活性化合物过程中,茶叶提取液中的所有化合物一同与α-淀粉酶竞争结合,直接筛选出对于α-淀粉酶具有较强的结合能力的活性化合物;本发明方法具有操作简单、快速、高效、成本低的优点,在茶叶活性成分的筛选研究领域具有广阔的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!