一种用于检测单增李斯特菌的无扩增时间分辨荧光侧流层析法及其检测平台的制作方法
本发明涉及一种即时检测技术,特别是涉及一种用于检测单增李斯特菌的无扩增时间分辨荧光侧流层析法及其检测平台。
背景技术:
1、单核细胞增生李斯特氏菌(listeria monocytogenes),简称单增李斯特菌,兼性厌氧,革兰氏阳性菌,广泛存在于自然界中。单增李斯特氏菌导致的细菌性食物中毒主要是通过食用受污染的食物,例如乳制品,即食肉和海鲜以及蔬菜和水果而发生的,且污染主要发生在加工过程中。单增李斯特菌感染会导致胃肠道疾病,对于免疫功能低下的患者会导致脑部和血液感染,或导致孕妇出现胎儿并发症。单增李斯特菌是一种会形成生物膜的嗜冷菌,对大多数消毒剂具有抵抗力。因此,在危害前建立快速、灵敏、低成本的即时检测(point of care testing,poct)方案已成为迫切需求。
2、利用序列特异性dna杂交的核酸侧向流动分析在poct检测中的应用意义巨大,因为它对设备的依赖性最小,速度快,灵敏度高,用户友好。nalfa方法与核酸扩增和crispr-cas12a技术联用,可以实现灵敏的核酸检测,并克服了目前的局限性。例如,gootenberg等人提出了一种名为sherlock的sars-cov-2检测方法,joung等人证明了对sars-cov-2样本的直接检测,并进一步开发了shine。上述所有的lfa-crispr方法都能实现准确和特异的检测。然而,以下局限性仍有待解决。(1)依靠核酸预扩增来实现小于100pm的高灵敏度检测,检测过程超过1小时;(2)crispr-cas12a系统由于其复杂的处理和非防腐性质,使用中容易出现交叉污染;(3)目前,lfa-crispr通常使用两端用修饰生物素和aunps标记的抗体探针,其制备复杂,难以用于定量检测,信号较弱。
技术实现思路
1、鉴于以上所述现有技术的缺点,本发明的目的在于提供一种用于检测单增李斯特菌的无扩增时间分辨荧光侧流层析法及其检测平台,用于解决现有技术中lfa-crispr需要预扩增、耗时久,crispr系统处理复杂且不防腐,抗体探针制备复杂、信号差的问题。
2、为实现上述目的及其他相关目的,
3、本发明的第一方面,提供一种用于检测单增李斯特菌的无扩增时间分辨荧光侧流层析(amplification-free time-resolved fluorescence lateral flow assay,afc-trfia)检测平台,所述afc-trfia检测平台包括侧流层析试纸(lfa)、eu-bio-mab荧光探针和crispr 冻干试剂,所述侧流层析试纸包括背板、nc膜、样品垫和吸收垫,所述nc膜上设有检测线和质控线,所述检测线上包被ssdna捕获探针,所述质控线上包被羊抗鼠二抗;所述eu-bio-mab荧光探针由铕时间分辨荧光微球(eu(iii)-trfm)与抗生物素抗体(bio-mab)偶联制得;所述crispr 冻干试剂包括cas12a核酸酶和crrna。
4、于本发明的一实施例中,用于识别单增李斯特菌的crrna的序列如seq id no.1~seq id no.3任一所示。
5、其中,1x所述crispr 冻干试剂包括20~30 mm hapes、3~8%蔗糖、2~3%普鲁兰糖、3~8%甘露醇、100 nm cas12a核酸酶和200 nm crrna。优选的,1x所述crispr 冻干试剂包括20mm hapes、5%蔗糖、2.5%普鲁兰糖、5%甘露醇、100 nm cas12a和200 nm crrna。优选的,为更好地保存,所述crispr 冻干试剂的ph为 8.0。
6、进一步的,在配置好上述试剂后进行冻干时,首先在-80℃的冰箱中进行5min预冷,再用液氮进行速冻并冷冻干燥过夜,即得到crispr冻干试剂,随取随用,在使用过程中省去了繁琐的添加。使用时,加入重悬液(40mmkcl、10mmmgcl2、3.5%w/vpeg-8000,trfm-bio-ssdna报告探针)进行重悬。其中,所述trfm-bio-ssdna报告探针由eu-bio-mab荧光探针与生物素修饰的ssdna(bio-ssdna)组合形成。所述trfm-bio-ssdna报告探针的浓度优选为3µg/ml。
7、进一步的,所述bio-ssdna的序列为5’/biotin-ttttttttatt/3’。所述bio-ssdna的添加量为20~60nm,优选为40nm。
8、进一步的,所述eu-bio-mab荧光探针的用量为2~3μg,优选为2.5μg。
9、于本发明的一实施例中,所述eu-bio-mab 荧光探针的制备方法包括以下步骤:
10、a、将eu(iii)-trfm与上样缓冲液混合并超声;
11、b、加入nhs和edc进行活化,金属浴中避光孵育一段时间;
12、c、添加抗bio-mab超声几分钟,在浴中避光震荡孵育一段时间;
13、d、结束后加入封闭液孵育一段时间,离心,弃上清,洗涤沉淀,最后,将沉淀物重新溶解在复溶液中,得到eu-bio-mab 荧光探针。其中,使用eu-trfm作为标记物,可以获得比aunps更强的荧光信号、更长的斯托克斯位移和明显更低的干扰半衰期,从而实现快速、灵敏的定量检测。
14、其中,所述上样缓冲液为mes溶液;所述封闭液为1%bsa溶于0.01m pb中;所述复溶液包括0.05mtris-hcl、3%w/v海藻糖、1%bsa和1%tween20,所述复溶液的ph为7.4。
15、在步骤a中,由于时间分辨荧光微球具有疏水性质,如果mes溶液中的电解质浓度过高,溶液中的带电粒子就会与荧光微球表面电荷基团发生中和作用,则会导致荧光微球团聚。因此,需要优化上样缓冲液的ph以保持微球充分分散,ph优选为6~8,更为优选为7。
16、具体的,在步骤a中,将10µl固型含量为1%的eu(iii)-trfm与800µlmes溶液(0.02m)混合,超声2min;在步骤b中,加入3~7µl浓度为1mg/ml的nhs和edc进行活化,金属浴(25℃500rpm)中避光孵育30min;在步骤c中,添加2.5ug抗bio-mab超声2min,在25℃500rpm的金属浴中避光震荡孵育2小时;在步骤d中,结束后加入200µl封闭液(1%bsa,溶于0.01mpb中)孵育30min,12000rpm离心10min后,弃上清,洗涤沉淀3次,最后,将沉淀物重新溶解在400µl复溶液(0.05mtris-hcl、3%w/v海藻糖、1%bsa和1%tween20,ph7.4)中,得到eu-bio-mab荧光探针。
17、于本发明的一实施例中,所述ssdna捕获探针的序列如seq id no.4所示。
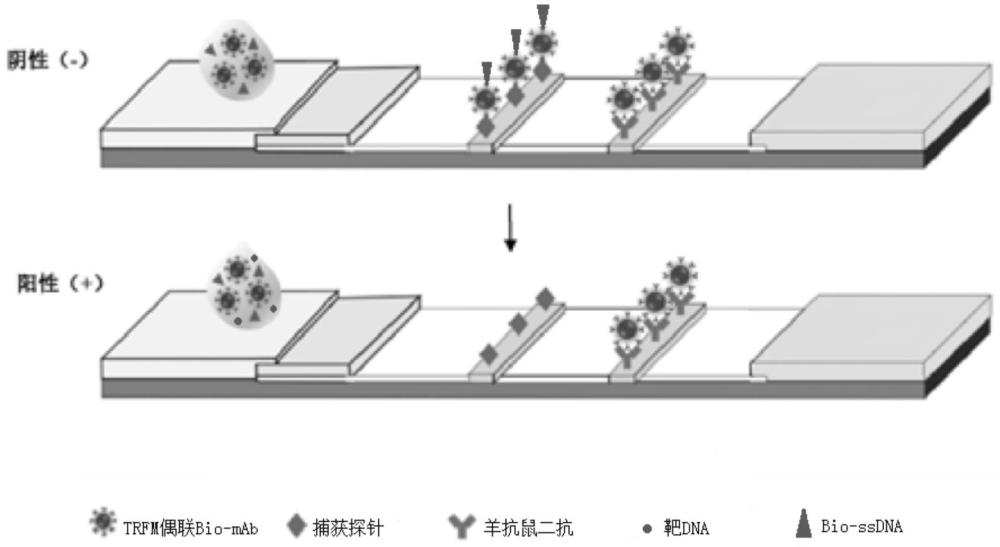
18、进一步的,所述ssdna捕获探针通过不同碳链长度的胺基进行修饰。优选在5’端修饰c3nh2、c6nh2、c12nh2等,更为优选为在5’端修饰c12-nh2。
19、进一步的,所述ssdna捕获探针的工作浓度为200~400μm,优选为300μm;所述羊抗鼠二抗的工作浓度为0.5~1.5mg/ml,优选为1mg/ml。
20、本发明的afc-trfia检测平台使用ssdna捕获探针代替常规的bio-sa体系捕获荧光报告探针,显著降低制备成本和时间。但这种探针也存在 nc 膜上组合不稳定的缺点,因此需要复杂的交联反应辅助固定,而通过化学方法在增强核酸和 nc 膜之间分子间作用力来固定捕获探针是一种更简单和更有效的方法。具体的,所述ssdna捕获探针直接与固定化缓冲液混合,然后使用点喷平台喷洒在nc膜上作为测试(t)线。所述固定化缓冲溶液包括吐温-20、tris-hcl、c2h5oh、c3h8o3、pbs、kcl、cacl2、nacl 和 mgcl2中的一种或多种。优选为kcl溶液,其浓度优选为0.8m。
21、进一步的,在所述侧流层析试纸上,所述检测线和质控线之间相距4~6mm;优选为5mm。所述nc膜、样品垫和吸收垫依次粘贴在背板上,所述背板为pvc板。所述样品垫与nc膜重叠部位长度为1~3mm,优选为2mm,所述样品垫置于nc膜上方;所述吸收垫与nc膜间重叠部位长度为1~3mm,优选为2mm,所述吸收垫置于nc膜上方,以确保反应液顺利通过整个条带。
22、进一步的,所述样品垫的制备方法为:将宽18~22mm的玻璃纤维样品垫浸入反应缓冲液中4 .5~5 .5min完成饱和,然后在45~55℃下干燥18~30h。其中,所述反应缓冲液包括0 .05m tris-hcl,2%w/v peg8000和1 .5%v/vtween-20,所述反应缓冲液的ph=8.0。所述吸收垫无需缓冲处理。
23、所述afc-trfia检测平台的检测原理如图1所示:在afc-trfia检测平台中,抗生物素抗体(bio-mab)和trfm偶联,并与生物素修饰的ssdna(bio-ssdna)组合形成trfm-bio-ssdna报告探针;当cas12a、crrna和靶dna都存在,形成三元crispr-cas/靶dna组合物时,crispr-cas12a的反式切割能力会被激活,trfm-bio-ssdna报告探针被非特异性切割,报告基因组合物在测试线上不产生任何信号积累,而在控制线上产生了明显的荧光信号;在没有靶标的情况下trfm-bio-ssdna报告探针由捕获探针捕获并积累在测试线上,羊抗鼠二抗在控制线上捕获过量的trfm-mab。简而言之,靶dna浓度与cas12a/crrna的反式裂解活性呈正相关,并与t线上的荧光信号负相关,测试线和控制线处产生的信号可以既可以通过荧光读取器分析实现定量检测,也可以通过手持紫外灯肉眼判断。
24、使用 afc-trfia 平台,可以准确的将单增李斯特菌与其他的单菌株病原体或多菌株混合系统区分开来,并且可以通过 hg-98 荧光阅读器得到 fit/it0的比率,定量检测单增李斯特菌的浓度。同时,使用手持式紫外灯(325 nm)也可以直观地分辨出耐药菌株。
25、本发明的第二方面,提供一种用于检测单增李斯特菌的无扩增时间分辨荧光侧流层析法,包括以下步骤:
26、s1、将铕时间分辨荧光微球与抗生物素抗体偶联得到eu-bio-mab荧光探针,将其与bio-ssdna组合形成trfm-bio-ssdna报告探针;
27、s2、提取待测样品的dna;
28、s3、将crispr冻干试剂、trfm-bio-ssdna报告探针和s2得到的dna混合得到上样混合液,孵育一段时间;
29、s4、将上样混合液加至侧流层析试纸的样品垫上,层析一段时间后,读取试纸的荧光信号。
30、在步骤s2中,所述dna通过加热裂解法提取得到。
31、在步骤s2中,所述加热裂解法包括以下步骤:将2ml样品重悬于200µl的tris-edta缓冲液中,加热裂解8min~10min,然后以12000×g的转速离心2min,取上清液作为底物,通过k5500超微分光光度计和nanodrops测定dna浓度和纯度。
32、在步骤s3中,孵育时间为10~30min,优选为20min。
33、在步骤s3中,将crispr冻干试剂与含有trfm-bio-ssdna报告探针的重悬液进行重悬,然后加入dna进行混合,从而得到上样混合液。
34、在步骤s4中,层析时间为6~10min,优选为8min。
35、表1、用于afc-trfia检测的crrna及核酸探针序列
36、
37、如上所述,本发明的一种用于检测单增李斯特菌的无扩增时间分辨荧光侧流层析法及其检测平台,具有以下有益效果:
38、1、本发明提供了一种基于crispr-cas12a的无扩增时间分辨荧光侧流层析法来靶向单增李斯特菌,通过高性能的组合crrna,实现无扩增一锅端检测,从而实现对单增李斯特菌的快速特异性检测;本发明对crispr系统进行冻干处理,在使用过程中省去了繁琐的添加,检测步骤减少,适用于快速、大批量的检测环境;afc-trfia检测平台由于其快速、灵敏、低成本和用户友好,是一种可接受的poct解决方案,可用于早期检测单增李斯特菌。
39、2、afc-trfia检测平台使用ssdna捕获探针代替常规的bio-sa体系捕获荧光报告探针,显著降低制备成本和时间;对ssdna捕获探针进行基于胺基的修饰,增加了立体结构,并用金属离子中和了带负电荷的磷酸盐骨架,促进了捕获探针在10min内的高效固定化,而不需要依赖设备。
40、3、通过对反应体系的优化,基于组合crrna的afc-trfia方法灵敏度显著提高,afc-trfia检测平台不需要预扩增,而且几乎是独立于仪器的,可以在30min内进行现场定量检测,这种方法不需要培训就能满足poct的要求,扩大了其在检测初筛中的应用。
- 还没有人留言评论。精彩留言会获得点赞!