一种检测(1-3)-β-D葡聚糖的免疫层析试纸及其制备方法和应用与流程
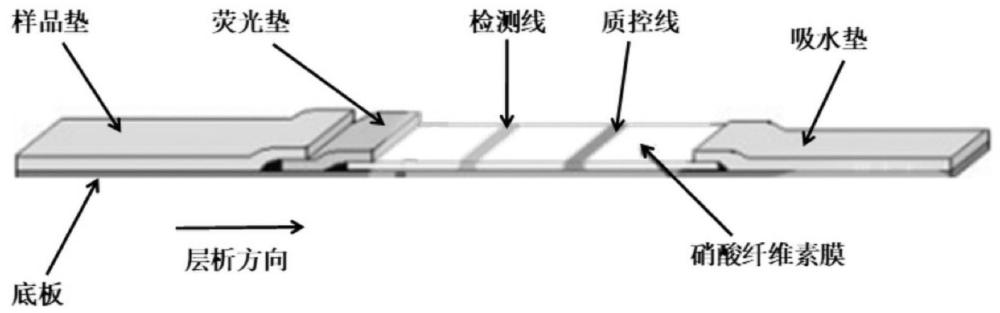
本发明属于生物,涉及一种检测(1-3)-β-d葡聚糖的免疫层析试纸及其制备方法和应用。
背景技术:
1、(1-3)-β-d葡聚糖广泛存在于真菌细胞壁中,占真菌细胞干质量的50%以上。由d-葡聚糖聚合而成,以β-1,3糖苷键连接的葡萄糖残基骨架作为主链,分支状β-1,6糖苷键连接的葡萄糖残基作为侧链。除结合菌(主要是根霉菌和毛霉菌)外,所有真菌胞壁成分中都含有(1-3)-β-d葡聚糖,以酵母样真菌含量最高,人体细胞、病毒、原核生物等不含该成分,这一特点使其成为检测深部真菌感染的理想标志物。当真菌侵入人体血液或深部组织并引起深部感染时,真菌细胞被吞噬细胞吞噬消化后,从细胞壁中释出(1-3)-β-d葡聚糖,导致血液及体液中该成分显著增加。而当感染浅部组织及定植真菌时,(1-3)-β-d葡聚糖很少释放到血液中,在体液中的含量不高。(1-3)-β-d葡聚糖有2种存在形式:一种是以单链形式存在的低级结构,另一种是以双股螺旋或三股螺旋形式存在的高级结构(1-3)-β-d葡聚糖呈中性,并含有少量的β-1,6糖苷键连接结构,在分子内多羟基作用下,形成致密的三螺旋结构,具有高免疫活性低溶解度的特点。因此,(1-3)-β-d葡聚糖定量检测是诊断深部真菌感染的有力依据,可用于侵袭性真菌病(invasive fungal disease, ifd)的鉴定。
2、由于ifd危险性大,发病率高,越来越成为危害人类健康及生命安全的重要因素,特别是免疫功能低下者或伴有严重基础疾病住院患者等。因此,快速准确的早期诊断深部真菌感染具有重要意义。目前,已开发出了多种基于鲎试剂的葡聚糖显色检测试剂盒,具有快速、灵敏、特异性强、重复性好等优点,在临床上已广泛应用。缺点是检测时间较长,并且传统方法生产的鲎试剂易受内毒素干扰,造成假阳性。鲎为国家二级保护动物,因此,基于免疫学检测葡萄糖试剂盒的开发迫在眉睫。如磁微粒化学发光技术,但其弊端为易受样品中生物素的干扰,检测准确度低。
3、荧光免疫层析法应用于ifd检测,具有操作简便、检测快速,对设备要求不高,插卡式读数,结果易于判断,大大缩短了检测时间。为易感人群的检测提供了一种有效的辅助手段。
4、综上所述,目前缺少针对于真菌(1-3)-β-d葡聚糖进行检测的免疫层析试纸,现有检测方法及试剂盒的检测准确度低,灵敏性不够高。如何提供一种检测(1-3)-β-d葡聚糖的免疫层析试纸及其制备方法,无需加热处理的同时提高检测的准确性和灵敏性,已成为目前生物技术领域亟待解决的问题之一。
技术实现思路
1、针对现有技术的不足和实际需求,本发明提供一种检测(1-3)-β-d葡聚糖的免疫层析试纸及其制备方法和应用,能够一次性检测真菌(1-3)-β-d葡聚糖,无需加热处理,灵敏度和准确度高,重复性和稳定性好。
2、为达到此发明目的,本发明采用以下技术方案:
3、第一方面,本发明提供了一种检测(1-3)-β-d葡聚糖的免疫层析试纸,所述免疫层析试纸包括样品垫、荧光垫、硝酸纤维素膜和吸水垫;所述荧光垫包被有荧光微球标记的抗体;所述荧光垫为经过处理的荧光垫,所述处理的方法包括:使用处理液1浸泡荧光垫后烘干,所述处理液1含有硼砂、葡萄糖和牛血清蛋白。
4、本发明的荧光免疫层析试纸条能够一次性检测真菌(1-3)-β-d葡聚糖,无需加热处理,灵敏度和准确度高,重复性和稳定性好。
5、本发明采用双抗体夹心荧光免疫层析技术,检测人血清样本中的真菌(1-3)-β-d葡聚糖。在荧光垫上包埋荧光微球标记的真菌(1-3)-β-d葡聚糖抗体和荧光微球标记的鸡igy抗体,在检测线(t)和质控线(c)上分别包被真菌(1-3)-β-d葡聚糖抗体和兔抗鸡igy抗体。若检测样本为阳性,则样本中的真菌(1-3)-β-d葡聚糖与荧光微球标记的真菌(1-3)-β-d葡聚糖抗体结合形成复合物,在层析作用下复合物沿纸条向前移动,经过检测线(t)时与预包被的真菌(1-3)-β-d葡聚糖抗体反应,形成免疫复合物而呈现荧光条带,荧光标记鸡igy抗体则在质控线(c)与兔抗鸡igy抗体结合显现荧光条带。若检测样本为阴性,不会形成免疫复合物,在检测线处不会出现条带,仅在质控线(c)出现条带。质控线(c)在检测样本时均应出现条带,所显现的荧光条带是判定层析过程是否正常的标准,同时也作为试剂的内控标准。使用荧光免疫分析仪扫描检测区得到荧光信号,显示真菌(1-3)-β-d葡聚糖的浓度值。
6、优选地,所述硼砂的浓度为10~25 mmol/l。
7、上述10~25 mmol/l中的具体点值可以选择10 mmol/l、12 mmol/l、14 mmol/l、18mmol/l、20 mmol/l、21 mmol/l、22 mmol/l、23 mmol/l、24 mmol/l、25 mmol/l等。
8、优选地,所述处理液1中葡萄糖的质量百分比为2~4%。
9、上述2~4%中的具体点值可以选择2%、3%、4%等。
10、优选地,所述处理液1中牛血清蛋白的质量百分比为4~8%。
11、上述4~8%中的具体点值可以选择4%、5%、6%、7%、8%等。
12、优选地,所述烘干的时间为2~5 h;温度为30~37℃;湿度小于<30%。
13、上述2~5 h中的具体点值可以选择2 h、3 h、4 h、5 h等。
14、上述30~37℃中的具体点值可以选择30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃等。
15、优选地,所述荧光微球标记的抗体包括真菌(1-3)-β-d葡聚糖抗体和鸡igy抗体。
16、优选地,所述荧光微球包括时间分辨荧光微球。
17、优选地,所述荧光微球表面修饰官能团包括羟基。
18、优选地,所述硝酸纤维素膜为经过处理的硝酸纤维素膜。
19、优选地,所述处理的方法包括:处理液2浸泡后烘干。
20、优选地,所述处理液2含有氯化钠和聚乙烯醇。
21、优选地,所述处理液2中氯化钠的质量百分比为0.8~1%。
22、上述0.8~1%中的具体点值可以选择0.8%、0.9%、1%等。
23、优选地,所述处理液2中聚乙烯醇的质量百分比为0.05~0.1%。
24、上述0.05~0.1%中的具体点值可以选择0.05%、0.06%、0.07%、0.08%、0.09%、0.1%等。
25、优选地,所述浸泡的时间为5~20 min。
26、上述5~20 min中的具体点值可以选择5 min、6 min、7 min、8 min、10 min、12min、14 min、16 min、20 min。
27、优选地,所述烘干的时间为2~5 h;温度为30~37℃;湿度小于<30%。
28、上述2~5 h中的具体点值可以选择2 h、3 h、4 h、5 h等。
29、上述30~37℃中的具体点值可以选择30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃等。
30、优选地,所述硝酸纤维素膜包被有测试线t和质控线c。
31、优选地,所述测试线t包被有真菌(1-3)-β-d葡聚糖抗体。
32、优选地,所述质控线c包被有兔抗鸡igy抗体。
33、优选地,所述样品垫为经过处理的样品垫。
34、优选地,所述处理的方法包括:处理液3浸泡玻纤后烘干。
35、优选地,所述处理液3包括蛋白稳定剂。
36、优选地,所述蛋白稳定剂包括蔗糖、葡萄糖、甘露糖、果糖、吐温20、聚乙烯醇或聚乙烯砒咯烷酮中任意一种或至少两种的组合。
37、优选地,所述处理液3包括pbs、甘露糖、吐温20和聚乙烯醇。
38、优选地,所述pbs的浓度为0.05~0.2 mol/l。
39、上述0.05~0.2 mol/l中的具体点值可以选择0.05 mol/l、0.06 mol/l、0.07 mol/l、0.08 mol/l、0.10 mol/l、0.12 mol/l、0.14 mol/l、0.16 mol/l、0.18 mol/l、0.2 mol/l等。
40、优选地,所述处理液3中蛋白稳定剂的质量百分比为0.1~2%。
41、上述0.1~2%中的具体点值可以选择0.1%、0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.6%、1.8%、2%等。
42、优选地,所述烘干的时间为2~5 h;温度为30~37℃;湿度小于<30%。
43、上述2~5 h中的具体点值可以选择2 h、3 h、4 h、5 h等。
44、第二方面,本发明提供了一种制备第一方面所述的免疫层析试纸的方法,所述方法包括:
45、使用荧光微球标记抗体,组装样本垫、荧光垫与硝酸纤维素膜、吸水垫和底板,即得所述荧光免疫层析试纸条。
46、优选地,所述荧光微球标记抗体的方法包括以下步骤:
47、(1)荧光微球和缓冲液混合超声,离心,重新加入缓冲液得到得到荧光微球混合液,再次超声;
48、(2)缓冲液溶n-羟基琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐混合避光活化,活化后离心,使用清洗液对活化后的微球进行洗涤;
49、(3)加入抗体,混匀超声,避光标记;
50、(4)将加入抗体后的混合溶液离心得到沉淀,与封闭液混匀超声,避光封闭;
51、(5)再次离心得到沉淀,使用荧光微球复溶液重悬超声。
52、步骤(1)中所述缓冲液包括4-羟乙基哌嗪乙磺酸、4-吗啉乙磺酸或3-吗啉丙磺酸中任意一种。
53、步骤(1)中所述缓冲液浓度为20~50 mmol/l,ph为6~8。
54、上述20~50 mmol/l中的具体点值可以选择10 mmol/l、15 mmol/l、20 mmol/l、25mmol/l、30 mmol/l、35 mmol/l、40 mmol/l、45 mmol/l、50 mmol/l等。
55、上述ph6~8中的具体点值可以选择6、6.5、7、7.5、8等。
56、步骤(1)中所述荧光微球和缓冲液体积比为1:(6~10)。
57、上述6~10中的具体点值可以选择6、7、8、9、10等。
58、步骤(1)中所述超声的时间为1~5 min。
59、上述1~5 min中的具体点值可以选择1 min、1.5 min、2 min、2.5 min、3 min、3.5min、4 min、4.5 min、5 min等。
60、步骤(1)中所述离心的温度为4~30℃,转速为15000~20000 g,离心10~30min。
61、上述4~10℃中的具体点值可以选择4℃、5℃、10℃、15℃、20℃、25℃、30℃等。
62、上述15000~20000 g中的具体点值可以选择15000 g、16000 g、17000 g、18000 g、19000 g、19950 g、20000 g等。
63、上述10~30 min中的具体点值可以选择10 min、15 min、20 min、25 min、30 min等。
64、步骤(2)中所述水溶n-羟基琥珀酰亚胺的浓度为10~50 mg/ml。
65、步骤(2)中所述1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐溶液的浓度为10~50mg/ml。
66、上述10~50 mg/ml中的具体点值可以选择10 mg/ml、15 mg/ml、20 mg/ml、25 mg/ml、30 mg/ml、35 mg/ml、40 mg/ml、45 mg/ml、50 mg/ml等。
67、步骤(2)中所述活化的转速为30~50 r/min,活化的时间为10~20 min。
68、上述30~50 r/min中的具体点值可以选择30 r/min、34 r/min、36 r/min、38 r/min、40 r/min、44 r/min、46 r/min、48 r/min、50 r/min等。
69、上述10~20 min中的具体点值可以选择10 min、11 min、12 min、13 min、14 min、15min、16 min、17 min、18 min、19 min、20 min等。
70、步骤(2)中所述用清洗液对活化后的微球洗涤,次数为1~3次。
71、上述1~3次中的具体点值可以选择1次、2次、3次等。
72、步骤(2)中所述用清洗液包括4-羟乙基哌嗪乙磺酸、4-吗啉乙磺酸、3-吗啉丙磺酸、吐温或s17中任意一种或至少两种的组合,所述清洗液浓度为0.1~0.5%。
73、上述0.1~0.5%中的具体点值可以选择0.1%、0.2%、0.3%、0.4%、0.5%等。
74、步骤(3)中所述标记的转速为30~50 r/min,活化的时间为1~16 h。
75、上述30~50 r/min中的具体点值可以选择30 r/min、34 r/min、36 r/min、38 r/min、40 r/min、44 r/min、46 r/min、48 r/min、50 r/min等。
76、上述1~16 h中的具体点值可以选择1 h、2 h、4 h、6 h、16 h等。
77、步骤(3)中所述微球与抗体的质量比为10:(1~5)。
78、上述1~5中的具体点值可以选择1、2、3、4、5等。
79、步骤(4)中所述封闭的转速为30~50 r/min,封闭的时间为30~60 min。
80、上述30~50 r/min中的具体点值可以选择30 r/min、34 r/min、36 r/min、38 r/min、40 r/min、44 r/min、46 r/min、48 r/min、50 r/min等。
81、上述30~50 min中的具体点值可以选择30 min、35 min、40 min、45 min、50 min等。
82、步骤(4)中所述封闭液包括牛血清蛋白、酪蛋白、聚乙烯基吡咯烷酮、聚乙二醇中任意一种,所述封闭液的浓度为0.5-1%;
83、上述0.5~1%中的具体点值可以选择0.5%、0.6%、0.7%、0.8%、0.9%、1%等。
84、第三方面,本发明提供了一种检测真菌(1-3)-β-d葡聚糖的试剂盒,所述试剂盒包括第一方面所述的检测真菌(1-3)-β-d葡聚糖的免疫层析试纸。
85、优选地,所述试剂盒还包括样本处理液。
86、优选地,所述样本处理液包括样本处理液a和样本处理液b;所述样本处理液a包括氢氧化物溶液和氯化物溶液;所述样本处理液b包括缓冲溶液。
87、优选地,所述氢氧化物溶液包括氢氧化钾溶液、氢氧化钠溶液、碳酸钠溶液或碳酸氢钠溶液中任意一种;氯化物溶液包括氯化钾溶液或氯化钠溶液中任意一种。
88、优选地,所述缓冲溶液包括4-吗啉乙磺酸缓冲液、4-羟乙基哌嗪乙磺酸缓冲液或3-吗啉丙磺酸缓冲液中任意一种。
89、优选地,所述氢氧化物溶液的浓度为0.1~1 m。
90、优选地,所述缓冲溶液的浓度为0.1~1 m。
91、上述0.1~1 m中的具体点值可以选择0.1 m、0.2 m、0.4 m、0.6 m、0.8 m、0.9 m、1m等。
92、优选地,所述样本、样本处理液a和样本处理液b的体积比(0.5~2):1:1。
93、上述0.5~2中的具体点值可以选择0.5、0.6、0.7、0.8、0.9、1、1.2、1.4、1.6、1.8、2等。
94、第四方面,本发明提供了第一方面所述的检测真菌(1-3)-β-d葡聚糖的免疫层析试纸或第三方面所述的检测真菌(1-3)-β-d葡聚糖的试剂盒在检测真菌中的应用。
95、与现有技术相比,本发明具有如下有益效果:
96、(1)荧光免疫层析法使用的材料硝酸纤维素膜和玻纤中含有(1-3)-β-d葡聚糖,本发明对这些材料分别用不同的处理液进行二次处理,消除了材料中(1-3)-β-d葡聚糖的干扰,增强了荧光免疫层析检测的敏感性;
97、(2)本发明中的样本处理液及处理方式也进行了优化,相较于基于鲎试剂的葡聚糖显色检测试剂盒样本碱处理后加热孵育(酶联免疫法、磁微粒化学发光法试剂盒中样本处理常常需要孵育),本发明无需加热处理,加入处理液后涡旋混匀可直接检测,操作简单便捷,提高了荧光免疫层析检测的敏感性和特异性。
- 还没有人留言评论。精彩留言会获得点赞!