应用计算流体力学来模拟计算血流储备分数的系统和方法与流程
本发明涉及人体生理学及血液动力学的计算分析的系统和方法,更具体而言涉及一种应用计算流体力学(CFD)来模拟计算血流储备分数的系统,和为血管树的计算流体力学(CFD)模型设置相应的入口边界条件和出口边界条件的方法。
背景技术:
冠心病主要病因是动脉硬化所致的冠脉狭窄。冠脉狭窄可引起冠脉血流量及其它血液动力学的重大改变,引起心肌相对和绝对缺血。冠脉造影及血管内超声均被认为是诊断冠心病的“金标准”,但它们只能对狭窄程度进行影像学评价,而狭窄到底对远端血流产生了多大影响(功能评价)却不得而知。自1995年Pijls等人提出通过压力测量推算冠脉血流的新指标-血流储备分数(Fractional Flow Reserve,FFR)(Pijls NH,Van Gelder B,Van der Voort P,Peels K,Bracke FA,Bonnier HJ,El Gamal MI.Fractional flow reserve a useful index to evaluate the influence of an epicardial coronary stenosis on myocardial blood flow.Circulation.1995Dec 1;92(11):3183-93通过引用结合于此以供参考),经过长期的基础及临床研究,FFR已经成为对冠脉狭窄功能性评价的“金标准”,以及冠状动脉重建术不可或缺的指导性工具。
FFR作为有创测量(即侵入式测量),不可避免地会带有一定风险以及可能会对机体造成一定程度的创伤。随着科技及研究水平的发展,尤其是医疗图像成像及重建技术、计算流体力学、高性能计算等领域,数值模拟计算FFR(虚拟FFR)正成为一个快速发展的前沿方向。相比于有创FFR,虚拟FFR为无创测量。根据临床试验对比,虚拟FFR在细致到病人个体的各个血管级别的尺度上,从准确性、敏感性、特异性、阳性预测值、阴性预测值上对心肌缺血的诊断具有非常高的能力,在与通过影像学评价的方法的对比上更显优越。
因为虚拟FFR的无创、量化分析及诊断能力的优越性,越来越多科研及商业机构对该技术进行基础及临床研究。由于这是一个新兴方向,各种相关的研究及改进方法、方式均有涉猎,但总体可归结为两个大方向:1.医疗图像的应用及模型重建2.作为计算流体力学(CFD)的准确性的一个重要因素:符合人体生理学特征的边界条件的研究及处理。目前主流的计算系统包括基于冠状动脉计算机X射线断层摄影血管造影术的FFRCT,基于旋转血管造影的vFFR,基于定量冠状动脉造影及心肌梗死溶栓的FFRQCA等。
作为一个前沿技术,虚拟FFR同样面对各种技术挑战及难题。其中,计算时间是该技术能否作为临床推广及新的“金标准”的一个关键。对于以准确性及模型复杂度为主导的方法,计算一个病例时间花费甚至长达100多个小时;对于快速计算的方法,最优时间可以缩短至10分钟以内,但这要求有经验的分析师进行操作,需要有创测量的帮助,以及对复杂的血管树模型的处理能力还受到限制等。即便在速度及准确性之间进行均衡,应用虚拟FFR进行模拟计算需时估计仍超7小时,这对该方法的临床推广造成很大的限制。此外,在准确性方面,应用CFD于虚拟FFR计算的另一主要挑战在于如何合理获得/设置CFD模型的边界条件。边界条件的合适与否,最大程度上决定了模拟计算的准确性。
目前,几乎所有主流前沿的血管计算系统在设置CFD模型的边界条件时,均需假定或统计得到人体血管树的流量分布比例,这也是现有计算方法在针对病人个体、甚至细化到病人自身各个血管的生理特征准确性的一个瓶颈。基于这种假定或统计所设置的边界条件不能体现个体的特异性,影响了模拟计算的准确性。此外,现有的血管计算系统为了自动且准确地预测临床关注的血管分支的流体参数,通常需要对相关的整个血管树(例如冠状动脉的整个血管树)进行CFD建模和计算,耗时久,且消耗计算资源大,为此阻碍了其进入临床推广。
因此,需要一种能够经由CFD来快速且自动地模拟计算FFR的系统和为血管树的流体力学模型设置相应的入口边界条件和出口边界条件的方法,该系统和方法能针对病人个体,独立(不依赖于分析师的经验也无需有创测量的介入)、自动、迅速且准确地得出对诸如冠状动脉的血管树各处的流体参数,并据此得到其功能性评价,包括FFR以及对疑似病变位置、病变对心肌缺血的影响、复杂的血管狭窄情况(如单支、多支血管病变,同一血管多处病变,中度狭窄病变,连续的病变,弥漫性病变,支架内再狭窄等)等的评估等。最好该系统和方法还能够针对临床关注的血管分支进行计算资源的倾斜,从而在计算资源有限的前提下,能够兼顾整个血管树的计算速度和临床关注的血管分支的计算的准确性。
技术实现要素:
针对以上意识到的技术问题,本发明提出了一种应用计算流体力学来模拟计算血流储备分数的系统,以及为血管树的CFD模型设置相应的入口边界条件和出口边界条件的方法,该系统和方法在边界条件的设置上对血管树的具体流量分布比例不做任何假设或统计,而是通过计算(例如根据个体的医学图像计算或者血管树的CFD计算)实际预测得出,从而确保边界条件是个体特异性的,由此提高了计算结果的准确度。并且,本系统和方法的另一个重要应用是能实际准确地预测在复杂网络下临床关注的各个血管出口的流量,如脑部血管,且兼顾总体计算时间,能够将总体计算时间控制在临床适用的范围内。并且,本系统和方法能够完全无创且自动化地实现,分析师无需丰富经验即可方便使用,也无需有创医疗图像的支持,减轻了分析师的负担同时也减少了病人的痛苦。
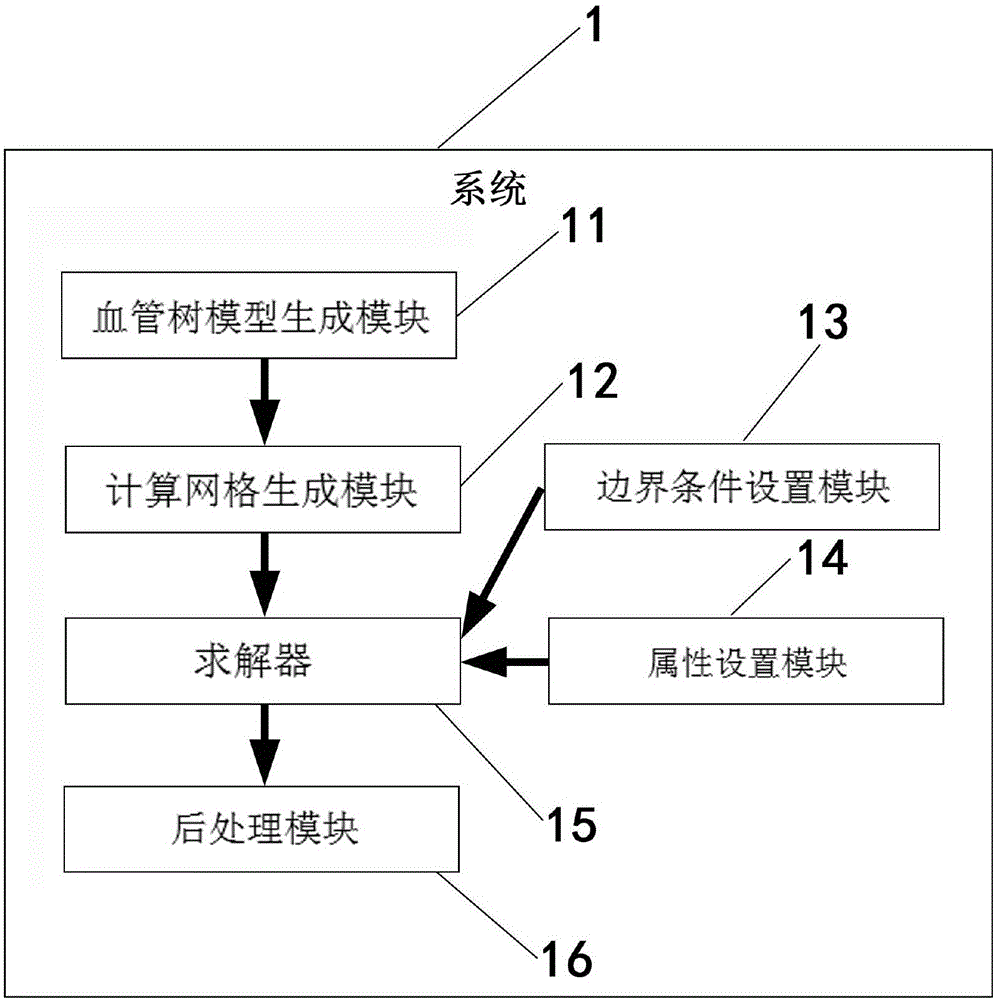
根据本发明的第一方面,提供了一种应用计算流体力学来模拟计算血流储备分数的系统,包括:
血管树模型生成模块,用于获取医学图像、执行分割并重建个体的血管树的几何模型;
计算网格生成模块,用于为所述血管树的几何模型生成计算网格,从而建立所述血管树的CFD模型,包括三维(3D)CFD模型;
边界条件设置模块,用于为所建立的所述血管树的CFD模型设置相应的入口边界条件和出口边界条件;
属性设置模块,用于设置血液的物理属性以及流动方程;
求解器,用于基于所述入口边界条件和出口边界条件、所设置的物理属性和流动方程,对所建立的所述血管树的CFD模型进行求解,以得到血管树各处的流体参数;以及
后处理模块,用于对由所述求解器对所建立的血管树的3D CFD模型进行求解所得到的所述流体参数进行后处理,以得到血管树各处的血流储备分数,其中,
所述入口边界条件和所述出口边界条件,至少用于血管树的三维计算流体力学模型以便得到供后处理的流体参数的那些边界条件,为个体特异性的。
所述血管树的CFD模型连同相应的入口边界条件和出口边界条件,有时可用于求解得到血管各处的流体参数,但有时仅仅用于模拟得到中间数据,例如用于确定所述3D CFD模型的入口边界条件和出口边界条件,该入口和出口边界条件良好体现了个体特异性。不管哪种用途,体现个体特异性的入口边界条件和出口边界条件,均能够提高模拟计算的准确度。
优选地,用于所述3D CFD模型以供求解得到流体参数的所述入口边界条件为各个入口处的流量,且根据个体的医学图像来确定。
优选地,所述计算网格生成模块所建立的所述血管树的CFD模型还包括一维(1D)CFD模型;所述求解器还对所述血管树的1D CFD模型进行求解,以得到血管树各处的流体参数;所述边界条件设置模块将用于所述血管树的3D CFD模型以供求解得到流体参数的入口处的所述入口边界条件和/或出口处的所述出口边界条件设置为所述求解器对所述血管树的1D CFD模型进行求解所得到的血管树对应各处的所述流体参数。所述流体参数通常可以是血液的流量、速度和压力中的任何一种,入口和出口边界条件可以设置相同或不同种的流体参数,只要求解时收敛较好。
优选地,用于所述3D CFD模型以供求解得到流体参数的所述出口边界条件为个体的血管树的各个出口处的微血管阻力。或者,所述出口边界条件通过对血管树的1D CFD模型求解来得到,具体说来,所述计算网格生成模块所建立的所述血管树的CFD模型还包括1D CFD模型;所述求解器还对所述血管树的1D CFD模型进行求解,以得到血管树各处的压力;所述边界条件设置模块将所述血管树的3D CFD模型的出口处的所述出口边界条件设置为所述求解器对所述血管树的1D CFD模型进行求解所得到的血管树对应各处的压力。
所述系统能够通过多种方法来计算个体的血管树的各个出口处的微血管阻力。例如,在所述系统中,所述边界条件设置模块还为所述血管树的3D CFD模型设置静息状态下的入口边界条件和出口边界条件;所述求解器还基于静息状态下的入口边界条件和出口边界条件对所述血管树的3D CFD模型进行求解,以得到血管树各个出口处的压力及流量;所述边界条件设置模块根据所述求解器在静息状态下的入口边界条件和出口边界条件下进行求解所得到的血管树各个出口处的压力和流量,或者根据所述求解器在静息状态下的入口边界条件和出口边界条件下进行求解所得到的血管树各个出口处的流量以及所述静息状态下的出口压力,来计算个体的血管树的各个出口处的微血管阻力。
优选地,为所述血管树的3D CFD模型设置的入口边界条件和出口边界条件不限于静息状态下的入口边界条件和出口边界条件,也可以根据个体医学图像和/或经验公式为所述血管树的三维计算流体力学模型设置初始的入口边界条件和出口边界条件,所述求解器还基于所述初始的入口边界条件和出口边界条件对所述血管树的三维计算流体力学模型进行求解,以得到血管树各个出口处的压力及流量。这些初始的入口边界条件和出口边界条件求解得到的流体参数不能直接供后处理,但对于计算出口处的微血管阻力来说准确度却够了,所得到的出口处的微血管阻力作为出口边界条件能够体现个体的特异性,且能够实现CFD模型的良好收敛。所述边界条件设置模块根据所述求解器在所述初始的入口边界条件和出口边界条件下进行求解所得到的血管树各个出口处的压力和流量,来计算个体的血管树的各个出口处的微血管阻力
再例如,在所述系统中,所述计算网格生成模块所建立的所述血管树的CFD模型还包括1D CFD模型;所述求解器还对所述血管树的1D CFD模型进行求解,以得到血管树各处的流量和压力;所述边界条件设置模块根据所述求解器对所述血管树的1D CFD模型进行求解所得到的血管树对应各处的流量和压力,来计算个体的血管树的各个出口处的微血管阻力。
优选地,用于所述3D CFD模型以供求解得到流体参数的出口边界条件也可以不依赖于血管树的微血管阻力的计算,而是通过3D-1D的耦合计算来实现。具体说来,所述计算网格生成模块为所述血管树的几何模型的整体或分支生成计算网格,从而建立所述血管树的整体的1D CFD模型,并且建立所述血管树的整体或分支的3D CFD模型;所述边界条件设置模块将所述血管树的整体的1D CFD模型的入口边界条件设置为充血状态下入口处的血流量,将其出口边界条件设置为静脉压力,且当建立所述血管树的整体的3D CFD模型以供求解得到流体参数时,所述边界条件设置模块将相应的入口边界条件设置为充血状态下入口处的流体参数;而当建立所述血管树的分支的3D CFD模型以供求解得到流体参数时,所述边界条件设置模块将相应的入口边界条件设置为所述求解器对所述血管树的整体的1D CFD模型进行求解所得到的血管树对应各处的流体参数。
根据本发明的第二方面,提供了一种为血管树的CFD模型设置相应的入口边界条件和出口边界条件的方法,所述CFD模型通过获取医学图像、执行分割并重建个体的血管树的几何模型,然后为所述血管树的几何模型生成计算网格来建立,且包括3D CFD模型,其中,至少用于血管树的三维计算流体力学模型的所述入口边界条件和所述出口边界条件均为个体特异性的。
所述入口边界条件能够通过多种方式设置为个体特异性的。优选地,用于所述3D CFD模型以供求解得到流体参数的所述入口边界条件为各个入口处的流量,且根据个体的医学图像来确定。
更优选地,所建立的所述血管树的CFD模型还包括1D CFD模型,所述方法还包括:对所述血管树的1D CFD模型进行求解,以得到血管树各处的流体参数,以及将用于所述3D CFD模型以供求解得到流体参数的入口处的所述入口边界条件和/或出口处的所述出口边界条件设置为通过对所述血管树的1D CFD模型进行求解所得到的血管树对应各处的所述流体参数。所述流体参数可以是血液的流量、速度和压力中的任何一种。入口边界条件和出口边界条件可以采用相同或不同种类的流体参数,只要确保良好的收敛过程。
作为可选方案,用于所述3D CFD模型以供求解得到流体参数的所述出口边界条件为个体的血管树的各个出口处的微血管阻力。所述个体的血管树的各个出口处的微血管阻力可以通过各种方式来计算。优选地,个体的血管树的各个出口处的微血管阻力如下计算得到:为所述血管树的3D CFD模型设置静息状态下的入口边界条件和出口边界条件;基于静息状态下的入口边界条件和出口边界条件对所述血管树的3D CFD模型进行求解,以得到血管树各个出口处的压力及流量;根据静息状态下的入口边界条件和出口边界条件下进行求解所得到的血管树各个出处的流量以及所述静息状态下的出口压力,或者根据静息状态下的入口边界条件和出口边界条件下进行求解所得到的血管树各个出处的压力和流量,来计算各个出口处的微血管阻力。
优选地,个体的血管树的各个出口处的微血管阻力可以如下计算得到:根据个体医学图像和/或经验公式为所述血管树的三维计算流体力学模型设置初始的入口边界条件和出口边界条件;基于所述初始的入口边界条件和出口边界条件对所述血管树的三维计算流体力学模型进行求解,以得到血管树各个出口处的压力及流量;根据在所述初始的入口边界条件和出口边界条件下进行求解所得到的血管树各个出口处的压力和流量,来计算个体的血管树的各个出口处的微血管阻力。
另外,优选地,个体的血管树的各个出口处的微血管阻力如下计算得到:建立所述血管树的1D CFD模型;对所述血管树的1D CFD模型进行求解,以得到血管树各处的流量和压力;根据对所述血管树的1D CFD模型进行求解所得到的血管树对应各处的流量和压力,来计算个体的血管树的各个出口处的微血管阻力。
优选地,所述方法还可以通过如下方式来设置用于所述3D CFD模型以供求解得到流体参数的出口边界条件:所建立的所述血管树的CFD模型还包括1D CFD模型;对所述血管树的1D CFD模型进行求解,以得到血管树各处的压力;以及将用于所述血管树的3D CFD模型以供求解得到流体参数的出口处的所述出口边界条件设置为通过对所述血管树的1D CFD模型进行求解所得到的血管树对应各处的压力。
优选地,所述方法还可以通过3D-1D耦合计算的方式来设置所述3D CFD模型的入口边界条件:建立的所述血管树的CFD模型包括所述血管树的整体的1D CFD模型,以及所述血管树的整体或分支的3D CFD模型;将所述血管树的整体的1D CFD模型的入口边界条件设置为充血状态下入口处的血流量,将其出口边界条件设置为静脉压力;且当建立所述血管树的整体的3D CFD模型以供求解得到流体参数时,将相应的入口边界条件设置为充血状态下入口处的血流量;而当建立所述血管树的分支的3D CFD模型以供求解得到流体参数时,将相应的入口边界条件设置为通过对所述血管树的整体的1D CFD模型进行求解所得到的血管树对应各处的流量。
附图说明
下面参考附图对本发明的各个实施例进行详细说明,其中
图1示出根据本发明一个实施例的应用计算流体力学来模拟计算血流储备分数的系统的框图;
图2示出由图1所示的系统的各个构件所依序执行的流程的示意图;
图3(a)-图3(c)示出根据本发明另一个实施例的CFD模型及边界条件的示例,其中,图3(a)示出医学图像的截面图与分割重建的几何模型之间的关系,图3(b)示出分割重建所得到的包括主动脉、左右动脉及血管分支的血管树的三维几何模型,图3(c)示出左动脉的血管树的CFD模型及相应边界条件,包括血管壁以及入口和出口边界条件。
图4示出根据本发明另一个实施例的进行3D-1D耦合计算的系统和方法所得到的左动脉及其分支的3D-1D耦合网络的示意图。
图5示出根据本发明所述另一个实施例的进行3D-1D耦合计算的系统和方法所计算得到的个体的左动脉中各处的FFR的图示。
具体实施方式
如图1所示,根据本发明一个实施例的应用计算流体力学来模拟计算血流储备分数的系统1,所述系统1包括:血管树模型生成模块11,用于获取医学图像、执行分割并重建个体的血管树的几何模型,例如,所获取的医学图像的截面图及分割重建的几何模型如图3(a)中所示;计算网格生成模块12,用于为所述血管树的几何模型生成计算网格,从而建立所述血管树的CFD模型,所述CFD模型包括3D CFD模型;边界条件设置模块13,用于为所建立的所述血管树的CFD模型设置相应的入口边界条件和出口边界条件;属性设置模块14,用于设置血液的物理属性以及流动方程;求解器15,用于基于所述入口边界条件和出口边界条件、所设置的物理属性和流动方程,对所建立的所述血管树的CFD模型进行求解,以得到血管树各处的流体参数;以及后处理模块16,用于对由所述求解器对所建立的血管树的3D CFD模型进行求解所得到的所述流体参数进行后处理,以得到血管树各处的血流储备分数,其中,由所述边界条件模块至少为3D CFD模型设置个体特异性的所述入口边界条件和所述出口边界条件,以便计算供后处理的血管树各处的流体参数。由此确保个体血管树各处的流体参数的准确性,进而能够准确地预测血管树中临床关注的各个血管分支处的流体参数。
所述系统的上述各个构件共同完成完整的FFR计算,涉及多个重要环节,包括医学图像的处理、血管树的分割及三维重建、几何模型及CFD计算网格的生成、CFD模拟计算及后处理等。下面以图2为例说明图1所示的系统的各个构件所依序执行的流程。
FFR计算的前处理由血管树模型生成模块11完成,其基于对个体的医学图像,例如符合DICOM规格的各种医学图像的血管进行分析和分割的结果,重建个体的血管树的几何模型。所述血管树模型生成模块11,例如能够利用包括vmtk(The Vascular Modeling Toolkit)的各种开源软件,基于对所述血管进行分析和分割的结果,计算并重建生成血管树的血管中心线及血管壁,从而构成所述血管树的几何模型。
FFR计算的CFD计算部分流程由所述计算网格生成模块12、边界条件设置模块13、属性设置模块14和求解器15配合完成。
具体说来,所述计算网格生成模块12利用包括vmtk的各种开源软件,为所述血管树的几何模型生成满足CFD计算要求的高质量计算网格,从而建立所述血管树的CFD模型,通常,建立所述血管树的3D CFD模型以供计算血管树各处的流体参数。如果单纯建立所述血管树的1D CFD模型并据此计算血管树各处的流体参数虽则迅速,几乎可以算得上是实时,但计算所得的血管树各处的流体参数的准确度尚不足以直接用于血管症状的临床诊断,但作为血管树的3D CFD模型的相应入口和出口处的边界条件是足够的,且充分体现了个体的特异性,能够大大提高3D CFD模型的模拟计算的准确度。
所述边界条件设置模块13设置针对病人个体的符合人体生理学特性的边界条件。CFD计算网格可认为是由空间上代表实际几何模型的点组成。准确的人体的完整血管脉络的CFD计算至少需要数十万网格,涉及数以百万计的方程、矩阵计算,因此,工程应用上几乎无法模拟完整的人体血管脉络。实际应用上一般只考虑对结果感兴趣的部分区域,即由边界定义的部分区域,在下文中我们将其称为血管树,该血管树可视临床需求而不同,例如,可以是冠状动脉的完整的血管树,入口边界(下文中也简称为“入口”)定义为左右主动脉与主动脉的分叉处,出口边界(下文中也简称为“出口”)定义为冠状动脉的血管树的微血管处。通过边界条件的设置,也可以定义不同的血管树,以下仅仅以冠状动脉的完整的血管树为例来说明边界条件的个体特异性设置,但血管树不限于此。
图3(a)-图3(c)示出根据本发明另一个实施例的CFD模型及边界条件的示例,其中,图3(a)示出医学图像的截面图、分割重建的几何模型以及两者之间的关系,图3(b)示出分割重建所得到的包括主动脉、左右主动脉及主要血管分支的血管树的三维几何模型,图3(c)示出左主动脉的血管树的CFD模型及相应边界条件,包括血管壁以及入口和出口边界条件(出口1,2,…,8)。
现有技术中,所述边界条件设置模块13只能通过统计或假设左右主动脉的入口处的流量比例的方式,来设置所述血管树的入口边界条件。现有技术还例如设置通用入口流量:利用大批量临床病例FFR测量及模拟比较,确定对左、右主动脉入口流量的优化值,应用该值于所有病例的计算。这种设置方式不能体现个体的特异性,统计或假设所得的入口边界条件未必适用于个体,从而降低了CFD计算结果的准确度。
本发明提供了为血管树的CFD模型设置相应的入口边界条件和出口边界条件的方法的多种示例,实现了入口边界条件和所述出口边界条件的个体特异性。这些方法的示例能够被系统1中的以上相关模块使用(下文中在描述这些方法的示例时给出了如何由系统1中的相关模块来实施的说明,但不意图对实施的模块进行限制),或者被所述系统中的附加模块使用来确定个体特异性的入口边界条件和出口边界条件,并传输给所述边界条件设置模块13以供使用和设置。
属性设置模块14用于设置血液的物理属性以及流动方程,所述血液的物理属性例如但不限于血液为牛顿流体且采用层流、符合人体生理学特性的个体的血液密度及血流粘性等,所述流动方程例如包括所述血液的流动为非定常流动、基于不可压流Navier-Stokes方程组等等。用户能够根据具体情况进行手动输入设置,或者默认设置,或者从系统自带的血液的物理属性以及流动方程库中选用。
求解器15用于基于所设置的入口边界条件和出口边界条件、所设置的物理属性和流动方程,对所建立的所述血管树的CFD模型进行求解,以得到中间结果或得到血管树各处的流体参数。所述CFD模型可以包括一维和三维的,如上所述,为了确保计算结果的准确性,1D CFD模型求解所得的血管树各处的流体参数通常只作为中间结果,并不直接用于血管的病理状态的临床诊断。3D CFD模型则可以在相应的入口和出口边界条件下求解得到血管树各处的流体参数,有时为其设置的入口和出口边界条件则仅用于求解得到中间结果而非血管树各处的流体参数。
FFR计算的后处理利用后处理模块16来实现。具体说来,该后处理模块16用于对由所述求解器15对所建立的血管树的3D CFD模型进行求解所得到的所述流体参数进行后处理,以得到血管树各处的血流储备分数(FFR)。例如,根据对3D CFD模型求解的结果,利用关系式FFR=Pd/Pa(Pd为血管各处的压力,Pa为主动脉处的平均压力),可计算得到血管各处的FFR。可选地,可以通过对3D CFD模型求解的结果进行后处理,来生成病例分析报告,优选地,狭窄处远端的FFR值可以作为最终的计算值写入病例分析报告中,若FFR<0.75,则表明该狭窄会导致血管的功能性缺血,需要进行介入治疗。对3D CFD模型求解的结果还包括其他临床关注的参数,如FFR回拉(pull-back)曲线、血管各处的血流速度及压力分布、血管各分支的流量分布、血管壁各处的剪切应力等,这些临床关注的参数也可以视需要写入病例分析报告中,以供医生作为诊断的参考。
下面具体描述本发明的为血管树的CFD模型设置用于求解得到血管各处的流体参数的相应的入口边界条件和出口边界条件的方法的多种示例,各个示例均实现了入口边界条件和所述出口边界条件的个体特异性。至少用于血管树的3D CFD模型的入口边界条件和所述出口边界条件可由个体的医学图像推导得到或经由个体的血管树的计算流体力学模型的求解来相应得到。尤其是,为了求解得到可供后处理的流体参数,用于3D CFD模型的个体特异性的入口边界条件和出口边界条件可以根据个体的医学图像或历史数据来推导得到,也可以经由1D CFD模型的求解来相应得到,还可以通过3D CFD模型在初始的入口和出口边界条件下的求解来得出。
入口边界条件
以冠状动脉的血管树为例,本方法单独计算左、右主动脉,入口边界为左、右主动脉与主动脉的分叉处(branch),设置该分叉处左、右主动脉各自的血流量为入口边界条件,具体可细分为两种方式。
第一种方式是,根据个体的医学图像,计算该病例的心肌质量,利用心肌质量与主动脉血流量的关系,得到主动脉血流量,左、右主动脉按比例分流(左主动脉分流60%且右主动脉分流40%),如此得到该交叉处左、右主动脉各自分流的血流量,并将其设置为入口边界条件。注意,这仅仅是根据个体的医学图像来确定各个入口处的流量的一个示例,利用了心肌质量与主动脉血流量之间的对应关系,根据要建模的心血管树的不同,还可以采用其他个体的医学图像根据该其他医学图像中的信息与入口处血管的血流量之间的其他对应关系来计算出入口处各血管的血流量,并将其设置为该具体心血管树的CFD模型的入口边界条件,注意,入口边界条件的这种设置方法可以适用于1D CFD模型和3D CFD模型两者。
还可以通过建立血管树的完整的1D CFD模型(例如利用系统1中的血管树模型生成模块11和计算网格生成模块12),并对其求解(例如利用所述系统1中的求解器15)来计算出完整的血管树中各处的流量,再将该计算所得的完整的血管树中相应各处的流量施加到所述血管树的3D CFD模型的入口边界处,设置为3D CFD模型的入口边界条件(例如利用所述系统1中的边界条件设置模块13)。该第二种方式很好地弥补了第一种方式的缺陷:有时无法根据个体的医学图像确定入口处血管的血流量。虽然第二种方式以流量为例,但也可以采用血液的流量、压力和速度中的任何一种或两种分别作为入口和出口边界条件。入口和出口边界条件采用同种流体参数也是可以的,只要确保3D CFD模型的收敛满足临床要求。即便没有为该1D CFD模型设置个体特异性的入口和出口边界条件,鉴于该1D CFD模型本身反映了个体的血管特征,通过CFD迭代求解,收敛时所获得的完整的血管树中对应于3D CFD模型的入口边界处的各处的流量也良好反映了个体特异性,从而也就为3D CFD模型设置了个体特异性的入口边界条件。1D CFD计算仅需非常少的网格数量,其计算速度非常迅速(可认为是实时计算),由此,通过1D CFD计算来得到3D CFD模型的入口边界条件在促进计算结果准确度的同时,也没有影响例如FFR等流体参数的完整流程的计算速度。
出口边界条件
有两类出口边界条件的设置方式:
第一种方式是,将出口边界条件设置为针对病人个体的冠状动脉的血管树各处的微血管阻力;第二种方式是,类似于入口边界条件的第二种设置方式,施加1D CFD计算结果于3D CFD模型的出口处,将3D CFD模型的出口边界条件设置为血管树的1D CFD模型的求解所得的血管中相应各处的压力。
第一种方式可以细分为两种子方式:
I.基于3D CFD计算
利用人体血流动力学的一个现象,即在静息状态下(Resting Condition)血管段压力变化非常小(不论血管段有无狭窄)的事实,将3D CFD模型的入口边界条件设置为心输出量周期内的平均流量Qin,将其出口边界条件设置为相应的平均压力pout,通过对3D CFD模型在如上静息状态下的入口和出口边界条件下进行求解,来计算预测各个出口边界处的流量Qi,out(i为各个出口的编号),利用关系式Pout=Qi,outRi计算各个出口边界处的微血管阻力Ri。
当然,也可以根据在静息状态下的入口边界条件和出口边界条件下进行求解所得到的血管树各个出口处的压力Pi,out和流量Qi,out,利用关系式Pi,out=Qi,outRi计算各个出口边界处的微血管阻力Ri。
虽然基于3D CFD计算各个出口处的微血管阻力采用静息状态下的入口和出口边界条件是比较便利的,但还有其他临床可行的办法。例如,该入口和出口边界条件可以是根据个体医学图像和/或经验公式所得到的初始的入口边界条件和出口边界条件(此处用“初始”来与为3D CFD模型设置以便直接计算可供后处理的流体参数的那些边界条件区别开)。例如,可以根据诸如个体的心脏的超声多普勒图像计算出平均心输出量,根据关于主动脉瓣血液泵出后流量如何在各级血管分支中分配的比例的经验公式,可以得到相应各处(诸如左右主动脉、微血管)的流量作为初始的入口边界条件和出口边界条件。
基于1D CFD计算:1D CFD计算仅需非常少的网格数量,其计算速度非常迅速(可认为实时计算),利用该优势,建立完整的冠状动脉树的1D CFD模型,根据上述任一种入口边界条件的设置方式来设置入口边界条件,出口边界条件则可全部设置为静脉压力(通常为0)。利用1D CFD在该设置的入口边界条件和出口边界条件下的计算,得到在1D CFD模型中对应3D CFD模型的各个出口的相应各处的流量及压力,利用关系式Pi,out=Qi,outRi计算3D CFD模型各个出口边界的微血管阻力Ri。图4示出为3D-1D耦合网络的示意图。本应用可极大简化3D CFD计算中对出口边界条件微血管阻力的求解。
第二种方式则利用1D CFD计算得到完整的冠状动脉的血管树中各处的压力,并将相应的压力施加至3D CFD模型对应的出口边界处。当然,除了压力,也可以采用其他种类的流体参数,包括流量、速度等,作为3D CFD模型的出口边界条件。
如上为了设置出口边界条件所涉及的1D CFD计算和3D CFD计算均可以通过系统1中的血管树模型生成模块11、计算网格生成模块12、边界条件设置模块13、属性设置模块14和求解器15来配合实现。例如,可以在系统1中的各上述构件中分别整合1D和3D的模型生成、网格生成、边界条件设置、属性设置和求解的功能,也可以在各上述构件中包含用于1D和3D的分立的子构件,通过1D的各子构件一起实现1D CFD计算,通过3D的各子构件一起实现3D CFD计算。
例如,求解器15也可以包括1D CFD求解器和3D CFD求解器,可用于如上计算血管树的3D CFD模型的入口边界条件和/或出口边界条件(该3D CFD模型和相应的入口边界条件和出口边界条件用于计算血管树中各处的流体参数以供临床诊断),也可用于计算血管树中各处的流体参数以供临床诊断。
基于高性能计算CFD求解器,可以模拟计算左、右主动脉血管树充血状态(Hyperemia)下的FFR,及临床关注的其他相关的血流参数。
例如,在所述边界条件设置模块13施加充血状态下左、右主动脉血流量作为入口边界条件,这里,充血状态下左、右主动脉血流量可以根据个体的医学图像和/或经验公式来确定,也可以通过1D CFD建模求解来得出,还可以通过3D CFD模型在初始的进出口边界条件下的求解来得出,例子在上面已经给出,且施加如上各种方式得到的各个出口边界处的微血管阻力作为出口边界条件的情况下,所述属性设置模块14可以设置血管流体为牛顿流体且为层流,设置符合人体生理学特性的血液密度及血流粘性,由求解器15对血管树的3D CFD模型计算非定常流动直至结果收敛,从而得到血管树各处的流体参数。后处理模块16执行的步骤在此不再赘述,据此计算得到血管树中各处的FFR。
以上方法计算FFR,依赖于冠状动脉的微血管阻力的计算作为出口边界条件,且最终通过对完整的血管树的3D CFD建模和计算来得到血管树中各处的流体参数。在实践中,需要进一步简化和加速边界条件的设置,也需要进一步加快流体参数的总的计算速度。此外,医生要求CFD建模不仅能够准确模拟计算完整的冠状动脉,还可以单独模拟计算特定的血管分支(如疑似病变段),且对冠状动脉各处的模拟计算的准确度是有区别的。例如,医生会希望通过实时的1D CFD建模计算来迅速获得完整的冠状动脉的相对准确的FFR分布,使得能够从中人工或自动选择出需要更多临床关注的特定的血管分支,并对该特定的血管分支进行相对耗时但准确度更高的3D CFD建模计算。
本发明提供一种进行3D-1D耦合计算(发明人将其称为虚拟数字减影心血管造影术)的系统和边界条件设置方法,以满足以上的升级需求,该系统和方法结合利用3D-1D CFD的特点及各自的优势,极大地简化对边界条件的要求。本方法不仅同样能相对准确地模拟计算完整的冠状动脉,更可更准确且针对性地单独模拟计算具体的血管分支(如疑似病变段),因此更近一步地大大缩短计算所需时间并且优先确保更多临床关注的具体的血管分支的模拟计算的准确性。
该方法利用属性设置模块14设置血管中的血液为牛顿流体且为层流,设置符合人体生理学特性的血液密度及血流粘性,并将流动方程设置为非定常流动直至结果对于求解器15收敛。视求解流体参数的具体需求,用于此具体需求的3D CFD网格及模型可以为整个左、右主动脉的血管树生成,也可以为某段具体的血管分支生成;1D CFD网格及模型则为完整的冠状动脉的血管树生成,该步骤可以通过系统1中的血管树模型生成模块11和计算网格生成模块12来实现。
利用所述边界条件设置模块13,为血管树的1D CFD模型和3D CFD模型设置相应的边界条件。其中,将1D CFD模型的入口边界条件设置为充血状态下左、右主动脉血流量,将1D CFD模型的出口边界条件设置为静脉压力(通常为0)。
针对3D CFD模型所模拟的是整个左、右主动脉的血管树还是仅仅为某个具体血管分支,设置不同的入口边界条件。具体说来,如模拟整个左、右主动脉的血管树,将其入口边界条件设置为施加充血状态下左、右主动脉血流量;如模拟某具体血管分支,则将其入口边界条件设置为利用1D CFD模型在如上设置的入口边界条件和出口边界条件(静脉压力)下在对应位置计算得到的流量,这里也可以采用除了流量以外的其他流体参数。
将3D CFD模型的出口边界条件设置为利用1D CFD模型在如上设置的入口边界条件和出口边界条件(静脉压力)下在对应位置计算得到的压力值,这里也可以采用除了压力以外的其他流体参数。
如此实现3D-1D CFD的耦合计算。具体说来,基于前述的1D及3D的网格、边界条件的处理,应用1D CFD求解器进行计算,将1D CFD的计算结果,按照前述对3D边界条件的处理,施加于3D的边界处,应用3D CFD求解器进行计算,以获取血管树中的所需各处的流体参数。
3D、1D CFD计算中,利用属性设置模块14均设置不可压流的Navier-Stokes(N-S)方程组(质量、动量守恒方程):
▽·u=0
u为流体速度矢量,p为压力,ρ为流体密度,υ为流体的运动粘性,从而1D CFD求解器和3D CFD求解器(或由整合了1D CFD和3D CFD求解的功能的求解器15)基于不可压流的N-S方程组来求解。
CFD计算后处理:根据计算得到的3D CFD结果,利用关系式FFR=Pd/Pa(Pd为血管各处的压力,Pa为主动脉处的平均压力),可计算得到血管各处的FFR。可选地,可以通过对3D CFD模型求解的结果进行后处理,来生成病例分析报告,优选地,狭窄处远段的FFR值可以作为最终的计算值写入病例分析报告中,若FFR<0.75,则表明该狭窄会导致血管的功能性缺血,需要进行介入治疗。对3D CFD模型求解的结果还包括其他临床关注的参数,如FFR回拉(pull-back)曲线、血管各处的血流速度及压力分布、血管各分支的流量分布、血管壁各处的剪切应力等,这些临床关注的参数也可以视需要写入病例分析报告中,以供医生作为诊断的参考。
以意图单独模拟冠状动脉中的左主动脉为例,图4示出了为完整的冠状动脉包括远端微血管生成的1D CFD网格以及仅为临床关注的左主动脉生成的3D CFD网格,通过上述的3D-1D耦合计算得到左主动脉中各处的FFR分布,如图5中所示,经实践证实该3D-1D耦合计算结果提供了充分的准确度和临床可接受的耗时,可以控制在1个小时之内。
本发明高度集成及自动化整个计算流程,包括医学图像的处理、计算模型的重建、计算本身及结果的后处理,实现大批量病例的快速准确计算。例如而非限制,可以使用C/C++语言来开发和优化上述1D和/或3D CFD模拟计算流程以及其耦合计算流程,系统1中的各个模块及其所实现的整个计算流程(包括FFR计算的前处理、FFR计算的CFD计算部分以及FFR计算的后处理、结果分析及报告生成等)可以使用Python、Bash Script等自动化实现,从而在确保模拟结果准确度的同时,提高了用户友好度。
以上实施例的说明只是用于帮助理解本发明的核心思想。应当指出,对于本领域的普通技术人员而言,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,但这些改进和修饰也落入本发明权利要求请求保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!