胃部肿瘤细胞图像识别判定装置、方法及胃部肿瘤切片识别判定设备与流程
本发明属于肿瘤切片判定领域,具体涉及一种胃部肿瘤细胞图像识别判定装置、识别判定方法及胃部肿瘤切片识别判定设备。
背景技术:
目前,人工智能技术蓬勃发展,其中深度学习已经成为当下人工智能的“顶梁柱”,尤其是谷歌于2016年1月在自然杂志上正式公开发表论文,宣布其alphago的电脑程序。更在2016年3月进行的围棋人机大战中,阿尔法狗(alphago)最终以4:1战胜了韩国名将李世石九段,引起了全世界的广泛关注,也让神经科学和深度学习等概念再次进入了公众的视野,由此引发了深度学习的应用热潮。而卷积神经网络(constitutionalneuralnetworks,cnn)正是目前深度学习中使用最为广泛且有效的算法,它是在多层神经网络的基础上发展起来的对图像分类和识别非常有效的一种深度学习方法。在2015年的imagenet挑战赛上,图像识别准确率机器首次超过了人类。2016年,imagenet竞赛,图像识别错误率进一步下降,错误率今年的最好成绩为:平均错误率0.02991,也就是2.99%左右,这说明cnn在图像识别上的应用前景非常值得期待。
在癌症发病率逐年上升的情况下,现在医院诊断肿瘤主要还是由医生人工去辨别医学显微图像,这就要求检测人员或医师具有丰富的临床经验,但这样的诊断方式存在着工作效率低,强度大,易疲劳和产生人为误差等诸多缺点,因此在医学图像分类识别包括各种肿瘤细胞的分类识别方面,国内外学者都做了很多相关的研究,取得了不小的进展,但在识别准确率和运行速率上还不尽如人意,离智能医疗诊断产业化还有不小的距离。在目前智能产业化发展迅猛的势头下,智能医疗诊断产业化是必然的趋势,而肿瘤细胞图像的分类识别是其重要核心之一,因此,肿瘤细胞图像识别的研究有着重大的意义。
肿瘤细胞图像作为一种自然图像,一方面由于组织器官形状的不规则性以及不同细胞类的差异性,细胞的结构、形状、稀疏程度、排列形状等,都会有非常大的差异,具有较大的复杂性;另一方面又因为其自身的性质使得它的高阶统计特性具有非高斯分布的特点,含有较多的冗余信息。这使得模式识别中一般的线性方法难以解决肿瘤细胞图像复杂性的问题,因此很多学者尝试用非线性的模式识别方法来解决。常用的非线性方法主要有主成分分析、小波分析、压缩感知、字典学习、聚类、流形学习以及尺度不变特征转换(sift)、决策树、svm、人工神经网络等这几大类,每一种分类方法都有其自身的特性和优点,但是在识别准确率和速率上均有待于提高。
此外,传统的胃肿瘤细胞图像识别依据经验人为地从细胞图像中提取特征,再在该特征上进行分类识别,这种方式存在盲目性、操作复杂和分类精度低等缺陷。
技术实现要素:
本发明是为了解决上述问题而进行的,通过提供一种同时含有卷积神经网络和量子自组织神经网络的胃部肿瘤细胞图像识别判定装置以及胃部肿瘤切片识别判定设备,来解决传统的肿瘤细胞识别方法存在的盲目性、复杂性、分类精度低的问题。为了实现上述目的,本发明提供了下述技术方案:
本发明提供了一种胃部肿瘤细胞图像识别判定装置,采用n个被医生做出判定并且由正常胃部细胞图像、增生胃部细胞图像以及癌变胃部细胞图像组成的已知类别的胃部细胞图像集进行识别训练,并基于识别训练结果对该n个已知类别的胃部细胞图像取自相同组织的待检胃部细胞图像进行识别判定,具有这样的技术特征:包括图像导入部,用于导入n个已知类别的胃部细胞图像或待检胃部细胞图像;预处理部,对每个已知类别的胃部细胞图像以及待检胃部细胞图像进行灰度化处理得到灰度图像,并根据一定方法对灰度图像的维度进行缩放;特征提取部,采用具有一定层数的卷积神经网络对每个缩放后的灰度图像进行多层特征提取,并将每层提取的特征进行降维,然后串联融合得到图像的特征矩阵;训练识别判定部,将n个已知类别的胃部细胞图像的特征矩阵作为训练集按预定训练参数的预定值对量子自组织神经网络进行训练,并采用该被训练好的量子自组织神经网络对每个待检胃部细胞图像的特征矩阵进行识别,对待检胃部细胞图像属于正常细胞图像、增生细胞图像还是癌变细胞图像进行判定,以及结果显示部,显示训练识别判定部的判定结果。其中,卷积神经网络的层数至少为五。预定训练参数包括量子自组织神经网络的竞争节点、邻域半径、学习速率以及训练次数,竞争节点为220~230、邻域半径为4~5、学习速率不小于1.0、训练次数为75~100。
本发明提供的胃部肿瘤细胞图像识别判定装置中,还可以具有这样的特征:还包括归一化处理部,将已知类别的胃部细胞图像以及待检胃部细胞图像转换成相应的唯一标准形式。
本发明提供的胃部肿瘤细胞图像识别判定装置中,还可以具有这样的特征:当所述训练识别判定部判定将所述待检胃部细胞图像不属于正常细胞图像、增生细胞图像以及癌变细胞图像中的任一种图像时,也将该待检胃部细胞图像设定为癌变细胞图像。
本发明提供的胃部肿瘤细胞图像识别判定装置中,还可以具有这样的特征:预处理部根据下式对每个肿瘤细胞图像进行灰度化处理:
y=0.3r+0.59g+0.11b
其中,y在yuv的颜色空间中指代点的亮度,r、g、b分别指代rgb颜色空间中的三个分量,
预处理部采用双线性插值算法对所述灰度图像的维度进行缩放。
本发明提供的胃部肿瘤细胞图像识别判定装置中,还可以具有这样的特征:卷积神经网络的层数为七,包括输入层、第一卷积层、第一下采样层、第二卷积层、第二下采样层、全连接层以及输出层。第一卷积层的卷积核大小为5×5,得到的特征图的个数为六;第一下采样层和第一卷积层一一对应,第一下采样层的特征图中的神经元与第一卷积层的特征图以2×2大小连接;第二卷积层的卷积核大小为7×7,特征图个数与第一下采样层的特征图的维度相同;第二下采样层和第二卷积层一一对应,第二下采样层的特征图中的神经元与第二卷积层的特征图以2×2大小连接;全连接层与所述第二下采样层之间全连接。
本发明提供的胃部肿瘤细胞图像识别判定装置中,还可以具有这样的特征:特征提取部采用主成分分析法对每层提取的特征进行降维。
本发明提供的胃部肿瘤细胞图像识别判定装置中,还可以具有这样的特征:训练识别判定部具有:训练调整单元,将构成三个类样本集合的m张已知类别的胃部细胞图像的特征矩阵作为训练样本,按一定公式计算每个训练样本的竞争获胜神经元j*,并根据预定训练参数的预定值调整竞争获胜神经元j*的神经元权值,得到与每个类样本集合相对应的获胜神经元集合;验证判定单元,将构成三个类样本集合的(n-m)张已知类别的胃部细胞图像的特征矩阵作为验证样本,按一定公式计算每个验证样本的竞争获胜神经元,并判定该竞争获胜神经元属于获胜神经元集合中的哪一类;计算设定单元,对验证判定单元的结果准确率进行计算并在验证判定单元的结果准确率不低于90%时,将训练后的量子自组织神经网络设定为识别量子自组织神经网络;以及识别判定单元,采用该识别量子自组织神经网络每个待检胃部细胞图像的特征矩阵进行识别判定。
本发明提供的胃部肿瘤细胞图像识别判定装置中,还可以具有这样的特征:竞争节点为225、所述邻域半径为5、所述学习速率不小于1.0、所述训练次数为100。
进一步,本发明还提供了一种胃部肿瘤细胞图像识别判定方法,包括如下步骤:采用图像导入部导入n个已知类别的胃部细胞图像或待检胃部细胞图像;采用预处理部对每个已知类别的胃部细胞图像以及待检胃部细胞图像进行灰度化处理得到灰度图像,并根据一定方法对所述灰度图像的维度进行缩放;采用特征提取部利用被分成一定层数的卷积神经网络对每个缩放后的灰度图像进行多层特征提取,并将每层提取的特征进行降维,然后串联融合得到图像的特征矩阵;采用训练识别判定部将n个已知类别的胃部细胞图像的特征矩阵作为训练集按预定训练参数的预定值对量子自组织神经网络进行训练,并采用该被训练好的量子自组织神经网络对每个待检胃部细胞图像的特征矩阵进行识别,对待检胃部细胞图像属于正常细胞图像、增生细胞图像还是癌变细胞图像进行判定;采用结果显示部显示训练识别判定部的判定结果。
进一步,本发明还提供了一种胃部肿瘤切片识别判定设备,具有这样的技术特征:包括切片扫描存储装置,对胃部肿瘤切片进行扫描获取胃部肿瘤细胞图像,并将该胃部肿瘤细胞图像作为待检胃部细胞图像进行存储;以及胃部肿瘤细胞图像识别判定装置,和切片扫描存储装置通信连接,采用n个被医生做出判定并且由正常胃部细胞图像、增生胃部细胞图像以及癌变胃部细胞图像组成的已知类别的胃部细胞图像进行识别训练,并基于识别训练结果对所述待检胃部细胞图像进行识别判定。其中,胃部肿瘤细胞图像识别判定装置为上述任一项所述的胃部肿瘤细胞图像识别判定装置。
发明的作用与效果
根据本发明所提供的胃部肿瘤细胞图像识别判定装置、方法及胃部肿瘤切片识别判定设备,由于胃部肿瘤细胞图像识别判定装置的特征提取部,采用被分成至少五层的卷积神经网络对每个缩放后的所述灰度图像进行多层特征提取,并将每层提取的特征进行降维,然后串联融合得到特征矩阵,其训练识别判定部将n个已知类别的胃部细胞图像的特征矩阵作为训练集按预定训练参数的预定值对量子自组织神经网络进行训练,使得本发明的胃部肿瘤细胞图像识别判定装置能够同时发挥卷积神经网络在自动提取图像的显著特征方面的优异性能以及量子自组织神经网络在模式识别和分类方面的优异性能,既能够从含有大量冗余信息并且具有高度复杂性的胃部肿瘤细胞图像中有效的提取显著特征,又能够快速的根据这些显著特征进行模式识别,进而实现正确分类。
因此,本发明的胃部肿瘤细胞图像识别判定装置避免了传统识别方法需要人工特征提取和分类过程中复杂的数据重建,在一定程度上能够取代人工去辨别医学显微图像,提高了医师的工作效率,缓解了医师工作强度大的状态。
附图说明
图1为本发明的实施例中胃部肿瘤切片识别判定设备的结构框图。
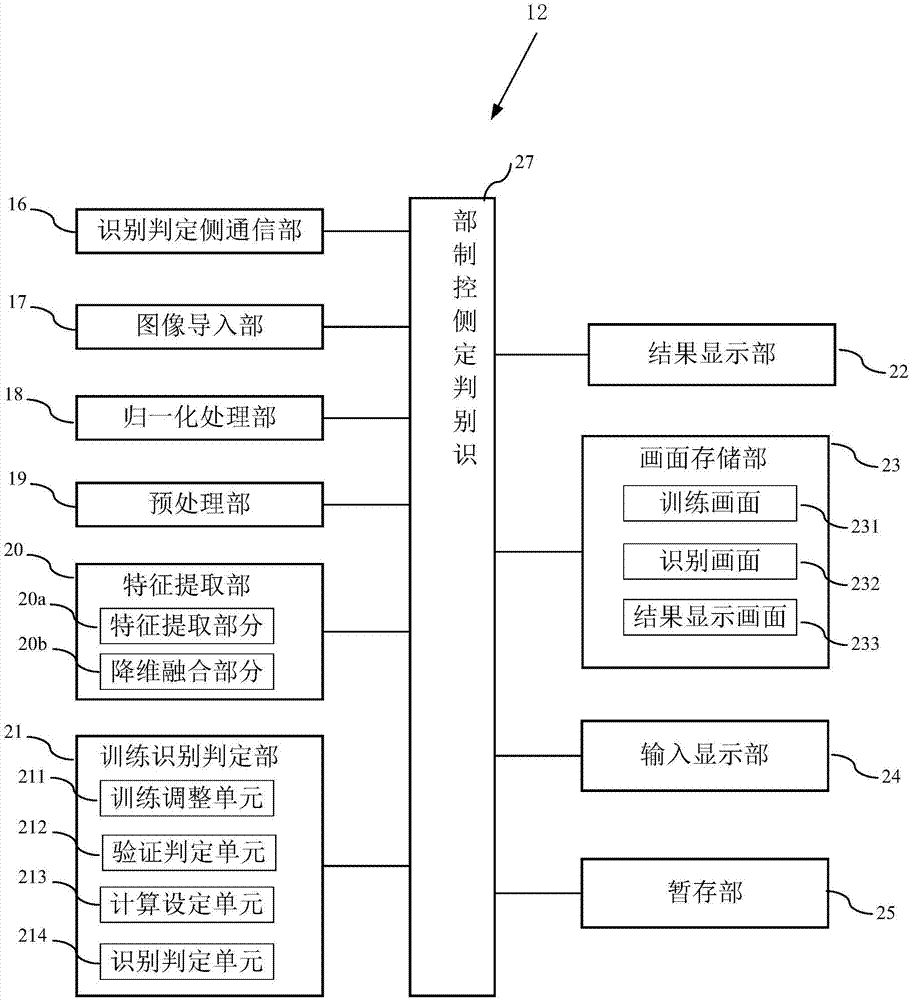
图2为本发明的实施例中胃部肿瘤细胞图像识别判定装置的结构框图。
图3(a)为本发明的实施例中训练调整单元的训练画面的示意图;图3(b)为本发明的实施例中训练调整单元训练完毕后的训练画面的示意图。
图4(a)为本发明的实施例中验证判定单元以及识别判定单元的识别画面的示意图;图4(b)为本发明的实施例中验证判定单元以及识别判定单元判定完毕后识别画面的示意图。
图5为本发明实施例中胃部肿瘤切片识别判定设备的动作流程图。
图6为本发明实施例中胃部肿瘤细胞图像识别判定装置的动作流程图;
图7为本发明实施例中特征提取部以及训练识别判定部的动作流程图。
具体实施方式
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,以下结合附图对本发明胃部肿瘤细胞图像识别判定装置以及胃部肿瘤切片识别判定设备作具体阐述。
图1是本发明所涉及的实施例中胃部肿瘤切片识别判定设备的结构框图。
如图1所示,胃部肿瘤切片识别判定设备10用于对胃部肿瘤切片进行快速判定,包括切片扫描存储装置11以及与其通信连接的胃部肿瘤细胞图像识别判定装置12。
切片扫描存储装置11包括扫描部13、存储部14以及扫描侧通信部15。扫描部对w个胃部肿瘤切片逐个进行扫描,获取w个彩色的胃部肿瘤细胞图像;存储部14将该胃部肿瘤细胞图像作为待检胃部细胞图像进行存储;扫描侧通信部15与胃部肿瘤细胞图像识别判定装置12相连接,将待检胃部细胞图像向胃部肿瘤细胞图像识别判定装置12发送。
胃部肿瘤细胞图像识别判定装置12包括识别判定侧通信部16、图像导入部17、归一化处理部18、预处理部19、特征提取部20、训练识别判定部21、结果显示部22、画面存储部23、输入显示部24、暂存部25以及识别判定侧控制部26。
识别判定侧通信部16和扫描侧通信部15通信连接,用于接收待检胃部细胞图像,接收到的待检胃部细胞图像被存储在暂存部25中。
图像导入部17用于导入存储在本地的n个已知类别的胃部细胞图像或待检胃部细胞图像。该n个已知类别的胃部细胞图像已被医生做出判定,并且由正常胃部细胞图像、增生胃部细胞图像以及癌变胃部细胞图像组成。
归一化处理部18将待处理的已知类别的胃部细胞图像以及待检胃部细胞图像原始图像转换成相应的唯一标准形式。
预处理部19对归一化处理后的每个已知类别的胃部细胞图像以及待检胃部细胞图像进行灰度化处理得到灰度图像,并根据一定方法对灰度图像的维度进行缩放。已知类别的胃部细胞图像以及待检胃部细胞图像均为原始的彩色肿瘤细胞图像,图像的维度非常高。假设维度为80×60,在预处理过程中,预处理部19先根据y=0.3r+0.59g+0.11b(y在yuv的颜色空间中指代点的亮度,r、g、b分别指代rgb颜色空间中的三个分量)对图像进行灰度化处理,然后采用双线性插值算法将图像缩放到60×60以保证满足输入要求。
特征提取部20包括特征提取部分20a以及降维融合部分20b。特征提取部分20a采用被分成七层的卷积神经网络对每个缩放后的灰度图像进行多层特征提取。该卷积神经网络包括输入层、第一卷积层c1、第一下采样层s2、第二卷积层c3、第二下采样层s4、全连接层f5以及输出层。
输入层用于输入缩放到60×60的灰度图像。
第一卷积层c1对输入层进行卷积运算来最大程度地提取原始图像的特征,实际上,它是通过一个5×5大小的卷积核来获得6个56×56(56=60-5+1)大小的特征图。卷积核是卷积神经网络提取特征好坏的关键所在,是生物视觉结构系统里的感受野的模型化表示。卷积核的大小决定一个神经元感受野的大小,卷积核过小,无法提取有效的局部特征;卷积核过大,提取的特征的复杂度可能远远超过卷积核的表示能力。因此,设置适当的卷积核,对于整个网络的性能至关重要,一般来说,卷积核大小通常选5×5的。
第一下采样层s2层对c1层作下采样处理,利用图像局部相关的原理,对图像进行子抽样,减少数据量的同时保留有用信息。由于卷积层和下采样层是一一对应的,故s2层也有6个特征图。特征图的每个神经元与c1层中相对应的特征图以2×2大小相连接,所以特征图的大小为28×28(28=56÷2)。该下采样层使用的缩放因子都是2,这样做的原因是要控制缩放下降的速度,因为缩放是指数级缩放,缩小的速度太快也意味着提取图像特征更加粗糙,将会失去更多图像细节特征。s2层每个单元的6个输入相加,乘以一个可训练参数,再加上一个可训练偏置,共(1+1)×6=12个训练参数,结果通过sigmoid函数来计算。
第二卷积层c3和第二下采样层s4的工作原理与前面的层是一样的,只是随着深度的增加,提取的特征更加抽象,也更具有表达能力。
第二卷积层c3对s2层特征图进行卷积,然而这两层并不是一一对应的。c3层有12个特征图,卷积核大小为7×7,移动步长是1,特征图的大小为22×22(22=28-7+1),训练参数为(7×7+1)×22×22=44200个。在卷积过程中每一个特征图都是由s2层中的几个特征图映射后叠加得到的。
第二下采样层s4,该层同样采用2×2大小的卷积,有12个大小为11×11(11=22÷2)的特征图,共(1+2)×12=24个可训练参数。
全连接层f5,该层有80个特征图与s4层的全部12个特征图的5×5邻域相连。由于s4层特征图的大小也是5×5,因此f5层特征图的大小为1×1(1=5-5+1),这就构成了s4与f5之间的全连接。
最后一层是输出层,由于样本共有3类,所以本层有3个结点,与f5层全连接,共(5×5)×12×3=900个训练参数。
降维融合部分20b采用主成分分析法(pca)将第一卷积层c1、第一下采样层s2、第二卷积层c3、第二下采样层s4提取的特征进行pca降维,并将降维后的每层特征进行串联融合,得到特征矩阵。
训练识别判定部21采用量子自组织神经网络(qsofm网络)对特征矩阵进行分类识别,包括训练调整单元211、验证判定单元212、计算设定单元213以及识别判定单元214。
训练调整单元211将构成正常、增生、癌变三个类样本集合的m张已知类别的胃部细胞图像的特征矩阵作为训练样本,对量子自组织神经网络进行训练。
图3(a)为本发明的实施例中训练调整单元的训练画面的示意图;图3(b)为本发明的实施例中训练调整单元训练完毕后训练画面的示意图。
如图2和图3(a)所示,训练调整单元的训练画面231存储在画面存储部23中,在训练开始,输入显示部24显示训练画面231,其上显示有多个训练参数,需要按要求填入每个训练参数的初始值,对qsofm网络进行初始化。这些训练参数包括训练样本的个数、竞争节点(即量子自组织神经网络竞争层神经元个数)、邻域半径、学习速率以及训练次数。
在本实施例中,训练样本的个数为150(即s=150),根据提供的训练样本个数,神经网络可以从本地随机读取相应个数的肿瘤细胞特征矩阵,构建一个二维矩阵作为分类器的输入数据。在这150张图像中,包括50张正常胃部细胞图像、增生胃部细胞图像以及癌变胃部细胞图像。
竞争节点的值在220~230范围内,优选225。在qsofm中,网络的拓扑结构由竞争层神经元个数决定,因此,竞争层神经元个数也会对图像分类的运行时间和准确率产生影响。通过实验,当竞争节点小于220时,无法准确得到三类样本的获胜神经元,而当竞争节点个数超过230时,分类效果一样反而影响运行速度。
邻域半径的值在4~5范围内,优选5。qsofm训练过程以获胜神经元为中心调整邻域内的神经元权值。通常情况下,网络的初始领域半径会比较大,但随着训练次数的不断增加,领域半径也会逐渐缩小。通过实验可以发现初始领域半径超过5的话对分类效果影响严重,初始领域半径小也能避免不必要的权值调整节省运行时间。
学习速率不小于1.0。学习速率η的大小能够确定每类对应获胜神经元的快慢,通过实验,当学习速率小于1.0时,聚类100次后还是无法完全确定每类样本对应的获胜神经元,而学习速率达到1.0以上时都可以很快确定每类样本对应的获胜神经元。
训练次数在75~100范围内,优选100。对于qsofm神经网络来说,训练次数的多少能够影响网络的分类准确度和训练时间。通常情况下,训练次数的增加可以提高网络的分类准确度。但当网络收敛后,训练次数的增加并不能提高网络的分类准确度,反而增加了网络的训练时间。
通过实验,当训练次数为75次时,每类样本对应的获胜神经元已经不再变化。经过多次试验当有监督聚类过程训练次数为100次时为佳,既可以避免训练次数过长,导致训练时间过长,也可以避免训练次数不够导致每类获胜神经元无法确定。
数值输入完毕后,点击开始训练按钮231a,开始进行训练。
在训练过程中,训练调整单元211首先计算各竞争层节点的网络坐标;然后按照式(1)和(2)计算学习速率η和领域半径r,按照式(3)和(4)计算计算竞争获胜神经元j*,按公式(5)调整以j*为中心半径r的领域内的神经元权值;而后,按序对每一个类样本集合mj,按公式(6)和公式(7)求取该类中心样本
η(s)=η0(1-s/max)(1)
其中,η0为学习速率的初始值;r0为邻域半径的初始值;s为循环记数节拍;max为最大循环步数。
其中,
其中,
其中,
如图3(b)所示,待训练完成后,结果显示部22的结果显示画面出现在训练画面上,显示训练完成的结果。
验证判定单元212将构成三个类样本集合的(n-m)张未知类别的胃部细胞图像作为验证样本,对训练后的量子自组织神经网络进行验证。
图4(a)为本发明实施例中验证判定单元的识别画面的示意图;图4(b)为本发明的实施例中验证判定单元验证完毕后识别画面的示意图。
如图2和图4(a)所示,验证判定单元212的识别画面232也存储在画面存储部23中。在训练开始,输入显示部24显示识别画面232,识别画面232上显示有图像路径、图像名称、图像大小、细胞图像标记以及开始识别按键。点击图像路径的操作键,导入一个验证样本后,该验证样本的图像名称、大小以及图像内容自动显示在相应的标记框内。
点击开始识别按键后,训练后的量子神经网络开始对导入的验证样本进行分类识别。此时,验证判定单元212按上述公式(3)和公式(4)计算每个验证样本的竞争获胜神经元,并判定该竞争获胜神经元属于获胜神经元集合中的哪一类。
如图4(b)所示,待判定完成后,结果显示部22结果显示画面出现在识别画面上,显示判定结果。被导入的验证样本的名称以及判定结果被暂存在暂存部25内。
计算设定单元213对验证判定单元的结果准确率进行计算,并在准确率不低于90%时,将量子自组织神经网络进行训练设定为识别量子自组织神经网络。
识别判定单元214采用该识别量子自组织神经网络每个待检胃部细胞图像的特征矩阵进行识别,对待检胃部细胞图像属于正常细胞图像、增生细胞图像还是癌变细胞图像进行判定。
当识别判定单元214判定待检胃部细胞图像不属于正常细胞图像、增生细胞图像以及癌变细胞图像中的任一种图像时,也将该待检胃部细胞图像设定为癌变细胞图像,由医生再次进行判断。例如,当识别判定单元214判定某个待检胃部细胞图像不具备正常图像的特征,但也不具备增生或癌变细胞图像的特征时,也将该模棱两可的图像判定为癌变细胞图像。
由于验证判定过程也是识别判定过程,所以,二者的识别画面和识别过程是完全相同的。
识别判定侧控制部26用于控制识别判定侧通信部16、图像导入部17、归一化处理部18、预处理部19、特征提取部20、训练识别判定部21、结果显示部22、画面存储部23、输入显示部24以及暂存部25的正常运行。
图5为本发明所涉及的实施例中的胃部肿瘤切片识别判定设备的动作流程图。
如图5所示,在本实施例中,胃部肿瘤切片识别判定设备的动作流程包含如下步骤:
步骤s1,扫描部对w个胃部肿瘤切片逐个进行扫描,获取w个彩色的胃部肿瘤细胞图像;
步骤s2,存储部14将该胃部肿瘤细胞图像作为待检胃部细胞图像进行存储;
步骤s3,扫描侧通信部15与胃部肿瘤细胞图像识别判定装置12相连接,将待检胃部细胞图像向胃部肿瘤细胞图像识别判定装置12发送;
步骤s4,接收待检胃部细胞图像,采用n个被医生做出判定并且由正常胃部细胞图像、增生胃部细胞图像以及癌变胃部细胞图像组成的已知类别的胃部细胞图像进行识别训练,并基于识别训练结果对待检胃部细胞图像进行识别判定;
步骤s5,结果显示部显示所述训练识别判定部的判定结果,结束。
图6是本发明实施例的胃部肿瘤细胞图像识别判定装置的动作流程图。
如图6所示,在本实施例中,胃部肿瘤细胞图像识别判定装置对胃部肿瘤细胞图像的识别判定流程包含如下步骤:
步骤s4-1,图像导入部17导入存储在本地的n个已知类别的胃部细胞图像或待检胃部细胞图像,图像被存储在暂存部25中,然后进入步骤s4-2。
步骤s4-2,归一化处理部18将待处理的已知类别的胃部细胞图像以及待检胃部细胞图像原始图像转换成相应的唯一标准形式,然后进入步骤s4-3。
步骤s4-3,预处理部19对归一化处理后的每个已知类别的胃部细胞图像以及待检胃部细胞图像进行灰度化处理得到灰度图像,并根据双线性插值算法对灰度图像的维度进行缩放,然后进入步骤s4-4。
步骤s4-4,特征提取部分20a采用被分成七层的卷积神经网络对每个缩放后的灰度图像进行多层特征提取,然后进入步骤s4-5。
步骤s4-5,降维融合部分20b采用主成分分析法(pca)将第一卷积层c1、第一下采样层s2、第二卷积层c3、第二下采样层s4提取的特征进行pca降维,并将降维后的每层特征进行串联融合,得到特征矩阵,然后进入步骤s4-6。
步骤s4-6,训练调整单元211将构成正常、增生、癌变三个类样本集合的m张已知类别的胃部细胞图像的特征矩阵作为训练样本,对量子自组织神经网络进行训练,然后进入步骤s4-7。
步骤s4-7,验证判定单元212将构成三个类样本集合的(n-m)张未知类别的胃部细胞图像的特征矩阵作为验证样本,对训练后的量子自组织神经网络进行验证,然后进入步骤s4-8。
步骤s4-8,计算设定单元213对验证判定单元的结果准确率进行计算,并在准确率不低于90%时,将量子自组织神经网络进行训练设定为识别量子自组织神经网络,然后进入步骤s4-9。
步骤s4-9,识别判定单元214采用该识别量子自组织神经网络每个待检胃部细胞图像的特征矩阵进行识别,判定待检胃部细胞图像属于正常细胞图像、增生细胞图像或者癌变细胞图像,然后进入步骤s4-10。
步骤s4-10,结果显示部22显示识别判定单元214的判定结果,结束。
图7为本发明实施例中特征提取部以及训练识别判定部的动作流程图。
图7用于直观说明特征提取部以及训练识别判定部的工作流程:
在训练调整单元211构建训练样本矩阵x和验证样本矩阵y后,依次进行步骤s4-4和步骤s4-5,然后进行步骤s4-6-1;
步骤s4-6-1,初始化qsofm系统参数,然后进行步骤s-4-6-2;
步骤s4-6-2,判断样本是否是测试样本,若判断结果为是,进入步骤s4-6-3;若判断结果为否,进入步骤s4-7;
步骤s4-6-3,训练qsofm神经网络。将训练样本的低维度特征数据矩阵输入初始化后的qsofm分类识别网络中,对qsofm分类识别网络进行聚类训练,最终得到可以用于分类识别的qsofm模型;
步骤s4-7,验证判定单元212将构成三个类样本集合的(n-m)张未知类别的胃部细胞图像的特征矩阵作为验证样本,经步骤s4-4和步骤s4-5得出验证样本图像的低维度特征数据矩阵,将其输入训练结束的qsofm分类识别网络,根据qsofm分类算法进行分类得出正常、增生、癌变和未知类。
本实施例的胃部肿瘤细胞图像识别判定装置适用于但又不局限于对胃部肿瘤细胞图像进行识别判定。
当本实施例的胃部肿瘤细胞图像识别判定装置用于识别判定其他种类的肿瘤细胞图像时,需要根据所要判定的肿瘤细胞的特点设定相应的训练参数,以达到保证识别准确率的目的。
实施例的作用与效果
根据本实施例所提供的胃部肿瘤细胞图像识别判定装置、方法及胃部肿瘤切片识别判定设备,由于胃部肿瘤细胞图像识别判定装置的特征提取部,采用被分成七层的卷积神经网络对每个缩放后的灰度图像进行多层特征提取,并将每层提取的特征进行降维和串联融合后得到特征矩阵,其训练识别判定部将n个已知类别的胃部细胞图像的特征矩阵作为训练集按预定训练参数的预定值对量子自组织神经网络进行训练,使得本实施例的胃部肿瘤细胞图像识别判定装置能够同时发挥卷积神经网络在自动提取图像的显著特征方面的优异性能以及量子自组织神经网络在模式识别和分类方面的优异性能,既能够从存在大量冗余信息并且具有较大的复杂性的胃部肿瘤细胞图像中有效的提取显著特征,又能够快速的根据这些显著特征进行模式识别,进而实现正确分类,实验表明,该装置的分类准确率可达91.65%。
因此,本实施例的胃部肿瘤细胞图像识别判定装置克服了传统的胃肿瘤细胞图像识别依据经验人为地从细胞图像中提取特征,再在该特征上进行分类识别,所存在的盲目性、操作复杂和分类精度低等缺陷,在一定程度上能够取代人工去辨别医学显微图像,提高了医师的工作效率,缓解了医师工作强度大的状态。
上述实施方式为本发明的优选案例,并不用来限制本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!