基于OCT的支架植入术前的分析系统及分析方法与流程
本发明涉及医疗器械技术领域,尤其涉及一种基于OCT的支架植入术前的分析系统及分析方法。
背景技术:
冠状动脉粥样硬化性心脏病,简称冠心病(coronary artery disease,CAD),是世界范围内死亡的主因。目前冠心病的治疗普遍采用经皮冠状动脉介入治疗术,即将支架导引到血管的狭窄部位,然后通过对球囊加压将支架撑开,从而使血管管腔扩大,提高血液流通能力。支架植入之前,对内腔精确测量是十分重要的,其决定了支架尺寸的选择以及支架放置的最优位置。若支架尺寸不合适,则可能导致支架贴壁不良,最终导致急性支架血栓以及晚期再狭窄。尤其,对于新一代的生物可吸收支架(bioresorbable vascular scaffold,BVS),由于其扩张性有限,因此血管内腔的测量对于支架尺寸的选择尤为重要。另外,支架植入最优位置的选择不仅需要考虑最小的内腔面积,还需要考虑分叉血管。如果一个分叉血管被支架覆盖,则有很高的病变风险,例如再狭窄以及阻碍血液流向分叉血管。因此,在支架植入之前,检测分叉血管以及测量主血管的大小是非常重要的。
血管内光学相干断层扫描(intravascular optical coherence tomography,IVOCT)图像由于其具有较高分辨率(10-20μm),正被广泛应用于支架植入术前的血管结构检测。然而,目前大多数分叉血管的检测以及主血管的测量都是采用人工方法。由于每次回拉都会产生271帧图像,因此使用人工分析耗时费力。这就要求使用自动分析方法来进行术前评估。因此有必要研究更为有效的自动检测方法来实现分叉血管的检测及主血管的分割。
技术实现要素:
为了解决上述问题,本发明提出一种基于OCT的支架植入术前的分析系统及分析方法,能够实现分叉血管以及主血管的自动检测与分割,克服了现有技术难以合理选择支架的尺寸及确定支架放置位置的问题。
本发明提出的具体技术方案为:提供一种基于OCT的支架植入术前的分析方法,所述分析方法包括以下步骤:
获取冠状动脉OCT图像;
将所述冠状动脉OCT图像变换为极坐标空间的OCT图像;
检测所述极坐标空间的OCT图像中导丝的上边界和下边界;
将所述上边界的图像和所述下边界的图像进行拟合得到血管的内壁轮廓;
将所述血管的内壁轮廓转换为笛卡尔坐标空间的血管的内壁轮廓;
获取所述笛卡尔坐标空间的血管的内壁轮廓中的分叉血管;
对所述笛卡尔坐标空间的血管的内壁轮廓进行显示。
进一步地,检测所述极坐标空间的OCT图像中导丝的上边界和下边界步骤包括:
对所述极坐标空间的OCT图像进行图像映射变换获得第一灰度图像;
对所述第一灰度图像分别进行两次动态规划获得上边界的图像和下边界的图像;
分别对所述上边界的图像和所述下边界的图像进行回溯得到导丝的上边界和下边界。
进一步地,所述第一灰度图像为:
其中,n表示一次回拉产生的冠状动脉OCT图像帧的数量,m表示在θ轴方向上的像素点的数目,aj表示对n个极坐标空间下的OCT图像帧在ρ轴方向上进行灰度值累加平均后的列向量,aj为:
aj=(a1,j,a2,j,...,ai,j,...,am,j)T
j表示当前OCT图像帧在n个OCT图像帧中的次序,j满足1≤j≤n;i满足1≤i≤m。
进一步地,将所述上边界的图像和所述下边界的图像进行拟合得到血管的内壁轮廓步骤包括:
分别将所述上边界的图像和所述下边界的图像中位于所述上边界和所述下边界之间的区域删除得到第一图像和第二图像;
将所述第一图像和所述第二图像进行拼接得到拼接后的图像;
对所述拼接后的图像进行动态规划得到第三图像;
对所述第三图像进行回溯得到第四图像;
将上边界所在的行及所述下边界所在的行插入所述第四图像得到内壁轮廓;
将所述内壁轮廓的两端进行拟合得到所述血管的内壁轮廓。
进一步地,获取所述笛卡尔坐标空间的血管的内壁轮廓中的分叉血管步骤包括:
在笛卡尔坐标中计算血管中的每个像素点到所述血管的内壁轮廓上的每个像素点的最短距离,将所述最短距离作为血管中的每个像素点的灰度值得到第二灰度图像;
将所述第二灰度图像中灰度值最大的像素点所在的位置作为所述血管的内壁轮廓的最大内切圆的圆心,将灰度值最大的像素点所对应的最短距离作为最大内切圆的半径,绘制所述血管的内壁轮廓的最大内切圆;
绘制所述最大内切圆的同心圆,所述同心圆的直径为所述最大内切圆的直径的1~2倍,判断所述血管的内壁轮廓上的像素点是否全部位于所述同心圆所在区域;
若所述血管的内壁轮廓上的像素点不全部位于所述同心圆所在区域,则存在分叉血管,检测所述分叉血管。
进一步地,若所述血管的内壁轮廓上的像素点不全部位于所述同心圆所在区域,则存在分叉血管,检测所述分叉血管步骤包括:
计算所述血管的内壁轮廓上的每个像素点与所述最大内切圆的圆心的连线和所述像素点的法线之间的夹角;
判断所述夹角是否大于角度阈值,若所述夹角大于所述角度阈值,则所述像素点属于分叉血管,获得所述分叉血管。
进一步地,所述方法还包括在对所述笛卡尔坐标空间的血管的内壁轮廓进行显示之前将所述分叉血管的轮廓从所述笛卡尔坐标空间的血管的内壁轮廓中去除得到主血管的轮廓。
本发明还提供了一种基于OCT的支架植入术前的分析系统,所述分析系统包括依次连接的探测单元、光信号处理单元、成像单元、数据处理单元及显示单元,所述数据处理单元包括:
图像获取模块,用于接收所述成像单元的冠状动脉OCT图像;
第一坐标变换模块,用于将所述冠状动脉OCT图像变换为极坐标空间的OCT图像;
导丝分割模块,用于检测所述极坐标空间的OCT图像中导丝的上边界和下边界;
内壁分割模块,用于将所述导丝的上边界的图像和下边界的图像进行拟合得到血管的内壁轮廓;
第二坐标变换模块,用于将所述血管的内壁轮廓转换为笛卡尔坐标空间的血管的内壁轮廓;
分叉血管检测模块,用于获取所述笛卡尔坐标空间的血管的内壁轮廓中的分叉血管;
图像输出模块,用于将所述笛卡尔坐标空间的血管的内壁轮廓输出至所述显示单元进行显示。
进一步地,所述数据处理单元还包括主血管分割模块,所述主血管分割模块用于将所述分叉血管的轮廓从所述笛卡尔坐标空间的血管的内壁轮廓中去除得到主血管的轮廓并将所述主血管的轮廓发送给所述图像输出模块进行显示。
进一步地,所述成像单元的OCT图像的坐标空间为笛卡尔坐标空间。
本发明提出的基于OCT的支架植入术前的分析系统及分析方法,通过分叉血管检测模块可以检测出分叉血管的位置以及主血管的尺寸,根据主血管的尺寸选择支架的尺寸,根据分叉血管的位置确定支架的放置位置,从而实现了分叉血管以及主血管的自动检测与分割,克服了现有技术难以合理选择支架的尺寸及确定支架放置位置的问题,有效降低了支架对分叉血管血流的影响,提高了冠状动脉介入治疗手术的成功率。
附图说明
通过结合附图进行的以下描述,本发明的实施例的上述和其它方面、特点和优点将变得更加清楚,附图中:
图1为基于OCT的支架植入术前的分析系统的模块示意图;
图2为图1中探测单元的结构示意图;
图3为数据处理单元的模块示意图;
图4为基于OCT的支架植入术前的分析方法的流程图;
图5为图3中步骤S3的流程图;
图6为导丝的上边界和下边界的示意图;
图7为图3中步骤S4的流程图;
图8为血管的内壁轮廓的示意图;
图9为图3中步骤S6的流程图;
图10为图8中步骤S61的流程图;
图11为第二灰度图像的示意图;
图12为最大内切圆的示意图;
图13为图8中步骤S62的流程图;
图14为血管的内壁轮廓上的每个像素点与最大内切圆的圆心的连线和像素点的法线之间的夹角的示意图;
图15为拟合后的主血管的轮廓的示意图;
图16为分叉血管和主血管的截面的示意图;
图17(a)为沿着回拉方向的各个横截面的不同区域的面积曲线图;
图17(b)为沿着回拉方向的各个横截面的不同区域的直径曲线图。
具体实施方式
以下,将参照附图来详细描述本发明的实施例。然而,可以以许多不同的形式来实施本发明,并且本发明不应该被解释为限制于这里阐述的具体实施例。相反,提供这些实施例是为了解释本发明的原理及其实际应用,从而使本领域的其他技术人员能够理解本发明的各种实施例和适合于特定预期应用的各种修改。
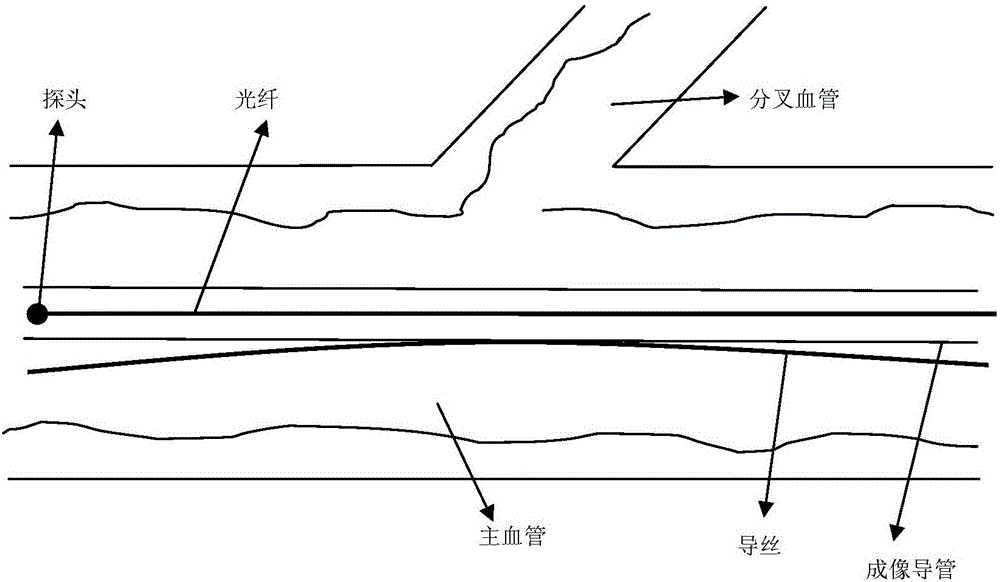
参照图1,本实施例提供的基于OCT的支架植入术前的分析系统包括依次连接的探测单元1、光信号处理单元2、成像单元3、数据处理单元4及显示单元5。本实施例中血管为冠状动脉,其包括分叉血管和主血管,探测单元1用于采集血管内的光信号,光信号处理单元2用于对光信号进行处理,成像单元3用于将处理后的光信号以图像的形式呈现,数据处理单元4用于对图像进行处理,以实现分叉血管和主血管的自动检测与分割,显示单元5用于对处理后的图像进行显示,其用于将分叉血管及主血管以多种形式显示出来。
参照图2,探测单元1包括探头、光纤、导丝及成像导管。导丝用于将成像导管引入血管,探头可对血管进行成像,探头和光纤置于成像导管内。
参照图3,数据处理单元4包括依次连接的图像获取模块41、第一坐标变换模块42、导丝分割模块43、内壁分割模块44、第二坐标变换模块45、分叉血管检测模块46及图像输出模块48。
图像获取模块41用于接收成像单元3的冠状动脉OCT图像,其中,冠状动脉OCT图像包括一次回拉过程中产生的多个OCT图像帧,多个OCT图像帧组成一幅连续的冠状动脉OCT图像,其反映的是一段冠状动脉的情况,每个OCT图像帧的大小为1024×1024,每个OCT图像帧可为8位灰度图,即图像中的像素点的灰度值范围为0~255,这里,冠状动脉OCT图像的坐标空间为笛卡尔坐标空间。
第一坐标变换模块42用于将冠状动脉OCT图像变换为极坐标空间的OCT图像。导丝分割模块43用于检测极坐标空间的OCT图像中导丝的上边界和下边界。极坐标空间的OCT图像包括左半部分和右半部分,左半部分位于导丝的左边,右半部分位于导丝的右边,其中左半部分和右半部分断开的地方即为导丝遮挡的地方,导丝的上边界即为导丝与左半部分的分界处,导丝的下边界即为导丝与右半部分的分界处。
内壁分割模块44用于将导丝的上边界的图像和下边界的图像进行拟合得到血管的内壁轮廓,这里,导丝的上边界的图像即为左半部分,下边界的图像即为右半部分。
第二坐标变换模块45用于将极坐标空间的血管的内壁轮廓转换为笛卡尔坐标空间的血管的内壁轮廓。分叉血管检测模块46用于获取笛卡尔坐标空间的血管的内壁轮廓中的分叉血管。由于血管包括主血管及与主血管连接的分叉血管,通过分叉血管检测模块46获取分叉血管的位置后便可以确定支架的放置位置,以使得支架不会覆盖分叉血管而阻碍主血管中的血液流向分叉血管。图像输出模块48用于将笛卡尔坐标空间的血管的内壁轮廓输出至显示单元5进行显示。
数据处理单元4还包括连接于分叉血管检测模块46和图像输出模块48之间的主血管分割模块47,主血管分割模块47用于将分叉血管检测模块46获取的分叉血管的轮廓从血管的内壁轮廓中去除得到主血管的轮廓并将主血管的轮廓发送给图像输出模块48。
参照图4,本实施例还提供了一种基于OCT的支架植入术前的分析方法,所述分析方法包括以下步骤:
步骤S1、获取冠状动脉OCT图像,其中,通过图像获取模块41获取冠状动脉OCT图像,冠状动脉OCT图像的坐标空间为笛卡尔坐标空间。
步骤S2、将冠状动脉OCT图像变换为极坐标空间的OCT图像。
具体的,通过第一坐标变换模块42将冠状动脉OCT图像变换为极坐标空间的OCT图像。第一坐标变换模块42通过下面的式子来将笛卡尔坐标空间的冠状动脉OCT图像变换为极坐标空间的冠状动脉OCT图像:
θ=arctan(y/x)
其中,x和y分别表示冠状动脉OCT图像中的像素点在笛卡尔坐标空间下的横坐标和纵坐标,θ和ρ分别表示冠状动脉OCT图像中的像素点在极坐标空间下的横坐标和纵坐标。
步骤S3、检测极坐标空间的OCT图像中导丝的上边界和下边界。
其中,通过导丝分割模块43检测极坐标空间的OCT图像中导丝的上边界和下边界。参照图5,步骤S3具体包括:
S31、对极坐标空间的OCT图像进行图像映射变换获得第一灰度图像;其中,图像映射变换过程如下:
若一次回拉产生的冠状动脉OCT图像包括n个OCT图像帧,则极坐标空间的OCT图像包括n个极坐标空间下的OCT图像帧,对n个极坐标空间下的OCT图像帧在ρ轴方向上进行灰度值累加平均,得到一个列向量aj,aj可表示为:
aj=(a1,j,a2,j,...,ai,j,...,am,j)T
其中,j表示当前OCT图像帧在n个OCT图像帧中的次序,j满足1≤j≤n;m表示在θ轴方向上的像素点的数目;i满足1≤i≤m。
对在ρ轴方向上灰度值累加平均后所得的n个向量aj依次排列得到一个矩阵A,表示如下:
如图6(a)所示,A对应的是一幅灰度图像即为第一灰度图像。
S32、对第一灰度图像即A分别进行两次动态规划获得与第一灰度图像即A大小相等的上边界的图像和下边界的图像;其中,对第一灰度图像进行第一次动态规划过程获得上边界的图像的过程如下:
对于A中每个灰度值为ai,j的像素点,其目标函数为:
其中,表示像素点灰度值的平均值;w1表示平均值计算时所用到的窗的长度。
确定目标函数后递推得到代价函数,导丝的上边界所对应的代价函数为:
C1(i,j)=f1(i,j) j=1
其中,d1决定了i*的搜索范围,表明了导丝的连续性,计算出代价函数的值后可以得到与第一灰度图像即A大小相等的上边界的图像。
对第一灰度图像进行第二次动态规划过程获得下边界的图像的过程如下:
对于A中每个灰度值为ai,j的像素点,其目标函数为:
其中,表示像素点灰度值的平均值;w1表示平均值计算时所用到的窗的长度。
确定目标函数后递推得到代价函数,导丝的下边界所对应的代价函数为:
C2(i,j)=f1(i,j) j=1
其中,d1决定了i*的搜索范围,表明了导丝的连续性,计算出代价函数的值后可以得到与第一灰度图像即A大小相等的下边界的图像。
S33、分别对上边界的图像和下边界的图像进行回溯得到导丝的上边界和下边界。其中,通过回溯可找到全局最优路径,即导丝的上下边界,如图6(b)示出了导丝的上下边界的检测结果。
步骤S4、将上边界的图像和下边界的图像进行拟合得到血管的内壁轮廓。其中,通过内壁分割模块44将上边界的图像和下边界的图像进行拟合得到血管的内壁轮廓。经过导丝分割模块42检测出导丝的上边界和下边界后,每个OCT图像帧中导丝的位置已经确定。
参照图7,步骤S4具体包括:
S41、分别将上边界的图像和下边界的图像中位于上边界和下边界之间的区域删除得到第一图像和第二图像,其中,位于上边界和下边界之间的区域指的是被导丝遮挡的区域。
S42、将第一图像和第二图像进行拼接得到拼接后的图像。
S43、对拼接后的图像进行动态规划得到第三图像;其中,动态规划过程如下:
对于第三图像中坐标为(i,j)的像素点,其目标函数为:
其中,表示像素点灰度值的平均值;w2表示平均值计算时所用到的窗的长度。
确定目标函数后递推得到代价函数如下:
C3(i,j)=f2(i,j) i=1
其中,d2决定了j*的搜索范围,表明了血管的内壁轮廓的连续性,n2表示去除导丝所在行后θ轴方向上像素点的个数。计算出代价函数的值后便得到第三图像。
S44、对第三图像进行回溯得到第四图像,其中,通过回溯可找到全局最优路径,全局最优路径即为第四图像。
S45、将上边界所在的行及下边界所在的行插入第四图像得到内壁轮廓。这里的内壁轮廓是不包括被导丝遮挡部分的内壁轮廓,即内壁轮廓的两端是断开的,图8(a)示出了笛卡尔坐标空间下的不包括被导丝遮挡部分的内壁轮廓。
S46、将内壁轮廓的两端进行拟合得到血管的内壁轮廓。其中,拟合得到的血管的内壁轮廓包括被导丝遮挡部分的内壁轮廓即为一个完整的血管的内壁轮廓,图8(b)示出了笛卡尔坐标空间下的拟合得到的血管的内壁轮廓。
步骤S5、将血管的内壁轮廓转换为笛卡尔坐标空间的血管的内壁轮廓。通过第二坐标变换模块45将血管的内壁轮廓转换为笛卡尔坐标空间的血管的内壁轮廓。第二坐标变换模块45通过下面的式子将极坐标空间的血管的内壁轮廓变换为笛卡尔坐标空间的血管的内壁轮廓:
x=ρ×cosθ
y=ρ×sinθ
其中,x和y分别表示冠状动脉OCT图像中的像素点在笛卡尔坐标空间下的横坐标和纵坐标,θ和ρ分别表示冠状动脉OCT图像中的像素点在极坐标空间下的横坐标和纵坐标。
步骤S6、获取笛卡尔坐标空间的血管的内壁轮廓中的分叉血管,其中,通过分叉血管检测模块46获取笛卡尔坐标空间的血管的内壁轮廓中的分叉血管。
参照图9,步骤S6包括以下步骤:
S61、判断所述笛卡尔坐标空间的血管的内壁轮廓中是否存在分叉血管。
参照图10,步骤S61具体过程如下:
S611、在笛卡尔坐标中计算血管中的每个像素点到血管的内壁轮廓上的每个像素点的最短距离,将最短距离作为血管中的每个像素点的灰度值得到第二灰度图像,如图11所示;其中,将最短距离作为血管中的每个像素点的灰度值得到第二灰度图像过程如下:
设血管中的像素点的集合为B,B(i,j)表示各像素点,(i,j)为对应像素点的坐标,血管的内壁轮廓上的像素点的集合为C,C(x,y)表示各像素点,(x,y)为对应像素点的坐标,则最短距离为:
D(i,j)=min{Distance[(i,j),(x,y)],(i,j)∈B,(x,y)∈C}
其中,
该式表示坐标为(i,j)的像素点和坐标为(x,y)的像素点之间的欧式距离。
将最短距离作为对应像素点B(i,j)的灰度值即可得到第二灰度图像。
S612、将第二灰度图像中灰度值最大的像素点所在的位置作为血管的内壁轮廓的最大内切圆的圆心,将灰度值最大的像素点所对应的最短距离作为最大内切圆的半径,绘制血管的内壁轮廓的最大内切圆,如图12所示。
S613、绘制最大内切圆的同心圆,同心圆的直径为最大内切圆的直径的1~2倍,判断血管的内壁轮廓上的像素点是否全部位于同心圆所在区域,若血管的内壁轮廓上的像素点全部位于同心圆所在区域,则不存在分叉血管。由于血管的形状并不是标准的圆形,有些地方为椭圆形,其突出于最大内切圆的边缘,所以,需要绘制最大内切圆的同心圆来将这些突出于最大内切圆的边缘部分包括进来,从而避免将这些突出区域误判断为分叉血管。优选的,同心圆的直径为最大内切圆的直径的1.5倍。通过该步骤后就可以判断出血管的内壁轮廓中是否存在分叉血管。
S62、若所述血管的内壁轮廓上的像素点不全部位于所述同心圆所在区域,则存在分叉血管,检测所述分叉血管。
参照图13,步骤S62具体过程如下:
S621、计算血管的内壁轮廓上的每个像素点与最大内切圆的圆心的连线和像素点的法线之间的夹角θx,y,下标x,y表示笛卡尔坐标空间中血管的内壁轮廓上的每个像素点的坐标。图14为该过程的示意图,其中长虚箭头为血管的内壁轮廓上的每个像素点的法线,短实箭头为血管的内壁轮廓上的每个像素点与最大内切圆的圆心的连线。
S622、判断夹角θx,y是否大于角度阈值θt,若夹角θx,y大于角度阈值θt即θx,y>θt,则该像素点属于分叉血管,从而获得分叉血管的轮廓。由图14可看出,在分叉血管和主血管的交界处附近以及分叉血管两侧的点的夹角较大。通过该步骤后便可以获得分叉血管的轮廓。
步骤S7、将分叉血管的轮廓从血管的内壁轮廓中去除得到主血管的轮廓。具体的,先将分叉血管的轮廓从血管的内壁轮廓中去除,然后再将剩余未闭合的主血管的轮廓进行拟合得到完整的闭合的主血管的轮廓。其中,通过主血管分割模块47将分叉血管的轮廓从血管的内壁轮廓中去除得到主血管的轮廓,拟合采用的方法为多项式曲线拟合的方法。图15示出了拟合后的主血管的轮廓。
步骤S8、对笛卡尔坐标空间的血管的内壁轮廓进行显示。其中,通过图像输出模块48将笛卡尔坐标空间的血管的内壁轮廓输出至显示单元5进行显示。
图像输出模块48输出包含有分叉血管的横截面图像以及整个纵截面图像,并将分叉血管检测与主血管分割的结果表示出来,最后绘出各个横截面不同区域的面积曲线。
参照图16,显示单元5对图像输出模块48的输出进行显示,如图16所示,在包含有分叉血管的横截面图像中,分叉血管的内壁轮廓用实线表示,拟合后的主血管轮廓用虚线表示,同时还标出了主血管的轮廓的最大内切圆。图16的横截面图像给出了相应的分叉血管区域、主血管区域和最大内切圆三部分的面积及最大内切圆的直径。在图16的纵截面图像中,也直观的显示了分叉血管的位置及大小。图17(a)和图17(b)分别绘出了沿着回拉方向的各个横截面的不同区域的面积和直径曲线图。
在实际临床应用中,关于本实施例的基于OCT的支架植入术前的分析系统与分析方法的具体实施过程如下:
在X光造影指导下,利用根据本实施例的基于OCT的支架植入术前的分析系统对冠状动脉病变部位进行扫描成像;
利用本实施例的基于OCT的支架植入术前的分析方法对IVOCT图像进行分析,并获得分割和测量结果;
根据主血管的分割和测量结果,选择尺寸合适的支架;
根据分叉血管和主血管的分割与测量结果,确定支架植入的最优位置;
基于冠状动脉的X光造影图像,通过经皮冠状动脉介入将选择的支架植入到所确定的最优位置;
通过对球囊加压,将支架撑开到合适位置(可通过OCT影像实时观察支架贴壁情况)。
本实施例提出的基于OCT的支架植入术前的分析系统及分析方法,通过分叉血管检测模块46可以检测出分叉血管的位置以及主血管的尺寸,根据主血管的尺寸选择支架的尺寸,根据分叉血管的位置确定支架的放置位置,从而实现了分叉血管以及主血管的自动检测与分割,克服了现有技术难以合理选择支架的尺寸及确定支架放置位置的问题,有效降低了支架对分叉血管血流的影响,提高了冠状动脉介入治疗手术的成功率。
以上所述仅是本申请的具体实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本申请原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本申请的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!