一种基于DBN神经网络的MRI脑肿瘤图像分割方法与流程
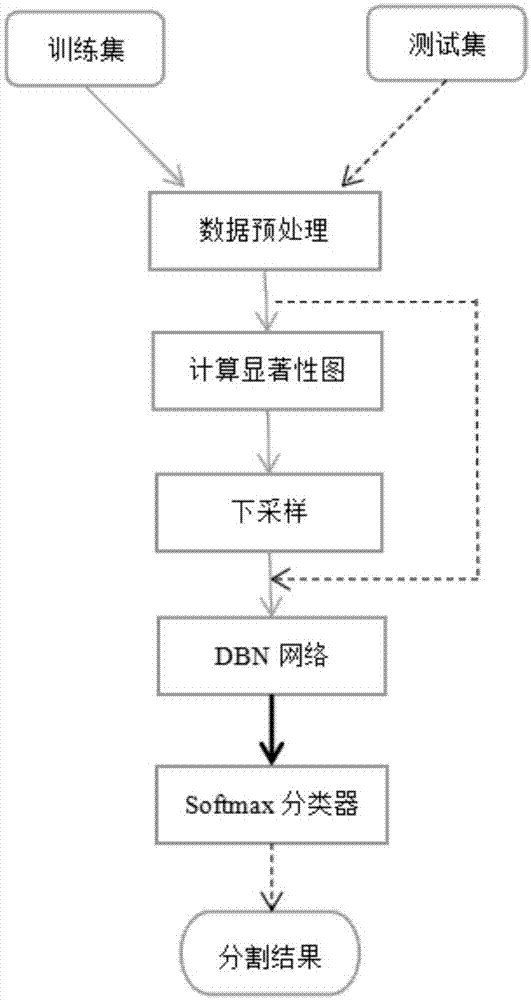
本发明属于图像处理
技术领域:
,具体涉及一种基于dbn神经网络的mri脑肿瘤图像分割方法。
背景技术:
近年来,脑部肿瘤已成为发病率和致死率最高的肿瘤之一。核磁共振成像(mri)能对大脑软组织进行高空间分辨率和高对比度成像,是医生进行脑结构分析的最佳选择,因此在临床上被广泛使用。在脑mri图像处理中,对肿瘤部分的精确分割是至关重要的一步,其对医生的后续分析和判断有着至关重要的作用。而目前,此步骤仍然严重依赖人工分割,这是非常耗时的,而且有着很强的不稳定性,因此寻找一种精确的自动化分割方法有着很高的实用价值。但是,由于脑部肿瘤形状、位置和结构的高度可变性,以及不同人、不同设备对成像的灰度分布的巨大影响,要寻求一种高精度的分割方法十分困难。目前,已有一些学者做了这方面的研究,他们大多采用传统的机器学习算法(如随机森林、马尔科夫随机场方法等),用于分割正常的脑组织(如白质和灰质)和异常的脑组织(如脑肿瘤)。然而,该类方法往往需要事先手工提取特征,因此要求设计者具备相关的专业知识,这在很多情况下是不太现实的,而且手工提取的特征具有针对性强,可拓展性差等缺点。深度学习模型的出现和发展完美的解决了这些问题。深度学习模型是指采用多层神经网络(一般指大于3层的神经网络)进行特征学习的一种层叠结构,其最初动机是模拟人脑进行学习和分析。深度学习模型较传统的机器学习算法具有更为强大的特征抽象能力,和复杂函数表达能力。其在很多任务(如语音识别、图像识别、机器翻译等)都表现出了无可比拟的优势。深度置信网络(dbn)是在玻尔兹曼机的基础上发展起来一种新型神经网络,它是一种无监督的概率生成模型,可用来拟合原始输入数据的概率分布。整个网络的训练分为两步,先通过对比散度算法无监督的逐层训练各个rbm,再通过反向传播算法有监督微调网络参数,这种训练方法可以使网络参数更接近于全局最优。实践证明,dbn在很多医学图像处理任务中都有非常不错的表现,如tuan等人将dbn与水平集结合用于心脏左心室的分割,取得了目前在该任务中最好的结果。技术实现要素:本发明所要解决的技术问题在于针对上述现有技术中的不足,提供一种基于dbn神经网络的mri脑肿瘤图像分割方法,在dbn的基础上进行改进,并应用于脑mri肿瘤的分割。本发明采用以下技术方案:一种基于dbn神经网络的mri脑肿瘤图像分割方法,先从已有的病人脑mri序列图像库中摘选出多幅作为训练样本,对其预处理并计算显著性图;然后下采样送入dbn神经网络先后进行无监督和有监督训练;训练完成后,将待分割的测试图像送入到网络进行分割,最后输出分割结果。具体的,包括以下步骤:s1、取脑mri序列图像中的n帧图像划分为训练集和测试集,并进行数据的预处理;s2、对每帧图像计算其显著性图,并对每幅显著图归一化;s3、根据显著性图对训练集样本进行下采样;s4、将步骤s3得到的训练集样本送入dbn网络进行通过对比散度法进行无监督预训练;s5、将训练集样本和其标签同时送入网络,通过adam算法微调网络参数;s6、以测试集图像中每个像素点为中心,取其9*9区域并展成81维的列向量,送入训练好的网络中进行测试,输出每个像素点的分类标签,得到分割后的二值图,图像边缘上的点通过对称填补的方式来补充其周围缺失的像素值。进一步的,步骤s1具体如下:s101、从患脑肿瘤的n个病人的脑mri序列图中选取其中肿瘤区域最大的切片,将其中t帧图像作为训练集dtrain,剩余的n-t帧作为测试集dtest;s102、对训练集和测试集的每帧图像di,1≤i≤n,通过对每幅图像进行归一化处理。4、根据权利要求3所述的一种基于dbn神经网络的mri脑肿瘤图像分割方法,其特征在于,计算如下:进一步的,步骤s2具体如下:s201、设每帧图像的第m行第n列的像素点值为求出每帧图像的均值s202、对每帧图像分别与5*5的高斯核进行卷积运算,得到每帧图像的高斯模糊图像s203、求出每帧图像的显著性图;s204、根据si得到归一化后的显著性图,表示第i帧图像的第m行第n列的像素的显著度值。更进一步的,步骤s203中每帧图像的显著性图具体如下:更进一步的,步骤s204中,归一化后的显著性图si计算如下:进一步的,步骤s3中,分别对训练集中每帧图像的每个像素点的显著度值按从大到小进行排序,以显著度最大的前h个像素点为中心在训练集图像中取9*9的正方形区域,并将其按行展为81维的列向量作为训练样本,得到t*h个训练样本,设ak表示第k个训练样本,lk表示第k个训练样本的标签,标签为0表示属于背景区域,标签为1表示属于肿瘤区域。进一步的,步骤s5具体如下:s501、训练时每次送入样本数量:batch_size=1024,设其中标记为0的样本为a(label=0),其个数为n0,标记为1的样本为a(label=1),其个数为n1,f(·)表示dbn网络的最后一层的输出;s502、求出每批次训练样本中的标签为0或1的样本的均值、样本在dbn网络最后一层输出的各特征维度上的总类内方差和样本在dbn网络最后一层输出的各特征维度的类间方差;s503、计算网络的损失函数如下:其中:sk表示第k个样本的显著度值,这里表示根据像素的显著度值分配给每个点相应的损失权重,从而促进网络对肿瘤区域的识别能力,softmax(·)表示softmax分类器函数,λ是可调节的超参数,表示散度正则项的权重,再通过adam算法最小化损失函数,不断更新网络参数直至收敛。更进一步的,步骤s502中,每批次训练样本中的标签为0或1的样本在最后一层输出的均值计算如下:其中,x∈{0,1},batch_size表示训练时每批次送入的样本数量,a(label=x)表示标记为x的样本,f(·)表示dbn网络的最后一层输出,μ(label=x)表示标记为x的样本在最后一层的特征均值;样本在dbn网络最后一层输出的各特征维度上的总类内方差δin计算如下:其中,nx表示标记为x的样本的数量;样本在dbn网络最后一层输出的各特征维度的类间方差δbetween计算如下:δbetween=(μ(label=0)-μ(label=1))2其中,μ(label=0)表示标记为0的样本在最后一层输出的均值,μ(label=1)表示标记为1的样本在最后一层输出的均值。与现有技术相比,本发明至少具有以下有益效果:本发明一种基于dbn神经网络的mri脑肿瘤图像分割方法,先从已有的病人脑mri序列图像库中摘选出多幅作为训练样本,对其预处理并计算显著性图;然后下采样送入dbn神经网络先后进行无监督和有监督训练,针对训练样本极度不平衡的情况,对非肿瘤区域进行了下采样处理,提高了阳性样本的检出率;训练完成后,即可将待分割的测试图像送入到网络进行分割,引入视觉注意模型,增强了网络对较难分割区域的分割准确率,最后输出分割结果。进一步的,采用归一化操作可以减小mri图片由于光线不均匀造成的干扰。进一步的,按显著度大小的排序对非肿瘤区域的像素进行下采样,可以在最大程度的保留非肿瘤区域的信息同时消除样本不平衡的影响,还可以起到减少训练所需的内存空间和计算量。进一步的,在网络反向传播的误差项中加入了散度正则项,增强了dbn网络提取特征的健壮性,进一步提高了网络的性能,同时,根据显著度值赋予各像素点不同的损失权重,可以使网络的“注意力”更多的集中在肿瘤区域和与其像素值相近的区域,从而提高网络对易错区域的识别能力。综上所述,本发明通过过归一化操作减少了mri图片由于光线不均匀造成的干扰,下采样操作消除了样本不平衡的影响,提高了阳性样本的检出率。同时散度正则项和视觉注意模型的引入进一步提高了网络的性能。下面通过附图和实施例,对本发明的技术方案做进一步的详细描述。附图说明图1为本发明的总流程图;图2为本发明中所使用的dbn网络结构图;图3为测试时所使用的其中一个mri切片图;图4为图3的显著性图归一化后的结果图;图5为图4的分割示意图,其中,(a)为真实标签图,(b)为本发明分割后的结果图。具体实施方式本发明提供了一种基于dbn神经网络的mri脑肿瘤图像分割方法,可用来辅助医生进行大脑肿瘤的诊断和分割。其实现过程是:先从已有的病人脑mri序列图像库中摘选出多幅作为训练样本,对其预处理并计算显著性图。然后下采样送入dbn神经网络先后进行无监督和有监督训练。训练完成后,即可将待分割的测试图像送入到网络进行分割,最后输出分割结果。本发明通过深度学习的方法提取图像特征免去了手工提取特征的繁琐和不稳定性。另外,下采样平衡样本和视觉注意机制的引入提高了像素分类的准确性,对mri脑肿瘤有较好的分割结果。请参阅图1,本发明一种基于dbn神经网络的mri脑肿瘤图像分割方法,包括以下步骤:s1、取脑mri序列图像中的n帧图像划分为训练集和测试集,并进行数据的预处理;s101、从患脑肿瘤的n个病人的脑mri序列图中选取其中肿瘤区域最大的切片,将其中t帧图像作为训练集dtrain,剩余的n-t帧作为测试集dtest。本申请实施例中,用到的训练和测试数据均来自于brats2015挑战赛的flair模态图像数据,每帧图像的分辨率均为:250*250像素;s102、对训练集和测试集的每帧图像di,1≤i≤n,通过对每幅图像进行归一化处理;计算如下:s2、对每帧图像计算其显著性图,并对每幅显著图归一化;s201、设每帧图像的第m行第n列的像素点值为求出每帧图像的均值计算如下:s202、对每帧图像分别与5*5的高斯核进行卷积运算,得到每帧图像的高斯模糊图像s203、求出每帧图像的显著性图,具体如下:s204、根据si得到归一化后的显著性图,表示第i帧图像的第m行第n列的像素的显著度值,从图5可以看出,肿瘤区域像素值与背景区域差异较大而具有较大的显著度;si计算如下:s3、根据显著性图对训练集样本进行下采样;分别对训练集中每帧图像的每个像素点的显著度值按从大到小进行排序,以显著度最大的前h个像素点为中心在训练集图像中取9*9的正方形区域,并将其按行展为81维的列向量作为训练样本。由此,会得到t*h个训练样本,设ak表示第k个训练样本,lk表示第k个训练样本的标签,标签为0表示属于背景区域,标签为1表示属于肿瘤区域;s4、将处理完成的训练集样本送入dbn网络进行无监督预训练;将步骤s3得到的训练集样本送入dbn网络进行通过对比散度法进行无监督预训练,dbn的网络结构参照图2;s5、将训练集样本和其标签同时送入网络,通过adam算法微调网络参数;s501、训练时每次送入样本数量:batch_size=1024,设其中标记为0的样本为a(label=0),其个数为n0,标记为1的样本为a(label=1),其个数为n1,f(·)表示dbn网络的最后一层的输出;s502、求出每批次训练样本中的标签为0或1的样本在最后一层输出的均值如下:其中,x∈{0,1},batch_size表示训练时每批次送入的样本数量,a(label=x)表示标记为x的样本,f(·)表示dbn网络的最后一层输出,μ(label=x)表示标记为x的样本在最后一层的特征均值;求出样本在dbn网络最后一层输出的各特征维度上的总类内方差如下:其中,nx表示标记为x的样本的数量;求出样本在dbn网络最后一层输出的各特征维度的类间方差如下:δbetween=(μ(label=0)-μ(label=1))2;其中,μ(label=0)表示标记为0的样本在最后一层输出的均值,μ(label=1)表示标记为1的样本在最后一层输出的均值。s503、计算网络的损失函数:其中:sk表示第k个样本的显著度值,这里表示根据像素的显著度值分配给每个点相应的损失权重,从而促进网络对肿瘤区域(显著度值高)的识别能力,softmax(·)表示softmax分类器函数,λ是可调节的超参数,表示散度正则项的权重,再通过adam算法最小化损失函数,不断更新网络参数直至收敛;s6、用训练好的网络模型对测试集图像进行分割。以测试集图像中每个像素点为中心,取其9*9区域并展成81维的列向量,送入训练好的网络中进行测试,输出每个像素点的分类标签,由此便得到了分割后的二值图。其中,图像边缘上的点通过对称填补的方式来补充其周围缺失的像素值。为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。通常在此处附图中的描述和所示的本发明实施例的组件可以通过各种不同的配置来布置和设计。因此,以下对在附图中提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实验内容:为了说明本发明的有效性和适应性,实验所使用的训练图像和测试图像均抽选自brats2015挑战赛数据库中不同病人flair模态下第80个切片数据。图3和图4分别展示了用于训练和测试的其中一幅图像和对应的标签图。将训练数据和测试数据按本发明的提出的方法进行预处理后送入网络进行训练和测试,测试结果的评价指标包括三项:骰子相似系数(dsc,dicesimilaritycoefficient)、灵敏度(sensitivity)、阳性预测值(ppv,positivepredictionvalue)。其中dsc的定义为:其中,vseg表示人工分割的结果,vgt表示图像的真实标签。灵敏度和阳性预测值分别定义如下:其中,tp代表本发明分割出的区域与真实标签为1的重叠区域,fp代表真是标签为0但在本发明中识别为1的像素,fn表示真实标签为1但在本发明中识别为0的像素。本发明与其他分割方法的比较如表1所示:表一本发明与brats2015挑战赛上其他分割方法的评价指标比较方法dscsensitivityppvzhao0.790.850.77festa0.720.720.77doyle0.710.870.66本发明0.730.880.70通过对比,用本发明对脑mri图像进行分割能起到较好的效果,各项指标均接近或优于其他方法,有一定的实用价值。以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1