锂二次电池用正极活性物质、锂二次电池用电极和锂二次电池的制作方法
本发明涉及一种新型的含有锂过渡金属复合氧化物的锂二次电池用正极活性物质、含有该正极活性物质的锂二次电池用电极和具备该电极的锂二次电池。
背景技术:
目前,锂离子二次电池所代表的非水电解质二次电池、特别是锂二次电池被广泛搭载于移动用终端等。这些非水电解质二次电池主要使用LiCoO2作为正极活性物质。但是,LiCoO2的放电容量为120~130mAh/g左右。
另外,作为锂二次电池用正极活性物质材料,已知有LiCoO2与其它化合物的固溶体。具有α-NaFeO2型晶体结构且作为LiCoO2、LiNiO2和LiMnO2这3种成分的固溶体的Li[Co1-2xNixMnx]O2(0<x≤1/2)在2001年已发表。作为所述固溶体的一个例子的LiNi1/2Mn1/2O2、LiCo1/3Ni1/3Mn1/3O2具有150~180mAh/g的放电容量,在充放电循环性能方面也优异。
对于如上所述的所谓“LiMeO2型”活性物质,已知有一种锂(Li)的组成比率相对于过渡金属(Me)的比率Li/Me大于1、例如Li/Me为1.25~1.6的所谓“锂过量型”活性物质(例如,参照专利文献1和2)。这样的材料可表示为Li1+αMe1-αO2(α>0)。在此,若将锂(Li)的组成比率相对于过渡金属(Me)的比率Li/Me设为β,则β=(1+α)/(1-α),例如在Li/Me为1.5时,α=0.2。
在专利文献1和2中记载有如上所述的活性物质。另外,在这些专利文献中,作为使用所述活性物质的电池的制造方法,记载了通过设置进行充电至少达到在超过4.3V(vs.Li/Li+)且4.8V以下(vs.Li/Li+)的正极电位范围中出现的电位变化较平坦的区域的制造工序,即使采用在使用时充电时的正极的最大到达电位为4.3V(vs.Li/Li+)以下或低于4.4V(vs.Li/Li+)的充电方法时,也能够制造可得到200mAh/g以上的放电容量的电池。
如此,与所谓“LiMeO2型”正极活性物质的情况不同,所谓“锂过量型”正极活性物质存在如下特征:通过至少在最初的充电中达到超过4.3V的较高的电位、特别是4.4V以上的电位地进行,可得到高放电容量。
另外,已知通过“锂过量型”正极活性物质的酸处理而预先拔出一部分Li,从而初期效率提高,并且容量、循环特性等也提高(例如,参照专利文献3~6)。
在专利文献3中记载了“一种正极活性物质的制造方法,其为由含锂氧化物得到正极活性物质的正极活性物质的制造方法,其特征在于,具备用酸性水溶液处理所述含锂氧化物的工序,所述含锂氧化物含有Li1+x(MnyM1-y)1-xO2(0<x<0.4、0<y≤1),所述M含有除锰以外的至少1种过渡金属,所述酸性水溶液中的氢离子量相对于所述含锂氧化物1mol为xmol以上且低于5xmol。”(权利要求5)的发明,作为该发明的目的,示出了“提供一种使非水电解质二次电池的优异的负荷特性和高初期充放电效率成为可能的高容量的正极活性物质和正极活性物质的制造方法”(第[0009]段)。
在专利文献4中记载了“根据权利要求1或2所述的锂离子二次电池用正极活性物质,其特征在于,将由通式(2)Li2-0.5xMn1-xM1.5xO3…(2)(式(2)中,Li表示锂,Mn表示锰,M表示NiαCoβMnγ(Ni表示镍,Co表示钴,Mn表示锰,α、β和γ满足0<α≤0.5、0≤β≤0.33、0<γ≤0.5。),x满足0<x<1.00的关系)表示、且晶体结构归属于空间群C2/m的层状过渡金属氧化物浸渍于酸性溶液而得到。”(权利要求3)的发明,作为该发明的目的,示出了“提供一种可发挥优异的初期充放电效率的锂离子二次电池用正极活性物质、使用该锂离子二次电池用正极活性物质的锂离子二次电池用正极和锂离子二次电池”(第[0008]段)。
在专利文献5中记载了“一种锂离子二次电池用正极活性物质的制造方法,其特征在于,包含如下工序:酸处理工序,使酸溶液与组成式:xLi2M1O3·(1-x)LiM2O2(M1表示以4价的锰为必需的一种以上的金属元素,M2表示1种以上的金属元素,0<x≤1,Li的一部分可以被置换成氢)所示的活性物质接触;和锂填补工序,使含有锂化合物的锂溶液与实施过酸处理的所述活性物质接触。”(权利要求1)和“根据权利要求1所述的锂离子二次电池用正极活性物质的制造方法,其中,所述酸溶液由硫酸水溶液、硝酸水溶液和硫酸铵水溶液中的任1种构成。”(权利要求2)的发明,作为该发明的课题,示出了“提供一种可通过正极活性物质的活化来抑制电池容量减小的锂离子二次电池用正极活性物质的制造方法”(第[0011]段)。
在专利文献6中记载了“一种锂二次电池正极材料用锂过渡金属系化合物粉体,其为通式(1)所示的氧化物,其特征在于,在晶体结构中具有Li空穴和氧空穴,基于JIS B 0601:2001的规定的一次粒子表面的均方根粗糙度(RMS)为1.5nm以下。xLi2MO3·(1-x)LiNO2···(1)(在此,x为满足0<x<1的数,M为平均氧化数为4+的1种以上的金属元素,N为平均氧化数为3+的1种以上的金属元素)”(权利要求1)和“根据权利要求1所述的锂二次电池正极材料用锂过渡金属系化合物粉体,其特征在于,锂过渡金属系化合物粉体由通过在pH35的溶剂中进行加热处理后,在200℃以上且900℃以下的温度下进行24小时以内热处理而得到的化合物构成。”(权利要求2)的发明,作为该发明的目的,示出了“提供一种能够提供初次的效率高、速率特性优异的锂二次电池的锂二次电池用正极材料和锂二次电池用正极与使用它们的锂二次电池”(第[0010]段)。
现有技术文献
专利文献
专利文献1:WO2012/091015
专利文献2:WO2013/084923
专利文献3:日本特开2009-004285号公报
专利文献4:日本特开2012-185913号公报
专利文献5:日本特开2012-195082号公报
专利文献6:日本特开2012-234772号公报
技术实现要素:
近年来,对电动汽车、混合动力汽车、插电式混合动力汽车这样的汽车领域中所使用的锂二次电池要求不仅放电容量大、而且初期效率和高速率放电性能优异的正极活性物质。
本发明是鉴于上述课题而完成的,其课题在于提供一种初期效率和高速率放电性能优异的锂二次电池用正极活性物质和使用该正极活性物质的锂二次电池。
本发明为一种锂二次电池用正极活性物质,其为含有锂过渡金属复合氧化物的锂二次电池用正极活性物质,所述锂过渡金属复合氧化物具有α-NaFeO2结构,过渡金属(Me)含有Co、Ni和Mn,锂(Li)相对于所述过渡金属的摩尔比Li/Me大于1.2且小于1.6,在根据使用氮气吸附法的吸附等温线并以BJH法求得的微分细孔容积显示最大值的细孔直径在至60nm为止的范围内的细孔区域中具有0.055cc/g以上且0.08cc/g以下的细孔容积,在1000℃下显示归属于空间群R3-m的单一相。
根据本发明,可提供一种能够制成初期效率和高速率放电性能优异的锂二次电池的正极活性物质。另外,可提供一种使用该正极活性物质的锂二次电池。
附图说明
图1为表示本发明的锂二次电池的一实施方式的外观立体图。
图2为表示将本发明的锂二次电池多个集合而成的蓄电装置的示意图。
具体实施方式
已知上述的所谓“锂过量型”活性物质的放电容量虽然一般比所谓“LiMeO2型”活性物质大,但初期效率低、高速率放电性能差。其中,对于初期效率,公知的是如专利文献3~5中所记载那样通过对活性物质进行酸处理而提高。近年来,对电动汽车、混合动力汽车、插电式混合动力汽车这样的汽车领域中所使用的锂二次电池要求不仅放电容量大、而且初期效率和高速率放电性能优异的正极活性物质。需要说明的是,虽然在专利文献6中记载了使初期效率和高速率放电性能提高的情况,但未记载进行酸处理的情况。
本发明是鉴于上述课题而完成的,其课题在于提供一种初期效率和高速率放电性能优异的锂二次电池用正极活性物质和使用该正极活性物质的锂二次电池。
在本发明中,为了解决上述课题,采用以下的方案。
(1)一种锂二次电池用正极活性物质,其为含有锂过渡金属复合氧化物的锂二次电池用正极活性物质,所述锂过渡金属复合氧化物具有α-NaFeO2结构,过渡金属(Me)含有Co、Ni和Mn,锂(Li)相对于所述过渡金属的摩尔比Li/Me大于1.2且小于1.6,在根据使用氮气吸附法的吸附等温线并以BJH法求得的微分细孔容积显示最大值的细孔直径在至60nm为止的范围内的细孔区域中具有0.055cc/g以上且0.08cc/g以下的细孔容积,在1000℃下显示归属于空间群R3-m的单一相。
(2)根据上述(1)所述的锂二次电池用正极活性物质,其中,所述锂过渡金属复合氧化物在X射线衍射测定中归属于(003)面的衍射峰的半峰宽在0.202°~0.265°的范围内。
(3)根据上述(1)或(2)所述的锂二次电池用正极活性物质,其中,Mn相对于所述过渡金属元素Me的摩尔比Mn/Me为0.5以上。
(4)根据上述(1)或(2)所述的锂二次电池用正极活性物质,其中,Mn相对于所述过渡金属元素Me的摩尔比Mn/Me为0.5以上且0.75以下。
(5)根据上述(1)~(4)中任一项所述的锂二次电池用正极活性物质,其中,Co相对于所述过渡金属元素Me的摩尔比Co/Me为0.05以上且0.40以下。
(6)根据上述(1)~(4)中任一项所述的锂二次电池用正极活性物质,其中,Co相对于所述过渡金属元素Me的摩尔比Co/Me为0.10以上且0.30以下。
(7)一种锂二次电池用电极,其含有上述(1)~(6)中任一项所述的锂二次电池用正极活性物质。
(8)一种锂二次电池,其具备上述(7)所述的锂二次电池用电极。
(9)一种上述(1)~(6)中任一项所述的锂二次电池用正极活性物质的制造方法,经由如下工序制作所述锂过渡金属复合氧化物:前体制作工序,制作含有Co、Ni和Mn作为过渡金属元素的前体;烧成工序,混合所述前体和Li盐在800℃以上的温度下进行热处理而制作氧化物;和酸处理工序,对所述氧化物进行酸处理。
(10)根据上述(9)所述的锂二次电池用正极活性物质的制造方法,其中,所述前体为碳酸盐化合物。
(11)根据上述(9)所述的锂二次电池用正极活性物质的制造方法,其中,所述前体制作工序包含从含有Co、Ni和Mn的pH7.5~11的水溶液中使碳酸盐共沉淀的工序。
(12)根据上述(10)或(11)所述的锂二次电池用正极活性物质的制造方法,其中,所述烧成工序在800℃以上且900℃以下的温度下进行热处理。
(13)根据上述(9)~(12)中任一项所述的锂二次电池用正极活性物质的制造方法,其中,所述酸处理工序使用硫酸。
本发明人等发现,通过将由碳酸盐前体制作的“锂过量型”活性物质(锂过渡金属复合氧化物)在适当的条件下进行化学处理(硫酸处理),初期效率以及高速率放电性能两者的特性提高,完成了本发明。上述效果可通过酸处理后的锂过渡金属复合氧化物的热稳定性、多孔性和结晶性这样的因素识别。具体而言,通过如上述(1)和(2)那样特定锂过渡金属复合氧化物的Li/Me比、半峰宽、细孔容积并确认在1000℃下进行热处理时的晶体结构维持,可得到发挥上述效果的物质。
作为可得到上述效果的技术因素,认为是因为影响活性物质中的锂离子的插入·脱离的结晶的牢固性、基于多孔度(细孔容积)的电解液的扩散得到改善。
从可得到高放电容量的方面考虑,本发明的锂二次电池用活性物质所含有的锂过渡金属复合氧化物的组成为过渡金属(Me)含有Co、Ni和Mn且锂(Li)相对于上述过渡金属的摩尔比Li/Me大于1.2的、作为典型例可以表示为Li1+αMe1-αO2((1+α)/(1-α)>1.2)的所谓“锂过量型”的组成。
在本发明中,为了得到初期效率和高速率放电性能优异的锂二次电池,优选Li相对于过渡金属元素Me的摩尔比Li/Me大于1.2且小于1.6、即在组成式Li1+αMe1-αO2中使1.2<(1+α)/(1-α)<1.6。其中,从可得到放电容量特别大、初期效率和高速率放电性能优异的锂二次电池这样的观点考虑,优选选择上述Li/Me为1.25~1.5的组成。需要说明的是,在本发明中,摩尔比Li/Me是酸处理后的比值,酸处理前的起始物质比其稍高。
在本发明中,为了提高锂二次电池的初期效率和高速率放电性能,Co相对于过渡金属元素Me的摩尔比Co/Me优选设为0.05~0.40,更优选设为0.10~0.30。
另外,为了提高锂二次电池的初期效率和高速率放电性能,Mn相对于过渡金属元素Me的摩尔比Mn/Me优选设为0.5以上。在所谓“LiMeO2型”活性物质中,使摩尔比Mn/Me为0.5以上时,若进行充电,则引起向尖晶石型的结构变化,成为不具有归属于α-NaFeO2结构的结构的物质,作为锂二次电池用活性物质存在问题,与此相对,在“锂过量型”活性物质中,即使使摩尔比Mn/Me为0.5以上进行充电时,也可维持α-NaFeO2结构,因此,摩尔比Mn/Me为0.5以上这样的构成表征所谓“锂过量型”活性物质。摩尔比Mn/Me更优选设为0.5~0.75。
本发明的锂过渡金属复合氧化物由通式Li1+α(CoaNibMnc)1-αO2表示,其中,1.2<(1+α)/(1-α)<1.6,a+b+c=1,a>0、b>0、c>0,本质上为由Li、Co、Ni和Mn构成的复合氧化物,但为了提高放电容量,优选含有1000ppm以上的Na。Na的含量更优选2000~10000ppm。
为了含有Na,可以采用在后述的制作碳酸盐前体的工序中使用碳酸钠等钠化合物作为中和剂并在清洗工序中使Na残留或者在之后的烧成工序中添加碳酸钠等钠化合物的方法。
另外,并不排除在不损害本发明的效果的范围含有Na以外的碱金属、Mg、Ca等碱土金属、Fe、Zn等3d过渡金属所代表的过渡金属等少量的其它金属。
本发明的锂过渡金属复合氧化物具有α-NaFeO2结构。合成后(进行充放电前)的上述锂过渡金属复合氧化物归属于空间群P3112或者R3-m。其中,对于归属于空间群P3112的锂过渡金属复合氧化物,在使用了CuKα灯管的X射线衍射图上,在2θ=21°附近确认到超晶格峰(Li[Li1/3Mn2/3]O2型的单斜晶中看见的峰)。但是,仅进行一次充电,若结晶中的Li脱离,则结晶的对称性发生变化,由此上述超晶格峰消失,上述锂过渡金属复合氧化物变为归属于空间群R3-m。在此,P3112为将R3-m中的3a、3b、6c位点的原子位置细分化而得到的晶体结构模型,在R3-m中的原子配置确认到秩序性时,采用该P3112模型。需要说明的是,“R3-m”原本应该在“R3m”的“3”上加杠“-”来表示。
本发明的锂过渡金属复合氧化物将以X射线衍射图案为基础并将空间群R3-m用于晶体结构模型时归属于(003)面的衍射峰的半峰宽设在0.202°~0.265°的范围内。通过这样操作,可提高正极活性物质的初期效率和高速率放电性能。需要说明的是,X射线衍射图上存在于2θ=18°±1°的衍射峰被指数化为空间群P3112和R3-m中米勒指数hkl中的(003)面。
另外,本发明的锂过渡金属复合氧化物在1000℃下显示归属于空间群R3-m的单一相。这意味着本发明的锂过渡金属复合氧化物即使在1000℃下进行热处理,晶体结构也不会发生变化。并不意味着如由后述的实施例所理解的那样经由在1000℃下进行热处理的工序得到本发明的锂过渡金属复合氧化物。在实施例中记载的制造条件下将烧成温度设为950℃以上时,可根据比较例6、7理解到无法得到本发明的锂过渡金属复合氧化物。该本发明的特征可通过在1000℃下进行热处理时作为X射线衍射图上归属于空间群R3-m的单一相(α-NaFeO2结构)被观察到而确认。确认方法的详细情况如后述的实施例中详细地记载那样,将正极活性物质1g载置于氧化铝制舟皿,用电炉在空气气氛中、常压下经3小时20分钟从常温升温至1000℃,在1000℃下保持10分钟。然后,返回至常温,使用X射线衍射装置进行粉末X射线衍射测定。射线源设为CuKα,加速电压和电流分别设为30kV和15mA。取样宽度设为0.01deg、扫描时间设为14分钟(扫描速度为5.0)、发散狭缝宽度设为0.625deg、受光狭缝宽度开放、散射狭缝设为8.0mm。对得到的X射线衍射数据绘制以最强峰为满刻度(full scale)的X射线衍射图,将未观测到起因于LiMn2O4的衍射峰的情况判断为“在1000℃下显示归属于空间群R3-m的单一相”。
由此,可得到高速率放电性能优异的锂二次电池。
进而,锂过渡金属复合氧化物优选以X射线衍射图案为基础并由基于里德伯尔德(Rietveld)法的晶体结构分析求出的氧位置参数在放电末为0.262以下,在充电末为0.267以上。由此,可得到高速率放电性能优异的锂二次电池。需要说明的是,氧位置参数是指对于归属于空间群R3-m的锂过渡金属复合氧化物的α-NaFeO2型晶体结构,将Me(过渡金属)的空间坐标定义为(0,0,0)、将Li(锂)的空间坐标定义为(0,0,1/2)、将O(氧)的空间坐标定义为(0,0,z)时的z的值。
即,氧位置参数为表示O(氧)位置从Me(过渡金属)位置偏离多少的相对指标(参照专利文献1和2)。
本发明的锂过渡金属复合氧化物和其碳酸盐前体优选粒度分布测定中的50%粒径(D50)为5~18μm。由氢氧化物前体制作锂过渡金属复合氧化物时,若不能控制为更小粒径,则无法得到优异的性能,但通过由碳酸盐前体制作,即使粒度分布测定中的50%粒径(D50)为5~18μm左右,也可得到放电容量大的正极活性物质。
为了得到初期效率、高速率放电性能优异的锂二次电池,本发明的正极活性物质的BET比表面积优选1m2/g以上,更优选2~7m2/g。
另外,为了得到高速率放电性能优异的锂二次电池,振实密度优选1.25g/cc以上,更优选1.7g/cc以上。
本发明的锂过渡金属复合氧化物在根据使用氮气吸附法的吸附等温线并以BJH法求得的微分细孔容积显示最大值的细孔直径在至60nm为止的范围内的细孔区域(至60nm为止的细孔区域)为0.055cc/g以上的细孔容积。由此,可得到初期效率和高速率放电性能优异的锂二次电池。另外,通过使上述细孔容积为0.08cc/g以下,可得到高速率放电性能特别优异的锂二次电池,因此,上述细孔容积优选为0.055~0.08cc/g。
接着,对制造本发明的锂二次电池用活性物质的方法进行说明。
本发明的锂二次电池用活性物质基本上可通过制备如目标活性物质(氧化物)的组成那样含有构成活性物质的金属元素(Li、Mn、Co、Ni)的原料并将其烧成而得到。但是,对于Li原料的量,估计在烧成中Li原料的一部分会消失,因此优选过量地添加1~5%左右。
在制作目标组成的氧化物时,已知有将Li、Co、Ni、Mn各自的盐混合并烧成的所谓“固相法”,预先制作使Co、Ni、Mn存在于一个粒子中的共沉淀前体并向其中混合Li盐并烧成的“共沉淀法”。在利用“固相法”的合成过程中,特别是由于Mn难以在Co、Ni中均匀地固溶,因此,难以得到各元素均匀地分布于一个粒子中的试样。迄今为止在文献等中进行了很多要通过固相法使Mn固溶于Ni、Co的一部分这样的尝试(LiNi1-xMnxO2等),但选择“共沉淀法”更容易以原子水平得到均匀相。因此,在后述的实施例中,采用“共沉淀法”。
在制作共沉淀前体时,由于Co、Ni、Mn中Mn容易被氧化,不容易制作Co、Ni、Mn以2价的状态均匀地分布的共沉淀前体,因此,Co、Ni、Mn的原子水平下的均匀的混合容易变得不充分。特别是在本发明的组成范围中,由于Mn比率比Co、Ni比率高,因此,除去水溶液中的溶解氧特别重要。作为除去溶解氧的方法,可以举出鼓泡不含氧的气体的方法。作为不含氧的气体,没有限定,可以使用氮气、氩气、二氧化碳(CO2)等。其中,如后述的实施例那样制作共沉淀碳酸盐前体时,若采用二氧化碳作为不含氧的气体,则可提供更容易生成碳酸盐的环境,故优选。
在溶液中使含有Co、Ni和Mn的化合物共沉淀而制作前体的工序中的pH没有限定,在要将上述共沉淀前体制成共沉淀碳酸盐前体时,可以设为7.5~11。为了增大振实密度,优选控制pH。通过使pH为9.4以下,可以使振实密度为1.25g/cc以上,可提高高速率放电性能。进而,通过使pH为8.0以下,可促进粒子生长速度,因此,可缩短原料水溶液滴加结束后的搅拌持续时间。
上述共沉淀前体优选为均匀地混合有Mn、Ni和Co的化合物。在本发明中,为了得到放电容量大的锂二次电池用活性物质,优选将共沉淀前体设为碳酸盐。另外,也可通过使用利用络合剂的晶析反应等,制作体积密度更大的前体。此时,通过与Li源混合并烧成,可得到更高密度的活性物质,因此,可提高单位电极面积的能量密度。
对上述共沉淀前体的原料而言,作为Mn化合物,可以举出氧化锰、碳酸锰、硫酸锰、硝酸锰、乙酸锰等作为一个例子,作为Ni化合物,可以举出氢氧化镍、碳酸镍、硫酸镍、硝酸镍、乙酸镍等作为一个例子,作为Co化合物,可以举出硫酸钴、硝酸钴、乙酸钴等作为一个例子。
在本发明中,采用在保持碱性的反应槽中滴加供给上述共沉淀前体的原料水溶液而得到共沉淀碳酸盐前体的反应晶析法。在此,作为中和剂,可使用锂化合物、钠化合物、钾化合物等,但优选使用碳酸钠、碳酸钠与碳酸锂、或碳酸钠与碳酸钾的混合物。为了使Na残留1000ppm以上,优选使碳酸钠与碳酸锂的摩尔比即Na/Li或者使碳酸钠与碳酸钾的摩尔比即Na/K为1/1[M]以上。通过使Na/Li或Na/K为1/1[M]以上,可减少在接下来的清洗工序中Na被过度除去而低于1000ppm的担心。
上述原料水溶液的滴加速度大幅影响生成的共沉淀前体的1个粒子内的元素分布的均匀性。特别是Mn不易与Co、Ni形成均匀的元素分布,因此,需要注意。对于优选的滴加速度,也受反应槽的大小、搅拌条件、pH、反应温度等影响,但优选30ml/min以下。为了提高放电容量,滴加速度更优选10ml/min以下,最优选5ml/min以下。
另外,在反应槽内存在络合剂且应用一定的对流条件时,通过在上述原料水溶液滴加结束后进一步继续搅拌,促进粒子的自转和搅拌槽内的公转,在该过程中,粒子彼此碰撞,同时使粒子阶段性地生长为同心圆球状。即,共沉淀前体经由将原料水溶液滴加到反应槽内时的金属络合物形成反应和上述金属络合物在反应槽内的滞留中产生的沉淀形成反应这样的2阶段的反应而形成。因此,通过适当选择上述原料水溶液滴加结束后进一步继续搅拌的时间,可得到具备目标粒径的共沉淀前体。
对于原料水溶液滴加结束后的优选的搅拌持续时间,也受反应槽的大小、搅拌条件、pH、反应温度等影响,但为了使粒子生长为均匀的球状粒子,优选0.5h以上,更优选1h以上。另外,为了减少因粒径变得过大而导致电池的低SOC区域中的输出性能不充分的担心,优选30h以下,更优选25h以下,最优选20h以下。
另外,用于使碳酸盐前体和锂过渡金属复合氧化物的二次粒子的粒度分布中的累积体积为50%的粒径即D50为5~18μm的优选的搅拌持续时间根据控制的pH而不同。例如,在将pH控制为7.5~8.2时,搅拌持续时间优选1~15h,在将pH控制为8.3~9.4时,搅拌持续时间优选3~20h。
在使用碳酸钠等钠化合物作为中和剂制作碳酸盐前体的粒子时,在之后的清洗工序中将附着于粒子的钠离子清洗除去,但在本发明中,优选在Na残留1000ppm以上这样的条件下进行清洗除去。例如,可以采用在对制作的碳酸盐前体进行抽滤并取出时,将利用离子交换水200ml的清洗次数设为5次这样的条件。
碳酸盐前体优选在80℃~低于100℃下在空气气氛中于常压下进行干燥。通过在100℃以上进行干燥,可在短时间内除去更多的水分,但通过在80℃下经长时间进行干燥,可制成显示更优异的电极特性的活性物质。其理由未必明确,但由于碳酸盐前体是比表面积为50~100m2/g的多孔体,因此,成为容易吸附水分的结构。因此,发明人推测可能是因为以下原因:通过在低的温度下进行干燥,使前体的状态成为在细孔中残留一定程度的吸附水的状态,此时,在与Li盐混合并烧成的烧成工序中可以以替换从细孔中除去的吸附水的方式在该细孔中进入熔融的Li,由此,与在100℃下进行干燥的情况相比,可得到更均匀的组成的活性物质。需要说明的是,在100℃下进行干燥而得到的碳酸盐前体呈黑褐色,但80℃下进行干燥而得到的碳酸盐前体呈肉色,因此,可根据前体的颜色来区别。
因此,为了定量地评价上述得知的前体的差异,测定各自的前体的色相,并与依据JIS Z 8721的日本涂料工业会发行的涂料用标准色(JPMA Standard Paint Colors)2011年度F版比较。色相的测定使用Konica Minolta公司制Color Leader CR10。根据该测定方法,对于表示亮度的dL*的值,越白该值越大,越黑该值越小。另外,对于表示色相的da*的值,红色越强该值越大,绿色越强(红色弱)该值越小。另外,对于表示色相的db*的值,黄色越强该值越大,蓝色越强(黄色弱)该值越大。
可知100℃干燥品的色相与标准色F05-20B相比,处于在红色方向到达标准色F05-40D的范围内,另外,与标准色FN-10相比,处于在白色方向到达标准色FN-25的范围内。其中,确认到与标准色F05-20B呈现的色相的色差最小。
另一方面,可知80℃干燥品的色相与标准色F19-50F相比,处于在白色方向到达标准色F19-70F的范围内,另外,与标准色F09-80D相比,处于在黑色方向到达标准色F09-60H的范围内。其中,确认到与标准色F19-50F呈现的色相的色差最小。
根据以上的见解,碳酸盐前体的色相优选与标准色F05-20B相比,dL、da和db均为+方向,更优选dL为+5以上、da为+2以上、db为+5以上。
本发明的锂二次电池用活性物质可以通过将上述碳酸盐前体与Li化合物混合后进行热处理而适当地制作。作为Li化合物,可以通过使用氢氧化锂、碳酸锂、硝酸锂、乙酸锂等而适当地制造。但是,对于Li化合物的量,估计在烧成中Li化合物的一部分消失,因此,优选过量地添加1~5%左右。
在本发明中,为了使锂过渡金属复合氧化物中的Na的含量为1000ppm以上,即使碳酸盐前体中所含的Na为1000ppm以下,也可以通过在烧成工序中将Li化合物以及Na化合物与上述碳酸盐前体混合而使活性物质中所含的Na量为1000ppm以上。作为Na化合物,优选碳酸钠。
烧成温度影响活性物质的可逆容量。
若烧成温度过高,则得到的活性物质伴随氧释放反应而崩塌,并且主相的六方晶以及单斜晶的Li[Li1/3Mn2/3]O2型所规定的相不会成为固溶相,存在分相而被观察到的倾向。若含量大量这样的分相,则导致活性物质的可逆容量减少,故不优选。在这样的材料中,在X射线衍射图上35°附近和45°附近观察到杂质峰。因此,烧成温度优选低于影响活性物质的氧释放反应的温度。在本发明的组成范围中,活性物质的氧释放温度大致为1000℃以上,但根据活性物质的组成,氧释放温度存在若干差异,因此,优选预先确认活性物质的氧释放温度。特别是试样中所含的Co量越多,则确认到前体的氧释放温度越向低温侧移动,因此,需要注意。作为确认活性物质的氧释放温度的方法,为了模拟烧成反应过程,可以将共沉淀前体与锂化合物混合而成的混合物供于热重量分析(DTA-TG测定),但在该方法中,测定设备的试样室中使用的铂被挥发的Li成分腐蚀而有可能损伤设备,因此可以将预先采用500℃左右的烧成温度进行一定程度结晶化的组成物供于热重量分析。
另一方面,若烧成温度过低,则存在结晶化不充分进行、电极特性降低的倾向。在本发明中,烧成温度优选至少设为800℃以上。通过使其充分结晶化,可减轻晶界的阻力,促进顺利的锂离子输送。
另外,发明人等对本发明活性物质的衍射峰的半峰宽进行了详细分析,由此确认了在至750℃为止的温度下合成的试样中晶格内存留应变,通过在其以上的温度下进行合成,可大体上除去应变。另外,微晶的尺寸与合成温度上升成比例地增大。因此,在本发明活性物质的组成中,也可通过使体系内几乎没有晶格的应变且尽可能实现微晶尺寸充分生长的粒子而得到良好的放电容量。具体而言,可知优选采用影响晶格常数的应变量为2%以下且微晶尺寸生长至50nm以上这样的合成温度(烧成温度)和Li/Me比组成。
虽然通过将它们成型为电极进行充放电也发现因膨胀收缩所致的变化,但从可得到即使在充放电过程中微晶尺寸也保持在30nm以上的效果来看,是优选的。
如上所述,烧成温度与活性物质的氧释放温度有关,但即使未达到从活性物质中释放氧的烧成温度,若超过900℃,则也会发现因一次粒子大幅生长所致的结晶化现象。其可通过用扫描型电子显微镜(SEM)观察烧成后的活性物质来确认。经由超过900℃的合成温度而合成的活性物质的一次粒子生长至0.5μm以上,成为对在充放电反应中的活性物质中的Li+迁移不利的状态,高速率放电性能降低。一次粒子的大小优选低于0.5μm,更优选为0.3μm以下。另外,在超过900℃的合成温度下,活性物质的细孔容积在至60nm为止的细孔区域中低于0.055cc/g,初期效率、高速率放电性能降低。
因此,为了提高初期效率、高速率放电性能,在将1.2<摩尔比Li/Me<1.6的本发明的锂过渡金属复合氧化物作为正极活性物质时,烧成温度优选设为800~900℃。
在本发明中,对如上制作的锂过渡金属复合氧化物进行酸处理。通过进行酸处理,与未进行酸处理的情况相比,初期效率和高速率放电性能两者提高。作为酸,优选硫酸。在利用硝酸等酸的处理中,酸处理前的晶体结构崩塌,有时高速率放电性能降低。利用硫酸的酸处理时间优选30秒~60秒。若进行180秒以上的酸处理,则虽然初期效率提高,但有可能无法维持酸处理前的晶体结构,高速率放电性能降低。另外,在通过硫酸实施了酸处理的锂过渡金属复合氧化物中残留有源自硫酸的硫(S)。
作为负极材料,没有限定,只要为可放出或者吸藏锂离子的形态的负极材料,则可以选择任意负极材料。例如可以举出:以Li[Li1/3Ti5/3]O4为代表的具有尖晶石型晶体结构的钛酸锂等钛系材料,Si、Sb、Sn系等的合金系材料锂金属,锂合金(锂-硅、锂-铝、锂-铅、锂-锡、锂-铝-锡、锂-镓和伍德合金等含锂金属合金),锂复合氧化物(锂-钛),氧化硅以及可吸藏·放出锂的合金,碳材料(例如石墨、硬碳、低温烧成碳、非晶碳等)等。
正极活性物质的粉体和负极材料的粉体优选平均粒子尺寸为100μm以下。出于提高非水电解质电池的高输出特性的目的,特别优选正极活性物质的粉体为10μm以下。为了以规定的形状得到粉体,可使用粉碎机、分级机。例如可使用乳钵、球磨机、砂磨机、振动球磨机、行星式球磨机、喷射磨、逆喷射磨、旋转气流型喷射磨、筛子等。在粉碎时也可使用使水或者己烷等有机溶剂共存的湿式粉碎。作为分级方法,没有特别限定,筛子、风力分级机等、干式、湿式均可根据需要使用。
以上,对作为正极和负极的主要构成成分的正极活性物质和负极材料进行了详述,但在上述正极和负极中,除上述主要构成成分以外,也可以含有导电剂、粘结剂、增稠剂、填料等作为其它构成成分。
作为导电剂,只要为不会对电池性能造成不良影响的电子传导性材料就没有限定,但通常可含有1种如下物质或以如下物质的混合物的形式含有:天然石墨(鳞状石墨、鳞片状石墨、土状石墨等)、人造石墨、炭黑、乙炔黑、科琴黑、碳晶须、碳纤维、金属(铜、镍、铝、银、金等)粉、金属纤维、导电性陶瓷材料等导电性材料。
其中,作为导电剂,从电子传导性和涂敷性的观点考虑,优选乙炔黑。导电剂的添加量优选相对于正极或负极的总重量为0.1重量%~50重量%,特别优选0.5重量%~30重量%。特别是若将乙炔黑粉碎成0.1~0.5μm的超微粒而使用,则可削减所需碳量,故优选。这些混合方法为物理性混合,其理想之处为均匀混合。
因此,可以用V型混合机、S型混合机、擂溃机、球磨机、行星式球磨机之类的粉体混合机以干式或者湿式进行混合。
作为上述粘结剂,通常可使用1种如下物质或以2种以上的混合物的形式使用如下物质:聚四氟乙烯(PTFE)、聚偏氟乙烯(PVDF)、聚乙烯、聚丙烯等热塑性树脂、乙烯-丙烯-二烯三聚物(EPDM)、磺化EPDM、苯乙烯丁二烯橡胶(SBR)、氟橡胶等具有橡胶弹性的聚合物。粘结剂的添加量优选相对于正极或负极的总重量为1~50重量%,特别优选2~30重量%。
作为填料,只要为不对电池性能造成不良影响的材料,则任何材料均可。通常可使用聚丙烯、聚乙烯等烯烃系聚合物、无定形二氧化硅、氧化铝、沸石、玻璃、碳等。填料的添加量优选相对于正极或负极的总重量为30重量%以下。
正极和负极可通过如下操作而适当地制作:将上述主要构成成分(正极中为正极活性物质,负极中为负极材料)和其它材料混炼而制成合剂,在混合到N-甲基吡咯烷酮、甲苯等有机溶剂或水中后,将得到的混合液涂布或压接在铝箔等集电体上并在50℃~250℃左右的温度下进行2小时左右加热处理。对于上述涂布方法,例如优选使用涂料辊等辊涂、丝网涂布、刮刀方式、旋涂、棒涂等方式涂布为任意的厚度和任意的形状,但并不限定于这些。
本发明的锂二次电池中使用的非水电解质没有限定,可使用一般提出在锂电池等中使用的非水电解质。作为非水电解质中使用的非水溶剂,可以举出:碳酸亚丙酯、碳酸亚乙酯、碳酸亚丁酯、氯代碳酸亚乙酯、碳酸亚乙烯酯等环状碳酸酯类;γ-丁内酯、γ-戊内酯等环状酯类;碳酸二甲酯、碳酸二乙酯、碳酸甲乙酯等链状碳酸酯类;甲酸甲酯、乙酸甲酯、丁酸甲酯等链状酯类;四氢呋喃或其衍生物;1,3-二烷、1,4-二烷、1,2-二甲氧基乙烷、1,4-二丁氧基乙烷、甲基二甘醇二甲醚等醚类;乙腈、苯甲腈等腈类;二氧戊环或其衍生物;环硫乙烷、环丁砜、磺内酯或其衍生物等单独或它们2种以上的混合物等,但并不限定于这些。
作为非水电解质中使用的电解质盐,例如可以举出:LiClO4、LiBF4、LiAsF6、LiPF6、LiSCN、LiBr、LiI、Li2SO4、Li2B10Cl10、NaClO4、NaI、NaSCN、NaBr、KClO4、KSCN等含有锂(Li)、钠(Na)或钾(K)中的1种的无机离子盐、LiCF3SO3、LiN(CF3SO2)2、LiN(C2F5SO2)2、LiN(CF3SO2)(C4F9SO2)、LiC(CF3SO2)3、LiC(C2F5SO2)3、(CH3)4NBF4、(CH3)4NBr、(C2H5)4NClO4、(C2H5)4NI、(C3H7)4NBr、(n-C4H9)4NClO4、(n-C4H9)4NI、(C2H5)4N-马来酸盐、(C2H5)4N-苯甲酸盐、(C2H5)4N-邻苯二甲酸盐、硬脂基磺酸锂、辛基磺酸锂、十二烷基苯磺酸锂等有机离子盐等,可以单独或者混合2种以上地使用这些离子性化合物。
进而,通过混合使用LiPF6或LiBF4与LiN(C2F5SO2)2这样的具有全氟烷基的锂盐,可进一步降低电解质的粘度,因此,可进一步提高低温特性,另外,可抑制自放电,故更优选。
另外,作为非水电解质,也可以使用常温熔融盐、离子液体。
作为非水电解质中的电解质盐的浓度,为了可靠地得到具有高电池特性的非水电解质电池,优选0.1mol/l~5mol/l,进一步优选为0.5mol/l~2.5mol/l。
作为间隔件,优选单独或者并用显示优异的高速率放电性能的多孔膜、无纺布等。作为构成非水电解质电池用间隔件的材料,例如可以举出:以聚乙烯、聚丙烯等为代表的聚烯烃系树脂、以聚对苯二甲酸乙二醇酯、聚对苯二甲酸丁二醇酯等为代表的聚酯系树脂、聚偏氟乙烯、偏氟乙烯-六氟丙烯共聚物、偏氟乙烯-全氟乙烯基醚共聚物、偏氟乙烯-四氟乙烯共聚物、偏氟乙烯-三氟乙烯共聚物、偏氟乙烯-氟乙烯共聚物、偏氟乙烯-六氟丙酮共聚物、偏氟乙烯-乙烯共聚物、偏氟乙烯-丙烯共聚物、偏氟乙烯-三氟丙烯共聚物、偏氟乙烯-四氟乙烯-六氟丙烯共聚物、偏氟乙烯-乙烯-四氟乙烯共聚物等。
从强度的观点考虑,间隔件的空孔率优选98体积%以下。另外,从充放电特性的观点考虑,空孔率优选20体积%以上。
另外,间隔件也可以使用例如由丙烯腈、环氧乙烷、环氧丙烷、甲基丙烯酸甲酯、乙酸乙烯酯、乙烯基吡咯烷酮、聚偏氟乙烯等聚合物和电解质构成的聚合物凝胶。若如上以凝胶状态使用非水电解质,则从具有防止漏液的效果的方面考虑优选。
进而,若间隔件将如上所述的多孔膜、无纺布等与聚合物凝胶联合使用,则电解质的保液性提高,故优选。即,通过形成在聚乙烯微孔膜的表面和微孔壁面被覆有厚度数μm以下的亲溶剂性聚合物的膜而使电解质保持于上述膜的微孔内,从而上述亲溶剂性聚合物凝胶化。
作为上述亲溶剂性聚合物,除聚偏氟乙烯以外,还可以举出:具有环氧乙烷基、酯基等的丙烯酸酯单体、环氧单体、具有异氰酸酯基的单体等交联而成的聚合物等。该单体可并用自由基引发剂并使用加热、紫外线(UV)或使用电子束(EB)等活性光线等进行交联反应。
作为其它的电池构成要素,有端子、绝缘板、电池盒等,但这些部件可以直接使用现有使用的部件。
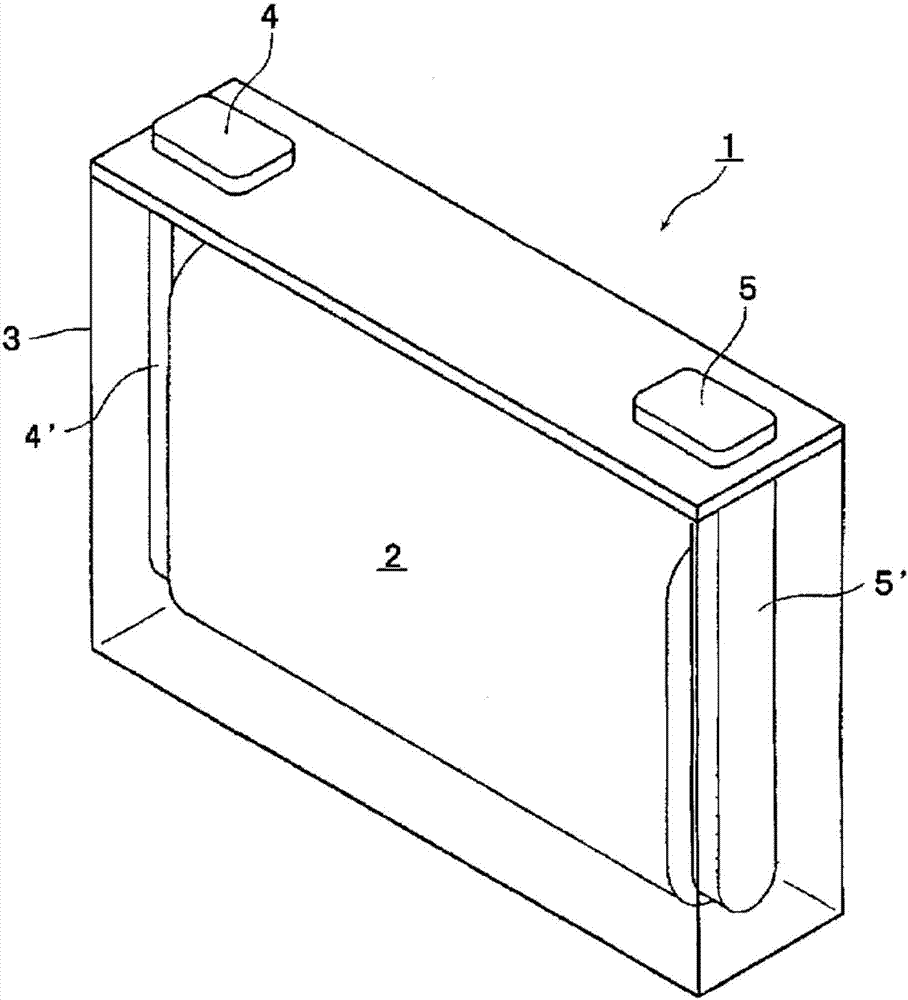
图1中示出作为本发明的锂二次电池的一实施方式的矩形的锂二次电池1的外观立体图。需要说明的是,图1为透视容器内部的图。图1所示的锂二次电池1将电极组2收纳于电池容器3。电极组2通过将具备正极活性物质的正极与具备负极活性物质的负极经由间隔件卷绕而形成。正极经由正极引线4’与正极端子4电连接,负极经由负极引线5’与负极端子5电连接。
对于本发明的锂二次电池的形状没有特别限定,作为一个例子可以举出圆筒型电池、方型电池(矩形的电池)、扁平型电池等。本发明也可以将上述的锂二次电池多个集合而成的蓄电装置的形式实现。将蓄电装置的一实施方式示于图2。在图2中,蓄电装置30具备多个蓄电单元20。各个蓄电单元20具备多个锂二次电池1。上述蓄电装置30可作为电动汽车(EV)、混合动力汽车(HEV)、插电式混合动力汽车(PHEV)等汽车用电源搭载。
现有的正极活性物质、本发明的活性物质均可充放电至正极电位达到4.5V(vs.Li/Li+)附近。然而,根据使用的非水电解质的种类的不同,若充电时的正极电位过高,则存在非水电解质被氧化分解而引起电池性能降低的担心。因此,有时要求即使在使用时采用充电时的正极的最大到达电位为4.3V(vs.Li/Li+)以下这样的充电方法也可得到充分的放电容量的锂二次电池。若使用本发明的活性物质,则即使在使用时采用充电时的正极的最大到达电位低于4.5V(vs.Li/Li+)这样的例如为4.4V(vs.Li/Li+)以下、4.3V(vs.Li/Li+)以下这样的充电方法,也可获得约200mAh/g以上这样的超过现有的正极活性物质的容量的放电电量。
本发明的正极活性物质为了具备高放电容量,优选构成锂过渡金属复合氧化物的过渡金属元素在层状岩盐型晶体结构的过渡金属位点以外的部分存在的比例小。其可如下实现:在供于烧成工序的前体中,前体核粒子的Co、Ni、Mn这样的过渡金属元素充分均匀地分布;和选择用于促进活性物质试样的结晶化的适当的烧成工序的条件。供于烧成工序的前体核粒子中的过渡金属的分布不均匀时,无法得到充分的放电容量。对于该理由未必明确,但本发明人等推测是由于如下理由:供于烧成工序的前体核粒子中的过渡金属的分布不均匀时,得到的锂过渡金属复合氧化物在层状岩盐型晶体结构的过渡金属位点以外的部分、即锂位点存在一部分过渡金属元素,引起所谓阳离子混排。同样的推测也可适用于烧成工序中的结晶化过程,若活性物质试样的结晶化不充分,则容易引起层状岩盐型晶体结构中的阳离子混排。上述过渡金属元素的分布的均匀性高的锂过渡金属复合氧化物,存在将X射线衍射测定结果归属于空间群R3-m时的(003)面与(104)面的衍射峰的强度比变大的倾向。在本发明中,基于X射线衍射测定的上述(003)面与(104)面的衍射峰的强度比I(003)/I(104)优选在放电末为1.0以上、在充电末为1.75以上。在前体的合成条件、合成步骤不适当时,上述峰强度比成为更小的值,常常成为低于1的值。
通过采用本说明书中记载的合成条件和合成步骤,可得到如上所述的高性能的正极活性物质。特别是可制成即使在将充电上限电位设定为低于4.5V(vs.Li/Li+)时、例如设定为低于4.4V(vs.Li/Li+)、4.3V(vs.Li/Li+)时也可得到高放电容量的锂二次电池用正极活性物质。
实施例
(实施例1)
<前体制作工序>
称量硫酸钴7水合物14.08g、硫酸镍6水合物21.00g和硫酸锰5水合物65.27g,将它们的全部量溶解于离子交换水200ml,制作Co:Ni:Mn的摩尔比为12.50:19.94:67.56的2.0M的硫酸盐水溶液。另一方面,在2L的反应槽中注入750ml的离子交换水,鼓泡30分钟CO2气体,由此使CO2溶解于离子交换水中。
将反应槽的温度设定为50℃(±2℃),使用具有搅拌电机的桨式叶片以700rpm的旋转速度搅拌反应槽内,同时以3ml/min的速度滴加上述硫酸盐水溶液。在此,通过在从滴加开始到结束为止的期间适当滴加含有1.0M的碳酸钠、1.0M的碳酸锂和0.4M的氨的水溶液进行控制以使反应槽中的pH总保持在7.9(±0.05)。滴加结束后,再继续3h反应槽内的搅拌。搅拌停止后,静置12h以上。
接着,使用抽滤装置分离反应槽内生成的共沉淀碳酸盐的粒子,再使用离子交换水进行200ml的清洗,将这样的清洗设为1次时,在进行5次清洗的条件下清洗除去附着于粒子的钠离子,使用电炉,在空气气氛中、常压下以80℃干燥20h。然后,为了使粒径一致,用玛瑙制自动乳钵粉碎数分钟。如此,制作共沉淀碳酸盐前体。
<烧成工序>
在上述共沉淀碳酸盐前体2.227g中以Li:(Co、Ni、Mn)的摩尔比为1.4的方式加入碳酸锂,使用玛瑙制自动乳钵充分混合,制备混合粉体。使用颗粒成型机在6MPa的压力下成型,制成直径25mm的颗粒。供于颗粒成型的混合粉体的量以设想的最终生成物的质量为2g的方式换算而确定。将1个上述颗粒载置于总长约100mm的氧化铝制舟皿,设置于箱型电炉(型号:AMF20),在空气气氛中、常压下经10小时从常温升温至850℃的温度,在升温后的温度下烧成4h。上述箱型电炉的内部尺寸为纵10cm、宽度20cm、深度30cm,在宽度方向以20cm间隔放入电热丝。烧成后,断开加热器的开关,在将氧化铝制舟皿放置于炉内的状态下自然放冷。其结果,炉子的温度在5小时后降低至约200℃左右,但之后的降温速度稍微平缓。经过一昼夜后,确认炉子的温度达到100℃以下后,取出颗粒,为了使粒径一致,使用玛瑙制自动乳钵粉碎数分钟。如此,制作含有2100ppm的Na、D50为8μm的起始物质的锂过渡金属复合氧化物Li1.17Co0.10Ni0.17Mn0.56O2。通过X射线衍射测定确认了该锂过渡金属复合氧化物具有α-NaFeO2结构。
<酸处理工序>
将0.05M硫酸水溶液200ml放入预先放入有搅拌子的锥形瓶,在其中加入上述起始物质的锂过渡金属复合氧化物5.00g,设置在磁力搅拌器上。然后,在室温、400rpm下,将酸处理时间设为30秒进行搅拌,由此进行酸处理。酸处理后的锂过渡金属复合氧化物在过滤后,用约1L的离子交换水进行清洗,用恒温槽在80℃下干燥一晚。如此,制作实施例1的锂过渡金属复合氧化物(酸处理试样)。
(实施例2)
在酸处理工序中,将酸处理时间从30秒变更为60秒,除此以外,与实施例1同样地制作实施例2的锂过渡金属复合氧化物。
(实施例3)
在烧成工序中,将烧成温度从850℃变更为800℃,除此以外,与实施例1同样地制作实施例3的锂过渡金属复合氧化物。
(实施例4)
在烧成工序中,将烧成温度从850℃变更为800℃,除此以外,与实施例2同样地制作实施例4的锂过渡金属复合氧化物。
(实施例5)
在烧成工序中,将烧成温度从850℃变更为900℃,除此以外,与实施例1同样地制作实施例5的锂过渡金属复合氧化物。
(实施例6)
在烧成工序中,将烧成温度从850℃变更为900℃,除此以外,与实施例2同样地制作实施例6的锂过渡金属复合氧化物。
(实施例7)
在烧成工序中,在上述共沉淀碳酸盐前体2.278g中以Li:(Co、Ni、Mn)的摩尔比为1.3的方式加入碳酸锂,制备混合粉体,制作起始物质的锂过渡金属复合氧化物Li1.13Co0.11Ni0.17Mn0.59O2,除此以外,与实施例1同样地制作实施例7的锂过渡金属复合氧化物。
(实施例8)
在烧成工序中,在上述共沉淀碳酸盐前体2.278g中以Li:(Co、Ni、Mn)的摩尔比为1.3的方式加入碳酸锂,制备混合粉体,制作起始物质的锂过渡金属复合氧化物Li1.13Co0.11Ni0.17Mn0.59O2,除此以外,与实施例2同样地制作实施例8的锂过渡金属复合氧化物。
(实施例9)
在烧成工序中,在上述共沉淀碳酸盐前体2.126g中以Li:(Co、Ni、Mn)的摩尔比为1.6的方式加入碳酸锂,制备混合粉体,制作起始物质的锂过渡金属复合氧化物Li1.23Co0.10Ni0.15Mn0.52O2,除此以外,与实施例1同样地制作实施例9的锂过渡金属复合氧化物。
(实施例10)
在烧成工序中,在上述共沉淀碳酸盐前体2.126g中以Li:(Co、Ni、Mn)的摩尔比为1.6的方式加入碳酸锂,制备混合粉体,制作起始物质的锂过渡金属复合氧化物Li1.23Co0.10Ni0.15Mn0.52O2,除此以外,与实施例2同样地制作实施例10的锂过渡金属复合氧化物。
(比较例1)
不进行酸处理,除此以外,与实施例1同样地制作比较例1的锂过渡金属复合氧化物。
(比较例2)
在酸处理工序中,将酸处理时间从30秒变更为180秒,除此以外,与实施例1同样地制作比较例2的锂过渡金属复合氧化物。
(比较例3)
在酸处理工序中,将酸处理时间从30秒变更为600秒,除此以外,与实施例1同样地制作比较例3的锂过渡金属复合氧化物。
(比较例4)
在酸处理工序中,将烧成温度从850℃变更为750℃,除此以外,与实施例1同样地制作比较例4的锂过渡金属复合氧化物。
(比较例5)
在烧成工序中,将烧成温度从850℃变更为750℃,除此以外,与实施例2同样地制作比较例5的锂过渡金属复合氧化物。
(比较例6)
在烧成工序中,将烧成温度从850℃变更为950℃,除此以外,与实施例1同样地制作比较例6的锂过渡金属复合氧化物。
(比较例7)
在烧成工序中,将烧成温度从850℃变更为950℃,除此以外,与实施例2同样地制作比较例7的锂过渡金属复合氧化物。
(比较例8)
在烧成工序中,在上述共沉淀碳酸盐前体2.339g中以Li:(Co、Ni、Mn)的摩尔比为1.2的方式加入碳酸锂,制备混合粉体,制作起始物质的锂过渡金属复合氧化物Li1.09Co0.11Ni0.18Mn0.62O2,除此以外,与实施例1同样地制作比较例8的锂过渡金属复合氧化物。
(比较例9)
在烧成工序中,在上述共沉淀碳酸盐前体2.339g中以Li:(Co、Ni、Mn)的摩尔比为1.2的方式加入碳酸锂,制备混合粉体,制作起始物质的锂过渡金属复合氧化物Li1.09Co0.11Ni0.18Mn0.62O2,除此以外,与实施例2同样地制作比较例9的锂过渡金属复合氧化物。
(比较例10)
在烧成工序中,在上述共沉淀碳酸盐前体2.104g中以Li:(Co、Ni、Mn)的摩尔比为1.65的方式加入碳酸锂,制备混合粉体,制作起始物质的锂过渡金属复合氧化物Li1.25Co0.09Ni0.15Mn0.51O2,除此以外,与实施例1同样地制作比较例10的锂过渡金属复合氧化物。
(比较例11)
在烧成工序中,在上述共沉淀碳酸盐前体2.104g中以Li:(Co、Ni、Mn)的摩尔比为1.65的方式加入碳酸锂,制备混合粉体,制作起始物质的锂过渡金属复合氧化物Li1.25Co0.09Ni0.15Mn0.51O2,除此以外,与实施例2同样地制作比较例11的锂过渡金属复合氧化物。
(比较例12)
在酸处理工序中,将0.10M硝酸水溶液100ml放入预先放入有搅拌子的锥形瓶,在其中加入上述作为起始物质的锂过渡金属复合氧化物2.00g,进行酸处理,除此以外,与实施例1同样地制作比较例12的锂过渡金属复合氧化物。
(比较例13)
在酸处理工序中,将0.10M硝酸水溶液100ml放入预先放入有搅拌子的锥形瓶,在其中加入上述作为起始物质的锂过渡金属复合氧化物2.00g,进行酸处理,除此以外,与实施例2同样地制作比较例13的锂过渡金属复合氧化物。
(比较例14)
<前体制作工序>
称量硫酸钴7水合物14.08g、硫酸镍6水合物21.00g和硫酸锰5水合物65.27g,将它们的全部量溶解于离子交换水200ml,制作Co:Ni:Mn的摩尔比为12.50:19.94:67.56的2.0M的硫酸盐水溶液。另一方面,在2L的反应槽中注入750ml的离子交换水,鼓泡30分钟Ar气体,由此将离子交换水中的溶解氧脱气。将反应槽的温度设定为50℃(±2℃),使用具备搅拌电机的桨式叶片以700rpm的旋转速度搅拌反应槽内,同时以3ml/min的速度滴加上述硫酸盐水溶液。在此,通过在从滴加开始到结束为止的期间适当滴加含有2.0M的氢氧化钠和0.5M的氨的水溶液进行控制以使反应槽中的pH总是保持在11.0(±0.05)。滴加结束后,再继续3h反应槽内的搅拌。搅拌停止后,静置12h以上。
接着,使用布氏漏斗(130mmφ)和抽滤装置分离反应槽内生成的共沉淀氢氧化物的粒子,再向布氏漏斗中注入100ml的离子交换水,用玻璃棒搅拌,由此清洗共沉淀化合物。通过进行1次该清洗作业,将附着于粒子的钠离子清洗·除去。接着,使用电炉,在空气气氛中、常压下以100℃进行干燥。然后,为了使粒径一致,用玛瑙制自动乳钵进行数分钟粉碎。如此,制作共沉淀氢氧化物前体。
<烧成工序>
在上述共沉淀氢氧化物前体1.768g中以Li/Me(Co、Ni、Mn)的摩尔比(相对于上述共沉淀氢氧化物前体混合的氢氧化锂的摩尔比)为1.5的方式加入氢氧化锂,使用玛瑙制自动乳钵充分搅拌,制备混合粉体。将其使用颗粒成型机在6MPa的压力下成型,制成直径25mm的颗粒。供于颗粒成型的混合粉体的量以设想的最终生成物的质量为2g的方式换算而确定。将1个上述颗粒载置于总长约100mm的氧化铝制舟皿,设置于箱型电炉(型号:AMF20),在空气气氛中、常压下经10小时从常温升温至1000℃,在1000℃下烧成4h。上述箱型电炉的内部尺寸为纵10cm、宽度20cm、深度30cm,在宽度方向以20cm间隔放入电热丝。烧成后,断开加热器的开关,在将氧化铝制舟皿放置于炉内的状态下自然放冷。其结果,炉子的温度在5小时后降低至约200℃左右,但之后的降温速度稍微平缓。经过一昼夜后,确认炉子的温度达到100℃以下后,取出颗粒,为了使粒径一致,用玛瑙制自动乳钵粉碎数分钟。如此,制作含有2000ppm的Na、D50为5μm的起始物质的锂过渡金属复合氧化物Li1.13Co0.11Ni0.17Mn0.59O2。
<酸处理工序>
在0.05M硫酸水溶液200ml中加入上述起始物质的锂过渡金属复合氧化物5.00g,以室温、400rpm搅拌30秒,过滤,进行水洗。然后,用恒温槽在80℃下干燥一晚,制作比较例14的锂过渡金属复合氧化物(酸处理试样)。
<细孔容积分布测定>
所有实施例和比较例的锂过渡金属复合氧化物按照以下的条件和步骤进行细孔容积分布测定。细孔容积分布的测定使用Quantachrome公司制的“autosorb iQ”和控制·分析软件“ASiQwin”。将作为测定对象的试样的锂过渡金属复合氧化物1.00g放入测定用的样品管,在120℃下进行12h真空干燥,由此充分除去测定试样中的水分。接着,通过使用液态氮的氮气吸附法在相对压力P/P0(P0=约770mmHg)为0~1的范围内测定吸附侧和脱离侧的等温线。然后,使用脱离侧的等温线并通过BJH法进行计算,由此评价细孔分布。
对于所有实施例和比较例的锂过渡金属复合氧化物,将根据使用氮气吸附法的吸附等温线并以BJH法求得的微分细孔容积显示最大值的细孔直径设为至60nm为止的范围内。
<半峰宽的测定>
所有实施例和比较例的锂过渡金属复合氧化物按照以下的条件和步骤进行X射线衍射测定,确定半峰宽。使用X射线衍射装置(Rigaku公司制、型号:MiniFlex II)进行粉末X射线衍射测定。射线源设为CuKα、加速电压和电流分别设为30kV和15mA。取样宽度设为0.01deg、扫描时间设为14分(扫描速度设为5.0)、发散狭缝宽度设为0.625deg、受光狭缝宽度开放、散射狭缝设为8.0mm。对于得到的X射线衍射数据,不除去源自Kα2的峰,使用作为上述X射线衍射装置的附带软件的“PDXL”对X射线衍射图上存在于2θ=18°±1°的衍射峰确定半峰宽。
需要说明的是,锂过渡金属复合氧化物的X射线衍射测定中归属于(003)面的衍射峰的半峰宽的值即使经过充放电也可基本上维持。但是,正极活性物质有时一部分因制作电极时的压制工序而破裂,因此,在从电池中所具备的正极中采取正极活性物质并测定其中所含的锂过渡金属复合氧化物的半峰宽时,应注意不要含有产生破裂的正极活性物质。
<酸处理后的结构稳定性的评价>
所有实施例和比较例的结构稳定性按照以下的顺序和条件进行X射线衍射测定并调查。将酸处理后的试样1g载置于氧化铝制舟皿,用箱型电炉(型号:AMF20),在空气气氛中、常压下经3小时20分钟从常温升温至1000℃,在1000℃下保持10分钟。使用X射线衍射装置(Rigaku公司制、型号:MiniFlex II)进行粉末X射线衍射测定。射线源设为CuKα、加速电压和电流分别设为30kV和15mA。取样宽度设为0.01deg、扫描时间设为14分钟(扫描速度设为5.0)、发散狭缝宽度设为0.625deg、受光狭缝宽度开放、散射狭缝设为8.0mm。对于得到的X射线衍射数据,将未观测到起因于LiMn2O4的衍射峰的情况评价为“结构稳定(显示归属于空间群R3-m的单一相)”、将观测到起因于LiMn2O4的衍射峰的情况评价为“结构不稳定(未显示归属于空间群R3-m的单一相)”。将评价结果为“结构稳定”的情况作为“○”、将“结构不稳定”的情况作为“×”并示于表1。
<锂二次电池的制作和评价>
分别使用所有实施例和比较例的锂过渡金属复合氧化物作为锂二次电池用正极活性物质,通过以下的步骤制作锂二次电池,评价电池特性。
以N-甲基吡咯烷酮作为分散介质,制作将活性物质、乙炔黑(AB)和聚偏氟乙烯(PVdF)以质量比90:4:6的比例混炼分散而得的涂布用糊剂。将该涂布糊剂涂布于厚度20μm的铝箔集电体的单面,经由干燥工序和压制工序制作正极板。需要说明的是,以所有实施例和比较例的锂二次电池彼此试验条件相同的方式,将涂布于单位一定面积的活性物质的质量和涂布厚度统一。
为了准确地观察正极的单独行为,对于对电极、即负极,使金属锂密合于镍箔集电体而使用。在此,在负极配置充分量的金属锂以使锂二次电池的容量不会受负极限制。
作为电解液,使用在碳酸亚乙酯(EC)/碳酸甲乙酯(EMC)/碳酸二甲酯(DMC)为体积比6:7:7的混合溶剂中以浓度为1mol/l的方式溶解LiPF6而成的溶液。作为间隔件,使用用聚丙烯酸酯进行了表面改性的聚丙烯制的微孔膜。外装体使用由聚对苯二甲酸乙二醇酯(15μm)/铝箔(50μm)/金属粘接性聚丙烯膜(50μm)构成的金属树脂复合膜,以正极端子和负极端子的开放端部露出在外部的方式收纳电极,除成为注液孔的部分以外,将上述金属树脂复合膜的内表面彼此相向的熔敷部分气密密封,注入上述电解液后,密封注液孔。
通过以上的步骤制作的锂二次电池在25℃下供于初期充放电工序。充电设为电流0.1CA、电压4.6V的恒定电流恒定电压充电,充电终止条件设为电流值衰减至1/6的时刻。放电设为电流0.1CA、终止电压2.0V的恒定电流放电。将该充放电进行2个循环。在此,在充电后和放电后分别设置30分钟的停止过程。
接着,变更充电电压,进行1个循环的充放电试验。电压控制均对正极电位进行。对该充放电试验的条件而言,充电设为电流0.1CA、电压4.3V的恒定电流恒定电压充电,充电终止条件设为电流值衰减至1/6的时刻。放电设为电流1CA、终止电压2.0V的恒定电流放电。将此时的放电电量记录为“放电容量(mAh/g)”(在表中表示为“1C capa”)。
将所有实施例和比较例的锂过渡金属复合氧化物的粉体物性和各自用作锂二次电池用正极活性物质的锂二次电池的试验结果示于表1。
[表1]
由表1可知,使用了如下锂过渡金属复合氧化物的正极活性物质的初期效率超过90%,优异,另外,1C容量高达190mAh/g以上,高速率放电性能优异(参照实施例1~10),所述锂过渡金属复合氧化物在酸处理后的摩尔比Li/Me大于1.2且小于1.6,根据使用氮气吸附法的吸附等温线并以BJH法求得的微分细孔容积显示最大值的细孔直径在至60nm为止的范围内(至60nm为止的细孔区域)具有0.055cc/g以上的细孔容积,在X射线衍射测定中归属于(003)面的衍射峰的半峰宽在0.202°~0.265°的范围内,进而,在1000℃下进行热处理时显示归属于空间群R3-m的单一相(○:维持酸处理前的晶体结构)。
与此相对,在锂过渡金属复合氧化物的摩尔比Li/Me为1.2以下的活性物质中,高速率放电性能降低(比较例8、9),在摩尔比Li/Me为1.6以上的活性物质中,初期效率和高速率放电性能降低(比较例10、11)。未进行酸处理的活性物质的上述细孔容积低于0.055cc/g,初期效率和高速率放电性能低(参照比较例1)。烧成温度高的活性物质、使用了氢氧化物前体的活性物质的上述细孔容积低于0.055cc/g,半峰宽低于0.202°,初期效率和高速率放电性能降低(参照比较例6、7、14)。酸处理时间长的活性物质、酸处理使用硝酸的活性物质在1000℃下进行热处理时未显示归属于空间群R3-m的单一相(×:酸处理前的晶体结构崩塌),高速率放电性能降低(参照比较例2、3、12、13)。烧成温度低的活性物质的半峰宽超过0.265°,高速率放电性能降低(参照比较例4、5)。
需要说明的是,锂过渡金属复合氧化物的摩尔比Li/Me的值因充放电而增减,因此,从电池中所具备的正极中采取正极活性物质,为了求出其中所含的锂过渡金属复合氧化物的摩尔比Li/Me的值,需要在预先使正极为放电末状态后采取。具体而言,采用以下的步骤。首先,从电池中取出正极。此时,为了安全,优选使电池为放电末状态后取出。接着,使用与电池中所使用的非水电解质相同组成的非水电解质,组装以金属锂为对电极的电池单元。对于该电池单元,将充电电压设为4.3V进行电流0.1CmA下的恒定电流充电后,插进30分钟的停止并以0.1CmA以下的电流进行恒定电流放电直至达到2.0V,形成放电末状态。从电池单元中取出正极,使用碳酸二甲酯进行充分清洗,在室温下干燥一昼夜后,从电极中取出合剂,采取正极活性物质。如此,调整为放电末状态的正极活性物质所含有的锂过渡金属复合氧化物的摩尔比Li/Me的值恢复至相对于原料中使用的正极活性物质所含有的锂过渡金属复合氧化物的摩尔比Li/Me的值减少约3%的程度。
工业上的可利用性
通过使用本发明的新型的含有锂过渡金属复合氧化物的正极活性物质,可提供初期效率和高速率放电性能优异的锂二次电池,因此,该锂二次电池作为混合动力汽车用、电动汽车用的锂二次电池很有用。
- 还没有人留言评论。精彩留言会获得点赞!