具有优异的硬度强度的正电极材料的制作方法
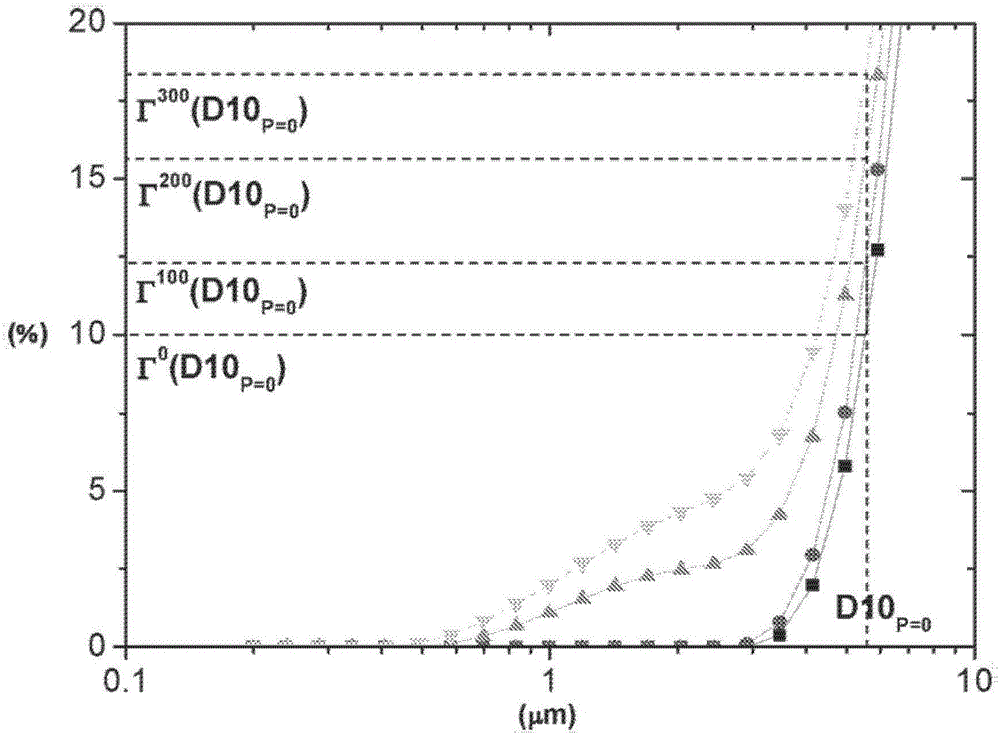
本发明涉及金属氧化物化合物并且涉及其制备方法。更具体来说,本发明涉及用于在锂和锂离子电池中使用的掺杂的金属氧化物嵌入化合物。近年来,二次锂离子电池由于它们相对高的重量和体积能量密度取代了其他电池系统。这些特征对于伴有便携式电子设备的小型化(如膝上型电脑、智能手机或摄像机...)是特别令人希望的并且预见到适合于具有长程范围的电动车辆(HEV或EV)。后者应用要求在实际工作条件下能够维持良好的充电-放电循环寿命的电池,即在超过延伸的温度范围和高倍率放电下几千次的循环。大多数可充电锂离子电池使用不包含锂金属的阳极材料,例如包含碳和/或金属合金(如硅合金、锡合金...)的材料。那么阴极必须包含锂,锂可以被可逆地在充电过程中脱出并且在放电过程中嵌入以便递送良好的循环寿命。作为用于可充电锂离子电池的阴极的大多数有希望的材料是具有衍生自α-NaFeO2的分层结构(空间群R-3m)的锂过渡金属氧化物。自从由Sony在1990年首先将Li离子电池引入至消费电子产品以来;LiCoO2仍然是最常用的阴极材料,由于其良好的循环寿命、非常高的压制密度(通常超过3.7g/cm3)以及在4.2V下针对石墨阳极的约140mAh/g的大比容量。然而,LiCoO2由于其非常高且波动的价格以及相对稀缺的钴是较不有利的,这限制了其用于新兴的EV大市场。由于镍的更大的可获得性以及更低的价格,已经研究了替代性阴极活性材料如LiNiO2。当与LiCoO2相比时LiNiO2的特征还是更高的比容量;典型地在4.2V下超过200mAh/g,由于过渡金属氧化物氧化还原对的较低的电势。LiNiO2具有两个缺点:(i)LiNiO2增加了安全考虑,因为在比LiCoO2更低的温度下它与电解质具有更剧烈的放热反应,如通过DSC(参见Dahn等人,固体离子(SolidStateIonics),69,265(1994))证实的,最终导致电池的热失控和灾害性破坏。因此,纯LiNiO2总体上不被选择用于商业锂离子电池中。(ii)在给定的电池电压下的更高的比容量意思是每单位LiNiO2更高量的Li可以被可逆地脱嵌(de-intercalated),导致在充电和放电循环时晶体体积的显著变化。该晶体体积的这种重复的大变化可能导致阴极材料的初级和二次颗粒不能够维持此类应力。在该电极中颗粒破裂和电接触损失可能发生,并且这最终损害Li离子电池的循环寿命。为了改进上述的问题,尤其涉及对于LiNiO2安全性的那些,已经引入了不同的掺杂元素,例如电化学不活跃的离子如Mg2+、Ti4+和Al3+(参见例如US6,794,085B2)。然而,这样一种掺杂策略时常地导致在实际电池中的比容量的减小和较低的功率,并且对于端应用不是优选的。更有希望的路线是Co和Mn代替Ni(如在US2003/0022063A1中披露的),导致具有理想化通式Li1+x[Ni1-a-bMnaCob]1-xO2的所谓的NMC类型的组合物。这个理想化的化学式明确地不考虑阳离子混合,该阳离子混合是金属(通常以二价态的镍)占据锂层中的位点的能力。总体上承认的是Mn是四价的,Co是三价的并且Ni携带2+/3+电荷。微不足道的是示出了有效地为Ni3+的镍离子的分数是:其中被称为锂与金属摩尔比。Ni3+摩尔含量因此等于:当Li:M接近于1时,意思是对于x~0(或-0.05≤x≤0.05),该Ni3+摩尔含量是约1-2a-b。这个最后的表达式将被认为是在以下实例中计算有效的Ni3+含量,其中约定的是“a”代表四价金属阳离子(实例包括(但不限于)Mn4+、Zr4+或Ti4+),并且b代表三价金属阳离子(实例包括(但不限于)Co3+和Al3+)。同样,有效Ni3+分数的计算可以延伸到考虑掺杂的二价金属阳离子如Mg2+和Ca2+;可以示出该含量是通过(1-2a-b)/(1-a-b-c)给出的,其中c代表二价阳离子的摩尔含量。在这些NMC材料中,当该有效的Ni3+含量增加时,比容量增加,因此从这些材料中可逆地脱嵌的Li的量增加。例如,当在4.2与2.7V之间针对石墨阳极循环时,受欢迎的组成如111(111代表Ni:Mn:Co的摩尔比,其中每摩尔产物约0.1摩尔Ni3+)、532(约0.2摩尔Ni3+)、622(约0.4摩尔Ni3+)和811(约0.7摩尔Ni3+)典型地具有对应地150、160、170和190mAh/g的比放电容量。当有效的Ni3+含量增加时,然后更多的锂离子可逆地从这些材料中脱出,导致更高的颗粒应变。最终应变将导致颗粒破裂和电极退化,因此加速容量衰减速率并且损害该电池的循环寿命。此外,此类颗粒破裂创建新的暴露表面,这些暴露表面最终将促进在阴极上的副反应,即电解质氧化,并且进一步减少该电池的循环寿命。此类问题对于要求较高功率输出的系统变得更加关键:典型地现代EV应用要求优于1C并且甚至最高达5C的工作C倍率(1C=1h并且5C=12分钟以完成全电池充电或放电)。阴极材料必须能够适应由晶胞的体积变化(由于在较短的时间量内Li离子的嵌入和脱嵌)产生的应变。明显地,难以设计能够递送大的比容量(即具有高的有效的Ni3+)并且能够适应较大的应变(尤其在较大的功率下)两者的材料。本发明的目的是提供此类材料。Li离子电池的体积能量密度(以Wh/L计)不仅受阳极电极和阴极电极两者的比放电容量(以mAh/g计)的影响,而且还受这些电极的重量密度(以g/cm3计)的影响。在阴极侧上,电极重量密度通过以下确定:(i)阴极材料的固有特性如拍实密度(TD)或压制密度,以及(ii)电极的生产工艺,例如在压延或压制步骤的过程中来增加电极密度。在这样一个步骤中,将单轴向应力施加在该电极上以便达到所希望的密度(或孔隙率)水平以实现高的体积能量。本发明目的是提供一种能够维持这种应力的阴极材料,即,具有在压力下在制造方法过程中不破裂的并且能够维持反复的充电-放电循环而不破裂的二次颗粒的材料。在这个方面,US2004/023113A1涉及阴极粉末的压缩密度和抗压强度的确定;这些实例主要是关于LiCoO2。在压缩密度的确定中,在29.4MPa的压力下压缩该粉末。与目前的现有技术的电极制作要求相比此类压力是低约10倍并且不代表在此方法过程中阴极材料的行为。已知的是具有非常致密的、非团聚的土豆形状的颗粒的特定形态的LiCoO2可以维持非常高的压缩应力而不破裂。复合的锂镍锰钴氧化物(NMC)具有由初级颗粒团聚制成的非常不同形态的二次颗粒。此类二次颗粒由于是优选的断裂点的颗粒间晶界的出现是更易碎的。杂质如未反应的碱金属盐(氢氧化物、碳酸盐、硫酸盐...)在晶界处累积。当全电池在大于4V的电位下工作时,这些未反应的盐分解并且溶解于该电解质中,使晶界是开放的并且未填充的,这显著地损害这些二次颗粒的机械耐受性。当在电池中在高功率下(=在高放电C-倍率下)工作时,包含过量的来源于电极加工的此类Li盐杂质的材料展示了对机械应力较低的耐受性,并且具有差的对于适应由Li嵌入和脱出产生的应变的耐受性。通常接受的是有效的Ni3+含量越高,杂质越多,LiOH和Li2CO3主要在晶界上累积,进一步增加了二次颗粒破裂的倾向。US2009/0314985A1描述了阴极粉末的抗压强度并且引入了粒径分布的D10值在200MPa下压缩该粉末之后应该改变不大于1μm的概念。这个标准未能适当地描述具有较低D10值的材料的行为;尤其当D10<1μm时。唯一的实例描述了具有+/-5mol%的Ni3+的D50=10μm的NMC111的行为。因为其低的有效的Ni3+含量,NMC111是较不易碎的NMC材料之一。具有较大有效的Ni3+含量-和较大比容量-同时保持相对低的二次颗粒脆性的材料对于现代应用是令人希望的。此外,在US2009/0314985A1中披露的制造方法对于大规模生产是不现实的:例如描述的是使用氧气流以及多步骤烧制,从而导致高成本和低生产量两者。此外,未提及阴极材料的循环寿命的改进特征为改进的硬度强度。概述从第一方面来看,本发明可以提供一种用于锂二次电池的粉末状正电极材料,该材料具有通式Li1+x[Ni1-a-b-cMaM’bM”c]1-xO2-z;M是组Mn、Zr和Ti中的任一种或多种元素,M’是组Al、B和Co中的任一种或多种元素,M”是不同于M和M’的掺杂剂,x、a、b和c是以mol表示,其中-0.02≤x≤0.02、0≤c≤0.05、0.10≤(a+b)≤0.65并且0≤z≤0.05;并且其中该粉末状材料的特征在于具有的BET值为≤0.37m2/g,Dmax为<50μm,并且其中该粉末状材料的特征在于具有对于P=200MPa,硬度强度指数(HSI)ΔΓ(P)值为不大于100%+(1-2a-b)×160%,其中其中D10P=0是非限制粉末(P=0MPa)的D10值,Γ0(D10P=0)是在D10P=0下非限制粉末的累积体积粒径分布,并且ΓP(D10P=0)是在D10P=0下压制样品的累积体积粒径分布,其中P是以MPa表示。在一个实施例中,M=Mn并且M’是Al和Co中的任一种。在另一个实施例中,Dmax<45μm。从以下实验中,清楚的是没有获得小于0.20m2/g的BET值。在更具体的实施例中,1-a-b≥0.5并且1+x<1.000。此外,该材料可包含最高达2mol%的W、Mo、Nb、Zr、或稀土元素。在一个实施例中,该材料包含第二相LiNx’Oy’,其中0<x’<1并且0<y’<2,其中N是W、Mo、Nb、Zr和稀土元素中的任一种或多种。诸位作者推测使用适当的添加剂或掺杂剂改性的材料可以是特征为增强的硬度强度以及还有改进的循环寿命。例如添加剂或掺杂剂T如W、Mo、Nb、Zr、或稀土元素就是这种情况。此类T元素具有与Li(例如Li2ZrO3、(Li2O)n(WO3),其中n=1、2、3;或Li3NbO4)并且有时还与M=Co、Ni和Mn(如在Li4MWO6化合物中)混合的特性。此类含T的混合物是稳定的并且在颗粒的晶界处累积;它引起晶界的稳定化,从而提供了对于应力以及在反复的电化学循环过程中更好的机械耐受性。该材料可具有Al2O3表面涂层,产生大于1000ppm、或甚至大于2000ppm的氧化铝含量。根据本发明的阴极材料可具有小于3000pm的F。在一个实施例中,该材料可具有低于0.5wt%、或低于0.25wt%、或甚至低于0.15wt%的Swt%含量。在不同的实施例中,提供了以下的特征:对于P=300MPa,ΔΓ(P)≤150+(1-2a-b)×160%,或者对于P=300MPa,ΔΓ(P)≤125%+(1-2a-b)×100%,或者对于P=300MPa,ΔΓ(P)≤180%,或者对于P=300MPa,ΔΓ(P)≤140%,或者对于P=300MPa,ΔΓ(P)≤100%。对于根据本发明的粉末状正电极材料-在洗涤之后它们可具有>1m2/g、或还大于1.5m2/g的BET值,-它们可具有大于3.0g/cm3、或大于3.2g/cm3、或还大于3.4g/cm3的压制密度。-它们可具有的可溶性碱含量为(Li2CO3+LiOH)<0.8wt%、或Li2CO3wt%+LiOHwt%<0.5wt%、或者还有Li2CO3wt%+LiOHwt%<0.3wt%。-它们可包含实质上不含大于20nm孔隙、或甚至不含大于10nm孔隙的二次颗粒,如在图9-10中说明的。-它们可包含含有小于20个大于20nm的空隙或甚至小于10个大于20nm的空隙的二次颗粒,如在图9-10中说明的。-它们可具有如通过具有R-3m空间群的假六方晶格定义的(104)峰的FWHM值,该值是大于0.1252θ度、或大于0.1402θ度、或甚至大于0.1502θ度。-它们可具有如通过具有R-3m空间群的假六方晶格定义的(015)峰的FWHM值,该值大于0.1252θ度、或大于0.1402θ度、或甚至大于0.1502θ度。-它们可具有如通过具有R-3m空间群的假六方晶格定义的(113)峰的FWHM值,该值大于0.162θ度、或大于0.182θ度、或甚至大于0.202θ度。根据本发明的阴极材料可具有0.1CEfad.≤(1-2a-b)×10%、或0.1CEfad.≤(1-2a-b)×5%、或1CEfad.≤(1-2a-b)×20%(参见用于电化学测试实验的详细说明的部分a)和c))。该材料在室温下在全电池中可循环至少1000次循环、或甚至至少1500次循环(具有大于80%的保留容量)。该材料在45℃下在全电池中还可循环至少900次循环、或甚至至少1500次循环(具有大于80%的保留容量)。清楚的是,根据本发明的另外的产品实施例可以通过组合之前所述不同产品实施例所涵盖的特征提供。从第二方面来看,本发明可以提供一种结合进电极中并且具有大于3.0+((1-2a-b)/2)g/cm3的电极密度的粉末状正电极材料。从第三方面来看,本发明可以提供一种锂二次电池,该锂二次电池包括一种包含锂过渡金属氧化物的颗粒的正电极活性材料;无Li的负电极,插入在该正电极与该负电极之间的隔膜;以及非水性电解质,其中该正电极活性材料的颗粒具有一个ΔΓ(P)值,该值对于P=300MPa不大于(1-2a-b)×180%,或者对于300MPa不大于2(1-x)(1-a-b)×140%、或者甚至在300MPa下小于(1-a-b)×100%。在一个实施例中,该材料具有大于0.162θ的(104)峰的FWHM并且证明了在室温下至少1000次循环、或甚至1500次循环(具有大于80%的保留容量)。在一个实施例中,该材料具有大于0.162θ的(104)峰的FWHM并且展示了在45℃下至少900次循环(具有大于80%的保留容量)。从第四方面来看,本发明可以提供一种用于制备根据本发明的粉末状正电极材料的方法,该材料具有通式Li1+x[Ni1-a-b-cMaM’bM”c]1-xO2-z,并且该方法包括以下步骤:-提供一种或多种包含Ni、M、M’和M”中的任一种或多种的前体材料和一种包含Li的前体材料的一种混合物,-在以℃表示的温度T下烧结该混合物,其中(945-(248*(1-2a-b)≤T≤(985-(248*(1-2a-b)),由此获得团聚的颗粒,并且-粉碎这些团聚的颗粒从而获得具有BET≤0.37m2/g并且Dmax<50μm的一种粉末。Dmax或D100值是所获得粉末的最大粒径。在一个实施例中,Dmax<45μm。从以下实验中,清楚的是没有获得小于0.20m2/g的BET值。在此应该提及的是US2011/193013描述了具有分层的晶体结构的粉末状锂过渡金属氧化物Li1+aM1-aO2±bM′kSm,其中-0.03<a<0.06,0≦m≦0.6,m是以mol%表示的,M是过渡金属化合物,由至少95%的组Ni、Mn、Co和Ti中的任一种或多种元素组成;M′存在于该粉末状氧化物的表面上,并且由组Ca、Sr、Y、La、Ce和Zr中的任一种或多种元素组成。在过高的温度下烧制具有BET值≤0.37m2/g的产物,导致孔隙率的增加,其导致硬度的减少。此外,US2006/233696描述了粉末状锂过渡金属氧化物,该氧化物具有组成LixMyO2并且通过在空气中从混合的过渡金属前体和Li2CO3的固相反应制备的,该粉末实际上不含Li2CO3杂质。在式M=M′1-kAk中,其中在0.65≦a+b≦0.85并且0.1≦b≦0.4的条件下M′=Ni1-a-b(Ni1/2Mn1/2)aCob;A是一种掺杂剂;并且0≦k≦0.05;并且在0.95≦x≦1.05的条件下x+y=2。所制备的产物的BET表面积太高,导致硬度的减小。最终,在US2010/112447中,正电极活性材料包含一种含有锂以及Ni、Mn、和Co的复合氧化物。Ni的摩尔比是从0.45至0.65,并且Mn的摩尔比是从0.15至0.35。该正电极活性材料在60MPa的压缩下具有3.3g/cm3或更大并且4.3g/cm3或更小的压制密度。该正电极活性材料在60MPa的压缩下具有100Ω·cm或更大并且小于1000Ω·cm的体积电阻率。然而所披露的材料具有1:1.03或更大、或1:0.95的(Ni+Mn+Co):Li比率。这个比率或者太高或者太低来允许获得具有所希望的硬度的产物。附图简述图1:随单轴向应力P(对于实例1,P=0、100、200和300MPa)而变化的累积粒径分布ΓP的发展。图2:随单轴向应力P(对于实例1,P=0、100、200和300MPa)而变化的累积粒径分布ΓP的发展的放大,并且示出了确定ΓP(D10P=0)的步骤。图3:当在4.2与2.7V之间循环时,在室温下EX1、EX2和CEX1的全电池循环寿命。随循环数(#)而变化的保留容量(以最初放电容量的%计)的发展。图4:当在4.2与2.7V之间循环时,在45℃下EX1、EX2和CEX1的全电池循环寿命。随循环数而变化的保留容量(以最初放电容量的%计)的发展。图5:实例1(a)、实例2(b)和对照实例1(c)的二次颗粒的截面SEM和SEM。图6:当在4.2与2.7V之间循环时,在室温下EX3、EX4和CEX2的全电池循环寿命。随循环数(#)而变化的保留容量(以最初放电容量的%计)的发展。图7:当在4.2与2.7V之间循环时,在45℃下EX3、EX4和CEX2的全电池循环寿命。随循环数(#)而变化的保留容量(以最初放电容量的%计)的发展。图8:实例3(顶部)和对照实例2(底部)的二次颗粒的SEM。图9:实例3(顶部)、实例4(中间)和对照实例2(底部)的二次颗粒的截面SEM。图10:实例5(a)、实例6(b)和对照实例7(c)的二次颗粒的截面SEM和SEM。图11:当在4.2与2.7V之间循环时,在室温下EX8、EX9和EX10的全电池循环寿命。随循环数(#)而变化的保留容量(以最初放电容量的%计)的发展。图12:当在4.2与2.7V之间循环时,在45℃下EX8、EX9和EX10的全电池循环寿命。随循环数(#)而变化的保留容量(以最初放电容量的%计)的发展。图13:实例8(a)、实例9(b)和实例10(c)的二次颗粒的SEM。图14:示出了随2θ(度)而变化的衍射强度(计数)的实例1的XRD图案。指示了α-NaFeO2晶胞(空间群R-3m)的003、104、015、018、110和113反射的位置。图15:实例1的018、110和113峰在63-702θ范围内的pseudo-Voigt分解的实例。空心点是在减去Kα2之后的实验数据I观察,黑色实线是使用3个pseudo-Voigt函数拟合的轮廓I计算并且虚线代表(I观察.-I计算)的量。详细说明本发明提供了一种能够在电极制作过程中维持大的机械应力并且在要求功率的应用中维持电化学应力的阴极材料。此类阴极材料在室温和45℃两者下在全电池中具有改进的循环寿命。因此,根据本发明的材料提供了重要的优点,如:-促进电极生产工艺的现有技术水平的电极密度:阴极材料二次颗粒能够在电极制造过程中维持高的单轴向应力,具有基本上较低的断裂和破裂的危险,-循环寿命的增加:这些阴极材料的二次颗粒在电极制造之后并且在高C-倍率下电化学循环时示出了基本上较低的断裂和破裂,并且在该电极内维持了在这些阴极二次颗粒、粘合剂、导电剂与集电体之间的良好的接触,以及-在高温下改进的循环寿命。在电极压制之后并且由于在循环时的颗粒破裂,使根据本发明能够维持较高应力的阴极活性材料的BET增加最小化,并且因此这限制了表面暴露,在该表面暴露处发生副反应如在较高的电压下电解质氧化。用于制备根据本发明的材料的方法通常是已知的,但是它是通过适当选择参数如在单步煮制过程中的烧结温度和Li/金属比率(在很大程度上取决于在化合物中的Ni3+含量),可以实现优越的硬度和其他特征。实际上,该煮制步骤的烧结温度受限于(985-(248*(1-2a-b))℃,并且该Li:M比率(=(1+x)/(1-x))是在0.98与1.02之间。还可以建立如(945-(248*(1-2a-b))℃的最小烧结温度以确保完成在前体之间的反应。发现用于限制烧结温度的理由是温度对颗粒的内孔隙率的直接影响。当该Li:M比率低于0.98时,由于位于Li位点上的Ni的量显著增加,存在容量的严重下降。当该Li:M比率大于1.02时,该可溶性碱含量增加,导致像在全电池中的严重的气体产生的问题,如在WO2012/107313中讨论的。对于该方法还重要的是:在烧结之后将团聚的颗粒柔和地粉碎或研磨以确保适当的硬度,并且,由于该研磨增加BET值,柔和地研磨意思是所研磨的产物的BET可以受限于≤0.37m2/g。由于粉碎和研磨可导致非常高的Dmax(是最大的粒径)值,从而严重地阻碍该容量,该研磨可以被控制以引起Dmax<50μm。实验概述a)评价钮扣电池中的电化学特性如下制备电极:将约27.27wt.%的活性阴极材料、1.52wt.%的聚偏二氟乙烯聚合物(KF聚合物L#9305,吴羽美国公司(KurehaAmericaInc.))、1.52wt.%的导电炭黑(SuperP,埃赫曼康密劳公司(ErachemComilogInc.))以及69.70wt.%的N-甲基-2-吡咯烷酮(NMP)(来自西格玛-奥德里奇公司(Sigma-Aldrich))通过高速均化器紧密地混合。然后将该浆料在铝箔上通过带式流延法铺成薄层(典型地100微米厚)。在蒸发该NMP溶剂之后,通过使用40微米的间隔的辊式压制机加工该流延膜。使用圆形的模口切刀(测量直径14mm)由该膜冲出电极。然后将这些电极在90℃下干燥过夜。随后称量这些电极以确定活性材料载量。典型地,这些电极含有90wt.%的活性材料,其中活性材料载量为约17mg(约11mg/cm2)。然后将这些电极放进一个充氩的手套箱并且组装在2325型钮扣电池体内。该阳极是具有500微米厚度的锂箔(来源:荷森(Hosen));该隔膜是Tonen20MMS微孔聚乙烯膜。该钮扣电池填充有1M的溶解在碳酸亚乙酯和碳酸二甲酯呈1:2的体积比率的混合物中的LiPF6的溶液(来源:泰科诺赛美材料株式会社(TechnoSemichemCo.))。在25℃下使用Toscat-3100计算机控制的恒电流循环台(来自日本东洋(Toyo))循环每个电池。在表8中详细说明了用于评价EX1、EX2、EX3、EX4、CEX1和CEX2的钮扣电池测试程序1。在表9中详细说明了用于评价EX5、EX6、EX7、EX8、EX9和EX10的钮扣电池程序2。这两个程序都使用160mA/g的1C电流定义并且包括如下3个部分:(i)部分I是在0.1C、0.2C、0.5C、1C、2C和3C下在4.3~3.0V/Li金属窗口范围内的倍率性能的评价。除了初始充电容量CQ1和放电容量DQ1是以恒电流模式(CC)测量的第一次循环之外,所有随后的循环特征为在充电过程中使用0.05C的结束电流标准的恒定电流-恒定电压。在每一次充电和放电之间允许对于第一次循环30分钟的停止时间并且对于所有随后的循环10分钟的停止时间。不可逆容量Qirr.以%表示为:在0.2C、0.5C、1C、2C和3C下的倍率性能表示为在保留的放电容量DQn(其中n=2、3、4、5和6对应地nC=0.2C、0.5C、1C、2C和3C)之间的比率,如下:例如3C-倍率(以%计)=(DQ6/DQ1)×100。(ii)部分II是在1C下的循环寿命的评价。钮扣电池程序1和2仅仅区别在于充电截止电压,对于程序1和2对应地是4.5V和4.3V/Li金属。在4.5V/Li金属下的放电容量是在0.1C下循环7下和1C下循环8下测量的。在0.1C和1C下的容量衰减如下计算并且每100次循环以%表示:以%计/100次循环,以%计/100次循环。在0.1C和1C下的能量衰减如下计算并且每100次循环以%表示。是在循环n下的平均电压。以%计/100次循环,以%计/100次循环。(iii)部分III是在4.5与3.0V/Li金属之间使用1C-倍率充电和1C-倍率放电的加速的循环寿命实验。容量和能量衰减如下计算:以%计/100次循环,以%计/100次循环,b)全电池制造650mAh的袋型电池制备如下:如以上描述的制备正电极活性材料粉末,将作为正电极导电剂的超导炭黑(Super-P)(从特密高公司(Timcal)可商购的Super-PTMLi)和石墨(从特密高公司可商购的KS-6)以及作为正电极粘合剂的聚偏二氟乙烯(从吴羽公司(Kureha)可商购的PVdF1710)添加到作为分散介质的NMP(N-甲基-2-吡咯烷酮)中,使得该正电极活性材料粉末、该正电极导电剂、与该正电极粘合剂的质量比设定为92/3/1/4。此后,捏合该混合物来制备一种正电极混合物浆料。然后将所产生的正电极混合物浆料施加在由15μm厚的铝箔制成的正电极集电体的两侧上。所施加的面积的宽度是43mm并且长度是450mm。典型的阴极活性材料载量是13.9mg/cm2。然后干燥该电极并且使用100Kgf的压力压延该电极。典型的电极密度是3.2g/cm3。此外,将充当正电极集电体接片(tab)的铝板电弧焊接到该正电极的末端部分上。使用可商购的负电极。简言之,将以96/2/2质量比的石墨、CMC(羧基-甲基-纤维素-钠)和SBR(苯乙烯-丁二烯-橡胶)的混合物施加在铜箔的两侧上。将充当负电极集电体接片的镍板电弧焊接到该负电极的末端部分上。典型的用于电池平衡的阴极和阳极放电容量比率是0.75。通过在以1:2的体积比的EC(碳酸亚乙酯)和DEC(碳酸二乙酯)的混合溶剂中以1.0mol/L的浓度溶解六氟磷酸锂(LiPF6)盐获得了非水性电解质。使用卷绕芯棒成螺旋形地缠绕正电极片、负电极片、以及在它们之间插入的由20μm厚度的微孔聚合物膜(从卡尔格德(Celgard)可商购的2320)制成的隔膜片,以便获得成螺旋形地缠绕的电极组件。然后在具有-50℃的露点的干空气室中将所缠绕的电极组件和该电解质放入铝层压的小袋中,使得制备了平的袋型锂二次电池。当充电到4.20V时,该二次电池的设计容量是650mAh。在室温下浸渍非水性电解质溶液8小时。同样在室温下,将该电池预充电其理论容量的15%并且老化1天。然后使用-760mmHg的压力脱气该电池30秒,并且密封该铝袋。如下制备该电池用于使用:使用0.2C(其中1C=650mA)的电流以CC模式(恒定电流)充电该电池直到4.2V然后CV模式(恒定电压)直到到达C/20的截止电流,之后以CC模式以0.5C倍率放电直到下降到2.7V的截止电压。c)循环寿命实验在以下条件下在25℃和45℃两者下将该锂二次全电池电池组充电和放电若干次以确定它们的充电-放电循环性能:-以CC模式在1C倍率下进行充电直到4.2V,然后CV模式直到达到C/20,-然后将该电池设定为停止10min,-以CC模式在1C倍率下完成放电直到2.7V,-然后将该电池设定为停止10min,-进行充电-放电循环直到该电池达到80%的保留容量。每100次循环,在0.2C倍率下以CC模式完成放电直到2.7V。在第n次循环下的保留容量计算为在循环n下所获得的放电容量与在循环1下所获得的放电容量的比率。d)XRDXRD图案是在RigakuD/MAX2200PCX射线衍射仪上以0.02度的步长在17-1442θ范围内记录的。扫描速度设定为每分钟1.0度。具有θ/2θBraggBrentano几何学的测角仪具有185mm的半径。铜靶X射线管是在40KV和40mA下操作。衍射束单色仪(基于弯曲的石墨晶体)被用于去除KBetaCu辐射。所收集的XRD图案包括使用常规的闪烁计数器检测器具有以1/2的Iα2/Iα1强度比的典型的波长和的KαCu辐射。入射光束光学设置包括10mm发散高度限制的狭缝(DHLS)、1度发散狭缝(DS)和5度竖直索勒狭缝。衍射光束光学设置包括1度反散射狭缝(SS)、5度竖直索勒狭缝和0.3mm接收狭缝(RS)。不同材料的结晶度是从(003)和(104)峰的半峰全宽(FWHM)计算的,其中hkl密勒指数(millerindices)对应于具有R-3m空间群的O3类型六方晶格,如由J.J.Braconnier、C.Delmas、C.Fouassier、和P.Hagenmuller,Mat.Res.Bull.(材料研究报告)15,1797(1980)定义的。通过对于(003)和(104)峰对应地在17与20之间的2θ以及在43与43.5之间的2θ使用如在来自日本理学(Rigaku)的“积分分析v6.0”软件中实施的Sonnevelt-Visser算法进一步减去背景贡献并且消除Kα2确定FWHM上。已经使用如下pseudo-Voigt函数在消除Kα2之后通过局部拟合实验强度Iobs.计算了015、018、110和113反射的FWHM:其中:I0是背景值(以计数计),n是在间距上所考虑的衍射峰的数目,Ii、μi、2θ0,i和FWHMi对应地是峰i(其中i=1...n)的pseudo-Voigt分布的高度(以计数计)、Lorentzian-Gaussian混合比率、2θ0位置(以2θ度计)和FWHM(以2θ度计)。在63~702θ范围上使用n=3个峰拟合的这样pseudo-Voigt的一个实例示出于图15中。018、110和113峰与平方相关系数R2很好地拟合,超过99.5%。诸位作者强调在这样条件下的FWHM确定是一个繁琐的操作并且可以使用大量不同的学术/开放式/商业的软件完成。e)材料硬度评价材料硬度是通过在单轴向应力下的粒径发展估算的,如下:-将阴极活性材料放入一个不锈钢造粒模(pelletdie)中并且施加100、200和300MPa的单轴向压力。然后使用手指轻轻地散开所获得的粒料以获得用于激光粒径分布测量的疏松的粉末。使用强解聚方法(如玛瑙研钵)不适合于这个步骤,因为这些颗粒将进一步破碎并且细颗粒的分数将增加。-在将粉末分散在水性介质之后,该激光粒径分布使用MalvernMastersizer2000(具有Hydro2000MU湿分散附件)测量。为了改进该粉末在该水性介质中的分散,施用足够的超声辐照,对于12的超声位移典型地1分钟,并且搅拌并且引入一种适当的表面活性剂。-硬度强度指数(HSI)定义如下:其中:-D10P=0是非限制粉末(P=0MPa)的D10值,-Γ0(D10P=0)是在D10P=0下非限制粉末的累积体积粒径分布。注意,根据定义Γ0(D10P=0)总是等于10%。-ΓP(D10P=0)是在D10P=0下使用P=100、200和300MPa压制样品的累积体积粒径分布。这个值可以通过在图上直接读数或通过使用拟合函数的局部近似确定。在单轴向压缩应力之后ΓP(D10P=0)值的增加是颗粒已经破裂成更小颗粒的直接证据。ΔΓ(P)是与Γ0(D10P=0)相比ΓP(D10P=0)的相对增加并且以%表示。因此在ΓP(D10P=0)上的变化和ΔΓ(P)是用于确定根据本发明的阴极粉末的HSI的定量测量。对于实例1,随单轴向应力而变化的累积粒径的此类发展示出于图1中,并且在图2中更明确(还参见以下)。在一个实施例中,根据本发明的粉末状锂混合的金属氧化物具有增加了不大于100%+(1-2a-b)×160%(在200MPa下)、在另一个实施例中150%+(1-2a-b)×160%(在300MPa下)并且在再另一个实施例中125%+(1-2a-b)×100%(在300MPa下)的ΔΓ(P)值;其中在阴极化合物Li1+x[Ni1-a-b-cMaM’bM”c]1-xO2-z中,a和b是对应地是Mn和Co的摩尔含量。f)压制密度如下测量压制密度:将3克粉末填充到具有1.300cm直径“d”的造粒模中。施加2.8吨(对应于207MPa的压力)的单轴向荷载持续30秒。在释放该荷载之后,测量所压制粉末的厚度“t”。然后如下计算球粒密度:3/(π×(d/2)2×t),以g/cm3计。此外,测量了在300MPa荷载下的粉末的密度并且给出了关于由于二次颗粒破裂成更小的颗粒的压制密度增加的信息。具体地,更小的颗粒通过填充二次颗粒填料的空隙而增加了表观密度。二次颗粒破裂并且创造的细粉越多,密度越大。这个特性在表中被列为在300MPa下的密度并且如下计算:3/(π×(d/2)2×t),以g/cm3计;其中“d”是该模口的直径(等于1.3cm)并且“t”是在300MPa荷载下该粒料的厚度。g)BET比表面积该比表面积采用布鲁诺尔-埃米特-泰勒(Brunauer-Emmett-Teller)(BET)法使用MicromeriticsTristar3000测量。在测量之前,将3g粉末样品在300℃下真空干燥持续1h,以便去除吸附的物种。“真实的”BET如下测量:将10g粉末样品浸入至100g水中并且室温下搅拌10分钟。然后使用具有抽吸的布氏过滤去除水溶液。收集洗涤的粉末并且在120℃下干燥3h。然后使用与同前相同的实验条件测量洗涤的粉末的真实的BET。一旦所有的Li盐(如LiOH、Li2CO3、Li2SO4、…)在高于4V的电位下已经溶解于该电解质中,真实的BET被认为代表了在全电池中看到的BET。在这种情况下,宝贵的定性信息在颗粒的微孔性上给出;例如预期的是孔越小,真实的BET越大。h)残余Li2CO3和LiOH滴定碱含量是材料表面特性,该表面特性可以通过分析表面与水之间的反应产物而定量地测量。如果将粉末浸到水中,则会发生表面反应。在该反应过程中,水的pH增加(随着碱性化合物溶解),并且该碱通过pH滴定来定量。滴定的结果是“可溶性碱含量”(SBC)。可以如下测量可溶性碱的含量:当Ni3+含量<0.4时将100ml去离子水添加到20g的阴极粉末中并且当Ni3+含量≥0.4时将100ml去离子水添加到4g的阴极粉末中,随后搅拌10分钟。然后通过使用具有抽吸的布氏过滤去除水溶液,由此获得>90g的包含可溶性碱的澄清溶液。在搅拌下在以0.5ml/min的速率添加0.1MHCl的过程中通过记录pH特征曲线直到pH达到3滴定可溶性碱的含量。通过滴定以低浓度溶解在去离子水中的LiOH和Li2CO3的适合的混合物获得了基准电压特征曲线。在几乎所有的情况下,观察到两个不同的平台。具有在pH8~9之间的端点γ1(以mL计)的上平台是OH-/H2O接着是CO32-/HCO3-,具有在pH4~6之间的端点γ2(以mL计)的下平台是HCO3-/H2CO3。在第一和第二平台γ1之间的拐点以及在第二平台γ2之后的拐点是从该pH特征曲线的导数dpH/dVol的相应的最小值获得的。该第二拐点总体上接近于pH4.7。然后以LiOH和Li2CO3重量百分数表示的结果如下:i)用于硫滴定的ICP使用Agilent720系列设备使用电感耦合等离子体原子发射光谱法(ICP-OES)测量硫含量。分析结果以重量百分数表示。在以下实例中进一步对本发明进行说明:实例1通过使用一种常规的高温烧结制备实例1(EX1)的粉末状阴极材料。以1.01的Li:M摩尔比混合Li2CO3(凯密特尔(Chemetall))和具有5/3/2的Ni/Mn/Co摩尔比的优美科公司(Umicore)大量生产的金属羟基氧化物前体,产生Li1.005Ni0.498Mn0.299Co0.199O2或Li1.005[Ni0.5Mn0.3Co0.2]0.995O2的通用组成。使用试用规模的装置使该混合物在910℃的温度下反应持续10小时。然后将烧结的饼粉碎并且分类以便获得非团聚粉末,其中平均粒径D50为9.9μm。电化学和物理特性示出于表1至7中。实例2通过使用常规的高温烧结制备实例2(EX2)的粉末状阴极材料。以1.01的Li:M摩尔比混合Li2CO3(凯密特尔)和具有5/3/2的Ni/Mn/Co摩尔比的优美科公司大量生产的金属羟基氧化物前体,产生Li1.005[Ni0.5Mn0.3Co0.2]0.995O2的通用组成。使用试用规模的装置使该混合物在930℃的温度下反应持续10小时。然后将烧结的饼粉碎并且分类以便获得非团聚粉末,其中平均粒径D50为10μm。电化学和物理特性示出于表1至7中。对照实例1:通过使用常规的高温烧结制备对照实例1(CEX1)的粉末状阴极材料。以1.01的Li:M摩尔比混合Li2CO3(凯密特尔)和具有5/3/2的Ni/Mn/Co摩尔比的优美科公司大量生产的金属羟基氧化物前体,产生Li1.005[Ni0.5Mn0.3Co0.2]0.995O2的通用组成。使用试用规模的装置使该混合物在950℃的温度下反应持续10小时。然后将烧结的饼粉碎并且分类以便获得非团聚粉末,其中平均粒径D50为10μm。电化学和物理特性示出于表1至7中。实例3通过使用常规的高温烧结制备实例3(EX3)的粉末状阴极材料。以1.01的Li:M摩尔比混合LiOH.H2O(SQM)和具有6/2/2的Ni/Mn/Co摩尔比的优美科公司大量生产的金属羟基氧化物前体,产生Li1.005Ni0.597Mn0.199Co0.199O2或Li1.005[Ni0.6Mn0.2Co0.2]0.995O2的通用组成。使用试用规模的装置使该混合物在860℃的温度下反应持续10小时。然后将烧结的饼粉碎并且分类以便获得非团聚粉末,其中平均粒径D50为11.6μm。电化学和物理特性示出于表1至7中。实例4通过使用常规的高温烧结制备实例4(EX4)的粉末状阴极材料。以1.01的Li:M摩尔比混合Li2CO3(凯密特尔)和具有6/2/2的Ni/Mn/Co摩尔比的优美科公司大量生产的金属羟基氧化物前体,产生Li1.005[Ni0.6Mn0.2Co0.2]0.995O2的通用组成。使用试用规模的装置使该混合物在870℃的温度下反应持续10小时。然后将烧结的饼粉碎并且分类以便获得非团聚粉末,其中平均粒径D50为12.8μm。电化学和物理特性示出于表1至7中。对照实例2:通过使用常规的高温烧结制备对照实例2(CEX2)的粉末状阴极材料。以1.01的Li:M摩尔比混合Li2CO3(凯密特尔)和具有6/2/2的Ni/Mn/Co摩尔比的优美科公司大量生产的金属羟基氧化物前体,产生Li1.005[Ni0.6Mn0.2Co0.2]0.995O2的通用组成。使用试用规模的装置使该混合物在890℃的温度下反应持续10小时。然后将烧结的饼粉碎并且分类以便获得非团聚粉末,其中平均粒径D50为12.8μm。电化学和物理特性示出于表1至7中。实例5、6和7这些实例将证明颗粒脆性和循环寿命可以通过改变Li:M组成受到影响。通过使用常规的高温烧结制备实例5、6和7(EX5、6和7)的粉末状阴极材料。混合Al2O3粉末、LiOH.H2O(SQM)和具有84.2/15.8的Ni/Co摩尔比的优美科公司大量生产的Ni、Co羟基氧化物前体,以便实现对于EX5、EX6和EX7对应地81.7/15.3/3.0的Ni/Co/Al摩尔比和等于0.98、1.00和1.02的Li:M。在775℃的温度下在O2流(4m3/Kg)中使用实验室规模的设备进行热处理持续10小时。然后将烧结的饼粉碎并且分类以便获得非团聚粉末,其中平均粒径D50为约12至13μm。电化学和物理特性示出于表1至7中。截面SEM和颗粒SEM示出于图8中。实例8、9和10这些实例将证明颗粒脆性和循环寿命可以通过改变Li:M组成和掺杂剂浓度受到影响。通过使用常规的高温烧结制备实例8、9和10(EX8、9和10)的粉末状阴极材料。混合Al2O3粉末、LiOH.H2O(SQM)和具有84.2/15.8的Ni/Co摩尔比的优美科公司大量生产的Ni-Co羟基氧化物前体,以便实现对于EX8和EX9对应地81.7/15.3/3.0的Ni/Co/Al摩尔比和等于0.98和1.00的Li:M并且对于EX10的82.8/15.5/1.7的Ni/Co/Al摩尔比和等于1.00的Li:M。在775℃的温度下在O2流(4m3/Kg)中使用中试规模的设备进行热处理持续10小时。然后将烧结的饼粉碎并且分类以便获得非团聚粉末,其中平均粒径D50为约12至13μm。电化学和物理特性示出于表1-7中。室温和45℃的全电池性能对应地在图11和12中示出。颗粒SEM在图13中示出。实例11、12、13、14和15通过以1.01的Li:M摩尔比混合Li2CO3(凯密特尔)和具有5/3/2的Ni/Mn/Co摩尔比的优美科公司大量生产的金属羟基氧化物前体制备200g的阴极材料并且使用马弗炉在910℃下使该混合物反应10小时。该通用组成是Li1.010Ni0.495Mn0.297Co0.198O2或Li1.010[Ni0.5Mn0.3Co0.2]0.990O2。然后将烧结的饼粉碎并且使用270目尺寸筛(53μm开口)筛分20g粉碎的产物,产生实例11(EX11)。Dmax=D100是799.5μm并且如不经过该筛的材料的重量部分确定的筛上粒分数(oversizefraction)是60.7%。BET是0.250m2/g。使用一个CremaniaCG-01150W研磨机研磨20g粉碎的产物15秒,产生实例12(EX12)。Dmax是38.7μm并且如不经过该筛的材料的重量部分确定的筛上粒分数是9.0%。BET是0.299m2/g。使用CremaniaCG-01150W研磨机研磨20g粉碎的产物30秒,产生实例13(EX13)。Dmax是38.2μm并且如不经过该筛的材料的重量部分确定的筛上粒分数是6.2%。BET是0.294m2/g。使用CremaniaCG-01150W研磨机研磨20g粉碎的产物60秒,产生实例14(EX14)。Dmax是33.1μm并且如不经过该筛的材料的重量部分确定的筛上粒分数是4.4%。BET是0.343m2/g。使用CremaniaCG-01150W研磨机研磨20g粉碎的产物300秒,产生实例15(EX15)。Dmax是32.0μm并且如不经过该筛的材料的重量部分确定的筛上粒分数是0.0%。BET是0.821m2/g。EX11至EX15的物理特性在表10中示出。由于团聚的颗粒,粉碎的产物EX11具有最低的BET和最大的筛上粒分数以及最大的Dmax值。EX11具有提供低的产品生产量(由于大的筛上粒分数)和差的制成均匀电极的能力(由于大尺寸的团聚体)的问题。因此EX11不适合于作为锂电池阴极材料的应用并且要求适当的解聚。通过增加研磨时间(从15至300秒)制备EX12至EX15,其结果是筛上粒分数和Dmax连续减小并且BET连续增加。筛上粒部分的减少是一种积极作用,因为产品生产量增加。然而,BET增加不是令人希望的,因为与电解质的寄生反应速率增加。特别地,诸位作者预期由于BET表面增加在EX15中的副反应将比在EX14中的进行的快约2.4倍。因此,在本发明的实施例中,仅仅研磨条件的特定选择允许控制Dmax、BET和筛上粒分数。讨论:EX1、EX2和CEX1具体地EX1、EX2和CEX1的特征为具有不同的ΔΓ(P=300MPa)值,从83.7%(对于EX1)、116.4%(对于EX2)增加至266.4%(对于CEX1)(在EX1的情况下表3中的数据是衍生自图1和2,对于EX2与CEX1获得了相似的图)。这个ΔΓ(P)的发展指示了与EX1和EX2相比当在CEX1中施加200MPa和300MPa的单轴向应力时,更多的颗粒破裂成更小的颗粒。钮扣电池循环寿命示出了(在表1中)容量衰减和能量衰减两者在4.5V下从EX1、EX2至CEX1增加。具体地,在较高充电/放电1C和1C/1C倍率下循环稳定性的改进是更显著的。使用EX1、EX2和CEX1的全电池电池组如在实验概述中描述的制造。对于EX1、EX2和CEX1实现了约3.20g/cm3的电极密度,其非常接近于当在208MPa下压制时粉末的密度值。在室温下随循环数而变化的保留容量的发展示出于图3中,并且在45℃下示出于图4中(对于每一个,顶部的点线是用于Ex1,中间的是用于Ex2并且底部的线是用于CEX1)。EX1示出了最好的保留容量,其中在室温下在2000次循环之后保留容量优于80%以及在45℃下在816次循环之后保留容量优于80%(表5)。在要求长循环寿命的应用如电动车辆或栅极存储的情况下,这样高的保留容量是特别非常适合的。相对地,CEX1证明了差的全电池循环性能。结论:在室温和45℃两者下循环时,在P=200和300MPa下的ΔΓ(P)的减小非常好地与在4.5V下的钮扣电池衰减的减小和全电池保留容量的改进相符。SEM图像(图5)的细致观察示出了:(i)与EX1(图5a)相比在CEX1(图5c)的情况下,初级颗粒的尺寸更发展。这是与003、104、015、018、110和118的FWHM的增加相一致,这归因于相干域的较小尺寸,因此初级颗粒的较小尺寸(表7和图14-15)。(ii)与EX1和EX2相比,在CEX1的颗粒内部,纳米空隙和孔(典型地10~100nm尺寸)的密度更高。EX1、EX2和CEX1具有接近0.30m2/g的类似的BET值(表4)。然而,它们真实的BET非常不同并且与CEX1相比EX1和EX2实质上高了约0.50m2/g。那么纳米孔的存在在EX1和EX2中也是预期的,但是具有比CEX1中的材料小得多的特征尺寸。作者的观点是与EX1和EX2相比,对于CEX1在电化学循环时,较大的结晶度和内孔隙率的存在以及具有大浓度和大特征尺寸(典型地超过10nm尺寸)的空隙是增强颗粒破裂的因素,并且因此使这些颗粒对于单轴向应力较不耐受性并且更易碎。在本发明中示出的是颗粒的内孔隙率可以通过工艺条件并且在这种情况下通过降低烧结温度控制。如随后在其他实例中示出的,其他适合的参数包括不同的Li:M比率和不同的杂质(如锂盐基物种)含量,这些参数影响晶界的稳定性并且因此增加了脆性。例如,过量的LiOH、Li2CO3和Li2SO4导致这些物种在晶界处的累积,晶界的不稳定以及最终增加的脆性。总之,EX1和EX2是本发明的实施例;CEX1是一个对照实例。EX3、EX4和CEX2同样地,EX3、EX4和CEX2遵循与EX1、EX2和CEX1相同的在循环稳定性与颗粒脆性之间的关系:ΔΓ(P)越低,钮扣电池和全电池循环寿命越好。具体地,EX3是优越的,在室温和45℃下分别超过1400次循环和超过1000次循环(图6-7)。当热处理温度增加时,观察到在颗粒内相同的空隙夹杂物和晶粒裂纹(图8-9)。然而,EX3、EX4和CEX2与EX1、EX2和CEX1的不同在于更大量的有效的Ni3+,EX1、EX2和CEX1中是0.2并且在EX3、EX4和CEX2中是0.4。与EX1、EX2和CEX1相比,这个较高的Ni3+含量产生约10mAh/g的较高的CQ1和DQ1值。残余的LiOH和Li2CO3含量还大量增加。具体地,EX1和EX3具有类似的结晶度(如通过XRDFWHM值示出的)但是EX3的颗粒具有比EX1更多破裂的倾向。其结果是,尤其在室温下,EX3的纽扣电池和全电池电化学特性不如EX1。与EX1相比EX3在45℃下的更好的循环寿命可能通过关于电解质氧化(由于不同的Ni/Mn/Co组成)不同的表面化学性质而解释并且这不被诸位作者很好地理解;但超过EX4和CEX2的改进被认为是与较低的脆性相关。EX5、EX6和EX7EX5、EX6和EX7不同在于它们增加的Li:M比率并且其结果是很多特性不同。严格地并且如在前言中解释的,有效的Ni3+含量随着Li:M增加,但是在这种情况中该Ni3+含量将被认为是恒定的并且等于0.817。钮扣电池评价示出了DQ1随着Li:M比率不断地增加,但是与此同时0.1C和1CQfad和Efad两者退化。注意到在4.5V下的1C/1C循环寿命不允许区别产品;充电和放电的深度,意味着从阴极材料可逆地脱出的Li的量太高,这拉平了差异。残余的LiOH和Li2CO3含量也随着Li:M增加。截面SEM(图10)示出了在颗粒内的空隙的密度和尺寸随着Li:M增加。XRDFWHM值(表7)也随着Li:M减小而增加,意思是结晶度随着Li:M减小。ΔΓ(P)硬度特性(表3)示出了更复杂的行为:如从SEM和XRD预期的,EX5具有最低的ΔΓ(P)和最好的纽扣电池特性。EX6和EX7具有比EX5更大的ΔΓ(P)值,尽管是相同的。EX7的粒径分布的仔细检查显示了<3μm体积分数是大约2%并且比EX5和EX6更高。实际上,尽管所有的样品具有在10~14μm之间接近的D50,但是EX7是这项研究的特征为这个<3μm分数的高值的唯一实例。诸位作者相信在粉末的后处理步骤过程中产生了这些细颗粒并且这些细颗粒是EX7超过EX6的更易碎特征的证据。作为结论,对于EX5、EX6和EX7,随着Li:M增加的残余碱含量和增加的结晶度导致更大的颗粒脆性。EX8、EX9和EX10对应地,EX8和EX9试图在中试规模上复制EX5和EX6,以便测量全电池特性。尽管在EX8与EX5之间以及EX9与EX6之间在特性上存在系统的偏移,但是在EX8与EX9之间的差异与对于EX5和EX6所报道的一致。与EX9相比,EX8示出了0.1C和1CQfad和Efad纽扣电池衰减的显著改进并且再次与ΔΓ(P)的减小很好地匹配。对于EX8展示的,全电池循环寿命在室温下是类似的但是在45℃下改进了约10%更多的循环。参见图11-12。截面SEM示出于图13中。与EX9相比,EX10具有更低的Al和Co含量,导致更高的Ni3+含量。EX10的ΔΓ(P)大幅度增加超过EX9并且0.1C和1CQfad和Efad纽扣电池和全电池室温和45℃循环稳定性降低。表1:使用程序1(4.3-4.5-4.5V/Li金属)的钮扣电池评价。表2:使用程序2(4.3-4.3-4.5V/Li金属)的钮扣电池评价。表3:脆性特性。(1)对于P=200MPa,100%+(1-2a-b)×160%(2)对于P=300MPa,150%+(1-2a-b)×160%(3)对于P=300MPa,125%+(1-2a-b)×100%表4:物理特性。表5:在室温和45℃下在全电池中达到80%保留容量的循环数。样品RT循环数45℃循环数EX1>2000816EX21075735CEX1938614EX31450>1000EX41230567CEX21139567EX5----EX6----EX7----EX81658453EX91681409EX101024329表6:粒径分布。表7:003、104、015、018、110和113峰的FWHM和2θ位置。单位是2θ度。表8:用于评价EX1、EX2、EX3、EX4、CEX1和CEX2的钮扣电池程序1。1C定义是160mA/g。表9:用于评价EX5、EX6、EX7、EX8、EX9和EX10的钮扣电池程序2。1C定义是160mA/g。表10:EX11至EX15的物理特性。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1