用于表征植物行为的方法和系统与流程
本申请要求2014年4月28日提交的美国临时专利申请号61/985,308的优先权的权益,其内容通过引用以其整体结合到本文中。
发明领域和背景
本发明在其某些实施方案中涉及农业,更具体但并非唯一地讲涉及用于表征植物行为的方法和系统。
由于农业扩展到之前未开垦区域所致,新的非生物胁迫抗性栽培种(即对诸如干旱、极端温度或盐分等胁迫条件有抗性的栽培种)的全世界的开发生产正在增长。所述区域常常遇到土壤肥力低、可变盐分的地下水、对水浸的敏感性、灌溉水品质恶化和用含高氯化物浓度的边际水灌溉。预期全球变暖的威胁和气象条件和降水水平的相关波动加快农业扩展到之前未开垦区域。
许多植物种对非生物胁迫的主要和直接反应是生长速率下降,这最终导致产量显著降低。在非生物胁迫下生长速率下降的原因中有根传导性降低,这引起突然的气孔关闭,导致蒸腾速率和光合作用降低。植物能够利用多种胁迫防御机制(尤其例如渗透压调节、抗氧化保护和离子内环境稳定机制)应付非生物胁迫。这些机制使植物甚至在胁迫条件下都能够完成其生命周期同时维持某种产量水平。
两种主要方法通过产生新的胁迫抗性栽培种来应付这些问题。第一种是使用不同候选基因的基因工程,第二种是传统育种。然而,由于田间的土壤质地、水分含量和盐分的空间变异、盐分和变化的光强度,故难以评价胁迫条件下的植物产量。
本申请的同一发明人的WO2010/049939涉及在两种或更多种植物的群体中鉴定一种或多种植物的系统和方法。所述方法包括监测该群植物的一个或多个参数并产生表明一个或多个参数的值的一个或多个时间信号。对信号进行处理以计算随一个或多个时间间隔各自的推移各植物的蒸腾速率和蒸腾速率的变化率的一个或两个。然后应用包括所计算的蒸腾速率的算法以评定植物的等级,鉴定出等级高于预定等级的植物。
发明概述
按照本发明一些实施方案的一个方面,提供用于表征植物的系统。该系统包括多个传感器,所述传感器经配置以感测表明出自全植物的蒸腾速率的第一参数和表明进入全植物的吸水速率的第二参数。该系统还包括处理器,所述处理器经配置接收来自传感器的信号,对信号进行处理以计算两个参数,并根据计算的参数表征植物。在本发明的一些实施方案中,处理器经配置以时刻计算第一参数和第二参数的至少一个。按照本发明的一些实施方案,处理器经配置以时刻计算第一参数和第二参数两者。
按照本发明的一些实施方案,处理器经配置以根据计算的参数来计算分值。
按照本发明的一些实施方案,植物是一群植物的成员,且处理器经配置以计算该群中各植物的分值,并根据分值评定该群的植物的等级。
按照本发明的一些实施方案,传感器包括用于感测第二参数的土壤含水量传感器和用于感测第一参数的重量传感器。
按照本发明的一些实施方案,该系统包括含有土壤和水并经设定以接受植物的容器,其中重量传感器是经布置以感测容器及其内含物的重量或重量变化的测压元件(load cell)。
按照本发明的一些实施方案,容器被覆盖以减少或防止水从容器中蒸发。
按照本发明的一些实施方案,处理器经配置以时刻从由测压元件产生的时间相关信号计算蒸腾速率,从而提供蒸腾速率的时间相关性。
按照本发明的一些实施方案,处理器经配置以根据蒸腾速率的时间相关性计算蒸腾速率的变化率。
按照本发明的一些实施方案,处理器经配置以时刻从由土壤含水量传感器产生的时间相关信号计算吸水速率,从而提供吸水速率的时间相关性。
按照本发明的一些实施方案,处理器经配置以从吸水速率的时间相关性计算吸水速率的变化率。
按照本发明的一些实施方案,处理器经配置以计算植物的水分利用效率。
按照本发明的一些实施方案,该系统包括经配置用于测量表明大气水分需要的其它参数的装置,其中处理器经配置以从装置接收时间相关信号,计算其它参数,并计算第一参数和其它参数间的比率。
按照本发明的一些实施方案,处理器经配置以计算蒸腾速率并将计算的蒸腾速率归一化至选自以下的至少一个归一化量值(normalizing quantity):植物叶表面积、叶的气孔密度和土壤水分含量。
按照本发明的一些实施方案,处理器经配置以将植物归类为至少一个分类群。
按照本发明的一些实施方案,处理器经配置以将植物归类为以下之一的分类群:(i)显示等水行为(isohydric behavior)的植物的分类群,和(ii)显示非等水行为的植物的分类群。
按照本发明的一些实施方案,处理器经配置以计算叶相对含水量的变化性,且其中分类依照变化性进行。
按照本发明的一些实施方案,处理器经配置以计算嫩枝重量比和根摄入率,且其中变化性根据嫩枝重量比和根摄入率间的差异计算。
按照本发明的一些实施方案,处理器经配置以接收至少一种水通道蛋白的表达谱,且其中分类部分基于所接收的表达谱。
按照本发明的一些实施方案,处理器经配置以根据参数的至少一个估算全植物导水率,且其中分类部分基于植物导水率。
按照本发明一些实施方案的一个方面,提供表征植物的方法。所述方法包括从多个传感器接收信号,所述信号与表明出自全植物的蒸腾速率的第一参数和表明进入全植物的吸水速率的第二参数有关。所述方法进一步包括处理信号以计算两个参数,并根据计算的参数表征植物。在本发明的一些实施方案中,时刻计算第一参数和第二参数的至少一个。在本发明的一些实施方案中,时刻计算第一参数和第二参数两者。
按照本发明的一些实施方案,所述方法包括根据计算的参数计算分值。
按照本发明的一些实施方案,所述方法包括可控制地改变植物所暴露的环境条件,并在改变后重新计算分值。
按照本发明的一些实施方案,所述方法包括选择针对其计算的分值高于预定阈值的环境条件的范围。
按照本发明的一些实施方案,植物是一群植物的成员,所述方法包括计算该群中各植物的分值,并根据分值评定植物的等级。
按照本发明的一些实施方案,所述方法包括选择植物群所暴露的环境条件,其中等级评定与所选的环境条件有关。
按照本发明的一些实施方案,计算包括时刻从由测压元件产生的时间相关信号计算蒸腾速率,从而提供蒸腾速率的时间相关性。
按照本发明的一些实施方案,所述方法包括根据蒸腾速率的时间相关性计算蒸腾速率的变化率。
按照本发明的一些实施方案,计算包括时刻从由土壤含水量传感器产生的时间相关信号计算吸水速率,从而提供吸水速率的时间相关性。
按照本发明的一些实施方案,所述方法包括从吸水速率的时间相关性计算吸水速率的变化率。
按照本发明的一些实施方案,所述方法包括计算植物的水分利用效率。
按照本发明的一些实施方案,所述方法包括接收与表明大气水分需要的其它参数有关的时间相关,其中所述方法包括计算其它参数和第一参数和其它参数间的比率。
按照本发明的一些实施方案,所述方法包括使计算的蒸腾速率归一化至选自以下的至少一个归一化量值:植物叶表面积、叶的气孔密度和土壤水分含量。
按照本发明的一些实施方案,所述方法包括将植物归类为至少一个分类群。
按照本发明的一些实施方案,所述方法包括将植物归类为以下之一的分类群:(i)显示等水行为的植物的分类群,和(ii)显示非等水行为的植物的分类群。
按照本发明的一些实施方案,所述方法包括计算叶相对含水量的变化性,其中分类根据变化性进行。
按照本发明的一些实施方案,所述方法包括计算嫩枝重量比和根摄入率,其中变化性根据嫩枝重量比和根摄入率间的差异计算。
按照本发明的一些实施方案,所述方法包括根据参数的至少一个估算全植物导水率,且其中分类至少部分地基于植物导水率。
除非另有定义,否则本文所用的所有技术和/或科学术语具有本发明所属领域普通技术人员通常理解的相同含义。虽然类似或等同于本文所述那些方法和材料的方法和材料可用于本发明实施方案的实施或测试,但下面描述了示例性的方法和/或材料。万一有抵触,将以本专利说明书(包括定义)为准。另外,材料、方法和实施例只是说明性的,无意是必然限制性的。
本发明实施方案的方法和/或系统的实施可包括以手工、自动或其组合进行或完成选定的任务。此外,按照本发明的方法和/或系统的实施方案的实际仪器和设备,可利用操作系统,通过硬件、软件或固件或其组合执行若干选定的任务。
例如,按照本发明的实施方案,用于进行选定任务的硬件可作为芯片或回路实施。作为软件,本发明实施方案的选定任务可利用任何合适的操作系统以多个被计算机执行的软件指令实施。在本发明的一个示例性实施方案中,本文所述方法和/或系统的示例性实施方案的一个或多个任务通过数据处理器(例如用于执行多个指令的计算平台)进行。任选数据处理器包括用于存储指令和/或数据的易失性存储器和/或用于存储指令和/或数据的持久性存储器,例如硬磁盘和/或可移动介质。任选还提供网络接线。还任选提供显示器和/或用户输入装置(例如键盘或鼠标)。
若干附图简述
本文参照附图,仅通过举例描述了本发明的一些实施方案。虽然现详细具体地参照附图,但要强调的是所示细节仅通过举例并用于说明性论述本发明的实施方案的目的。在这一方面,随附图一起的描述使本领域技术人员清楚可如何实施本发明的实施方案。
附图中:
图1A显示由于在夜晚和随后的白天时间内的蒸腾所致温度受控温室中生长的对照番茄植物的重量变化;
图1B显示图1A植物的计算的全植物蒸腾(WPT);
图2A-C分别显示植物、湿灯芯(wet wick)和恒重的重量变化速率中的平均和叠加振荡;
图3A-C分别显示图2A、2B和2C示图的自相关函数;
图3B-F分别显示全植物、浸水灯芯(submerged wick)和恒重残差时间系列的波谱;
图4A显示5天脱水对瞬间WPT速率的作用(平滑振荡的);
图4B显示在图4A的平滑图形上叠加的WPT速率中观察到的振荡图形;
图4C显示湿灯芯的平滑和振荡蒸发速率;
图4D显示在图4C的平滑图形上叠加的蒸发的振荡图形;
图5A-F显示典型番茄全植物、切离嫩枝的平滑WPT速率和叠加振荡及湿灯芯的蒸发速率和叠加振荡;
图6A-C显示ABA缺陷型sitiens植物和对照植物的振荡和平滑WPT速率及湿灯芯的蒸发速率和叠加振荡的代表性结果;
图7A-D显示两株杨树(银白杨(Populus alba))植物的振荡和平滑WPT速率及湿灯芯的蒸发速率和叠加振荡的代表性结果;
图8A-B显示对照植物和突变体植物;
图9A和9B分别显示图8中的对照植物和突变型植物的蒸腾;
图10显示图8中的对照植物和突变型植物的气孔孔径大小;
图11是适于表征本发明一些实施方案的一种或多种植物的系统的示意图;
图12A-C显示与图12C所示参比(浸水灯芯)环境蒸气压不足(VPD)相比,在5天脱水处理期间2株番茄植物的蒸腾速率(图12A和12B);
图13A-E显示不同的全植物参数沿土壤-环境水梯度的变化。(A)连续6天的实验期间(包括3天的充分灌溉接着3天的干旱)的每日VPD和辐射(Rad)。(B)在充分灌溉和干旱处理过程中M82和MP1植物的重量变化(相对于这些植物的最初重量)。观察到的重量增加(用箭头标示)是灌溉直到排水孔水平的结果(图20B)。(C) 6天实验期间SWC的变化。(D)在实验过程中的全植物蒸腾E [mmole m-2 s-1]。为了排除植物大小对蒸腾速率的作用,我们将植物水分散失速率归一化至叶表面积。(E)全植物冠层蒸气导度gsc [mmole m-2 s-1]计算为E与同时计算的VPD的比率。各曲线(B-E)是各系9-10株植物的均值;每90分钟计算SE。
图14A-C显示中午蒸腾与SWC。在(A)夏季实验(与图1相同的植物)和(B)冬季实验的整个期间随SWC而变化的中午全植物蒸腾(对于MP1,n = 11,对于M82,n = 9,有关环境条件的描述参见图21A)。(C)最大日蒸腾速率(Emax)的均值(±SE)和临界SWC (θcr)的均值(±SE)。星号标示非重叠95%置信区间。
图15A-C显示不同SWC水平上的gsc、叶RWC和Ψ叶的变化。使植物在土壤渗透仪系统中生长,并连续监测(A)均值(±SE,n = 5)和全植物gsc。当盆达到预先确定的高SWC水平(70-80%)、中等SWC水平(40-50%,夏季实验约θcr)和低SWC水平(10-20%)时,从这些盆中的植物上收获叶,并测量(B) RWC和(C) Ψ叶。各数据点是来自在测量时达到精确SWC的盆中的5株不同植物的5片叶的均值± SE (图13A-E所述相同的植物)。星号标示处理内各品系间的显著性差异(Student t检验,p < 0.05)。不同的字母表示不同处理中相同品系中午测量之间的显著差异[单因素方差分析(ANOVA)检验,P < 0.05]。
图16A-C显示在不同的SWC水平下系统的不同组件的导水率。(A)土壤导水率(K土壤),(B)全植物导水率(K植物)和(C)壤-植物连续体的导率(K总)。各点是各品系的5株植物的均值± SE。不同的字母表示不同处理中相同品系中午测量之间的显著差异[单因素方差分析(ANOVA)检验,P < 0.05]。
图17A-C显示在不同的SWC水平下每日水分流入量和流出量及全植物水平衡。同时测量(A) M82和(B) MP1的植物水分散失速率(ET)和根吸水速率(Jr)的每日形式。流入量和流出量间的累积差异为(C)全植物相对含水量(RWC)的改变。各数据点为各品系的至少9株植物的均值± SE。斜率下的连线标示蒸腾速率和在该蒸腾速率下由根吸收水的速率之间的显著性差异(Student t检验,p < 0.05每30分钟进行)。插图显示7和9:30 am之间斜率的幅度。
图18A-C显示不同的SWC水平下M82和MP1中SlTIP1;1、SlTIP1;2和SlPIP1;5的相对表达谱。在不同的SWC条件(~80%、~50%、~20%)下MP1(灰色条形柱)和M82 (黑色条形柱)中的(A) SlTIP1;2、(B) SlTIP2;1和(C) SlPIP1;5的相对表达的qPCR分析。数据表示为均值± SE (N = 5)。柱上不同的字母表示显著差异(t检验,P < 0.05)。
图19A和19B显示液泡水分供应:不间断蒸腾图示。叶片水分状况的动力学缓冲的水流量控制。(A)黎明前在高土壤水分可用性条件下的叶和(B)中午在低土壤水分可用性条件下的相同叶。在紧密靠近细胞质的叶肉细胞壁的微细管结构内产生叶的负水势(Nobel,2009),这使得胞质有脱水危险。我们提出如下避免这种危险:(i)通过维持分隔这2个区室的质膜的低传导性,和(ii)根据液泡膜的水分传导升高对液泡的缓冲作用(Pft)。平行地,降低细胞壁中的水势从木质部吸入水分。另外,K叶“阀” (维管束鞘水分传导)控制水分向叶中移动(Shatil-Cohen等,2011;Shatil-Cohen和Moshelion,2012;Pantin等,2013),这与叶水势、相对含水量(RWC)和膨压丧失速率有关。分别由于TIP和PIP的长期活性所致,较高的Pft和K叶水平被认为是造成非等水和等水植物间的差异的分子机制的一部分。
图20A-C显示土壤渗透仪系统和完整处理概括方案。(A)加载MP1和M82番茄植物的原型温室陈列(由48个称重土壤渗透仪组成)。该完全自动化的系统同时从全部植物中收集数据。(B)包括3.9-L盆的单一单位的图示,将盆通过容器顶部的开口插入不透明塑料排水容器中。盆-容器系统坐落在灵敏的温度补偿测压元件上。排水容器的目的是在一天内保持植物可获得水(0-600 mL)以避免由白天灌溉事件引起的重量改变,所述灌溉事件将使连续的瞬间蒸腾速率的计算复杂化。每盆中的土壤探头连续监测生长介质的体积含水量和电导率。灌溉系统受预编程的阀(CPV)控制。开发了用于植物专用的多项生理学分析的算法以提供(C)在充分灌溉、干旱和恢复期内在不同的受测品系中重量的平均变化和SE。
图21A-D显示在响应土壤-环境水梯度时的全植物蒸腾调节(冬季实验)。(A)在连续8天实验期间的每日VPD和辐射(Rad),该实验包括2天充分灌溉,接着5天干旱。(B)与其初始重量相比,在充分灌溉和干旱处理过程中M82和MP1植物重量的相对变化。从开始灌溉直到水达到排水孔时盆的重量增加(另参见图20B)。(C)在这些阶段的土壤含水量(SWC)。为了排除植物大小对蒸腾速率的作用(这可能与MP1植物中所观察到的较快的重量丢失和较快的SWC降低有关),使植物水分散失速率归一化至叶表面积。(D)全植物蒸腾E [mmole m-2 s-1]和(E)全植物冠层蒸气导度(gsc [mmole m-2 s-1])计算为E与同时测量的VPD的比率。如所预期的,浸水灯芯对照处理显示在实验期间几乎不变的水分流失。各曲线(B-E)为9株M82植物或11株MP1植物的均值。每90分钟计算SE值。
图22显示在冬季实验中在不同的SWC水平下叶RWC和Ψ叶之间的关系。使植物在土壤渗透仪系统中生长,并连续监测SWC。当观察到SWC = 70-80%、SWC = 40-50% (约θcr)和SWC = 10-20%的预先规定的值时,从植物上收获叶,并测量其中午(A) RWC和(B) Ψ叶。各条柱为3-5株不同的植物的9片叶的均值± SE,所述植物的盆在测量时达到精确SWC。星号标示处理中各品系间的显著差异(Student t检验,p < 0.05)。不同的字母表示不同处理中相同品系中午测量间的显著差异[单因素方差分析(ANOVA)检验,P < 0.05]。
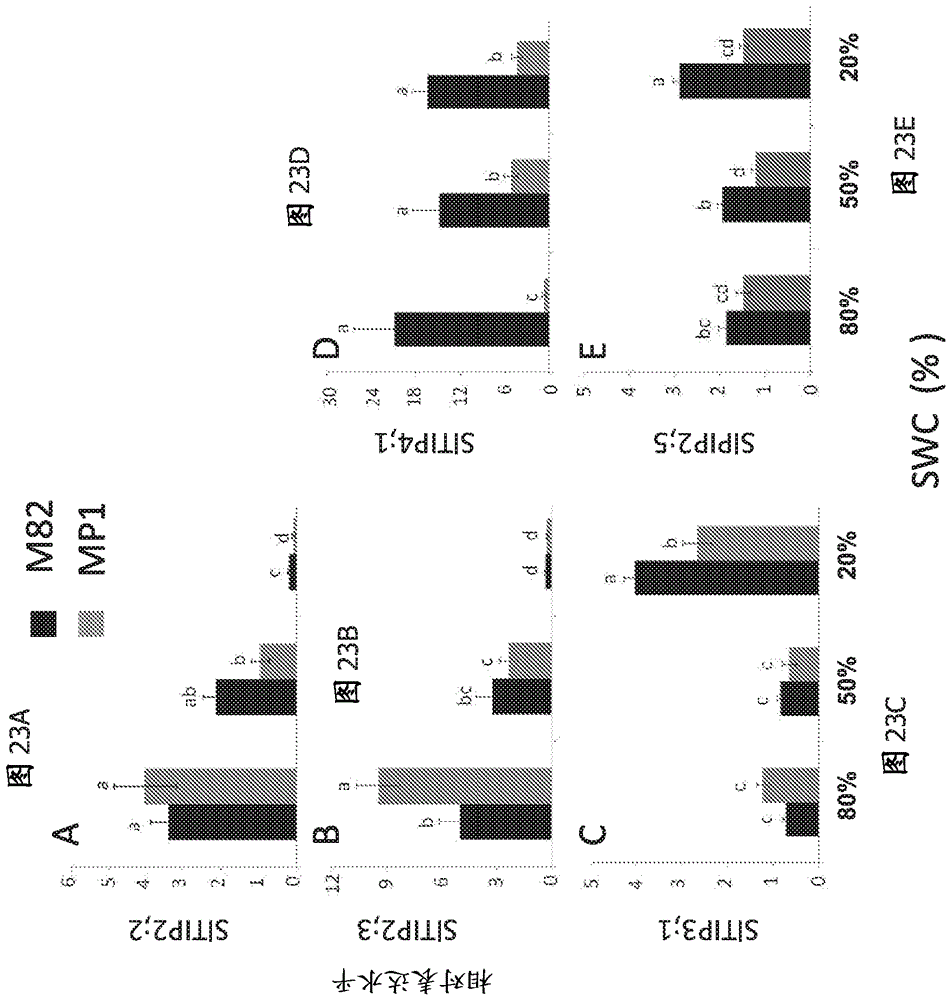
图23A-E显示不同的SWC水平下M82和MP1植物中SlTIP2;2、SlTIP2;3、SlTIP3;1、SlTIP4;1和SlPIP2;5 AQP的相对表达谱。在不同的SWC水平(~80%、~50%、~20%)下MP1 (灰色条形柱)和M82 (黑色条形柱)中(A) SlTIP2;2,(B) SlTIP2;3,(C) SlTIP3;1,(D) SlTIP4;1和(E) SlPIP2;5相对表达的qPCR分析。数据表示为均值± SE (N = 5)。柱上不同的字母表示显著差异(t检验,P < 0.05)。
图24显示全植物生长速率。全植物重量(g)的均值(±SE)。星号标示品系间的显著性差异(Student t检验,p < 0.05)。
本发明具体实施方案的描述
本发明在其某些实施方案中涉及农业,更具体但并非唯一地讲涉及用于表征植物的方法和系统。
本发明实施方案基于以下认识:为了正确地评价植物参数,除了测定水从全植物流向大气(通过计算蒸腾速率相关参数)以外,还要了解进入全植物的水流入量(例如通过测量特别但不必在植物根附近的土壤湿度(moister))是有利的。在本发明不同的示例性实施方案中,时刻,例如至少每60分钟一次或至少每30分钟一次或至少每10分钟一次或至少每5分钟一次或至少每4分钟一次或至少每3分钟一次或至少每2分钟一次或至少每1分钟一次计算表示蒸腾速率的参数和表示水流入量的参数的至少一个、更优选两个。
如本文所用,出自全植物的蒸腾意指总体通过叶、更优选总体通过植物的所有蒸腾器官(例如叶、茎、花、果实)离开植物的总水量。
如本文所用,出自全植物的蒸腾速率为总体通过叶、更优选总体通过植物的所有蒸腾器官(例如叶、茎、花、果实)离开植物的每单位时间的总水量。
按照本发明的一些实施方案,利用离开植物和进入植物的水通量以根据其在正常和异常(例如水胁迫)条件下的根功能估算根系的相对活性并表征植物。本发明实施方案的系统任选和优选执行自动化筛选总体和更优选在干旱下的生理学根部性能性状。在本发明不同的示例性实施方案中,同时执行两种或更多种、更优选许多植物的数据收集、分析和表征。筛选任选和优选精确找出显示在不同发育阶段和土壤类型中在不同处理下有优良的根吸水的植物。
本发明在至少一些实施方案中提供这样的系统,其同时监测两个或更多个植物的群中的蒸腾速率和土壤水分变化,并鉴定群中相对于其它植物的特性提高的那些植物,如按其蒸腾速率和由植物根吸收的水分之间的关系所测定的。
按照本发明的一些实施方案,植物的重量增加通过重量传感器测量并用作其蒸腾速率的代表。还考虑了测量表示蒸腾速率的参数的其它装置。例如,可使用红外摄像机以生成平面的热成像,数据处理器可分析热成像,并估算植物的散热速率,在此情况下散热速率用作植物蒸腾速率的代表。
按照本发明的一些实施方案,土壤湿度或土壤含水量(SWC)通过土壤湿度传感器测量并用作由植物吸收的水量的代表。优选将土壤湿度传感器置于植物附近。还考虑了用于测量表示由植物吸收的水量的参数的其它装置。代表性实例包括而不限于用于测量土壤中的含水量的NMR装置或X射线装置、用于测量土壤水分湿张力的张力计等。
上述装置的任一个可单独或通过系统补充使用。优选系统包括测量表示植物的蒸腾速率的参数的至少一个装置或传感器和测量表示由植物吸收的水量的参数的至少一个装置或传感器。
传感器产生时间相关信号,所述信号表示由传感器感测的各个参数(重量、含水量)并任选和优选对其进行分析。在一些实施方案中,植物是封闭在容器中的盆栽植物,所述容器含有与盆的内含物有流体连通的适量的水。在这些实施方案中,传感器可以是测量容器以及容器的内含物(包括水)的质量或重量的测压元件。植物所致蒸腾引起容器中水的量随时间减少,这反映在由传感器感测的质量或重量下降。因此,通过监测一段时间内容器的质量或重量(例如同时用于两个或更多个容器),可计算随时间变化的蒸腾速率,并且通过监测一段时间内的SWC,评价植物利用水的量和任选还有利用水的速率。
在本发明不同的示例性实施方案中,处理随时间推移由传感器产生的信号以测定两个或更多个时期内的蒸腾速率和吸水。对于每个时期,处理可包括计算该时期内蒸发水的平均数和标准偏差,提取该时期内蒸发水和植物质量增加之间的比率。该比率称为植物的“水分利用效率”(WUE)。另外,还通过测定被植物吸收的水分提取每个时期的水分利用。
处理任选和优选根据统计分析评定植物的等级,例如,根据至少一个参数,例如但不限于蒸腾速率和/或吸水速率和/或吸水速率和蒸腾速率间的差异和/或具体SWC中的WUE和蒸腾评定植物的等级。这允许鉴定群中具有优选特性的植物。
等级评定可用于一个以上的目的。在本发明的一些实施方案中,植物暴露于其中的环境条件(温度、干旱水平、湿度、光等)是可控变化的,并根据变化后的至少一个参数计算分值。这可重复一次或多次使得描述植物特性的分值与各环境条件相关。这允许选择改进植物行为的环境条件的所需范围。例如,在使分值归一化至0和1之间的数值时,分值超过介于0和1之间的预定阈值的任何环境条件可定义为适于植物生长的环境条件。预定阈值的代表性实例为至少0.5或至少0.6或至少0.7或至少0.8或至少0.9。
在本发明的一些实施方案中,植物是一群植物的成员,计算选定环境条件的群中各植物的分值。在这些实施方案中,根据分值评定植物的等级,其中等级评定与所选的环境条件有关。这允许选择所选环境条件的最佳植物或植物组。环境条件还可变化,并在变化后重复群中植物的分值计算和等级评定。这也允许选择变化环境条件的最佳植物或植物组。最后,可产生输出以提供环境条件范围列表,和预期在各个环境条件范围下行为改进的植物或植物组的相应列表。
在一个实施方案中,在两个或更多个时期内处理信号,其中通过植物群所暴露的一组的一个或多个环境条件表征两个或更多个时期的每一个。在一个时期内,环境条件可以是对照环境条件,而在另一个时期内,环境条件可以是胁迫条件。为了检查植物从胁迫中恢复,可回设条件以控制。可通过胁迫和恢复的不同组合重复该方案。在两个时期之间可改变的环境因素包括例如水的可用性、湿度、温度、辐照、盐分、土壤矿物质含量以及生物参数例如土壤中细菌和病原体。例如,可指定在胁迫环境条件下具有高蒸腾速率的植物比在相同条件下具有较低蒸腾的植物高的等级。在该实施方案中,处理可进一步包括计算在植物暴露于环境条件的改变和在从该胁迫中恢复期间蒸腾速率和水分利用的变化率。等级评定还可包括当植物的环境条件改变时检测的蒸腾速率和/或吸水的变化率。任选和优选指定其中当环境条件更多胁迫时蒸腾速率慢慢降低的植物比其蒸腾较快降低的植物高的等级评定。任选和优选指定其中当环境条件变得较少胁迫时蒸腾速率快速提高的植物比其蒸腾较慢增加的植物高的等级评定。任选和优选指定在胁迫条件下吸水较高的植物比吸水低的植物高的等级。
在一个实施方案中,利用本发明鉴定植物生长的最适环境条件。在该实施方案中,在两个或更多个时期的每一个中,将植物暴露于不同的环境条件中。
植物的等级评定可通过若干方法的任一种进行,使不同水平的筛选成为可能。一种方法包括预先确定的时间内目标和对照植物的累积重量的比较。通过统计工具将每个个别植物的重量增加与目标植物群和对照植物的平均重量增加进行比较。
在评定植物等级的另一种方法中,利用累积蒸腾,通过每日蒸腾和每日吸水求和,以提供指定时期内植物蒸腾的水含量的度量。任选和优选将每个个别植物的累积蒸腾和吸水与目标植物群和对照植物的平均累积蒸腾进行比较,并且将两者与潜在蒸腾速率(大气需要)进行比较。
在另一种方法中,通过将某一时期内的累积重量增加除以该时期内的累积蒸腾,来测定WUE。
可通过信号采样,从通过重量传感器产生的信号测定瞬间蒸腾速率,以获得重量时间系列。重量时间系列任选和优选被平滑至某种程度(例如经噪声降低处理)以分离出昼间蒸腾(水分流失)趋势。然后通过平滑重量变化的时间导数(例如一阶时间导数)计算昼间蒸腾速率的形式。任选和优选将每个个别植物的峰值蒸腾速率及其计时与目标植物群和对照植物的平均峰值蒸腾速率和计时进行比较,并且将两者与潜在蒸腾速率进行比较。
可通过信号采样,从通过土壤湿度传感器产生的信号测定瞬间吸水速率,以获得湿度时间系列。湿度时间系列任选和优选被平滑至某种程度(例如经噪声降低处理)。然后可通过湿度时间系列中变化的时间导数(例如一阶时间导数)计算吸水速率。
现参照附图,图11是按照本发明的至少一些实施方案用于同时监测植物或两个或更多个植物的群体的蒸腾速率的系统1的示意图。系统1任选和优选还鉴定群中相对于其它植物特性提高的那些植物。
系统1包括一个或多个监测装置2,其中各监测装置2用来监测各个植物4的蒸腾速率和吸水。为简要起见,且仅举例来说,图11显示了2个监测装置2a和2b。通常,可配置系统1以包括等于待监测的群中的植物数的多个监测装置2。
各监测装置2任选和优选包括感测一个或多个与植物有关的参数的两个或更多个传感器3、6。在图11 (其不被视为限制性的)中,装置2a包括传感器3a和传感器6a,装置2b包括传感器3b和传感器6b。各传感器3、6产生表示由传感器感测的相应的测量参数的时间相关信号,所述信号被传送到处理站8用于如下解释的进一步处理。传感器6和处理站8间的通信可通过如图11所示的有线信道,其中传感器6的每一个通过通信线10与处理站8连接,所述通信线可任选为有线的。或者,传感器可经无线信道与处理站8通信。在图11所示的一个优选的实施方案中,植物4为保持在盆12中的盆栽植物,每盆12被封装在容器14中。容器14在图11中以剖视图显示,以显示盆12和装在容器14中的植物4的部分。每盆12含有生长介质,所述介质可为固体,例如土壤或人工生长介质,或可为液体,如水培植物生长的情况。
传感器3可为置于土壤中的湿度传感器,任选和优选在植物根的附近。各个容器14含有适量的水18,所述水通过盆12中的孔16与盆12的内含物流体连通。在这个优选的实施方案中,传感器6是测量容器14以及容器内含物(包括水18)的质量的测压元件,而将传感器3置于盆内部的土壤中。植物4所致蒸腾引起容器14中水18的量随时间推移减少,这反映在由传感器6感测的质量的减少。
测压元件可被校准以指示室的绝对重量或相对于基线的重量或相对于基线或相对于之前的重量测量的重量变化。测压元件优选足够灵敏,足以检测重量的极快(例如在10分钟或更短内,或在1分钟或更短内,或在10秒钟或更短内,或在5秒钟或更短内或在1秒钟或更短内)的变化和重量的极小变化(例如小于1 gr、或小于0.1 gr或小于0.01 gr的变化)。
在试验站,优选提供多个容器14和植物4。一天一次(通常在蒸腾速率非常低的夜里)给容器14装水到预先确定的水平(取决于所采用的胁迫),在干旱胁迫期间,一个或多个容器14不装水,或在盐分胁迫期间可装入含盐水等。盆12任选和优选用盖子20(植物的茎22通过盖子穿过)盖上以减少或防止水分从盆的内含物中蒸发。同样地,各个容器14任选和优选用盖子24 (茎22通过盖子穿过)盖上以防止水从容器14中蒸发。
因此通过监测一段时期内容器14的质量,可在处理装置8中计算一段时期内的蒸腾速率,并且通过监测SWC,可按如下解释的计算吸水速率。
传感器6,当作为测压元件执行时,也可用来监测盆12以及其包括植物4的内含物的质量。在植物4生长时,植物4的质量增加,并且通过监测盆12的质量,使得监测一段时期内的盆12的质量允许按如下解释的在处理站8计算一段时期内植物的生长速率,并由此计算产量。
系统1任选和优选进一步包括装置26以测定大气水分需要。装置26包括优选由纺织品制成的灯芯28。将灯芯28的一部分浸入容器32的水30中,相当于下述“湿灯芯”。任选和优选将灯芯28的大部分暴露于环境空气中,使得灯芯28从容器32吸收的水可从灯芯蒸发。装置26进一步包括传感器34,所述传感器是用于监测容器32及其内含物的质量的测压元件。测压元件34产生表示容器32及其内含物的质量的时间相关信号,所述信号经可为有线信道或无线信道的信道36与处理站8通信。容器32任选每日用水充满至预先确定的水平。
系统1可任选包括其它传感器(未显示),例如监测随时间推移的株冠温度、盆12的含水量或水势的传感器。还考虑了其它外部传感器(未显示),用于测量环境光、环境温度和环境相对湿度的至少一种。
传感器(例如传感器3、6和34)的一个或多个产生与处理站8通信的时间相关信号。处理站8包括CPU 38,所述CPU包括多路复用器40,其相继将各输入信号发送至模数转换器42,所述转换器以预先确定的时间并以预先确定的频率采集输入信号样本。采样频率可为例如每12小时,更优选,更优选,更优选,甚至更优选,还更优选每2小时、每小时、每10分钟、5分钟或每分钟、每30秒钟或每10秒钟。越高的采样频率允许越短的采样时间,越短的采样时间趋于显示包括蒸腾速率的振荡(否则在较低的采样频率时可忽略)的瞬间蒸腾速率。数字化信号的样本通过钟43计时打印,计时打印样本被存储在CPU的存储器44中。各信号存储在存储器44的文件45中,所述文件通过在其中产生信号的监测装置的标识符是可寻址的。CPU含有经配置以处理存储在存储器44中的信号的处理器46。处理优选包括从信号中过滤装置相关噪声。
对于通过测压元件6产生的信号,处理任选和优选包括例如通过计算滤过信号的时间导数,来计算监测装置的植物4的蒸腾速率。对于通过湿度传感器3产生的信号,处理任选和优选包括例如通过计算滤过信号的时间导数,来计算植物4的吸水速率。
处理还可包括例如通过计算信号的时间导数,来计算监测装置上的植物4的生长速率。处理还可包括将计算的蒸腾速率与来自灯芯28的蒸发速率进行比较。处理还可包括计算各植物的蒸腾速率与其生长速率间的比率。处理还可包括计算植物4的根吸水作为SWC的时间导数。
在本发明的一些实施方案中,处理包括计算叶相对含水量(RWC)的变化性,并将植物归类为以下之一的分类群:(i)显示等水行为的植物的分类群,和(ii)显示非等水行为的植物的分类群。例如,当特定植物的叶RWC的变化性高于预先确定的RWC变化性阈值时,处理器可将植物归类为非等水的,而当特定植物的叶RWC的变化性低于预先确定的RWC变化性阈值时,处理器可将植物归类为等水的。RWC变化性阈值可以百分比表示。适于本发明实施方案的代表性RWC变化性阈值包括而不限于约5%或约10%或约15%或约20%。
RWC变化性的测量优选在预先确定的时间内,其可以是而不限于约1小时至约一天。因此,例如,当在预先确定的时间内相对于基线RWC,叶的RWC改变超过P%时,处理器可将植物归类为非等水的,而当在预先确定的时间内相对于基线RWC,叶的RWC改变小于P%时,处理器可将植物归类为等水的,其中P为约5-约20。基线RWC可方便地设置为100%,当可选择任何其它的基线水平。
RWC的变化性可根据根摄入率和蒸腾速率计算。在本发明的一些实施方案中,对根摄入率和蒸腾速率间的差异随时间求积分,将积分的结果除以植物的重量以求出RWC的变化性。积分优选但不必是离散积分。以下的实施例部分提供所述计算的代表性实例。
处理站8还任选和优选包括用户输入装置48,其可为键盘50或计算机鼠标52,可允许用户将任何相关信息输入存储器44中,所述信息例如在各个监测装置中的植物4的标识符、在其下获得信号的环境条件。显示装置54用来显示任何输入信号或任何处理的结果。
按照本发明的至少一些实施方案,信号处理在两个或更多个时期的每一个内进行。通常,通过植物群所暴露的一组的一个或多个环境条件表征两个或更多个时期的每一个。在一个时期内,环境条件可以是对照环境条件,而在另一个时期内,环境条件可以是胁迫条件。系统1因此可进一步包括用于在植物4的环境中产生所需条件的装置(图11中未显示)。所述装置可包括用于产生所需温度、湿度、水盐分等的装置。
可配置处理器46以使蒸腾速率归一化至各植物叶的表面积或至叶中的气孔密度。可按本领域已知,使用扫描仪测定叶的表面积。
对于每个时期,处理可任选和优选包括计算在一段期间内在群中观察到的蒸腾速率的平均数和标准偏差或蒸腾速率和生长速率间的比率。处理可任选和优选还包括按照下面更详细描述的本领域的任何已知方法使信号的任何波动或其它噪声平滑。然而,应注意到,信号仍可振荡,表示植物蒸腾速率的振荡,而非噪声。
处理可任选和优选进一步包括根据统计分析评定群中各植物的等级,例如,根据其蒸腾速率或其蒸腾速率和生长根摄取的比率和胁迫耐受性评定植物的等级。任选比较多个植物群间的平滑蒸腾速率图,另外或备选振荡蒸腾速率图之间的差异,所述植物群可例如任选根据物种、物种内的品系或所述品系的遗传修饰形式而不同;对于最后的选择,任选将特定品系的一个或多个遗传修饰的形式与非修饰品系或与修饰品系的其它形式进行比较。
要认识到,为清楚起见在单独的实施方案的情况下描述的本发明的某些特征,也可在单一实施方案中组合提供。相反地,为简明起见在单一实施方案的情况下描述的本发明的各种特征,也可单独或以任何合适的亚组合或在本发明的任何其它描述的实施方案中合适地提供。在不同实施方案的情况下描述的某些特征不被视为那些实施方案的必要特征,除非实施方案没有那些要素便无效。
在下列实施例中提供如上文描述和如随附权利要求书部分要求保护的本发明的不同实施方案和方面的实验支持。
实施例
现参照下列实施例,所述实施例与上述描述一起以非限制性方式说明本发明的一些实施方案
实施例1
在Faculty of Agricultural, Food and Environmental Quality Sciences, Rehovot, Israel,使用本发明的系统在温室中进行实验研究。该系统包括3.9升种植盆,该盆放置在与CR10数据记录器(Campbell, scientific inc. USA)连接的温度补偿的测压元件(Tadea-Huntleigh,Israel)上。盆装入商品化种植介质(一种泥炭和凝灰岩熔渣的混合物),并使单株植物在各盆中生长。将每盆通过容器顶盖的孔沉入塑料容器(13x21.5x31.5 cm H W L)中。将盆和容器的顶部用铝箔密封以防止蒸发。在高水平灌溉条件下,每日向容器中加水到高于盆底2 cm的高度。用过量的水灌溉易于滤去每天在种植介质中蓄积的盐。将商品化肥料溶液0.2% (Super Grow,Hortical Israel)加入灌溉水中,一种称为“加肥灌溉”的过程。加肥灌溉确保a)植物不遭受水胁迫,和b)白天容器重量只通过植物蒸腾单调地减少。
在3分钟时间段内对每10 s记录的盆重量读数取平均。该平均时间段低于振荡频率(20-40分钟)且高于奈奎斯特频率(可从一组数据获得有用信息的最高频率),而且发现对振荡具有较小作用。在通过将70 gr钢珠从700 mm的高度投下激发后,测压元件读数在2 s后稳定(生产商的数据)。因此,10秒钟重量采样间隔确保适当遵循0.5 g/10秒钟重量降低的最大速率。
为了从植物蒸腾速率的短期振荡中鉴定和隔离由测量和数据采集系统引起的任何噪声,将约6 kg的恒重(大致等于容器+盆+植物的质量)放入温室中的测压元件上2天。
植物
使番茄植物(Solanum lycopersicom,之前称为Lycopersicon esculentum L.)在由14小时光和10小时暗构成的光照周期中在受控环境温室和商品化温室两者中生长。受控环境温室中的温度在夜晚时间为18℃,在正午时间为35℃,在这2个极端温度之间逐渐变化。商品化温室中的环境条件用带有湿垫子的风扇控制。使脱落酸(ABA)缺陷型系sitiens栽培种(Ailsa Craig如近等基因系的背景,Andrew J. Thompson博士惠赠)和杨树植物(银白杨)在商品化温室中生长。在这些实验中使用从1年龄杨树植物插条(高出种植介质表面约10厘米)再生的4月龄嫩枝。
通过将放在测压元件上的5株植物中的2株野生型番茄植物的根切下,来进行切割番茄嫩枝实验(Cut tomato shoot experiment)。在晚上进行根切除,同时将植物浸入自来水中以防气泡渗入木质部中。然后将番茄嫩枝浸入含有2升自来水的容器中,所述容器放置在测压元件上。通过停止灌溉6天产生脱水条件。
叶面积测量;在实验结束时立即切下番茄叶,使用自动扫描仪(Li cor,Li 3100型面积计量仪)扫描。使用便携式叶面积扫描仪(Li cor,Li-3000A型),在不切割叶的情况下测量杨树叶面积。
测量垂直悬挂的编织布条(0.14 m2)的重量丢失,将所述布条的较低端浸入水中(本文称为“湿灯芯”)。自湿灯芯的重量丢失速率提供对瞬间大气需要的评估。与湿灯芯重量下降有关的噪声也用来表明与对动态单调重量变化的测压元件响应有关的噪声水平。通过下面解释的时间系列分析,对来自具有植物、湿灯芯的测压元件的数据和恒重数据进行分析。
数据分析
通过所测重量时间系列的一阶导数,计算容器的水分流失速率,为全植物蒸腾(WPT)速率的负值
其中Wk和Wk+1是在时间tk和随后的时间步长tk+1测量的容器重量。一般来说,微分法起高通滤波器的作用,因此显著放大高频噪声。噪声可通过平滑(消除长期趋势)所测数据(时间系列)降低或消除,使得它在光谱分析之前变成固定的。引导变分模式(leading variation pattern)的微分法提供平滑图形WPT速率。任何方法均可用于平滑数据,包括非参数平滑(例如移动平均数、Savitzky-Golay和FFT过滤)和非参数回归(将若干阶的多项式、指数函数、对称和不对称转移函数等拟合至所测数据)。
本文假设容器-重量时间系列遵循累加模型
其中W为在时间tk的重量,假如它随时间平缓变化,为与该值的偏差。在平滑时间系列上叠加的系统重量振荡也是时间系列,被称为“残差时间系列” (残差是所测数据和拟合曲线之间的差异)。当残差时间系列的均值为零时,所测时间-系列的趋势被适当地去除。我们假定残差时间系列 (方程式2)是2个时间系列的叠加;一个由起源于数据采集和其它系统相关噪声的残差造成,,另一个来自起源于WPT的固有振荡的残差,。对于恒重、湿灯芯和植物运行的独立测量的时间系列被用来通过自相关函数研究和的性质并检查其随机性(白噪音)。
的光谱分析来用探索循环模式的存在。光谱分析将具有周期分量的复杂时间系列分解成少数特定波长的基础正弦波(正弦和余弦)函数。通过鉴定重要的基础周期分量,可实现目标现象的特性,即鉴定WPT速率中基础周期分量的波长和重要性。这种光谱分析显示时间系列中不同长度的周期。
残差时间系列的光谱(振幅与频率)通过快速傅里叶变换(FFT)计算,所述快速傅里叶变换将时域信号或时间系列分解成复指数(正弦和余弦)。恒重残差时间系列的光谱将用来确定频率阈值,所述频率阈值可用来从植物-重量残差时间系列滤出高频噪声(低通滤波器)。随后,通过逆FFT将过滤光谱重建成时间系列(在时域中)。重建的低通过滤的时间系列的时间导数 (为的低通滤波)提供使平滑WPT速率叠加的振荡蒸腾速率。
实验1
全植物蒸腾(WPT)速率的振荡
图1A显示在温度受控的温室中生长的对照番茄植物在夜晚和随后的白天时间内通过蒸腾的典型的实测重量变化。通过如图1B所示的实测重量时间系列的时间导数(方程式1)计算WPT速率。该时间导数有噪声,尽管表观相对平滑重量减轻图形(图1A)。噪声振幅在夜晚和上午早期时间较低,随后增加,在上午后期和下午早期时间达到最大,并在晚上时间再次下降。平滑图形附近的重量振荡通常被视为随机信号(白噪音),其不含有关蒸腾速率的图形及其依赖于环境条件的有用信息,因此在数据平滑过程中忽略。
或者,通过先使重量时间系列平滑,然后计算时间导数,来计算WPT速率(图1B)。使用30个数据点窗口宽度,通过Savitzky-Golay (S-G)方法使度量-重量时间系列平滑。该平滑方法基于数据内移动窗口间的最小平方二次多项式(尽管也可使用较高级次)拟合。S-G方法可应用于过滤窗口的不同宽度,并且被视为产生精确平滑导数的非常好的方法,为其中蒸腾/蒸发速率通过重量减轻的导数测定的本研究的一个优势。用针对宽范围的过滤窗口宽度的S-G方法获得非常高的R2值,并且由于过滤窗口宽度减小,拟合改进。然而,由于过滤窗口宽度减小,预测的吸水图形包括较低频率和较高振幅的振荡,并且对于极窄窗口R2→1,这意味着平滑曲线穿过所有数据点,且导数的图形与所测数据的数值微分法获得的相同(图1B)。图1B显示之前用S-G方法针对全植物平滑的数据时间系列的时间导数。
图2A、B、C分别显示全植物、湿灯芯和恒重的重量变化速率的平均振荡和叠加振荡。之后说明了计算振荡蒸腾速率的方法。全植物、湿灯芯和恒重的不同的振荡图形表明WPT速率的振荡的确是一种生理现象,在测压元件和数据采集系统中独立于噪声或在环境条件下的直接振荡。
为了排除WPT速率中的振荡是系统和环境噪声的可能性,通过计算信号的自相关,针对随机性(白噪音)检查了全植物、湿灯芯和恒重的残差(所测数据和通过S-G方法时间系列的数据平滑之间的差异)。图3A、C、E分别显示3种情况的自相关函数。受控重量残差时间系列的自相关函数 (图3E)在滞后=0时具有强峰,且对于所有其它的滞后接近零。该形状表明可被视为白噪音。与此相反,全植物残差时间系列自相关函数 (图3A)对前200滞后是周期性的,其中峰与峰间的差异平均为40滞后。这表明了全植物残差时间系列可与白噪音相区分。湿灯芯的自相关函数(图3C)表明该数据的残差时间系列也不是随机的。在这种情况下随机性偏离可与温室内环境条件的改变相关。全植物与湿灯芯的自相关函数之间(分别为图3A和C)和两者与恒重的自相关函数之间(图3E)的显著差异表明全植物的残差时间系列含有与使平滑重量减轻图形叠加的振荡植物蒸腾图形相关的非随机噪声,超出湿灯芯蒸发的叠加振荡。
随机性的其它试验是光谱分析,其也被用来从“有色”噪声中过滤白(随机)噪声。图3B、D和F分别显示全植物、浸水灯芯和恒重残差时间系列的光谱。恒重大体平坦的光谱(图3F)表明其残差时间系列几乎是随机信号(白噪音)。全植物的光谱(图3B)在低于2.5 h-1的频率下具有高振幅,在较高频率下具有较低的振幅。湿灯芯光谱在低于2 h-1的频率下具有高振幅(仍低于全植物),在较高频率下具有较低的振幅。为了过滤白噪音,在进一步分析前,对低于2 h-1的一段过滤器通过频率对两种光谱进行低通过滤。重建的低通过滤的残差时间系列的时间导数分别显示植物的WPT速率的振荡和使平均蒸腾/蒸发速率叠加的湿灯芯的蒸发速率(图2A、B)。对于不同天数和不同环境条件的植物获得图2和3中的相似结果。
干旱对WPT速率图形的振荡的作用
图4A显示通过逐渐消耗种植介质中的水获得的5天脱水对瞬间WPT速率(平滑振荡的)作用。图4B中分别显示叠加在图4A中的平滑图形上的WPT速率中所观察到的振荡图形。在图4的第1天之前的晚上提供最后一次灌溉。出于比较,在图4C中显示了湿灯芯的平滑和振荡蒸发速率,且在图4D中分别显示了叠加在图4C中的平滑图形上的蒸发的振荡图形。图4显示:1)在前两天植物可获得水以满足大气需要,且平滑和振荡WPT速率的特征图形与图2A所示的特征图形类似。平滑蒸腾速率图形在每天具有两个峰(图4A);早晨一个较低峰和和午后一个较高峰。2)由于种植介质中水消耗所致,蒸腾速率在最后两天显著降低。这些天每一天的两个峰具有相似的高度,它们之间有明显的下降。与全植物的每日两峰图形不同,平滑湿灯芯蒸发速率的恒定值中有一个峰(图4C)。单个每日峰的计时与平滑WPT速率的第二峰一致。3) WPT速率的振荡图形明显不同于湿灯芯蒸发速率的振荡图形,后者在白天时间内具有一致的振幅值,略不同于夜晚时间的振幅值(图4C、D)。相比之下,WPT速率的每日振荡图形随时间显著变化。它在夜晚时间低,在9:00 AM左右开始增加,接近正午和下午早期加强,此时VPD和蒸腾速率高,并在下午较后时间逐渐降低(图4A、B)。白天和夜晚时间WPT和蒸发速率间振荡振幅的显著差异(分别为图4B和D)表明WPT速率的振荡是与变化的周围环境条件有关的固有生理过程。4) WPT速率振荡的振幅取决于水可用性,如图4A、B中最后2天可见。在前3天其相对于正午时间内平滑蒸腾速率的值高得多。5)预料不到地,观察到振荡夜晚蒸腾速率图形(图4A、B);在前3个夜晚较高并且在随后的2个夜晚接近零。
全植物与切离嫩枝
图5显示典型的番茄全植物、切离嫩枝的平滑WPT速率和叠加振荡及湿灯芯的蒸发速率和叠加振荡。图5D显示“母体”植物(其结果见图5C)的嫩枝的结果。与两峰每日平滑WPT速率图形(图2、4和5A-C)不同,切离嫩枝的平滑蒸腾速率图形(图5D)在早晨具有单峰,接着蒸腾速率的单调下降。如前所见(图2和4A),WPT速率的每日第二峰与湿灯芯的单峰一致(图5E、F)。注意,图5D中的单峰高于此时(图5B)和之前白天同一时间(图5A、C)的全植物的瞬间蒸腾速率,可能由于在全植物中流动的根阻力所致。嫩枝蒸腾速率的振荡图形和振幅(图5D)总的来说与自湿灯芯的蒸发速率获得的类似(图5E、F),且两者均低于WPT速率的振荡图形和振幅(图5A-C)。
ABA缺陷型突变体
图6显示ABA缺陷型sitiens植物和对照植物的振荡和平滑WPT速率和湿灯芯的蒸发速率和叠加振荡的代表性结果。因为比较两种不同的植物,所以使蒸腾速率归一化至各植物的叶面积,并使湿灯芯归一化至其自身的表面积。当与对照相比时,sitiens突变体显示显著较高的每日蒸腾速率(图6A)。与对照植物相比,这些植物显示特有的和高得多的振幅和频率振荡图形。这些振荡始于黎明时,并持续一整天(图6B和C)。虽然sitiens植物在早晨9 AM左右失去膨胀,但它在一整天继续蒸腾,并在夜晚保持膨胀度。
与作为较高木质部脆弱植物的杨树比较
图7显示2株杨树(Populus alba)植物的振荡和平滑WPT速率和湿灯芯的蒸发速率和叠加振荡的代表性结果。使蒸腾速率归一化至各植物的叶面积。杨树相对的低蒸腾速率是(与灯芯大致相同)由于其尺寸小所致(图7)。杨树植物的振荡图形与对照番茄植物大不相同(图2和4-6),但与sitiens植物的类似(图6)。如WPT的黎明后振荡检测的(图7),振荡加剧,并在整个白天时间保持相同图形。该蒸腾速率图形(包括振荡)可能与番茄和杨树之间空腔脆弱性胁迫(cavitation vulnerability stress)的差异有关。
实验2
针对蒸腾模式测试等基因番茄突变
在近交品种M82的遗传背景下的等基因番茄“突变文库”中应用本发明的方法。该文库的田间预筛选得到甚至在用水充分浇灌的营养物供应条件下显示萎蔫反应的29个突变体品系。各品系成员的量自1到11变化,总共350株个体。
筛选方法包括6个十分灵敏的温度补偿测压元件(称重土壤渗透仪),所述元件与数据记录器连接,并每3分钟采样。将单一盆栽植物置于测压元件上1-2天。时间取决于鉴定与对照植物和浸水灯芯相比受测突变体的蒸腾模式的能力(提供有关大气需要的信息)。通过用铝箔覆盖种植介质表面来防止盆表面的蒸发。每天傍晚对植物进行水肥混合灌溉。将盆浸入容器中以保持根的恒定的水可用性。从350株植物中,鉴定出表示两个突变体品系2株单独的植物。
2株植物(选自在温室中同时监测的系列中的42株植物)表示干旱处理期间蒸腾速率的2种不同模式(策略)。该图表示在高通量选择过程中PLANTarray所用的5个标准之一(参见材料与方法)。
突变体#30,具有低于对照植物40%的叶面积(图8)蒸腾相似的水量(图9a),即每叶面积单位较高的蒸腾速率。突变体#7,具有比对照植物小得多的叶面积(图8)蒸腾比对照少得多(图9b)。寻找突变体间蒸腾差异的原因,我们发现气孔孔径大小(图10)和密度显著改变。与对照(17± 0.14;均值± SE,N=29)相比,突变体#7的每0.1 (mm)2叶尺寸的平均气孔数显著较低(11± 0.16;均值± SE,N=29),而其它突变体(#30)每0.1 (mm)2叶具有显著较高的气孔数(23± 0.16;均值± SE,N=29)。与对照相比(26.94±12.4;均值± SE,N=29),突变体#30的平均气孔孔径显著较小(11.86 ± 6.3;均值± SE,N=29),其中突变体#7平均气孔孔径显著较高(66±12.4:均值± SE,N=29;P值= 0.001)。
这些结果允许在约8周监测后在350株植物群中鉴定出气孔缺陷突变体,这显著短于常规的田间筛选方法。
实施例2
不完全了解在面临土壤水分可用性和大气水分需要的波动时维管植物管理其水分平衡所采用的不同策略的调整。
该实施例涉及对在响应土壤水分可用性和大气需要间的失衡时,在等水和非等水番茄(Solanum lycopersicum)品系中水分内环境稳态调节的动力学和动态学进行的研究。除环境辐射亮度和蒸气压不足以外,采用根据自称重装置和SWC推导的蒸腾速率和根吸水间的差异连续监测全植物蒸腾速率、根-嫩枝水通量比率的新系统,在特定环境条件下表征植物的行为。同时从几十株植物中收集这些测量数据,支持所有植物的全植物气孔导度、用水效率、相对含水量变化和导水率的计算(还考虑根吸水计算相对含水量变化)。各种SWC水平下两个栽培种的几种水通道蛋白(AQP)的表达谱显示2种液泡膜AQP (TIP)和1种质膜AQP (PIP)的表达的差异。
该实施例显示将等水与非等水行为区分开来的主要特征是叶相对含水量的变化性(RWC)。在两个品系中,叶水势随干旱发展而降低。然而,与在非等水品系中相比,在等水品系中,RWC在较窄的范围内波动。下面还描述了液泡特别是其TIP对调节叶片水分状况和用于蒸腾的不间断供水的动态缓冲作用。
材料与方法
实验设置
该研究在位于以色列Rehovot的Faculty of Agriculture, Food and Environment的温室中在2011年12月和2012年6月进行(分别称为冬季和夏季实验)。在温室中,将植物保持在自然光条件下,并使用通风孔和/或冷却的湿空气以确保温室中的最高温度不超过35℃。温度和相对湿度在夏季实验中为25-35℃和40-60%的范围,在冬季实验中为18-35℃和20-35%。实验设置包括42个置于温度补偿的测压元件(1042 C4;Vishay Intertechnology,USA)上的3.9-L盆。将盆装载商品化种植介质(Matza Gan;Shaham,Givat-Ada,Israel),每盆含1株植物。自此,该种植介质可称为“土壤”。将每盆通过其顶盖上的孔放入塑料容器(13 × 21.5 × 31.5 cm;高×宽×长)中。土壤表面和容器用铝箔覆盖以避免蒸发。将土壤湿度传感器(5TE;Decagon Devices,USA)放置在各盆中。通过校准传感器测定Topp三阶多项式方程(Topp等,1980)的特定系数。
在充分灌溉处理时,每日用水装入容器中以确保一整天的水可用性,并避免日间对任何补充灌溉的需要,这可能产生重量。在干旱处理时不供水。各个容器中的排水孔保持容器中水的水平在每次浇水后高于盆底2 cm。过量灌溉旨在防止盐在土壤中的任何蓄积。这种设置确保了容器重量在白天进程中只因植物蒸腾而单调地降低。每日与灌溉水一起以0.2% (v/v)供应商品化肥料溶液(Super Grow 6-6-6+3;Hortical,Kadima,Israel) (加肥灌溉)。
将6个湿灯芯置于另外6个测压元件上,其输出提供环境条件对蒸腾的作用的参考。各灯芯为编织的地板抹布,将其下部分浸入水中。使用传感器(HC2-S3-L;Rotronic,Switzerland和LI-COR 190 Quantum Sensor;LI-COR,USA)监测温室中的温度和相对湿度和光合有效辐射(PAR)。
将称重土壤渗透仪、土壤湿度传感器和环境传感器通过AM16/32B多路复用器(Campbell Scientific,USA)与CR1000数据记录器连接。每15秒钟记录称重土壤渗透仪和环境传感器的读数,并且将每3分钟时期的平均数储存在数据记录器中用于进一步分析。每3分钟测量土壤湿度。
该研究包括番茄植物(Solanum lycopersicum)的2个品系MP1和M82,其分别显示非等水和等水行为。各实验包括3个阶段。在第一个阶段,称为预处理,每日灌溉植物(参见上文详情)。在第二个阶段,称为干旱处理,终止灌溉。在第三个阶段,称为恢复处理,重新开始每日灌溉。在完成所有这些阶段后,取出植物嫩枝,称重并测量各嫩枝的叶面积(LI-COR 3100面积计量仪;LI-COR,USA)。
在干旱处理期间的不同的3天同时测量叶水势(Ψ叶) (Arimad 3000 Pressure Chamber;MRC,Israel)和相对含水量(RWC)。每次测量包括经过相似SWC水平(~80%、~50%和~20%)处理的各品系的5株植物。在白天6 am、10 am和2 pm当盆中的含水量达到规定的SWC水平时,收集测量数据。从每株植物的单片叶中收集测量数据。采用Sade等(2009)中描述的方案,评价RWC。
根据黎明前(Wm)和晚上(We)的测压元件读数之间的差异,计算植物每日蒸腾(PDT)。Wm和We计算为30分钟时间内的平均重量。当在灌溉事件后从容器中的排水结束时,根据连续两天早晨(分别为k+1和k)容器重量间的差异(Wk+1 - Wk),测定每日植物重量增加(ΔPWk)。注意由于排水受容器壁中的孔控制,只由植物重量增加决定所观察到的重量差异。
对农艺用水效率(WUE) (定义为植物重量增加(ΔPW)和蒸腾的水量之间的比率)进行了评估,而不是评估植物的生理用水效率(累积的CO2分子和蒸发的H2O分子间的比率)。通过拟合在预处理阶段累积植物重量增加与累积水蒸腾的线性曲线,测定各品系的WUE。在干旱处理进程中每日植物重量增加应用以下方程式2.1计算,其中WUE为各品系的拟合线性曲线的斜率。
计算每株植物的叶面积比率(LAR) (定义为实验结束时叶面积(LA)和嫩枝重量之间的比率),并对不同的品系取平均。还计算了不同植物的嫩枝-重量比率(SWR) (定义为实验结束时所测嫩枝重量和计算的植物重量之间的比率) (对于两个品系SWR = 0.6)。叶面积(单位:cm2)应用以下方程式2.2估算。
全植物蒸腾速率[ET (g/h)]是白天重量减轻的一阶时间导数的负值。重量数据的数值导数有噪声,应在计算导数前进行数据-平滑程序。将Savitzki-Golay (1964)方法用于此目的(Wallach等,2010)。通过将平滑SWR数据的一阶导数(采用盆重量数据所用的相同方法测定)乘以盆中种植介质的体积,计算根摄入率jr。在预先确定的时间内的水流入量(根摄取)和水流出量(蒸腾)间的差异诱导植物RWC的变化。瞬间全植物RWC变化(ΔRWC)为自午夜(n = 0;RWC = 100%)开始的RWC变化的总和除以植物重量。在方程式2.3 (下文所示)中,Δt为采样事件间的时间间隔(0.05小时),PW为特定天的植物重量。
蒸气压不足(VPD)为饱和空气的蒸气压和环境空气的蒸气压之间的差异(单位:KPa)。在植物中,这是指气孔下腔中的压力和大气压之间的差异。在方程式4 (下文所示)中,T为空气温度(℃),RH为相对湿度(0-1),0.611为0℃下的饱和蒸气压,17.502和240.97为常数(Buck,1981)。
归一化至植物叶面积的蒸腾速率(E [mmol sec-1 m-2])等同于通过气体交换装置测量的公值,但是指全植物,不仅仅是通过装置测量的小面积。冠层蒸气导度(gsc [mmol sec-1 m-2])可应用方程式2.5计算,其中Patm为大气压(101.3 KPa)。
通过将van Genuchten模型(Van-Genuchten,1980)拟合至所采集的ψ(θ)数据,计算ψ(θ)之间的关系的特征曲线(其中ψ为土壤基质电势,θ为SWC)和土壤导水率函数K(θ)。
表1
用于该研究的种植介质的van Genuchten模型参数
植物导水率
一般来说,全植物导水率等于蒸腾(E,归一化至叶面积)除以叶(Ψ叶)和根之间的势差。在该研究中不测量根电势,所以我们假设黎明前叶水势(ΨPD)与根电势平衡(Holloway-Phillips和Brodribb,2011)。因此,全植物导水率(K植物)应用以下方程式2.6计算:
蒸腾与土壤含水量
比较不同植物随时间推移的行为可导致错误的推论,因为未在相似的水可用性水平下比较植物的固有参数。在某一时间,比其它植物蒸腾多的植物将面对较低的SWC水平。为此,将植物的蒸腾(E)对SWC (θ)作图。所提供的每日E和θ值为在11 am和1 pm之间观察到的平均值。应用方程式2.7以拟合各番茄品系的E(θ)数据。在方程式2.7中,Emax、b和θcr为模型拟合参数。
数据分析
应用Matlab软件(MathWorks,USA)进行所有的数据分析。数据集包括每日数据(每株植物每天1个值)和每3分钟计算的连续数据(每株植物每天480个值)。在P < 0.05下被视为显著不同的均值利用Student t检验和单因素ANOVA比较(在图例中注释)。对于两个品系方程式2.7的参数比较使用95%置信区间进行。非重叠置信区间标示在P < 0.05下的显著性差异。
气孔孔径和密度
如(Geisler和Sack,2002)中的详述将背轴叶气孔印在玻璃上。在夏季实验约11 am时采用所有样品。对气孔计数,并在安装了Hitachi (Hitachi;Japan) HV-D30 CCD照相机的亮场倒置显微镜(Zeiss 1M7100;Zeiss,Jena,Germany)下拍照。稍后应用ImageJ软件面积测量工具,分析气孔图像以测定孔径尺寸。将显微镜标尺(Olympus;Tokyo,Japan)用于尺寸校准。
定量PCR (qPCR)定量分析基因表达
在与用于测量RWC和叶水势的其它叶片相同的时间收获用于该分析的番茄叶(参见上文“实验设置”)。使用Tri-Reagent (Molecular Research Center,USA)提取总的RNA,并用无RNA酶的DNA酶(Fermentas,Vilnius,Lithuania)处理。按照生产商说明书,使用EZ-First Strand cDNA Synthesis Kit (Biological Industries,Israel)制备cDNA。在Corbett Research Rotor-Gene 6000 Cycler中,在SYBR Green I (Takara,Japan)存在下进行qPCR。番茄β-肌动蛋白基因(Sade等,2012)用为参比用于cDNA量的标准化。反应程序如下:94℃下30秒钟,接着由94℃下10秒钟、在60℃下30秒钟组成的40个循环,然后在72℃下再20秒钟。用于扩增特定片段的引物对列于下表2。
表2
结果
多种植物每日蒸腾速率的比较
两个十分近缘的番茄品系M82和MP1用于该研究,因为(按照我们之前收集的未发表数据)这些品系分别显示等水和非等水行为。首先使用新的高通量全植物诊断系统定义了一组可比较的标准和参数,其使我们能够强调在特定环境条件下的不同全植物水-调节行为的生理差异(参见材料与方法和图20A-C)。
大范围SWC (θ)水平下全植物蒸腾速率(E)和冠层蒸气导度(gsc)的观察结果(图13A-E)显示MP1的E和gsc始终高于M82品系的E和gsc。发现与E随时间推移的图相比,对E与θ作图(图14A-C)提供用于比较不同植物的蒸腾调节的更多生理相关性。植物蒸腾越多SWC降低越快且越早面临水分不足的事实为使用作为比较植物蒸腾行为基础的θ提供依据。
MP1显示更易变的蒸腾与土壤含水量比率
E随θ作图(图14A-C)显示指定环境条件下至临界SWC水平(θcr)的一致的中午蒸腾水平(Emax),且当θ进一步下降时E急剧减少。所述E相对于θ的变化表明只有当θ < θcr时,土壤水分可用性才是限制因素;而当SWC大于临界水平(θ > θcr)时,大气水分要求控制E。在所检查的θ水平和光条件范围内,MP1的E/θ比率始终高于M82的E/θ比率,正如我们在夏季(图14A)和冬季实验两者中测量的(图14;天然辐照度的水平在冬季较低;而采用人工手段以在不同季节保持VPD在类似水平下,图21A和图13A)。
当土壤中可获得充足的水分时,植物运送水的能力与许多生理、形态和解剖特征有关,所述特征一起决定各植物的Emax。这些近缘的番茄品系的气孔密度和孔径的比较显示两个品系相似的气孔密度(对于MP1和M82分别为24 ± 3和21.3 ± 1.3个气孔/0.1 mm2,均值± SE,MP1 n = 至少16片叶),且相似的土壤-环境水势差存在下MP1的气孔孔径大于M82的气孔孔径(分别为45.5 ± 1.6 µm2和25.2 ± 2 µm2,均值± SE,n = 至少16片叶)。因此,可以得出结论,M82显示比MP1更保守的水分平衡管理行为。这种差异可影响相似的叶-水分状态的气孔反应的差别灵敏性或叶片水分状况(LWS)调节的不同机制的利用。
非等水和等水植物中叶片水分状况调节中的差异
我们监测在相似的大气条件下在3种不同的SWC水平下计算的gsc,叶RWC和Ψ叶之间的关系(图15A-C)。在夏季,在充分的土壤水分可用性下,两个品系显示类似的每日gsc变化形式,即在8 am左右达到峰值,接着在1 pm左右下降,在白天后期达到平衡。两个品系的叶RWC和Ψ叶下降直到10 am左右,之后达到平衡。虽然在两个品系的叶RWC形式间未记录到差异,但MP1植物在中午之前比M82达到较低的Ψ叶值(图15A-C,左栏)。
在中等土壤水分可用性(40-50%,恰低于θcr)的条件下,gsc的速率在两个品系中逐渐增加,在9 am左右达到峰值,然后在白天的其余时间内适度下降。MP1植物在整个上午时间保持较高的gsc值,但是两个品系间的差异在午后消失。两个品系叶RWC形式与在充分灌溉处理时所观察到的类似(即在早晨快速降低,在10 am左右稳定)。然而,虽然在这种处理下中午在M82中观察到RWC水平与在充分灌溉处理时观察到的类似,但在这种处理下MP1植物的RWC水平比在充分灌溉处理时所观察到的显著较低(~6%)。另一方面,Ψ叶,在两个品系中在白天时间单调下降,其中观察到M82的较高值。两个品系间的差异在白天是显著的(图15A-C,中栏)。
在最低的SWC水平(10-20%)下,在两个品系的gsc速率间未检测出差异,所述各gsc速率非常低。Ψ叶值在SWC降低时持续降低,但是在两个品系的中午Ψ叶值间没有显著性差异。然而,M82的RWC值显著高于所观察到的MP1的RWC值;在这些条件下MP1的含水量为~22%,低于正常灌溉条件(图15A-C,右栏)。这些结果(在冬季实验中证实的,参见图22)表明MP1比M82利用更多的非等水调节策略。
非等水和等水植物中全植物水分调节的差异
引人关注的是,RWC是叶片水分状况的最保守的要素。此外,与M82形成对比,MP1在充分灌溉条件下在其RWC不降低的情况下保持较高的蒸腾水平的事实,表明MP1植物具有较高的植物导水率水平(K植物)。测量SWC允许评估土壤基质电势和土壤导水率(K土壤;图16A)。连同叶水势(参见材料与方法)和瞬间蒸腾速率(方程式2.6)一起,这些数据可用来评估植物导水率(K植物;图16B)。在充分灌溉的条件下,K土壤不降低K植物,K植物保持高水平。MPI的中午K植物比M82的更快下降,导致在SWC降低时MP1的K植物较大下降。2个液压系统的综合传导性(在单位调整后)为土壤–植物系统的导水率,称为K总 (图16C)。
在K土壤降低时MP1植物保持比M82植物高的蒸腾速率、导致MP1中K植物较急剧下降的事实,表明这2个品系在其水分平衡调节的嫩枝-根协调形式上不同。可通过比较随着水流出株冠的同时水流入根(J根),来评估全植物水平衡(ET;图17A-C)。J根通过连续测量SWC (使用土壤探头)来测定,ET通过同时连续测量植物重量来评估(参见材料与方法)。两种流动之间无差异表明始终如一的全植物RWC;而两种流动间的偏差表明全植物RWC降低或增加(图17C;材料与方法)。从MP1植物收集的每日RWC数据图显示,与M82相比,在严重的胁迫下,该品系遭受相当大的水分流失;这个观察结果与我们的人工叶RWC测量一致。
一般来说,在两个品系中,在清晨,流出植物的水分比流入植物的水分多。这之后是上午后期的流量平衡,其在正午持续,并在午后流入量大于流出量。
在不同的土壤含水量水平存在下非等水和等水植物的TIP和PIP表达谱
虽然在甚至较干燥的土壤中在M82中观察到嫩枝-根协调的这种模式,但MP1植物显示少得多的根-嫩枝同步,允许与摄取相比大得多的流出量。这种流动平衡评估与MP1植物中测量的较低RWC值一致(图15A-C和图17A-C)。
已知质膜固有蛋白PIP AQP控制细胞的渗透通透性和植物的导水率。已表明液泡膜AQP即TIP调节植物RWC和等水行为,表明了AQP可能参与造成这2个番茄品系水分平衡调节差异的细胞机制。当我们比较从3种SWC处理中收集的MP1和M82叶中几种TIP和PIP的表达水平时,我们发现在强烈和中等干旱条件两者下与在M82中相比,MP1中以显著较高的水平表达两种TIP和一种PIP (图18)。假设4种较多TIP和一种较多的PIP (其表达水平在两个品系中无不同或在响应干旱条件时降低)对两个品系的渗透性水通透性和水力概况具有较小的作用(图23A-E)。
讨论
在高VPD存在下,如果通过蒸腾失去的含水量大于通过茎接受的含水量,则叶有脱水的危险。蒸腾的细微调节取决于沿土壤–植物–大气连续体(SPAC)的许多控制点。沿SPAC的不同要素灵敏度的轻微改变可导致采用不同的水分平衡管理策略,这可反应在植物的蒸腾速率上(Monteith,1965;Farquhar和Wong,1984;Franks等,1997;Feddes和Raats 2004;Buckley,2005)。在本实施例中,监测不同处理中植物蒸腾速率的变化。
具有相似的气孔密度的等水番茄品系M82和非等水番茄品系MP1间的比较,显示这2个品系所采用的全植物E和gsc调节机制的显著差异。因此,这些番茄品系用作良好的模式植物用于分离将等水行为与非等水行为相区分的叶状态与环境阈值信号。
蒸腾和土壤含水量之间的关系
有关叶内部“关闭”信号的问题,这些信号如何通过保卫细胞转移和表征什么不同的控制行为仍未解决(Buckley,2005)。本实施例中的结果显示在两个品系中相似的E和gsc形式,其中对环境信号的敏感度不同(图13A-E)。然而,为了揭示调节这些过程的生物学机制,需要在实验过程中消除或减少与土壤水分变化有关的环境差异。因此,将两个品系的中午E值与SWC水平进行比较,而不是评估随时间推移的E (图14A-C)。不论环境条件如何(冬季或夏季),在相似SWC水平下MP1保持高于M82的E水平的事实表明,在品系茎间观察到的差异主要来自生物学调节的差异而不是来自土壤水分可用性的差异。夏季中两个品系的Emax值大大提高可为对一些大气参数(例如辐射强度和/或VPD)的直接敏感的结果。共识是保卫细胞不感知相对湿度或VPD (Mott等,1999)和在响应VPD增加时所观察到的气孔关闭是对叶片水分状况改变的间接反应(Farquhar,1978;Mott和Franks,2001;Buckley,2005)。另一方面,气孔孔径对光的反应是众所周知的。
在相似VPD条件下重复该实验,但显著不同的光条件(夏季和冬季;图13A和图21A)显示辐射强度强烈影响两个品系的Emax。与冬季实验相比,夏季实验期间自然辐射强度约35%增加(分别~1400 µmol sec-1 m-2与~900 µmol sec-1 m-2)增加MP1的Emax和gsc 3.6倍,并增加M82的Emax和gsc 2.9倍。尽管响应光改变的相似模式,但MP1植物显示对这种辐射差异较大的敏感性。然而,虽然当在土壤中容易获得水时,光和VPD控制Emax,但在较低的SWC水平下,土壤水分可用性变成蒸腾的限制因素。当SWC下降低于θcr时观察到Emax逐步降低,表明当θ < θcr时,土壤水分可用性变成Emax的限制因素,阻止植物满足大气水分要求(参见与SWC有关的线性Emax,图14A-B)。此外,θcr的值取决于瞬间大气水分要求,并随E降低而降低(如冬季实验中所观察到的)。引人关注的是,虽然在MP1和M82的Emax值间观察到显著差异,但在相关的θcr值间未记录到差异(图14C)。这表明蒸腾水分流失的一些来自植物RWC而不是来自土壤(这点在下文进一步讲述)。
蒸腾和叶片水分状况之间的关系
MP1和M82的不同的气孔调节可由对相似的叶片水分状况的差异性气孔敏感性或在相似环境条件下叶片水分状况的差异性调节所致。在相似和较低的RWC和Ψ叶水平下观察到MP1的较高水平的E和gs (图15A-C)表明与M82相比,该品系对这些参数的差异较不敏感。
M82比MP1更好地保持其RWC,正如对等水品系所预期的。另一方面,M82的Ψ叶在整个SWC水平范围内下降。实际上,在整个干旱期间在两个品系中RWC比Ψ叶更慢地降低(图15A-C,图22),与等水植物的经典定义不一致(Tardieu和Simonneau,1998)。在对遗传修饰的M82植物的品系进行的研究中报告了类似的结果,该品系通过增加液泡膜对水的通透性实现了非等水(Sade等,2012)。较高的膨压丧失点被视为耐旱性性状(Kramer和Boyer,1995;McDowell,2011;Bartlett等,2012)。物种内和物种间膨压丧失点处叶水势的变化允许保持膨压丧失点处较高的相对含水量,如最新综述所报告的(Bartlett等,2012),表明了RWC在叶片水分状况层次上处于较高位置。按照这些结论,我们认为应修改等水行为的定义以强调RWC在叶片水分状况中的作用(即“等水植物在正午达到恒定的叶RWC并且在比非等水植物更宽的SWC水平范围内保持该RWC水平”)。
从细胞水平到全植物:造成等水和非等水行为之间的差异的机制
当SWC高时,两个番茄品系显示显著不同的E和gsc水平和显著不同的气孔孔径。尽管MP1的较高蒸腾速率,但是所观察到的MP1的RWC和Ψ叶水平与所观察到的M82的无不同,极可能是由于高K植物所致,其支持充分流入以保持稳态的叶片水分状况。然而,K植物可能不被视为特别在亚最佳土壤水分条件下区分等水与非等水行为的唯一参数。随SWC降低,MP1的K植物比M82更快下降(图16B)。然而,在充分的水可用性下且在轻微干旱胁迫下,MP1保持较高的E和gsc,导致叶中显著水分亏缺。甚至在最干的土壤(10-20%含水量),MP1植物比M82植物保持较高的水流入量和流出量间的差异(图17A-C),导致这些植物的叶中甚至更大的水分亏缺。
对付水分亏缺需要缓冲机制以保护胞质中进行的生物化学反应。最近,我们提出通过其AQP调节液泡膜的渗透性水通透性,在胞质的这种补偿机制中起重要作用(Sade等,2009;Sade等,2012)。其它研究表明TIP的表达和植物生长势和干旱胁迫抗性(Tyerman等,1999;Lin等,2007;Peng等,2007)以及TIP和PIP表达之间的相似关系,所述TIP和PIP表达与高gs和K叶正相关(Pou等,2012)。
的确,两种TIP的转录物表达谱显示MP1叶和M82叶中的差异表达,包括在所有条件下在MP1中较大的SlTIP1;2表达。在MP1中,SlTIP1;1在高和中等SWC水平下以相似水平表达。然而,在M82中,SlTIP1;1在50% SW处理中以显著较低的水平表达(图18B)。另外,质膜PIP,SlPIP1;5的表达水平,在MP1中是在M82中观察到的5倍(图18C)。引人关注的是,随干旱的发展,该基因的表达以类似于针对MP1的K植物观察到的方式快速降低。SlPIP1;5与AtPIP1;2 (来自拟南芥(Arabidopsis thaliana))和NtAQP1 (来自烟草(Nicotiana tabacum)近缘,其显示在这些物种中在植物导水率的调节中起重要作用(Sade等,2010)。
若干研究显示K叶的动态阀样行为(Cochard等,2007;Levin等,2007)和根径向传导(Maggio和Joly,1995;Carvajal等,1996;Clarkson等,2000;Tournaire-Roux等,2003;Gorska等,2008;Bramley等,2010),其强有力地取决于环境信号并对环境信号起反应。这种径向流动在叶和根两者中很可能由水通道蛋白调节(Tournaire-Roux等,2003;Maurel等,2009;Shatil-Cohen等,2011;Shatil-Cohen和Moshelion,2012)。我们提出差异性TIP和PIP表达在区分等水与非等水行为的渗透-液压调节机制中起作用。因此,较大的导水率(支持较大的水流入)将抗衡作为较高gsc的结果的较高E速率。高水平的液泡渗透通透性可提供液压缓冲,使胞质的渗透内环境稳态能够面对叶供需水分平衡的短暂改变。我们提出较大的渗透缓冲可导致胞质中启动胁迫信号之前较长的时间,导致气孔保持较长时间的开放、较长时间的光合作用和非等水品系较快速的生长(图24)。然而,一达到θcr,这种控制策略就导致较快的RWC损失、较快的叶干燥和较大的液压失效风险。
本实施例提供SPAC中水运动的液压模拟(图19A和19B)。液压模拟基于动态径向流体阻力,其随电势非线性变化并且据推定受PIP控制。液泡水库通过TIP保留并释放水以补偿在负叶水分平衡存在时的胞质水分亏缺。
本文所用术语“约”是指±10%。
本文使用措词“示例性”意指“用作实例、例子或例证”。描述为“示例性”的任何实施方案不一定解释为相对于其它实施方案是优选的或有利的和/或排除来自其它实施方案的特征的并入。
本文使用措词“任选”意指“在一些实施方案提供且不在其它实施方案中提供”。本发明的任何具体实施方案可包括多个“任选的”特征,除非所述特征有抵触。
术语“包括”、“构成”、“包括”、“含有”、“具有”及其同根词意指“包括但不限于”。
术语“由……组成”意指“包括并限于”。
术语“基本由……组成”意指组合物、方法或结构可包括其它成分、步骤和/或部分,但只有其它成分、步骤和/或部分不实质性地改变所要求保护的组合物、方法或结构的基础特征和新特征。
如本文所用,单数形式“a”、“an”和“the”包括复数指代物,除非文中另有明确规定。例如,术语“化合物”或“至少一种化合物”可包括多种化合物,包括其混合物。
在本申请中,本发明的不同的实施方案可以范围形式存在。应了解,范围形式的描述仅出于方便和简洁,不应解释为本发明范围的不可变更的限制。因此,范围的描述应视为具体公开了所有可能的子范围以及该范围的各个数值。例如,范围例如1-6的描述应视为具体公开了例如1-3、1-4、1-5、2-4、2-6、3-6等子范围,以及该范围的各个数,例如1、2、3、4、5和6。不论范围宽度均适用。
每当本文规定数值范围时,均意指包括该指定范围的任何引述的数值(分数或整数)。短语“介于”第一标示数字和第二标示数字“之间的范围”和“从”第一标示数字“到”第二标示数字“的范围”在本文互换使用,意指包括第一标示数字和第二标示数字和期间的所有分数和整数。
尽管本发明结合其具体的实施方案加以描述,但是十分明显的是,许多替换、修改和变化对本领域技术人员而言是显而易见的。因此,本发明旨在包括所有落入所附权利要求书的精神和广大范围内的这些替换、修改和变动。
本说明书所提及的所有出版物、专利、专利申请都通过引用以其整体结合到本说明书中,其程度与每个独立出版物、专利、专利申请具体而单独指明通过引用结合到本文中一样。另外,在本申请任何参考文献的引用或标示都不得解释为承认这样的参考文献都可作为本发明的现有技术获得。就使用章节标题而言,不应解释为必然的限制。
参考文献
Ache P, Bauer H, Kollist H, Al-Rasheid KAS, Lautner S, Hartung W, Hedrich R (2010) Stomatal action directly feeds back on leaf turgor: new insights into the regulation of the plant water status from non-invasive pressure probe measurements (气孔作用直接反馈在叶膨压中:来自非侵入性压力探头测量的植物水状态调节的新见解). Plant Journal 62: 1072-1082。
Bartlett MK, Scoffoni C, Sack L (2012) The determinants of leaf turgor loss point and prediction of drought tolerance of species and biomes: a global meta-analysis (叶膨压丧失点的决定因素和物种和生物群系耐旱性的预测:整体元分析). Ecology Letters 15: 393-405。
Birnbaum K, Shasha DE, Wang JY, Jung JW, Lambert GM, Galbraith DW, Benfey PN (2003) A gene expression map of the Arabidopsis root (拟南芥根的基因表达图谱). Science 302: 1956-1960。
Bramley H, Turner NC, Turner DW, Tyerman SD (2010) The contrasting influence of short-term hypoxia on the hydraulic properties of cells and roots of wheat and lupin (短期缺氧对小麦和羽扇豆的细胞和根的水压性质的对比影响). Functional Plant Biology 37: 183-193。
Buck AL (1981) New equations for computing vapor pressure and enhancement factor (计算蒸气压和增强因数的新方程式). Journal of Applied Meteorology 20: 1527-1532。
Buckley TN (2005) The control of stomata by water balance (通过水分平衡控制气孔). New Phytologist 168: 275-292。
Carvajal M, Cooke D, Clarkson D (1996) Responses of wheat plants to nutrient deprivation may involve the regulation of water-channel function (小麦植物对营养物剥夺的反应可包括水通道功能的调节). Planta 199: 372-381。
Clarkson DT, Carvajal M, Henzler T, Waterhouse RN, Smyth AJ, Cooke DT, Steudle E (2000) Root hydraulic conductance: diurnal aquaporin expression and the effects of nutrient stress (根导水率:昼间水通道蛋白表达和营养物胁迫的作用). Journal of Experimental Botany 51: 61-70。
Cochard H, Venisse J-Sp, Barigah TtSvr, Brunel N, Herbette Sp, Guilliot As, Tyree MT, Sakr S (2007) Putative Role of Aquaporins in Variable Hydraulic Conductance of Leaves in Response to Light (在响应光时水通道蛋白在叶片可变导水率中的推定作用). Plant Physiology 143: 122-133。
Farquhar GD (1978) Feedforward Responses of Stomata to Humidity (气孔对湿度的前馈反应). Functional Plant Biology 5: 787-800。
Farquhar GD, Wong SC (1984) An Empirical Model of Stomatal Conductance (气孔导度的经验模型). Functional Plant Biology 11: 191-210。
Feddes RA, Raats PAC (2004) Parameterizing the soil – water – plant root system (确定土壤–水–植物根系的参数). 载于RAdR Feddes, G. H.; Van Dam, J.C.编辑, Unsaturated-zone Modeling: Progress, Challenges and Applications Kluwer Academic, Wageningen, 第95-132页。
Franks PJ, Cowan IR, Farquhar GD (1997) The apparent feedforward response of stomata to air vapor pressure deficit: information revealed by different experimental procedures with two rainforest trees (气孔对空气蒸气压不足的表观前馈反应:用2种雨林树的不同实验方法揭示的信息). Plant, Cell & Environment 20: 142-145。
Geisler M, Sack FD (2002) Variable timing of developmental progression in the stomatal pathway in Arabidopsis cotyledons (拟南芥子叶中气孔途径的发育进程的可变时机). New Phytologist 153: 469。
Gorska A, Zwieniecka A, Michele Holbrook N, Zwieniecki M (2008) Nitrate induction of root hydraulic conductivity in maize is not correlated with aquaporin expression (玉米中根导水率的硝酸盐诱导与水通道蛋白表达无关). Planta 228: 989-998。
Holloway-Phillips M-M, Brodribb TJ (2011) Minimum hydraulic safety leads to maximum water-use efficiency in a forage grass (最小液压安全性导致饲用牧草的最大用水效率). Plant, Cell & Environment 34: 302-313。
Kaldenhoff R, Bertl A, Otto B, Moshelion M, Uehlein N (2007) Characterization of Plant Aquaporins (植物水通道蛋白的表征). 428: 505-531。
Kramer PJ, Boyer JS (1995) Water relations of plants and soils (植物和土壤的水分关系). Academic Press, Inc。
Levin M, Lemcoff JH, Cohen S, Kapulnik Y (2007) Low air humidity increases leaf-specific hydraulic conductance of Arabidopsis thaliana (L.) Heynh (Brassicaceae) (低空气湿度增加拟南芥(L.) Heynh (十字花科)的叶片特异性导水率). Journal of Experimental Botany 58: 3711-3718。
Levin M, Lemcoff JH, Cohen S, Kapulnik Y (2007) Low air humidity increases leaf-specific hydraulic conductance of Arabidopsis thaliana (L.) Heynh (Brassicaceae) (低空气湿度增加拟南芥(L.) Heynh (十字花科)的叶片特异性导水率). Journal Of Experimental Botany 58: 3711。
Lin W, Peng Y, Li G, Arora R, Tang Z, Su W, Cai W (2007) Isolation and functional characterization of PgTIP1, a hormone-autotrophic cells-specific tonoplast aquaporin in ginseng (人参中激素自养细胞特异性液泡膜水通道蛋白PgTIP1的分离和功能表征). Journal Of Experimental Botany 58: 947-956。
Maggio A, Joly RJ (1995) Effects of Mercuric Chloride on the Hydraulic Conductivity of Tomato Root Systems (Evidence for a Channel-Mediated Water Pathway) (氯化汞对番茄根系导水率的作用(通道介导的水途径的证据)). Plant Physiology 109: 331-335。
Maurel C, Santoni V, Luu D-T, Wudick MM, Verdoucq L (2009) The cellular dynamics of plant aquaporin expression and functions (植物水通道蛋白表达和功能的细胞动力学). Current Opinion In Plant Biology 12: 690-698。
Maurel C, Simonneau T, Sutka M (2010) The significance of roots as hydraulic rheostats (根作为液压变阻器的重要性). Journal Of Experimental Botany 61: 3191-3198。
Maurel C, Verdoucq L, Luu D-T, Santoni V (2008) Plant Aquaporins: Membrane Channels with Multiple Integrated Functions (植物水通道蛋白:具有多种综合功能的膜通道). Annual Review Of Plant Biology 59: 595-624。
McDowell N, Pockman WT, Allen CD, Breshears DD, Cobb N, Kolb T, Plaut J, Sperry J, West A, Williams DG, Yepez EA (2008) Mechanisms of plant survival and mortality during drought: why do some plants survive while others succumb to drought (干旱期间植物存活和死亡的机制:为什么一些植物存活而其它死于干旱) New Phytologist 178: 719-739。
McDowell NG (2011) Mechanisms Linking Drought, Hydraulics, Carbon Metabolism, and Vegetation Mortality (连接干旱、水力学、碳代谢和植被死亡的机制). Plant Physiology 155: 1051-1059。
Monteith JL (1965) Evaporation and environment (蒸发和环境). Symposia of the Society for Experimental Biology 19: 205-234。
Mott KA, Franks PJ (2001) The role of epidermal turgor in stomatal interactions following a local perturbation in humidity (表皮膨胀在局部湿度扰动后气孔相互作用中的作用). Plant, Cell & Environment 24: 657-662。
Mott KA, Parkhurst DF (1991) Stomatal Responses To Humidity In Air And Helox (气孔对空气和Helox中的湿度的反应). Plant Cell And Environment 14: 509。
Mott KA, Shope JC, Buckley TN (1999) Effects of humidity on light-induced stomatal opening: evidence for hydraulic coupling among stomata (湿度对光诱导的气孔开启的作用:气孔间液力联轴器的证据). Journal Of Experimental Botany 50: 1207-1213。
Nardini A, Raimondo F, Lo Gullo MA, Salleo S (2010) Leafminers help us understanding leaf hydraulic design (潜叶虫有助于我们理解叶液压设计). Plant, Cell & Environment。
Nobel P (2009) Physicochemical and Environmental Plant Physiology (物理化学和环境植物生理学)。
Pantin F, Monnet F, Jannaud D, Costa JM, Renaud J, Muller B, Simonneau T, Genty B (2013) The dual effect of abscisic acid on stomata (脱落酸对气孔的双重作用). New Phytologist 197: 65-72。
Peng Y, Lin W, Cai W, Arora R (2007) Overexpression of a Panax ginseng tonoplast aquaporin alters salt tolerance, drought tolerance and cold acclimation ability in transgenic Arabidopsis plants (人参液泡膜水通道蛋白的过量表达改变转基因拟南芥植物的耐盐性、耐旱性和冷适应能力). Planta 226: 729-740。
Pou A, Medrano H, Flexas J, Tyerman SD (2012) A putative role for TIP and PIP aquaporins in dynamics of leaf hydraulic and stomatal conductances in grapevine under water stress and re-watering (在水胁迫和再浇水下葡萄树中的TIP和PIP水通道蛋白在叶液压动力学和气孔导度中的推定作用). Plant, Cell & Environment: no-no。
Sack L, Holbrook NM (2006) Leaf hydraulics (叶片水力学). Annual Review Of Plant Biology 57: 361。
Sack L, Holbrook NM (2006) Leaf hydraulics (叶片水力学). Annual Review of Plant Biology 57: 361-381.
Sade D, Eybishtz A, Gorovits R, Sobol I, Czosnek H (2012) A developmentally regulated lipocalin-like gene is overexpressed in Tomato yellow leaf curl virus-resistant tomato plants upon virus inoculation, and its silencing abolishes resistance (在病毒接种时在番茄黄曲叶病毒抗性番茄植物中过量表达的发育调节的脂笼蛋白样基因及其沉默消除抗性). Plant Mol Biol 80: 273-287。
Sade N, Gebremedhin A, Moshelion M (2012) Risk-taking plants: Anisohydric behavior as a stress-resistance trait (冒风险植物:作为胁迫抗性性状的非等水行为). Plant Signaling & Behavior 7: 767-770。
Sade N, Gebretsadik M, Seligmann R, Schwartz A, Wallach R, Moshelion M (2010) The Role of Tobacco Aquaporin1 in Improving Water Use Efficiency, Hydraulic Conductivity, and Yield Production Under Salt Stress (烟草水通道蛋白1在改进在盐胁迫下的用水效率、导水率和产量中的作用). Plant Physiology 152: 245-254。
Sade N, Vinocur BJ, Diber A, Shatil A, Ronen G, Nissan H, Wallach R, Karchi H, Moshelion M (2009) Improving plant stress tolerance and yield production: is the tonoplast aquaporin SlTIP2;2 a key to isohydric to anisohydric conversion (改进植物胁迫耐受性和产量:液泡膜水通道蛋白SlTIP2;2对等水与非等水转化是关键的吗) New Phytol 181: 651-661。
Shatil-Cohen A, Attia Z, Moshelion M (2011) Bundle-sheath cell regulation of xylem-mesophyll water transport via aquaporins under drought stress: a target of xylem-borne ABA (在干旱下胁迫水通道蛋白的木质部-叶肉水分运输的维管束鞘细胞调节:木质部运载的ABA的目标) The Plant Journal 67: 72-80。
Shatil-Cohen A, Moshelion M (2012) Smart pipes: The bundle sheath role as xylem-mesophyll barrier (巧妙的管道:作为木质部-叶肉屏障的维管束鞘作用). Plant Signaling & Behavior 7: 1088-1091。
Shatil-Cohen A, Moshelion M (2012) Smart Pipes: The bundle sheath role as xylem-mesophyll barrier (巧妙的管道:作为木质部-叶肉屏障的维管束鞘作用). Plant Signaling & Behavior 7: 1088-1091。
Steudle E (2000) Water uptake by roots: effects of water deficit (通过根的吸水:水分亏缺的作用). J. Exp. Bot. 51: 1531-1542。
Taiz L, Zeiger E (2002) Plant physiology, 第3版. Sinauer Associates, Sunderland, Mass。
Tardieu F, Simonneau T (1998) Variability among species of stomatal control under fluctuating soil water status and evaporative demand: modelling isohydric and anisohydric behaviours (在振荡的土壤水分状态和蒸发要求下气孔控制类型间的变化性:等水和非等水行为的模型化). Journal Of Experimental Botany 49: 419-432。
Topp GC, Davis JL, Annan AP (1980) Electromagnetic determination of soil water content: Measurements in coaxial transmission lines (土壤含水量的电磁测定:同轴传输线的测量). Water Resour. Res. 16: 574-582。
Tournaire-Roux C, Sutka M, Javot H, Gout E, Gerbeau P, Luu D-T, Bligny R, Maurel C (2003) Cytosolic pH regulates root water transport during anoxic stress through gating of aquaporins (缺氧胁迫期间胞质pH通过水通道蛋白门控调节根部水分运输). Nature 425: 393-397。
Tyerman SD, Bohnert HJ, Maurel C, Steudle E, Smith JAC (1999) Plant aquaporins: their molecular biology, biophysics and significance for plant water relations (植物水通道蛋白:其分子生物学、生物物理学和植物水分关系的重要性). Journal of Experimental Botany 50: 1055-1071。
Tyerman SD, Niemietz CM, Bramley H (2002) Plant aquaporins: multifunctional water and solute channels with expanding roles (植物水通道蛋白:具有扩展作用的多功能水分和溶质通过). Plant Cell Environ 25: 173-194。
Uehlein N, Lovisolo C, Siefritz F, Kaldenhoff R (2003) The tobacco aquaporin NtAQP1 is a membrane CO2 pore with physiological functions (烟草水通道蛋白NtAQP1是具有生理功能的膜CO2孔). Nature 425: 734-737。
Van-Genuchten MT (1980) A Closed-form Equation for Predicting the Hydraulic Conductivity of Unsaturated Soils (用于预测非饱和土壤的导水率的封闭形式方程式). Soil Sci. Soc. Am. J. 44:892-898。
Wallach R, Da-Costa N, Raviv M, Moshelion M (2010) Development of synchronized, autonomous, and self-regulated oscillations in transpiration rate of a whole tomato plant under water stress (水胁迫下全番茄植物的蒸腾速率的同步化、自主和自调节振荡的发展). J. Exp. Bot. 61: 3439-3449。
- 还没有人留言评论。精彩留言会获得点赞!