高血压引起的组织纤维化动物模型及其制备方法和应用与流程
本发明涉及生物技术领域,更具体地涉及一种高血压引起的组织纤维化动物模型及其制备方法和应用。
背景技术:
组织纤维化(fibrosis)是一种以器官组织内纤维结缔组织增多,实质细胞减少为病理特征的疾病,可发生于多种器官,持续进展可致器官结构破坏和功能减退,乃至衰竭。据美国有关统计资料证明,该国因各种疾病而致死的病人中,接近45%可以归于组织纤维增生疾病。组织纤维化是组织遭受损伤后的组织修复反应,如果这种修复反应过度、过强和失控时,增生的纤维结缔组织就会引起器官的纤维化和导致器官的功能下降。因此,组织纤维化多继发于各种慢性疾病,如高血压导致心血管和肾脏纤维化,慢性肾炎所导致的肾脏纤维化等。目前对纤维化发生过程的分子机制仍未完全阐明,当前临床上对组织纤维化的治疗缺乏特效药物。
ets-1(e26avianleukemiaoncogene1,5'domain)是转录因子ets家族成员,参与了多种组织细胞的增殖,凋亡,分化和迁移过程。ets-1在体内表达广泛于内皮细胞,血管平滑肌细胞,成纤维细胞等组织细胞中,但是其在内皮细胞中表达最高,且ets-1在体内的生理功能具有组织特异性。
目前,对ets-1在组织纤维化发生过程中的作用机制,特别是作用靶点仍缺乏有效的体内研究手段。对ets-1体内功能的研究都是基于ets-1全身敲除小鼠模型和尾静脉注射多肽抑制剂进行的,无法组织特异性的研究ets-1在小鼠体内调控纤维化发生的生理功能。其中,ets-1全身敲除小鼠大部分无法存活到成年,有多器官发育缺陷,用该小鼠构建组织纤维化损伤模型实验数据不准确。ets-1多肽抑制剂对ets-1活性抑制不完全,尾静脉注射以后对ets-1的抑制无组织特异性,且在身体不同部位分布不均匀,用该小鼠构建组织纤维化损伤模型实验数据不准确。因此,本领域迫切需要构建一种ets-1组织特异性敲除的组织纤维化动物模型。
技术实现要素:
本发明的目的在于提供一种ets-1内皮细胞特异性敲除的动物模型。
在本发明的第一方面,提供了一种非人哺乳动物的高血压引起的组织纤维化动物模型的制备方法,该方法包括以下步骤:
(1)提供ets-1条件敲除的非人哺乳动物a,和同一物种的内皮细胞特异性cre表达的非人哺乳动物b;
(2)将所述的动物a与动物b交配繁育,获得ets-1在内皮细胞特异性敲除的非人哺乳动物c;
(3)培养所述的动物c,从而得到所述的高血压引起的组织纤维化动物模型。
在另一优选例中,所述动物a基因组的ets-1基因中的一个或多个外显子的两侧插入有loxp序列。
在另一优选例中,所述动物a的ets-1基因中的外显子7和外显子8的两侧插入有loxp序列。
在另一优选例中,所述的loxp序列之间还插入有筛选标记。
在另一优选例中,所述筛选标记为neo基因。
在另一优选例中,所述动物b的基因组中包含一外源cre表达盒。
在另一优选例中,所述的外源cre表达盒包括:(a)内皮细胞特异性启动子;和(b)位于所述内皮细胞特异性启动子下游的cre基因。
在另一优选例中,所述的内皮细胞特异性启动子包括启动子tie2。
在另一优选例中,所述的动物c的ets-1基因在内皮细胞中特异性敲除。
在另一优选例中,所述敲除包括ets-1基因不表达,或表达没有活性的ets-1蛋白。
在另一优选例中,所述特异性敲除是通过敲除ets-1基因的外显子7和8实现的。
在另一优选例中,在步骤(3)中,对所述的动物c进行高血压诱导,从而得到所述的高血压引起的组织纤维化动物模型。
在另一优选例中,所述高血压诱导为利用血管紧张素ii(angii)进行诱导。
在另一优选例中,所述非人哺乳动物为啮齿动物或灵长目动物,较佳地包括小鼠、大鼠、兔、猴。
在另一优选例中,与野生型对照动物相比,进行高血压诱导后,所述的高血压引起的组织纤维化动物模型具有以下一个或多个特征:
(a)心室壁肥厚程度减轻;
(b)心肌纤维化减轻,较佳地为心肌血管周围的纤维化减轻;
(c)肾脏纤维化。
在本发明的第二方面,提供了一种本发明第一方面所述方法制备的动物模型的用途,所述的模型用于研究ets-1在组织纤维化发生过程中的作用。
在另一优选例中,所述组织纤维化是与高血压相关的(引起的)组织纤维化。
在本发明的第三方面,提供了一种本发明第一方面所述方法制备的动物模型的用途,将该模型用作研究组织纤维化的动物模型。
在另一优选例中,所述高血压引起的的组织纤维化包括:肾脏纤维化、心肌纤维化、血管纤维化、或其组合。
在本发明的第四方面,提供了一种本发明第一方面所述方法制备的动物模型的用途,将该模型用于筛选或鉴定可减轻或治疗组织纤维化的物质(治疗剂)。
在本发明的第五方面,提供了一种用本发明第一方面所述方法制备的非人哺乳动物模型。
在另一优选例中,对于ets-1基因敲除而言,所述的非人哺乳动物模型是杂合的或纯合的。
在另一优选例中,所述的ets-1基因敲除是ets-1基因在内皮细胞中特异性敲除。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
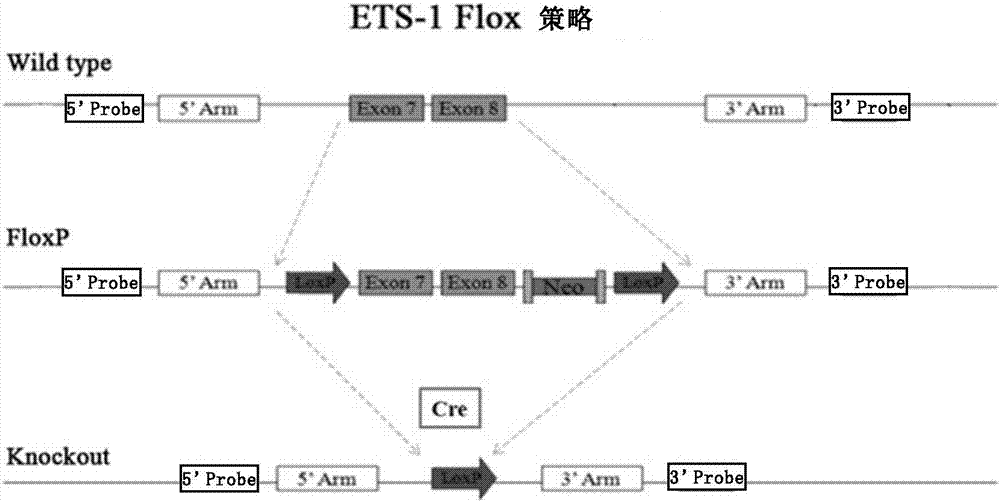
图1显示了ets-1内皮细胞条件敲除小鼠(tie2cre/ets-1f/f小鼠)的构建示意图。
图2显示了ets-1条件敲除小鼠(ets-1f/f小鼠)的构建示意图。
图3显示了内皮细胞特异性cre表达小鼠(tie2cre小鼠)的构建示意图。
图4a显示了tie2cre/ets-1f/f小鼠在angii灌流前后的收缩压。
图4b显示了angii灌流2周后,tie2cre/ets-1f/f小鼠心室壁厚度统计数据。
图4c-图4f显示了各组的心室横切面(wt:c;tie2cre/ets-1f/fd;wt+angii:e;tie2cre/ets-1f/f+angii:f)。
图4g-图4j显示了各组心脏的h&e染色结果(wt:g;tie2cre/ets-1f/fh;wt+angii:i;tie2cre/ets-1f/f+angii:j)。
图4k-图4n显示了各组的肾脏纵切面(wt:k;tie2cre/ets-1f/fl;wt+angii:m;tie2cre/ets-1f/f+angii:n)。
图5a-图5h显示了各组心脏的masson染色结果(wt:a,e;tie2cre/ets-1f/fb,f;wt+angii:c,g;tie2cre/ets-1f/f+angii:d,h)。
图5i-图5p显示了各组心脏的天狼星红染色结果(wt:i,m;tie2cre/ets-1f/fj,n;wt+angii:k,o;tie2cre/ets-1f/f+angii:l,p)。
具体实施方式
本发明人经过广泛而深入地研究,首次意外地发现一种高血压引起的组织纤维化动物模型及其制备方法和应用。具体地,本发明提供了一种ets-1内皮细胞特异性敲除动物,其可以作为高血压引起的组织纤维化动物模型,其制备方法包括步骤:将ets-1条件敲除的非人哺乳动物a和同一物种的内皮细胞特异性cre表达的非人哺乳动物b交配繁育,获得ets-1在内皮细胞特异性敲除的非人哺乳动物c,即为所述的高血压引起的组织纤维化动物模型。本发明的动物模型可以用于高血压引起的的组织纤维化的研究。
术语
ets-1基因
ets-1(e26avianleukemiaoncogene1,5'domain)是转录因子ets家族成员,参与了多种组织细胞的增殖,凋亡,分化和迁移过程。ets-1在体内表达广泛于内皮细胞,血管平滑肌细胞,成纤维细胞等组织细胞中,但是其在内皮细胞中表达最高,且ets-1在体内的生理功能具有组织特异性。
ets-1基因最早是作为一种原癌基因被发现,参与调控了多种肿瘤的发生和转移。随着对ets-1研究的加深,发现该基因在器官发育,组织的损伤修复,炎症等多种病理生理过程中都发挥了重要作用。而最新研究表明,ets-1参与了组织纤维化疾病的发生过程,但其具体的调控机制还有待研究阐明。
组织纤维化
组织纤维化(fibrosis)是一种以器官组织内纤维结缔组织增多,实质细胞减少为病理特征的疾病,可发生于多种器官,持续进展可致器官结构破坏和功能减退,乃至衰竭。
组织纤维化是组织遭受损伤后的组织修复反应,如果这种修复反应过度、过强和失控时,增生的纤维结缔组织就会引起器官的纤维化和导致器官的功能下降。因此,组织纤维化多继发于各种慢性疾病,如高血压导致心血管和肾脏纤维化,慢性肾炎所导致的肾脏纤维化等。
基因失活
对于功能未知基因的研究可采用许多方法,例如使有待研究的基因失活,分析所得的遗传修饰的表型变化,进而获得该基因的功能信息。这一研究方法的另一优点是可以将基因功能和疾病进行关联,从而在获得基因功能的同时也能获得该基因作为潜在药物或者药物靶点所能治疗的疾病信息和疾病动物模型。基因失活的方法可通过基因剔除、基因中断或基因插入的方式来完成。其中,基因剔除技术是研究人类基因在整体中的功能的非常强有力的手段。
如本文所用,术语“基因失活”、“基因敲除”可互换使用,指通过对某一目的基因进行中断、敲除等遗传操作,从而使得该目的基因的表达和/或活性大幅下降甚至完全丧失。
本发明利用“组织特异性cre-loxp系统”,将ets-1条件敲除小鼠(ets-1f/f)与内皮细胞特异性cre表达小鼠(tie2cre)杂交,获得ets-1在内皮细胞的特异性敲除小鼠(tie2cre/ets-1f/f小鼠)。其中,ets-1条件敲除小鼠的基因组中ets-1基因的外显子7和外显子8的两侧插入有loxp标记;内皮细胞特异性cre表达小鼠的基因组中包含一外源cre表达序列,所述的外源cre表达序列包括:(a)内皮细胞特异性启动子(tie2),和(b)位于所述内皮细胞特异性启动子下游的cre基因。本发明在个体水平上,将上述两种小鼠的杂交,获得在内皮细胞中特异性表达cre重组酶的子代小鼠,从而将内皮细胞基因组中的loxp位点之间的ets-1基因切除,实现ets-1基因在内皮细胞中的特异性失活。
cre重组酶是于1981年从p1噬菌体中发现,属于λint酶超基因家族。cre重组酶基因编码区序列全长1029bp(embl数据库登录号x03453),编码38kda蛋白质。cre重组酶是一种由343个氨基酸组成的单体蛋白。它不仅具有催化活性,而且与限制酶相似,能识别特异的dna序列,即loxp位点,使loxp位点间的基因序列被删除或重组。cre重组酶有70%的重组效率,不借助任何辅助因子,可作用于多种结构的dna底物,如线形、环状甚至超螺旋dna。它是一种位点特异性重组酶,能介导两个loxp位点(序列)之间的特异性重组,使loxp位点间的基因序列被删除或重组。
loxp(locusofx-overp1)序列:来源于p1噬菌体,是有两个13bp反向重复序列和中间间隔的8bp序列共同组成,8bp的间隔序列同时也确定了loxp的方向。cre在催化dna链交换过程中与dna共价结合,13bp的反向重复序列是cre酶的结合域。
动物模型
在本发明中,提供了一种的非人哺乳动物的高血压相关组织纤维化动物模型,所述动物模型如本发明第5方面所述。
如本文所用,术语“高血压引起的组织纤维化动物模型”、“高血压相关组织纤维化动物模型”可互换使用,均指本发明第5方面所述的动物模型。
具体地,本发明利用tie2cre工具小鼠和ets-1flox/flox小鼠杂交构建了一个ets-1在内皮细胞中的条件敲除小鼠,在小鼠内皮细胞特异性的敲除了ets-1的表达,使发明人可以在体内水平组织特异性的研究ets-1在内皮细胞中的功能。
为了研究ets-1在纤维化疾病过程中的作用,选择了angii诱导高血压小鼠模型,该模型中小鼠心血管和肾脏可发生继发性纤维化改变。使用皮下微量泵的方法,用tie2cre/ets-1flox/flox小鼠构建高血压小鼠模型,研究表明ets-1的表达在内皮细胞中被抑制可显著缓解angii诱导引起的小鼠心血管和肾脏的纤维化进程。该小鼠模型完全符合实验设计要求。
事实上,现有技术中诱导高血压的其他方法也可以用于本发明动物模型的构建,如以口服、药物或添加含angii的食物或饮水的方式进行高血压诱导。
本发明构建的angii诱导内皮特异性ets-1基因敲除小鼠高血压动物模型使研究者可以在组织特异性的角度,去更精确的研究ets-1在组织纤维化疾病发生过程中的分子机制,为开发ets-1抑制剂类抗组织纤维化药物提供理论基础。
本发明的主要应用:
本发明使用angii诱导ets-1内皮细胞条件敲除小鼠(tie2cre/ets-1flox/flox小鼠)构建的高血压小鼠模型,可具有多种不同的应用。代表性的应用包括(但并不限于):
1.对ets-1在高血压所致组织纤维化过程中分子机制的研究。
2.对ets-1在小鼠内皮细胞中功能特异性的研究。
本发明的主要优点包括:
(a)利用angii诱导ets-1内皮细胞条件敲除小鼠(tie2cre/ets-1flox/flox小鼠)构建的高血压小鼠模型。
(b)本发明构建的小鼠模型对ets-1在内皮细胞中组织特异性的失活,能在体内水平,组织特异性的研究ets-1在内皮细胞中生理功能的分子机制。
(c)ets-1内皮细胞条件敲除小鼠在正常饲养状态下无表型,用该小鼠构建angii诱导高血压小鼠模型研究高血压继发性心血管和肾脏纤维化过程,数据清晰可靠。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
通用材料和方法
1.ets-1条件敲除小鼠(ets-1f/f小鼠)的构建采用染色体同源重组技术进行,构建示意图如图2所示。
2.内皮细胞特异性cre表达小鼠(tie2cre小鼠)为基因敲除工具鼠,购自美国thejacksonlaboratory公司,构建示意图如图3所示。
实施例1
ets-1内皮细胞条件敲除小鼠模型的构建
为了特异性地研究ets-1在心脏内皮细胞中的功能,构建了ets-1条件敲除小鼠(ets-1flox/flox)模型。实验流程如图1所示。
通过品系杂交,将ets-1条件敲除小鼠(ets-1f/f)与内皮细胞特异性cre表达小鼠(tie2cre)杂交,获得了ets-1在内皮细胞的特异性敲除小鼠(tie2cre/ets-1f/f小鼠)。
通过对2月龄tie2cre/ets-1f/f小鼠心脏表型分析表明,突变鼠无心脏结构发育异常,超声心动图检测显示心脏功能正常。
实施例2
高血压小鼠模型构建和研究
通过在小鼠皮下埋微量泵(alzent,models1002,1004)灌流angii(a9525,sigma-aldrich)2或4周的方法,构建angii灌注高血压小鼠模型。
结果如图4所示,使用angii灌流小鼠2周后,ets-1在内皮细胞中的表达缺失不会对angii引起的血压升高造成改变,即不会减轻或者加重高血压的发生(图4a);但在angii灌流2周后,tie2cre/ets-1f/f小鼠心室壁肥厚程度较对照组显著减轻(图4b-4j),肾脏纤维化也显著缓解(图4k-4n)。masson染色和天狼星红染色显示突变鼠心肌纤维化,特别是心肌血管周围的纤维化显著减少(图5),表明ets-1在内皮细胞中的缺失对angii引起的心肌纤维化过程具有保护作用。该小鼠模型符合实验设计要求。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!