一种桃叶卫矛茎尖超低温保存方法与流程
本发明涉及一种茎尖长期保存方法,具体是一种桃叶卫矛茎尖超低温保存方法。
背景技术:
桃叶卫矛,又名白杜、丝绵木,是卫矛科卫矛属的一种小乔木,是我国常见的观赏类庭园树种之一,其叶形秀丽,植株繁茂,包被有红色假种皮的果实可长期宿存于枝头,到了冬季,白雪红果相映,十分美丽,为冬季的北方园林增添了不少色彩。桃叶卫矛在耐寒、抗旱、抗风等方面具有良好的适应性;桃叶卫矛果实总皂苷对人肝癌细胞系-smmc、人宫颈癌细胞系-hela和乳腺癌细胞系-mcf7有明显的抑制生长作用;桃叶卫矛的种子含丰富的脂肪类物质,含油率高达40%以上,可用做工业用油;木材细腻坚韧,可用于雕刻、制帆杆或滑车等;种子及根药用,可用于治疗膝关节痛、漆疮等疾病。由此可见,桃叶卫矛是一种集工业、药用、观赏应用于一体的植物,具有较高的推广价值。若采用传统的种植保存,极易使其受到病菌或虫害的影响,进而造成极大的人力财力的损失,由于茎尖具有良好的分生能力,因此目前已经广泛地将其应用于植物种质资源的离体保存。
植物种质资源超低温保存是指将植物细胞、组织或器官在液氮(-196℃)的超低温条件下进行保存。在如此低的温度下,植物材料中参与新陈代谢的各种生物酶的活性受到极大抑制,生物体新陈代谢基本停止,处于“假死”状态,利用该方法可以实现植物种质资源的永久保存。目前成功进行超低温保存的材料类型有种子、休眠芽、茎尖分生组织、花粉、合子胚(胚轴)、体细胞胚、悬浮细胞、愈伤组织、原生质体等。而较于植物的其他部位,顶端分生组织具有更强的分生能力,而当茎尖经过超低温保存后依然能够保持较强的分生能力,因此茎尖也是超低温保存的首选材料之一,因此已经广泛应用于植物种质资源超低温保存。
将超低温保存技术应用于茎尖保存,其优点:操作简单易行、占用空间小、安全稳定保存成本低同时还能很好服务于育种工作,还可以避免病虫害的引入,为地区间、国际间的种质交换提供方便。
桃叶卫矛茎尖超低温保存目前还未见报道。因此,研发一种适合于桃叶卫矛茎尖的可行的超低温保存方法是非常必要的。
技术实现要素:
本发明的目的是通过以下技术方案来实现:
本发明涉及一种桃叶卫矛茎尖玻璃化超低温保存的方法,依次包括:桃叶卫矛茎尖的剥离、茎尖预处理、装载、pvs2玻璃化处理、液氮保存、解冻和卸载以及恢复培养的方法。
优选地,所述的桃叶卫矛茎尖的剥离具体是指:在无菌条件下,从生长健康的无菌桃叶卫矛组培苗上剥取的茎尖长度为2~3mm的离体茎尖。
优选地,所述的预处理是指:将剥离后的茎尖放入预培养液中处理,预培养液中蔗糖最适浓度为0.4mol/l的ms盐溶液,于环境条件为25℃的人工气候箱中暗培养2d。
优选地,所述的装载具体是指:将预培养后的离体茎尖转接于装载液中,于室温下装载10~30min;所述的装载液的组成为:2m甘油+0.4m蔗糖的ms盐溶液。
优选地,所述的玻璃化处理具体是指:将装载后的茎尖放入100%pvs2玻璃化溶液于0℃条件下处理30min;所述的pvs2玻璃化溶液的组成为:ms盐溶液+30%甘油+15%乙二醇15%+15%二甲基亚砜+0.4m蔗糖。
优选地,所述的液氮保存是指:将pvs2溶液处理后的茎尖换上新的pvs2溶液,然后迅速将冷冻管浸入液氮中,至少冷冻1h以上。
优选地,所述的解冻和卸载是指:将液氮保存后的冷冻管取出并于40℃水浴中化冻70s,再将冷冻管转至超净工作台上用卸载液洗涤20min;所述的卸载液的组分为:ms盐溶液+1.2m蔗糖。
优选地,所述的恢复培养具体是指:将卸载液洗涤后的茎尖接种在恢复培养基上进行恢复培养;所述的恢复培养基为ms+6-ba1.0mg/l;所述的恢复培养条件为:先在25℃人工气候箱中暗培养7d,然后转入组培苗培养室进行培养。
与现有技术相比,本发明存在以下有益结果:
本发明的一种桃叶卫矛茎尖超低温保存的方法,是一种长期安全、稳定可靠、简单有效的保存桃叶卫矛优良种质资源的方法,超低温保存后桃叶卫矛茎尖成活率高达70%;本发明以不定芽茎尖为超低温保存材料,一方面取材方便,另一方面由于茎尖含有茎尖分生组织,细胞再生能力较强,遗传稳定性高。
附图说明
图1为本发明实施例3中桃叶卫矛茎尖长度对超低温保存后茎尖成活率的影响
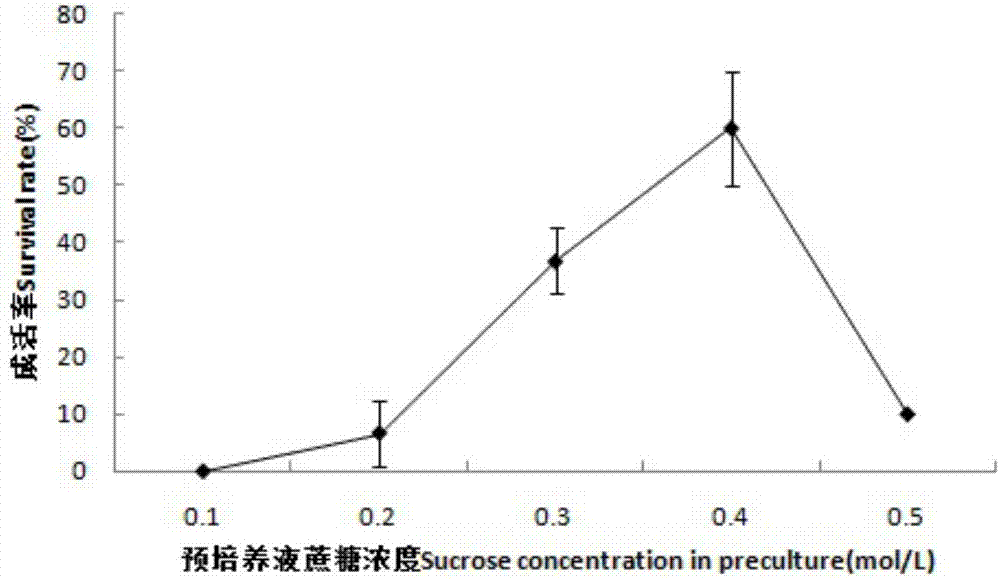
图2为本发明实施例4中预培养液蔗糖浓度对超低温保存后茎尖成活率的影响
图3为本发明实施例4中预培养时间对超低温保存后茎尖成活率的影响
图4为本发明实施例5中装载液处理时间对超低温保存后茎尖成活率的影响
图5为本发明实施例6中pvs2溶液处理时间对超低温保存后茎尖成活率的影响
图6为本发明实施例7中卸载液处理时间对超低温保存后茎尖成活率的影响
图7为本发明中桃叶卫矛茎尖超低温保存体系流程图;a桃叶卫矛实生苗顶芽;b桃叶卫矛离体茎尖;c超低温保存后转入恢复培养基的桃叶卫矛茎尖;d暗培养7d后桃叶卫矛茎尖存活情况;e超低温保存后存活的茎尖;f超低温保存后死亡的茎尖;g,h超低温保存后桃叶卫矛茎尖形成的愈伤组织;i超低温保存后桃叶卫矛茎尖愈伤组织的增殖;j超低温保存后桃叶卫矛茎尖愈伤组织的分化;k分化芽的增殖;l分化芽成苗;m超低温保存后桃叶卫矛再生苗的生根;n超低温保存后桃叶卫矛再生苗的移栽。
具体实施方式:
下面结合实施例对本发明做进一步详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程。
实施例1
一种桃叶卫矛茎尖超低温保存的方法,具体操作如下:
1)在无菌条件下,从生长健康的无菌桃叶卫矛组培苗上剥取的茎尖长度为2~3mm的离体茎尖;
2)将剥离后的茎尖放入预培养液中处理,预培养液中蔗糖最适浓度为0.4mol/l的ms盐溶液,于环境条件为25℃的人工气候箱中暗培养2d;
3)将预培养后的离体茎尖转接于装载液中,于室温下装载10~30min;所述的装载液的组成为:ms盐溶液+2m甘油+0.4m蔗糖;
4)将装载后的茎尖放入100%pvs2玻璃化溶液于0℃条件下处理30min;所述的pvs2玻璃化溶液的组成为:ms盐溶液+30%甘油+15%乙二醇+15%二甲基亚砜+0.4m蔗糖;
5)将pvs2溶液处理后的茎尖换上新的pvs2溶液,然后迅速将冷冻管浸入液氮中,至少冷冻1h以上;
6)将液氮保存后的冷冻管取出并于40℃水浴中化冻70s,再将冷冻管转至超净工作台上用卸载液洗涤20min;所述的卸载液的组分为:ms盐溶液+1.2m蔗糖;
7)将卸载液洗涤后的茎尖接种在恢复培养基上进行恢复培养;所述的恢复培养基为ms+6-ba1.0mg/l;所述的恢复培养条件为:先在25℃人工气候箱中暗培养7d,然后转入组培苗培养室进行培养。
实施例2无菌苗的获得
在桃叶卫矛的营养生长期(5~8月份),将带茎尖的外植体带回实验室用洗洁精水进行清洗,并在流动水下冲洗1~2h。冲洗完毕后将外植体放置在超净工作台上进行灭菌。首先用75%酒精对其表面灭菌10s,用无菌水冲洗3~4遍;再利用不同的灭菌剂处理不同时间进行深度灭菌(如表1所示),最后用无菌水冲洗6~8遍。然后将剥离的茎尖接种于ms+6-ba2.0mg/l+naa0.5mg/l+30g/l的蔗糖+7g/l琼脂,ph值为5.8的培养基上。15d后统计各瓶中的污染率、死亡率以及成活率。同时为了研究愈伤组织最适宜的培养基,将茎尖接种于不同浓度培养基上,以ms为基本培养基,加入30g/l的蔗糖,不同浓度的6-ba和naa,30d后统计愈伤组织诱导率及其生长情况。然后以所得的愈伤组织为材料,来研究最适宜愈伤组织分化幼芽的培养基激素配比,在ms基本培养基中将不同浓度的6-ba和naa进行组合后加入,其他条件设为30g/l的蔗糖+7g/l琼脂,ph值为5.8。然后当分化芽长至3cm以上时对其进行剥离接种于1/2ms+naa0.2mg/l的生根培养基上。
研究结果表明(如表2所示)采用hgcl2进行灭菌后外植体的萌发率要明显高于采用naclo进行灭菌,且污染率小。并且随着处理时间的增加,外植体污染率在逐渐减小,但是其死亡率也在增加,在具体试验操作中也发现部分茎尖外植体由于未将hgcl2冲洗干净,外植体出现发黄枯萎的现象,因此选择75%酒精10s+0.1%hgcl24min作为最佳灭菌方法。另外不同浓度的6-ba和naa组合对桃叶卫矛愈伤组织的诱导起着显著的作用(如表3所示),随着6-ba浓度的逐渐提高,桃叶卫矛愈伤组织的出愈率呈现出先升高后降低的趋势;随着naa浓度的逐渐升高,桃叶卫矛愈伤组织的出愈率呈现出逐渐降低的趋势。此外当6-ba浓度和naa浓度相差较大时,出愈率高。最终比较可知当6-ba浓度为1.0mg/l,naa浓度为0.1mg/l时,桃叶卫矛出愈率最高可达98.0%,且生长情况良好。同时,对于芽分化最适培养基的研究结果表明不同浓度的6-ba和naa对芽的分化和增殖具有明显的作用(如表4所示)。随着6-ba浓度的逐渐升高,愈伤组织上芽的分化率和增殖系数不断增加;而当6-ba与naa相结合时,芽的分化率呈现不同的变化。当6-ba浓度为0.5mg/l时,不论naa浓度的高低,芽的分化率和增殖系数都比较低,且分化芽的长势弱;当愈伤组织接种在6-ba浓度为1.5mg/l,naa浓度为0.2mg/l的培养基上时,芽的分化率可达99%,增值系数为3.21,且分化芽的生长状况良好。
表1试验所用的不同灭菌方式组合
表2不同灭菌剂及其处理时间对桃叶卫矛外植体生长的影响
表3不同生长调节剂及其浓度配比对愈伤组织诱导的影响
表4不同生长调节剂及其浓度配比对芽分化与增殖的影响
实施例3
测试了茎尖长度对桃叶卫矛茎尖超低温保存的影响:无菌条件下剥取生长健康的无菌桃叶卫矛组培苗的茎尖,通过体视显微镜可以观察到桃叶卫矛茎尖部位是对称型,因此在剥离过程中可以依据所剩幼叶的对数来确定茎尖长度,共设置1~2mm(不包含叶原基)、2~3mm(包含一对叶原基)、3~5mm(包含两对叶原基)三个梯度。研究结果表明(如图1所示)桃叶卫矛茎尖长度对超低温保存后茎尖成活率有显著影响。当茎尖长度为2~3mm时,超低温保存后茎尖成活率可达83.33%,远大于长度为1~2mm和3~5mm的茎尖。当茎尖长度为1~2mm时,由于茎尖分生组织外面没有幼叶包被使得分生组织承受较大损害,最终失活;而当茎尖长度为3~5mm时,虽然茎尖分生组织得到良好的保护,但是由于茎尖体积过大,导致在玻璃化过程中茎尖分生组织部位脱水不彻底,进而使得在超低温保存过程中形成结晶破坏细胞结构,最终使得茎尖失活。因此在茎尖剥离过程中选择适当的切取长度对于超低温保存后茎尖成活是至关重要的。
实施例4
测试了预培养基中蔗糖浓度和预培养时间对桃叶卫矛茎尖超低温保存的影响:仅改变预培养基中的蔗糖浓度和预培养时间,首先将剥取的茎尖分别放入装有不同浓度(0.1m~0.5m)蔗糖的ms盐溶液中进行预培养;预培养环境条件为25℃暗培养,培养时间为(0、1d、2d、3d);然后统计茎尖经过超低温保存后恢复培养的成活率。研究结果表明(如图2图3所示)将剥离的茎尖放入不同蔗糖浓度的预培养液中进行预培养不同时间后,茎尖经过超低温保存后的成活率各有不同,当蔗糖浓度为0.4m时,预培养时间为2d时,茎尖成活率最高可达60%。由此可知预培养是影响桃叶卫矛茎尖超低温保存成活率的关键因素,最佳的预培养蔗糖浓度为0.4m,培养时间为2d。
实施例5
测试了装载液处理时间对超低温保存后茎尖成活率的影响:茎尖经过预培养处理后转入超净工作台,将茎尖连同预培养液一同倒入培养皿(d=120mm)中,再用无菌牙签将茎尖挑入装有loading溶液的冷冻管中,室温下装载不同的时间(0、10、20、30min)。研究结果表明(如图4所示)茎尖经过装载液处理和对照组之间存在显著差异,当茎尖不经装载液处理直接进行pvs2脱水处理时,茎尖成活率仅为6%;当装载液处理时间为10min时,茎尖成活率可达70%,而随着装载时间的进一步延长,处理10min的成活率与处理20min、40min的结果没有显著性差异,因此为了节省时间提高保存效率,装载液最佳处理时间为10min。
实施例6
测试了pvs2溶液处理时间对超低温保存后茎尖成活率的影响:茎尖经过loading溶液处理后转入在玻璃化溶液pvs2中,在0℃冰盒中处理不同的时间(0、20、40、60min)后,测定茎尖的成活率;研究结果表明(如图5所示)当茎尖未经pvs2溶液处理直接投入液氮中保存后,茎尖在恢复培养时全部失活变白;当pvs2处理时间为60min时,茎尖成活率最高可达73.3%,而当处理时间进一步延长至80min时,成活率降低至50%。
实施例7
测试了卸载液处理时间对超低温保存后茎尖成活率的影响:将装有茎尖的冷冻管从液氮中捞出后迅速投入40℃水浴锅中化冻70s,再将冷冻管中的茎尖转入uploading溶液中处理不同的时间(0、10、20、30min),洗涤过程在无菌环境中进行;研究结果表明(如图6所示)当不经过卸载液处理的茎尖直接进行恢复培养时,茎尖全部死亡,说明茎尖外部仍有残留的pvs2溶液;利用含1.2m蔗糖的ms盐溶液对化冻后的茎尖洗涤10min后,茎尖成活率可达80%以上,洗涤时间的长短对茎尖成活率的影响不显著。
实施例8
测试了恢复培养基对超低温保存后茎尖成活率的影响:超低温保存后的桃叶卫矛茎尖经uploading溶液洗涤后,接种在不同的恢复培养基上进行培养,培养条件为先在25℃人工气候箱中暗培养7d,然后转入组培苗培养室进行培养。根据不同生长调节剂的配比将恢复培养基设置为:①ms;②ms+6-ba1.0mg/l;③ms+6-ba1.0mg/l+naa0.1mg/l;研究结果表明(如表5所示)茎尖在不添加激素的培养基中的成活率低于添加激素的培养基;此外还可以看出在只添加6-ba的恢复培养基中茎尖恢复效果优于添加6-ba和naa的恢复培养基,由此可知,6-ba对于超低温保存后茎尖成活率具有显著影响。
表5恢复培养基对超低温保存后茎尖成活率的影响
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此领域技术的人士能够了解本发明内容并加以实施,并不能以此限制本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!