一种由大型真菌子实体转接菌种的制备方法与流程
本发明涉及一种菌种的制备技术,尤其涉及一种由大型真菌子实体转接菌种的制备方法。
背景技术:
大型真菌是指能形成肉质或胶质子实体的一类高等真菌,是自然界中物种多样性最为丰富的生物群。其作为生态系统中的主要分解者,在生态系统的能量和物质循环中起着决定性的作用,除此之外,很多大型真菌属于食药用真菌,具有较高的营养价值和药用价值。随着现代生物技术的不断深入,逐渐从大型真菌的形态特征和组织结构等宏观研究上升到分子生物学领域。因此,由大型真菌子实体转接获得纯净真菌菌种成为关键技术环节。
目前获得大型真菌子实体转接的方法有组织分离法、孢子分离法、菇木分离法等。其中,组织分离法是通过子实体的部分组织来分离获取纯菌种,该种方法所获得的纯菌种遗传性状稳定,后代不易发生变异,是选育优良菌种的简便有效方法。但大部分大型真菌子实体中菌丝的含量相对较少,且在转接过程中极易受到细菌的污染,这严重影响了菌种分离的成功率。
技术实现要素:
本发明的目的是提供一种由大型真菌子实体转接菌种的制备方法,对大型真菌子实体样品进行转接后纯培养其真菌菌丝,大大提高了大型真菌子实体纯培养的成功率。
本发明的目的是通过以下技术方案实现的:
本发明的由大型真菌子实体转接菌种的制备方法,包括步骤:
(1)大型真菌子实体灭菌:将于野外获取的大型真菌子实体冷藏带回,用蒸馏水冲洗后用75%酒精均匀的喷洒于子实体进行消毒;
(2)接种:沿菌柄对半掰至菌盖分成两半,用灭菌的锋利刀片切取小块菌柄和菌盖组织,将其转接到添加链霉素的马铃薯固体培养基pda上;
(3)分离纯化:于25℃恒温培养7~10天观察菌丝萌发情况,挑取白色绒毛状菌丝与培养基一起至新制备的pda培养基中作扩大培养,至获得单一菌种。
由上述本发明提供的技术方案可以看出,本发明实施例提供的由大型真菌子实体转接菌种的制备方法,快速、经济、有效,分离菌种成功率高,适用于大多数的大型真菌,且技术简单,易于普及。
附图说明
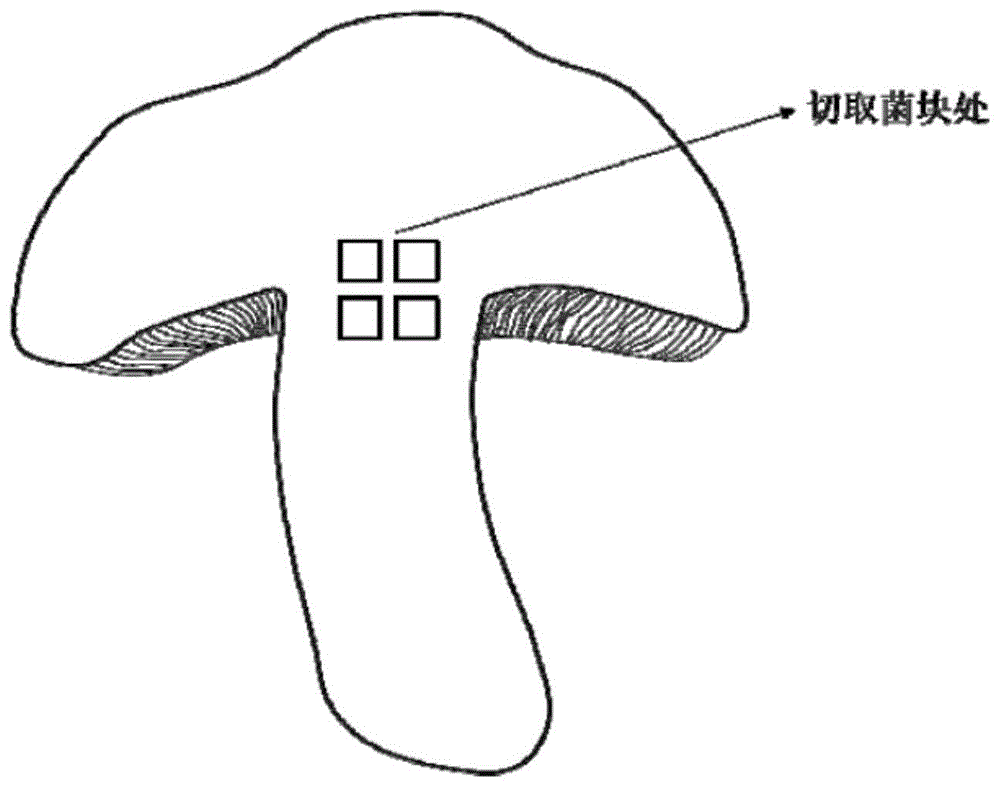
图1为本发明实施例提供的由大型真菌子实体转接菌种的制备方法的子实体切取菌块示意图。
图2为本发明实施例提供的由大型真菌子实体转接菌种的制备方法的培养基中菌块放置示意图。
具体实施方式
下面结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明的保护范围。本发明实施例中未作详细描述的内容属于本领域专业技术人员公知的现有技术。
本发明的由大型真菌子实体转接菌种的制备方法,其较佳的具体实施方式是:
包括步骤:
(1)大型真菌子实体灭菌:将于野外获取的大型真菌子实体冷藏带回,用蒸馏水冲洗后用75%酒精均匀的喷洒于子实体进行消毒;
(2)接种:沿菌柄对半掰至菌盖分成两半,用灭菌的锋利刀片切取小块菌柄和菌盖组织,将其转接到添加链霉素的马铃薯固体培养基pda上;
(3)分离纯化:于25℃恒温培养7~10天观察菌丝萌发情况,挑取白色绒毛状菌丝与培养基一起至新制备的pda培养基中作扩大培养,至获得单一菌种。
所述的大型真菌子实体需保持新鲜,采摘时挑选旺盛生长、菌盖边缘内卷的幼嫩子实体作为供试的组织分离材料。
所述的菌柄和菌盖组织大小为0.5cm×0.5cm。
所述的添加链霉素的铃薯固体培养基pda的配置方法:
称取去皮马铃薯200g切成小块,同1200ml蒸馏水放入锅中加热至沸腾后保持15min后过滤;
称取葡萄糖20g,琼脂15~20g,kh2po43g,mgso4·7h2o1.5g于滤液中,并再次加热至完全溶解,补充水至1000ml;
常规配置的pda培养基灭菌处理后转移至后超净工作台中冷却,待50℃时混入0.2g链霉素充分摇匀,并趁热倒入已灭菌的100mm培养皿中。
所述的灭菌条件均为高温高压灭菌,将刀片、常规配置的pda培养基和培养皿放入高压灭菌锅中灭菌,121℃保持30min。
所述的超净工作台需事先进行酒精擦拭、紫外线灭菌和通风处理工作。
所述的接种、扩大培养过程和倒平板在关闭紫外线和通风处理的超净工作台中进行,并始终保持靠近酒精灯火焰附近。
所述的恒温培养于恒温培养箱内,培养过程中保持黑暗无光照。
所述的白色绒毛状菌丝为目标子实体的真菌菌丝,在培养过程中易受到霉菌、细菌污染,在挑取菌丝过程中选择距离污染点远的菌丝,同时转移的菌丝应包含部分培养基。
所述的分离纯化过程无次数限制,重复进行,直至获得纯菌种。
本发明的由大型真菌子实体转接菌种的制备方法,首先将野外生长旺盛的幼嫩大型真菌子实体冷藏带回,用蒸馏水小心冲洗后用75%酒精均匀的喷洒于子实体进行消毒,然后沿菌柄对半掰至菌盖分成两半,用灭菌的锋利刀片切取大小约为0.5cm×0.5cm的菌柄和菌盖组织,将其转接到添加链霉素的马铃薯固体培养基pda上,最后将已接种的培养皿置于恒温培养箱中,保持黑暗条件于25℃培养7~10天后观察菌丝萌发情况,挑取远离杂菌污染点的白色绒毛状菌丝(含少量培养基)至新制备的pda培养基中作扩大培养,至获得单一菌种。
本发明的特点是克服了传统转接过程中易受外界污染的缺点,大幅度提高大型真菌子实体转接菌种的成功率。添加链霉素进行pda培养基的改良,降低了分离纯化菌种过程中的细菌污染;利用组织分离法的操作简单、快捷,以及传性状稳定的优点,实现了对大型真菌子实体转接菌种的高效性。
具体实施例:牛肝菌子实体菌种转接
下面结合附图对本发明实施例作进一步地详细描述,如图1、图2所示:
(1)子实体采集:2018年8月于北京延庆山区进行子实体的采集工作,应注意挑选较为幼嫩,菌盖边沿内卷的牛肝菌子实体若干,连根部少量土壤一起轻轻摘下,放入便携式冰箱带回。
(2)培养基制备:称取去皮马铃薯200g切成小块,用适量蒸馏水煮沸,在整个过程持续30min后用纱布过滤。在滤液中加入葡萄糖20g,琼脂15~20g,kh2po43g,mgso4·7h2o1.5g再次加热至完全溶解(补充水至1000ml)。将其放入高温高压灭菌锅于121℃灭菌30min,迅速转移至后已提前用酒精擦拭、紫外线灭菌和通风处理的超净工作台中冷却,待约为50℃时混入0.2g链霉素充分摇匀,并趁热倒入已灭菌的100mm培养皿中。注意添加链霉素和倒平板过程均需要靠近酒精灯火焰附近。
(3)牛肝菌转接:将带回的牛肝菌用蒸馏水轻轻冲洗,并去除与子实体无关的其他杂质,用75%酒精喷洒于牛肝菌子实体表面进行消毒。在超净工作台中进行组织分离,沿牛肝菌菌柄对半掰至菌盖分成两半,用灭菌的锋利刀片切取0.5cm×0.5cm的组织若干。将其分别转接到添加链霉素的马铃薯固体培养基pda中央,一个培养基可放置3~4个组织块,共转接4~5个培养基。
(4)分离纯化培养:在恒温培养箱中25℃黑暗培养7~10天,观察菌丝萌发情况,表现为子实体块周围出现白色绒毛状菌丝。挑取培养基上远离杂菌的菌丝(含少量培养基)接种到新的pda培养基中,再次于25℃黑暗培养,重复筛选以便获得最纯净的菌种。
综上可见,该由大型真菌子实体转接菌种的制备方法至少具备以下优点:
①该由大型真菌子实体转接菌种的制备方法操作简单,易于学习,操作快速。
②该由大型真菌子实体转接菌种的制备方法可以根据不同的真菌种类进行适时、适地的灵活调整。
③与传统的马铃薯固体培养基pda相比,该由大型真菌子实体转接菌种的制备方法可以有效抑制细菌的污染,提高纯化成功率。
④与其他子实体转接菌种技术相比,该方法通过利用组织分离法的操作简单、快捷,以及传性状稳定的优点,实现了对大型真菌子实体转接菌种的高效性。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求书的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!