营养乳剂及其制备方法和应用与流程
本发明涉及营养食品领域,尤其是涉及一种营养乳剂及其制备方法和应用。
背景技术:
目前,对于临床重症患者及外科术后的病人,普遍存在营养不良的问题,其严重影响有关并发症的发生率及病人预后,增加了患者病痛,延长了住院时间。临床营养制剂的出现使这一问题得到改善,其主要分为肠内营养(Enteral Nutrition)制剂和肠外营养(Parenteral Nutrition)制剂。由于肠内营养制剂更能满足人体生理需求,改善病理状态,随着临床运用的发展,肠内营养制剂的优势相比于肠外营养制剂逐渐突显。然而,肠内营养制剂通常包含多种营养组分和生理活性物质,由于其组分复杂,目前普遍存在稳定性差,存在如易分层(creaming)、沉淀(precipitate)、絮凝或胶凝、变色、气味难闻、味道差等问题。
技术实现要素:
基于此,有必要针对传统的营养制剂存在的稳定性差的问题,提供一种营养乳剂及其制备方法和应用。
本发明解决上述技术问题的技术方案如下。
一种营养乳剂,包括油脂、水、抗氧剂、蛋白质及碳水化合物;其中,所述油脂在所述营养乳剂中的体积分数为1.0~50.0%,所述水在所述营养乳剂中的体积分数为50.0~99.0%;所述抗氧剂为亲水性抗氧剂与疏水性抗氧剂的混合物;每100mL所述营养乳剂中含有所述抗氧剂0.01~0.3g、含有所述蛋白质0.1~10.0g、含有所述碳水化合物0.1~40.0g。
在其中一个实施例中,所述油脂选自大豆油、花生油、芝麻油、沙棘油、葵花籽油、亚麻籽油、苏子油、椰子油、橄榄油、鱼肝油及中链脂肪酸酯中的一种或几种的混合物。
在其中一个实施例中,所述亲水性抗氧剂选自儿茶酚、维生素C、亚硫酸钠及硫代硫酸钠中的一种或几种的混合物,所述疏水性抗氧剂选自生育酚、叔丁基对羟基茴香醚、二丁基甲苯酚及硫代甘油中的一种或几种的混合物,且所述亲水性抗氧剂与所述疏水性抗氧剂的质量比为1:(1~20)。
在其中一个实施例中,所述蛋白质选自乳清蛋白、蛋清蛋白、β-乳球蛋白、大豆分离蛋白、乳铁蛋白、乳清分离蛋白、酪蛋白及酪蛋白酸盐中的一种或几种的混合物。
在其中一个实施例中,所述碳水化合物选自葡萄糖、蔗糖、海藻糖、麦芽糊精、麦芽糖、淀粉、乳糖、甜菊多糖及低聚麦芽糖中的一种或几种的混合物。
在其中一个实施例中,所述营养乳剂还含有色素,且每100mL所述营养乳剂中含有所述色素0.1~1.0g,所述色素是亲水性色素与疏水性色素的混合物,其中,所述亲水性色素选自栀子蓝、栀子黄、栀子红、藻蓝蛋白、番茄红素、胭脂红酸、叶绿色、姜黄素及柠檬黄素中的一种或几种的混合物;所述疏水性色素为胡萝卜素。
在其中一个实施例中,所述油脂在所述营养乳剂中的体积分数为3.0~40.0%,所述水在所述营养乳剂中的体积分数为60.0~97.0%;每100mL所述营养乳剂中含有所述抗氧剂0.05~0.25g、含有所述蛋白质0.5~4.0g、含有所述碳水化合物5.0~20.0g。
一种上述任一实施例所述的营养乳剂的制备方法,包括如下步骤:
步骤一:将蛋白质溶解于水中充分水化,得到蛋白质水溶液;
步骤二:将所述亲水性抗氧剂与所述碳水化合物溶解在所述蛋白质水溶液中,得到水相溶液;
步骤三:将所述疏水性抗氧剂溶解于油脂中,得到油相溶液;
步骤四:将所述水相溶液与所述油相溶液混合剪切形成粗乳;
步骤五:对所述粗乳进行乳化均质处理,即得。
在其中一个实施例中,所述步骤一中的水化时间为1~24h;
所述步骤三中溶解的温度为25~180℃,溶解的时间为1~50min,配以涡旋的时间为1-10min;
所述步骤四中剪切的速度为100~30000r/min,剪切的时间为30s~10min;
所述步骤五中均质的方法为高压均质、微射流或超声乳化,且若使用高压均质,其均质的压力为200~1500bar,均质的循环次数为2~20次。
上述任一实施例所述的营养乳剂在制备肠内营养制剂、保健食品、药物制剂、饮料或化妆品中的应用。
上述营养乳剂是发明人通过大量的创造性实验制备得到的一种安全的双抗氧剂型营养乳剂,并确定了其最佳组分及含量。在最佳组分及含量范围内,并在油脂和水的配合下,以及在蛋白质和碳水化合物、亲水性及疏水性双抗氧剂的协同作用下,使得该营养乳剂具有良好的稳定性,低温及常温长期放置后无乳析、分层、絮凝等不稳定现象发生,无不良气味,体系中为100~300nm的乳滴,均匀分散,低粘度,对营养油脂的保护能力和冻融稳定性极佳。另外,由于该乳液体系无需额外添加任何化学合成的乳化剂、抗氧剂等成分,也无需调整产品的酸碱度,在补充蛋白质和营养油脂的同时补充碳水化合物,实现蛋白质、碳水化合物、脂肪三大能量补充,因此具有安全无毒、利于吸收的特点,可广泛应用在肠内营养制剂、保健食品、药物制剂、饮料或化妆品等领域。
上述营养乳剂的制备方法,无需额外添加任何化学合成的乳化剂、抗氧剂等成分,也无需调整酸碱度,具有操作简便、工艺参数可控、经济易行、适合工业化生产的优点。
附图说明
图1为实施例1中所制得的营养乳剂随油相与水相比例变化的平均粒径-储存时间折线图;
图2为实施例2中所制得的营养乳剂随蛋白质用量变化的平均粒径-储存时间折线图;
图3为实施例3所制得的营养乳剂随抗氧剂种类选择变化的平均粒径-储存时间折线图;
图4为实施例4所制得的营养乳剂随亲水性抗氧剂种类选择变化的平均粒径-储存时间折线图;
图5为实施例5所制得的营养乳剂随水溶性抗氧剂用量变化的平均粒径-储存时间折线图;
图6为实施例6所制得的营养乳剂随栀子黄色素用量变化的平均粒径-储存时间折线图;
图7为实施例7所制得的营养乳剂随栀子蓝色素用量变化的平均粒径-储存时间折线图;
图8为实施例8所制得的营养乳剂的粒径分布图;
图9为实施例8所制得的营养乳剂的粘度与剪切速率曲线图;
图10为实施例8所制得的营养乳剂微观透射电镜图;
图11为实施例9所制得新鲜制备的不同抗氧剂种类的营养乳剂的粒径分布、电位图;
图12为实施例9所制得的新鲜制备及存储三个月后的营养乳剂随抗氧剂种类选择变化的浊度条形图。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
一实施方式的营养乳剂包括油脂、水、抗氧剂、蛋白质及碳水化合物。
其中,油脂在营养乳剂中的体积分数为1.0~50.0%。优选的,油脂在营养乳剂中的体积分数为3.0~40.0%。油脂优选选自于大豆油、花生油、芝麻油、沙棘油、葵花籽油、亚麻籽油、苏子油、椰子油、橄榄油、鱼肝油及中链脂肪酸酯中的一种或几种的混合物。油脂用于给营养乳剂提供饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸等。
水优选纯水。水在营养乳剂中的体积分数为50.0~99.0%。优选的,水在营养乳剂中的体积分数为60.0~97.0%。
本实施方式的抗氧剂为亲水性抗氧剂与疏水性抗氧剂的混合物。其中,亲水性抗氧剂优选选自于儿茶酚、维生素C、亚硫酸钠及硫代硫酸钠中的一种或几种的混合物;疏水性抗氧剂优选选自于生育酚、叔丁基对羟基茴香醚(BHA)、二丁基甲苯酚(BHT)及硫代甘油中的一种或几种的混合物。亲水性抗氧剂与疏水性抗氧剂的质量比优选但不限于为1:(1~20),进一步优选为1:(5~15),更进一步优选为1:10。
蛋白质优选选自于乳清蛋白、蛋清蛋白、β-乳球蛋白、大豆分离蛋白、乳铁蛋白、乳清分离蛋白、酪蛋白及酪蛋白酸盐中的一种或几种的混合物。
碳水化合物优选选自于葡萄糖、蔗糖、海藻糖、麦芽糊精、麦芽糖、淀粉、乳糖、甜菊多糖及低聚麦芽糖中的一种或几种的混合物。
在本实施例中,每100mL营养乳剂中含有抗氧剂0.01~0.3g、含有蛋白质0.1~10.0g、含有碳水化合物0.1~40.0g。优选的,每100mL营养乳剂中含有抗氧剂0.05~0.25g、含有蛋白质0.5~4.0g、含有碳水化合物5.0~20.0g。
进一步,在本实施方式中,营养乳剂还含有色素。每100mL营养乳剂中含有色素0.1~1.0g。色素是亲水性色素与疏水性色素的混合物。亲水性色素优选选自于栀子蓝、栀子黄、栀子红、藻蓝蛋白、番茄红素、胭脂红酸、叶绿色、姜黄素及柠檬黄素中的一种或几种的混合物;疏水性色素优选为胡萝卜素。
本实施方式还提供了一种营养乳剂的制备方法,其包括如下步骤:
步骤一:将蛋白质溶解于水中充分水化,得到蛋白质水溶液;
步骤二:将亲水性抗氧剂与碳水化合物溶解在蛋白质水溶液中,得到水相溶液;
步骤三:将疏水性抗氧剂溶解于油脂中,得到油相溶液;
步骤四:将水相溶液与油相溶液混合剪切形成粗乳;
步骤五:对粗乳进行乳化均质处理,即得。
步骤一中的水化时间优选但不限于为1~24h,只要使蛋白质充分水化即可。
步骤三中溶解的温度为25~180℃,溶解的时间为1~50min,溶解时配以涡旋,涡旋的时间为1-10min。优选的,溶解的温度为25~40℃,溶解的时间为1~30min,配以涡旋的时间为1~5min。
步骤四中剪切的速度为100~30000r/min,剪切的时间为30s~10min。优选的,剪切的速度为1000-10000r/min,剪切的时间为30s~5min。
步骤五中均质的方法可是高压均质、微射流或超声乳化。若使用高压均质,均质的压力为200~1500bar,均质的循环次数为2~20次。优选的,高压均质时,均质的压力为500~800bar,均质的循环次数为3~6次。
优选的,还包括在步骤五之后对得到的营养乳剂进行灭菌的步骤。
本实施方式的营养乳剂包括油脂、水、抗氧剂、蛋白质及碳水化合物等成分,其中,蛋白质作为可大量食用的乳化剂,用于生产肠内营养制剂具有独特的优势。蛋白质不但作为三大营养物质之一,还可同时发挥乳化剂与稳定剂的作用。通过外界高能量的输入,油相被破碎分散为均一的纳米级油滴,蛋白质发挥表面活性剂的作用,在油滴表面形成吸附蛋白膜保护层,或溶解分散在水相中,阻止乳滴之间的聚结。
不饱和脂肪酸是构成体内脂肪的一种脂肪酸,是人体必需的脂肪酸。不饱和脂肪酸根据双键个数的不同,分为单不饱和脂肪酸和多不饱和脂肪酸二种。食物脂肪中,单不饱和脂肪酸有油酸,多不饱和脂肪酸有亚油酸、亚麻酸、花生四烯酸等。人体不能合成亚油酸和亚麻酸,必须从膳食中补充。根据双键的位置及功能又将多不饱和脂肪酸分为ω-6系列和ω-3系列。亚油酸和花生四烯酸属ω-6系列,亚麻酸、DHA、EPA属ω-3系列。脂肪酸对于人体具有重要的生理作用:保持细胞膜的相对流动性,以保证细胞的正常生理功能;使胆固醇酯化,降低血中胆固醇和甘油三酯;是合成人体内前列腺素和凝血恶烷的前躯物质;降低血液粘稠度,改善血液微循环;提高脑细胞的活性,增强记忆力和思维能力。一般患者由于进食困难,这类必需成分需要从营养剂中获得,但是由于其富含功能性双键,极易被氧化使得丧失相应营养功能并且因此会加速乳剂酸败变质破坏营养乳剂中的其他营养物质,因此本实施方式选择同时加入亲水性抗氧剂和疏水性抗氧剂,可有效防止脂肪酸氧化变质。
本实施方式的营养乳剂具有安全无毒、利于吸收的特点,可广泛应用在肠内营养制剂、保健食品、药物制剂、饮料或化妆品等领域。且该营养乳剂的制备方法,无需额外添加任何化学合成的乳化剂、抗氧剂等成分,也无需调整酸碱度,具有操作简便、工艺参数可控、经济易行、适合工业化生产的优点。
以下为具体实施例部分。
实施例中给出的营养乳剂的原料及其配比比较具体,可理解,在其他实施例中,不限于如此,如原料配比可以满足如下配比即可:油脂在所述营养乳剂中的体积分数为1.0~50.0%,水在所述营养乳剂中的体积分数为50.0~99.0%,每100mL所述营养乳剂中含有所述抗氧剂0.01~0.3g、含有所述蛋白质0.1~10.0g、含有所述碳水化合物0.1~40.0g;各原料也可以用其他功能类似的原料替代,在此不再赘述。
实施例1
一种临床营养乳剂,每100mL由以下原料制备而成,如表1所示。
表1
上述临床营养乳剂的制备方法包括以下步骤:
(1)将酪蛋白酸钠分散溶解于超纯水中,常温磁力搅拌充分水化4h,得到蛋白质水溶液,即为水相溶液;
(2)将苏子油与亚麻油于常温下涡旋2min,得到混合油溶液,即为油相溶液;
(3)将油相溶液与水相溶液搅拌混匀,于转速为10000r/min的条件下高速剪切分散60s,得到粗乳;
(4)将粗乳高压均质,均质的循环次数为5次,均质压力为500bar,制备得到临床营养乳剂。
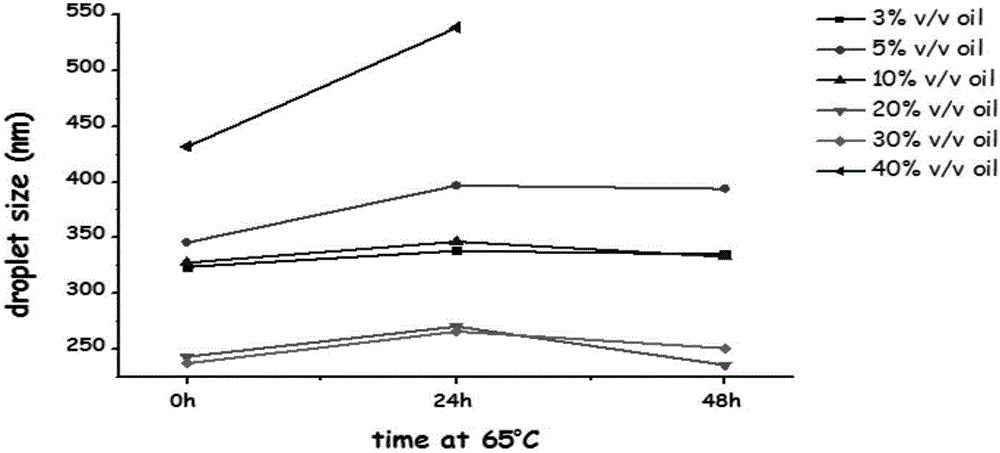
强所制备的临床营养乳剂经纳米粒度分析仪检测,检测方法为将样品稀释100倍后放于样品检测池中平衡120s后进行检测,至少扫描20次得到粒径分布曲线,且取三个时间点,分别为新鲜制备后、模拟加速1个月、模拟加速2个月,结果如附图1所示。结果显示不同组别的临床营养乳剂的平均粒径差别极大,其中20v/v%、30v/v%油相含量的临床营养乳剂粒径在三个时间点变化浮动均不大,且均在250nm左右,说明该两种处方用量获得的临床营养乳剂成乳性和稳定性良好,且由于30v/v%油相含量的临床营养乳剂粘度较20v/v%油相含量的临床营养乳剂显著性增大,从流变学角度分析不利于后期运输、存储、复配及泵送使用,且二者用量均符合营养学摄取建议范围,因此认为20v/v%油相含量的临床营养乳剂为本实施例中的最优处方。
实施例2
一种临床营养乳剂,每100mL由以下原料制备而成,如表2所示。()
表2
上述临床营养乳剂的制备方法包括以下步骤:
(1)将酪蛋白酸钠分散溶解于超纯水中,常温磁力搅拌充分水化4h,得到蛋白质水溶液,即为水相溶液;
(2)将苏子油与亚麻油于常温下涡旋2min,得到混合油溶液,即为油相溶液;
(3)将油相溶液与水相溶液搅拌混匀,于转速为10000r/min的条件下高速剪切分散60s,得到粗乳;
(4)将粗乳高压均质,均质的循环次数为5次,均质压力为500bar,制备得到临床营养乳剂。
强所制备的临床营养乳剂经纳米粒度分析仪检测,检测方法为将样品稀释100倍后放于样品检测池中平衡120s后进行检测,至少扫描20次得到粒径分布曲线,且取四个时间点,分别为新鲜制备后、模拟加速1个月、模拟加速2个月、模拟加速6个月,结果如附图2所示。结果显示不同组别的临床营养乳剂的平均粒径差别极大,在此范围中,随着蛋白质用量增大,乳剂粒径明显减小,实验结果显示0.5g的酪蛋白酸钠不足以在该体系中起到很好的乳化效果,1.0g酪蛋白酸钠体系较于0.5g酪蛋白酸钠体系有了显著性提高,但是普遍认为纳米乳的粒径控制在250nm左右为佳,说明该两种处方用量获得的临床营养乳剂成乳性和稳定性良好,而2.0g酪蛋白酸钠体系和4.0g酪蛋白酸钠体系的粒径相近,皆在200nm~250nm范围,而4.0g酪蛋白酸钠体系粘度明显增大,从流变学角度分析不利于后期运输、存储、复配及泵送使用,且二者用量均符合营养学摄取建议范围,因此认为2.0g酪蛋白酸钠含量的临床营养乳剂为本实施例中的最优处方。
实施例3
一种临床营养乳剂,每100mL由以下原料制备而成,如表3所示。()
表3
上述临床营养乳剂的制备方法包括以下步骤:
(1)将酪蛋白酸钠、水合儿茶酚分散溶解于超纯水中,常温磁力搅拌充分水化4h,得到蛋白质水溶液,即为水相溶液;
(2)将生育酚与苏子油、亚麻油于常温下涡旋2min,得到混合油溶液,即为油相溶液;
(3)将油相溶液与水相溶液搅拌混匀,于转速为10000r/min的条件下高速剪切分散60s,得到粗乳;
(4)将粗乳高压均质,均质的循环次数为5次,均质压力为500bar,制备得到临床营养乳剂。
将所制备的临床营养乳剂经纳米粒度分析仪检测,检测方法为将样品稀释100倍后放于样品检测池中平衡120s后进行检测,至少扫描20次得到粒径分布曲线,且取四个时间点,分别为新鲜制备后、模拟加速1个月、模拟加速2个月、模拟加速3个月,结果如附图3所示。结果显示不同组别的临床营养乳剂的平均粒径差别极大:没有加入抗氧剂的乳剂体系最不稳定,加入两种抗氧剂的乳剂体系最为稳定,而只加入亲水性抗氧剂的乳剂体系要优于只加入疏水性抗氧剂的乳剂体系,可能是由于该乳剂体系为O/W型乳剂,水相为连续相,体积占比较大,所以亲水性抗氧剂较疏水性抗氧剂在体系中起到更显著的作用。本实施例中选择的两种抗氧剂均为天然抗氧剂,实验结果看来具有显著的协同作用,因此认为加入双抗氧剂的临床营养乳剂为本实施例中的最优处方。
实施例4
一种营养乳剂,每100mL由以下原料制备而成,如表4所示。()
表4
上述营养乳剂的制备方法包括以下步骤:
(1)将酪蛋白酸钠、水合儿茶酚分散溶解于超纯水中,常温磁力搅拌充分水化4h,得到蛋白质水溶液,即为水相溶液;
(2)将生育酚与苏子油、亚麻油于常温下涡旋2min,得到混合油溶液,即为油相溶液;
(3)将油相溶液与水相溶液搅拌混匀,于转速为10000r/min的条件下高速剪切分散60s,得到粗乳;
(4)将粗乳高压均质,均质的循环次数为5次,均质压力为500bar,制备得到营养乳剂。
将所制备的营养乳剂经纳米粒度分析仪检测,检测方法为将样品稀释100倍后放于样品检测池中平衡120s后进行检测,至少扫描20次得到粒径分布曲线,且取五个时间点,分别为新鲜制备后、模拟加速1个月、模拟加速2个月、模拟加速3个月、模拟加速6个月,结果如附图4所示。结果显示不同组别的临床营养乳剂的平均粒径差别极大:仅加入疏水性抗氧剂生育酚的乳剂体系较于其他三种体系最不稳定,模拟加速一个月后乳剂体系便表现出来不稳定的现象,其次不稳定的为仅加入0.01g水合儿茶酚的乳剂体系,模拟加速3个月开始变得不稳定,而加入0.02g水合儿茶酚的乳剂体系和加入0.05g水合儿茶酚的乳剂体系无明显差别,均可在模拟加速6个月时仍然保持较好的稳定性,从营养学角度来看,水合儿茶酚为天然抗氧剂,对于人体延缓衰老具有显著的效果,且两个用量范围均在建议添加范围内,因此认定两种均为优化处方。
实施例5
一种临床营养乳剂,每100mL由以下原料制备而成,如表5所示。()
表5
上述临床营养乳剂的制备方法包括以下步骤:
(1)将酪蛋白酸钠、水合儿茶酚或者维生素C分散溶解于超纯水中,常温磁力搅拌充分水化4h,得到蛋白质水溶液,即为水相溶液;
(2)将生育酚与苏子油、亚麻油于常温下涡旋2min,得到混合油溶液,即为油相溶液;
(3)将油相溶液与水相溶液搅拌混匀,于转速为10000r/min的条件下高速剪切分散60s,得到粗乳;
(4)将粗乳高压均质,均质的循环次数为5次,均质压力为500bar,制备得到临床营养乳剂。
将所制备的临床营养乳剂经纳米粒度分析仪检测,检测方法为将样品稀释100倍后放于样品检测池中平衡120s后进行检测,至少扫描20次得到粒径分布曲线,且取四个时间点,分别为新鲜制备后、模拟加速1个月、模拟加速2个月、模拟加速5个月,结果如附图5所示。结果显示不同组别的临床营养乳剂的平均粒径差别极大:仅加入疏水性抗氧剂生育酚的乳剂体系较于其他两种体系最不稳定,所选的两种亲水性抗氧剂用量相同,选择水合儿茶酚的乳剂体系要明显优于选择维生素C的乳剂体系,从营养学角度来看,二者均为天然抗氧剂,而实验结果说明在该乳剂体系中,水合儿茶酚与生育酚的协同作用明显优于维生素C与生育酚的协同作用,因此认为加入水合儿茶酚-生育酚双抗氧剂的临床营养乳剂为本实施例中的最优处方。
实施例6
一种临床营养乳剂,每100mL由以下原料制备而成,如表6所示。()
表6
上述临床营养乳剂的制备方法包括以下步骤:
(1)将酪蛋白酸钠、水合儿茶酚与栀子黄色素分散溶解于超纯水中,常温磁力搅拌充分水化4h,得到蛋白质水溶液,即为水相溶液;
(2)将生育酚与苏子油、亚麻油于常温下涡旋2min,得到混合油溶液,即为油相溶液;
(3)将油相溶液与水相溶液搅拌混匀,于转速为10000r/min的条件下高速剪切分散60s,得到粗乳;
(4)将粗乳高压均质,均质的循环次数为5次,均质压力为500bar,制备得到临床营养乳剂。
将所制备的临床营养乳剂经纳米粒度分析仪检测,检测方法为将样品稀释100倍后放于样品检测池中平衡120s后进行检测,至少扫描20次得到粒径分布曲线,且取两个时间点,分别为新鲜制备后、长期实验3个月,结果如附图6所示。结果显示不同组别的临床营养乳剂的平均粒径无显著性差别:粒径均在250nm以下,加入200mg与1000mg栀子黄素色的乳剂体系较于没有加入栀子黄色素的乳剂体系稳定性更佳,由于栀子黄色素具有共轭双键,所以也有一定的抗氧化作用,可以起到保护乳剂体系不被氧化变质的作用,且从营养学角度来看,栀子黄色素为天然色素,在生活生产实际中有很好的应用基础,且染色后的乳剂体系色彩鲜艳,由于色素建议使用范围区间较广,色彩可控性佳,因此本实施例结论为在建议使用范围内的乳剂体系均为优选处方,后续根据实际需求再做具体选择。
实施例7
一种临床营养乳剂,每100mL由以下原料制备而成,如表7所示。()
表7
上述临床营养乳剂的制备方法包括以下步骤:
(1)将酪蛋白酸钠、水合儿茶酚与栀子蓝色素分散溶解于超纯水中,常温磁力搅拌充分水化4h,得到蛋白质水溶液,即为水相溶液;
(2)将生育酚与苏子油、亚麻油于常温下涡旋2min,得到混合油溶液,即为油相溶液;
(3)将油相溶液与水相溶液搅拌混匀,于转速为10000r/min的条件下高速剪切分散60s,得到粗乳;
(4)将粗乳高压均质,均质的循环次数为5次,均质压力为500bar,制备得到临床营养乳剂。
将所制备的临床营养乳剂经纳米粒度分析仪检测,检测方法为将样品稀释100倍后放于样品检测池中平衡120s后进行检测,至少扫描20次得到粒径分布曲线,且取两个时间点,分别为新鲜制备后、长期实验3个月,结果如附图7所示。结果显示不同组别的临床营养乳剂的平均粒径无显著性差别:粒径均在250nm左右,加入低含量200mg栀子蓝素色的乳剂体系较于加入高含量1000mg栀子蓝色素的乳剂体系稳定性更佳,从营养学角度来看,栀子蓝色素为天然色素,且染色后的乳剂体系色彩鲜艳,由于色素建议使用范围区间较广,色彩可控性佳,因此本实施例结论为在建议使用范围内的乳剂体系均为优选处方。
实施例8
一种营养乳剂,由以下原料制备而成:
上述营养乳剂的制备方法包括以下步骤:
(1)将酪蛋白酸钠、水合儿茶酚分散溶解于超纯水中,常温磁力搅拌充分水化4h,得到蛋白质水溶液,即为水相溶液;
(2)将生育酚与苏子油、亚麻油于常温下涡旋2min,得到混合油溶液,即为油相溶液;
(3)将油相溶液与水相溶液搅拌混匀,于转速为10000r/min的条件下高速剪切分散60s,得到粗乳;
(4)将粗乳高压均质,均质的循环次数为5次,均质压力为500bar,制备得到营养乳剂。
将所制备的营养乳剂经纳米粒度分析仪检测,检测方法为将样品稀释100倍后放于样品检测池中平衡120s后进行检测,至少扫描20次得到粒径分布曲线,结果如附图8所示,粒径为239nm左右,多分散系数较小,峰型呈狭窄单峰状。所制备的营养乳剂经马尔文旋转流变仪检测,将约1mL乳剂样品放于锥板上预热五分钟以达到平衡,测定温度恒定为25℃,剪切速率为0.001s-1-1000s-1,分别模拟实际应用中的存储、运输、复配、封装、泵送及管饲等过程,结果如附图9所示,得到的营养乳剂体系粘度始终低于1.8pa.s,且剪切速率为10s-1-1000s-1为模拟管饲使用过程,黏度不随剪切速率的变化而变化,说明该营养乳剂为低粘度牛顿流体,能够适用于重症患者的管饲或需流体食物等特殊饮食方式进食的人群。所制备的营养乳剂的微观形态采用透射电镜表征,将乳剂用超纯水稀释适当倍数后,取10μL滴在覆有铜网的支持膜上,于室温下干燥数分钟,再滴加1%磷钨酸溶液于铜网上染色5min,最后将乳剂置于120kV,20000倍数的透射电镜进行拍摄,结果如附图10所示,呈圆润光滑的球形,且粒径在250nm左右,粒径分散度较小。
实施例9
一种临床营养乳剂,每100mL由以下原料制备而成,如表8所示。()
表8
上述临床营养乳剂的制备方法包括以下步骤:
(1)将酪蛋白酸钠、水合儿茶酚分散溶解于超纯水中,常温磁力搅拌充分水化4h,得到蛋白质水溶液,即为水相溶液;
(2)将生育酚与苏子油、亚麻油于常温下涡旋2min,得到混合油溶液,即为油相溶液;
(3)将油相溶液与水相溶液搅拌混匀,于转速为10000r/min的条件下高速剪切分散60s,得到粗乳;
(4)将粗乳高压均质,均质的循环次数为5次,均质压力为500bar,制备得到临床营养乳剂。
将所制备的临床营养乳剂经纳米粒度分析仪检测,检测方法为将样品稀释100倍后放于样品检测池中平衡120s后进行检测,至少扫描20次得到粒径分布、多分散系数及电位势能,结果如附图11所示,不同组别的临床营养乳剂的各项指标在新鲜制备后并没有显著性差别。所制备的临床营养乳剂经浊度仪检测,检测方法为讲样品稀释30倍后芳羽样品检测池中,待平衡后直接读数,每个样品检测3次得到,结果如附图12所示,不同组别的临床营养乳剂体系差别极大:显然,没有加入抗氧剂的乳剂体系最不稳定,加入两种抗氧剂的乳剂体系最为稳定,而只加入亲水性抗氧剂的乳剂体系要优于只加入疏水性抗氧剂的乳剂体系,可能是由于该乳剂体系为O/W型乳剂,水相为连续相,体积占比较大,所以亲水性抗氧剂较疏水性抗氧剂在体系中起到更显著的作用。本实施例中选择的两种抗氧剂均为天然抗氧剂,实验结果看来具有显著的协同作用,因此认为加入双抗氧剂的临床营养乳剂为本实施例中的最优处方。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!