双乙酸钠在提高动物肠道菌群多样性中的应用的制作方法
本发明涉及食品、医药、畜牧兽医技术领域,具体地涉及双乙酸钠在提高动物肠道菌群多样性中的应用。
背景技术:
肠道菌群是定殖于宿主胃肠道的上千种不同细菌的集合体,由相互交流和相互制约的复杂菌群构成,是一个关联紧密的微生态系统。据目前的推算人体肠道中的细菌种类达1000多种,数量高达1014,人体肠道内细菌总数约是人体体细胞的10多倍。近年来的研究表明,肠道菌群对于维持人体健康十分重要,肠道菌群是一个被遗忘的器官,参与调节宿主的多方面生理机能,包括消化、营养代谢、天然免疫系统成熟等。
人的肠道是一个相互关联的粘膜细胞与微生物组成的复杂组织。如同所有的生态系统一样,其中微生物多样性至关重要。在肠道生态系统里,多样性意味着各种不同种类的微生物共生。高度的多样性为系统内所有的物种提供了保护,因为它们之间的相互关联创造了一个稳定的网络,保证了资源的获取与流动。多样性的丧失会危害生态系统的健康,而关键种的丧失则会导致生态系统崩溃。由于抗生素的滥用、不良的生活方式和饮食结构的改变弄丢了很多和我们共同进化的肠道微生物物种,这有可能会引发广泛的健康问题,包括肥胖、糖尿病、肝脏疾病、炎症性肠病、肠易激综合征、腹泻、哮喘、自闭症、多发性动脉硬化甚至于衰老都可能。科学家研究发现,人体70~80%的免疫系统疾病大多源自于肠道微生物多样性的改变。因此,维持肠道微生物的多样性对保持人们的健康十分重要。
肠道菌群多样性下降是指肠道内的微生物组成发生了变化,益生菌数量减少,而有害菌数量增加。维持肠道微生物的多样性的方法,主要是抗生素的合理使用及使用益生菌和益生元。目前抗生素的合理使用已经被大多数人认识并已应用于健康实践中。益生菌产品也已大量上市,然而实际应用效果反应不一,很多的时候还会引起菌群多样性下降,影响正常的生理功能。益生元具有很好的调整肠道菌群的作用,是未来的发展方向,主要成分是功能性低聚糖。这一类益生元可以定向起到增殖某些有益菌的作用,但对菌群多样性的增加并没有太显著的影响。目前市场仍缺乏高效增加菌群多样性且食用安全的产品。
双乙酸钠(sodiumdiacetate,简称sda),是一种性质稳定、价格低廉的新型食品防腐剂、酸味剂、改良剂和防霉剂,具有良好的抗细菌和抗真菌作用。中国和美国食品与药品管理局把双乙酸钠认定为安全物质,可以广泛应用于食品中。由于双乙酸钠抗菌性及其在消化道中易于被分解成乙酸并解离出h+,可以使肠胃中的ph值下降,必定影响肠道菌群的生长。通常人们推测双乙酸钠可能有抗生素类似的效应,造成肠道菌群多样性的降低。目前尚未见有双乙酸钠能提高动物肠道菌群多样性的报道。
技术实现要素:
本发明的目的是为了克服现有技术的上述不足,提供双乙酸钠在提高动物肠道菌群多样性中的应用,本发明通过添加适量双乙酸钠后,肠道菌群多样性得到显著提高。
本发明的另一目的在于提供双乙酸钠在提高动物肠道微生物otu数量、物种丰富度chao1指数、种群结构多样性shannon指数和/或均匀度simpson指数中的应用。
本发明的另一目的在于提供一种提高动物肠道菌群多样性的方法。
为了实现上述目的,本发明是通过以下方案予以实现的:
本发明通过肠道菌群人源化小鼠模型干预实验研究发现,添加适宜剂量的双乙酸钠能够极其显著地提高模型小鼠的肠道菌群多样性,其中alph多样性指数(chao1、shannon和simpson)显著提高,otu数提高2~4倍,对肠杆菌属(enterobacter)、埃希氏-志贺氏菌(escherichia-shigella)、变形杆菌属(proteus)、粪杆菌属(faecalibacterium)、肠球菌属(enterococcus)、链球菌属(streptococcus)和螺杆菌属(helicobacter)等有害菌的丰度都有显著降低作用,可以显著降低肠道和机体的炎症水平,缓解便秘,减少动物腹泻,提高动物生长速度,增强动物抗病能力。
因此,本发明请求保护双乙酸钠在提高动物肠道菌群多样性中的应用。
本发明还请求保护双乙酸钠在提高动物肠道微生物otu数量、物种丰富度chao1指数、种群结构多样性shannon指数和/或均匀度simpson指数中的应用。
优选地,当双乙酸钠的灌服剂量为33.3mg/kg·d-1或300.0mg/kg·d-1时,能显著提高动物肠道中拟杆菌门(bacteroidetes)菌群丰度。
优选地,当双乙酸钠的灌服剂量为33.3mg/kg·d-1时,能显著提高动物肠道中普氏菌属(prevotella)、螺杆菌属(helicobacter)菌群丰度。
优选地,当双乙酸钠的灌服剂量为100.0mg/kg·d-1时,能显著提高动物肠道中拟杆菌属(bacteroides)、考拉杆菌属(phascolarctobacterium)、颤螺菌属(oscillospira)、脱硫弧菌属(desulfovibrio)菌群丰度。
优选地,当双乙酸钠的灌服剂量为300.0mg/kg·d-1时,能显著提高动物肠道中普氏菌属(prevotella)菌群丰度。
优选地,当双乙酸钠的灌服剂量为33.3mg/kg·d-1或300.0mg/kg·d-1时,能显著提高动物肠道中厌氧菌菌群丰度。
本发明还请求保护一种提高动物肠道菌群多样性的方法,在食品中添加0.05~0.5g/kg双乙酸钠或在猪饲料中添加20~500g/吨双乙酸钠。
与现有技术相比,本发明具有以下有益效果:
本发明通过肠道菌群人源化小鼠模型干预实验研究发现,添加适宜剂量的双乙酸钠能够极其显著地提高模型小鼠的肠道菌群多样性,其中alph多样性指数(chao1、shannon和simpson)显著提高,otu数提高2~4倍,对肠杆菌属、埃希氏-志贺氏菌、变形杆菌属、粪杆菌属、肠球菌属、链球菌属和螺杆菌属等有害菌的丰度都有显著降低作用,可以显著降低肠道和机体的炎症水平,缓解便秘,减少动物腹泻,提高动物生长速度,增强动物抗病能力。
附图说明
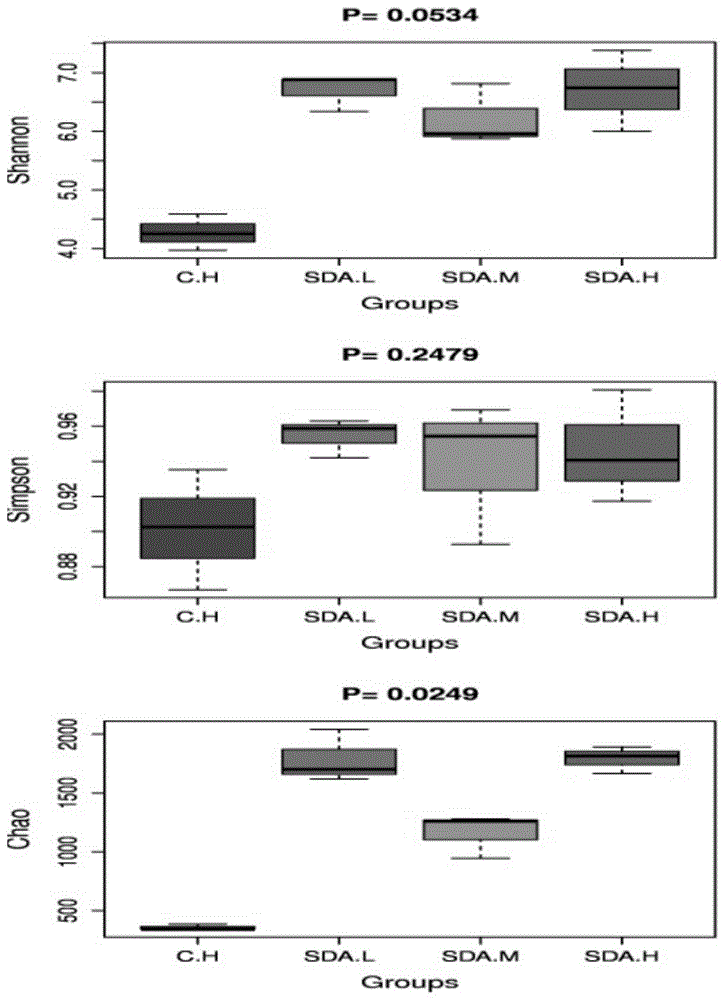
图1为双乙酸钠干预对小鼠肠道菌群α多样性的影响。
图2为双乙酸钠实验组与对照组的小鼠肠道菌群结构的pcoa分析。
图3为双乙酸钠干预对小鼠肠道菌群out的影响韦恩图。
图4为双乙酸钠实验组与对照组的小鼠肠道菌群在门水平下的构成。
图5为实验组与对照组的小鼠肠道菌群在属水平下的构成。
图6为差异显著的功能菌变化。
具体实施方式
下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
1、实验动物
动物实验方案遵照广东海洋大学动物实验伦理委员会的相关规定制定和执行。实验使用20只spf级6周龄雌性c57bl/6j小鼠,购于北京华阜康生物科技股份有限公司,许可证批号:scxk(京)2016-0002)。
实验动物被单独饲养在笼中,期间可以自由获取co60辐照灭菌的全价配合饲料(营养成分按照gb14924.3-2001要求)和无菌水,饲养环境温度为20~25℃,相对湿度为40~70%,明暗循环周期为12h,压力梯度为20~50pa,全新风,单向流动。严格按照广东海洋大学实验动物中心(syxk2014-0053)操作规范,每周进行3次换水瓶和更换垫料。
2、试剂
双乙酸钠为食品级(纯度≥99%),深圳安泰生物科技有限公司;
微板定量显色基质法鲎试剂盒,厦门鲎试剂生物科技股份有限公司;
实施例1
一、实验动物的处理
1、伪无菌小鼠模型的构建
实验小鼠购得后,先使用co60辐照灭菌维持饲料同笼喂养1周,以确保小鼠适应饲养环境,并达到相似的肠道菌群基础水平。待适应后灌胃小鼠抗生素混合液(万古霉素200mg/kg·d-1,新霉素200mg/kg·d-1,甲硝锉200mg/kg·d-1),持续3日。
2、肠道菌群人源化小鼠(hfa)模型的建立
收集1位健康志愿者(男,19岁,无消化道疾病,无代谢性疾病,3月内无服用抗生素)清晨第1次排出的新鲜粪便,在厌氧无菌条件下称质量,以质量比1:9加入0.1mpbs缓冲液稀释,振荡混匀取上清后获得粪便悬液。将20只伪无菌小鼠灌胃健康志愿者粪便悬液0.3ml,隔日1次,人肠道菌群在小鼠肠道内定殖3周后获得hfa小鼠。
3、实验分组
将20只hfa小鼠随机分为4组,双乙酸钠低、中、高剂量组为干预组,每组各5只,分别灌胃33.3mg/kg·d-1、100.0mg/kg·d-1、300.0mg/kg·d-1双乙酸钠,持续7日;对照组5只小鼠为人源化对照组,灌胃无菌水,持续7日。
二、样本的采集
1、粪便样本的采集:对小鼠采用常规抓取、按摩腹部的方法,在洁净台中采集新鲜粪便颗粒到无菌ep管中,采集后即刻冰浴,直至转入–80℃冰箱中待用。每只小鼠至少采集3颗粪便颗粒,一次采集不足者,可以在同一天的多个时间点反复采集。
2、血清样本的采集:待小鼠实验周期结束后,禁水禁食12小时,进行眼球取血,分离血清,储存于-80℃的冰箱中备用。
三、小鼠肠道菌群结构分析
粪便dna提取:采用粪便dna提取试剂盒qiaampfastdnastoolminikit(德国qiagen公司产品)抽提粪便dna,并进行合格检查。
illumina高通量16srdna测序:通过采用illuminahiseq测序平台,使用引物为515f-806r对v4区进行扩增测序,测序得到fastq格式的原始数据,再配对拼接成单条序列。通过barcode确定序列对应的样本。用qiime序列进行质控过滤,去掉嵌合体,得到有效序列。
1、otu聚类与统计
用r软件编写程序,对全部样本所包含的序列的长度分布进行统计。根据otu的聚类结果,默认以97%相似度下以otu为单位绘制韦恩图,比较不同样品(组)之间共有、特有的otu数目。
2、各分类水平组成分析
通过对otu的聚类和注释的结果统计,得到不同分类水平上(由门、纲、目、科、属、种组成)各个样本的微生物类群落组成数量。根据物种注释结果,对每个样本或分组在各分类水平上(门、纲、目、科、属)选取丰度排名前10的物种绘制相对丰度柱状图,分析不同样本或分组间物种组成比例情况。根据不同样本的分类单位的相似度进行聚类,了解样品之间的相似性以及属水平上的群落构成相似性。
3、群落多样性(alpha多样性)指数分析
通过otu丰度矩阵,计算样本的群落多样性(alpha多样性)指数,利用chao1指数和ace指数指示群落的丰富度(即群落中微生物成员如otu的数量),shannon指数和simpson指数反映群落的均匀度(即各成员间的丰度差异大小)。
4、主坐标pcoa(principalco-ordinatesanalysis)分析
通过一系列的特征值和特征向量进行排序后,通过对样本距离矩阵作降维分解,展现样本在某种特定距离的分布。
5、小鼠肠道菌群功能差异预测分析
基于bugbase对16s高通量结果根据氧需求(包括厌氧菌、好氧菌、兼性菌)表型进行比较。用stamp软件对kegg代谢途径差异进行分析。
6、统计学处理方法
数据处理采用spss20.0统计软件;多组间比较采用单因素方差分析,两两比较采用tukey检验;以p<0.05为差异有统计学意义。
四、结果和分析
1、双乙酸钠干预对小鼠肠道菌群α多样性的影响
chao1丰富度估计指数通过计算群落中只检测到1次和2次的otu数估计群落中实际存在的物种数。shannon指数综合考虑了群落的丰富度和均匀度。shannon指数值越高,表明群落的多样性越高。simpson多样性指数也是评价群落多样性的常用指数之一,simpson指数值越高,表明群落多样性越高。
从图1中可以看出,双乙酸钠干预组的α多样性chao1、shannon和simpson指数和对照组均有显著差异。表明双乙酸钠使用后肠道菌群的多样性显著提高。
2、双乙酸钠干预对小鼠肠道菌群β多样性的影响
将测序获得的所有序列按照97%相似度进行otu分类,将众多的肠道菌群组分进行分类、合并,基于加权spearman距离进行pcoa分析,并选取最具代表菌群的因素为主坐标轴进行作图,通过pcoa图展现所测样品肠道菌群结构的相似性和差异性。如果样本的距离越接近(即物种的丰度和构成越相似),则它们在pcoa图中的距离越近。
如图2所示,空白对照组和实验组的整体距离较大,说明两个组间的小鼠肠道菌群存在较大差异。从pc1角度观察,距离差异极为明显,说明小鼠组间的物种的丰度和构成差异性极为显著(p<0.05)。从pc2角度观察,距离差异小。说明从这一角度看小鼠的肠道菌群存在着一定程度上的相似性。结合组间和组内分析可知,双乙酸钠干预下小鼠肠道菌群的beta多样性差异较为显著(p<0.05),组间肠道菌群存在着一定程度上的相似性。
3、双乙酸钠干预对小鼠肠道菌群otu的影响
如图3所示,双乙酸钠干预后的实验组,其肠道内容物dna样品测得的otu与对照组(444个otu)相比,在低剂量干预后有151个out未测出,新增加1416个otu(p<0.05);中剂量干预条件下有86个out未测出,新增加了1506个otu;高剂量下干预后有210个out未测出,增加了1489个otu。低剂量组总otu为1709个,中剂量组1874,高剂量组1778,而空白对照组总otu只有444个,前者分别是后者的3.85、4.22和4.00倍。由此可知,双乙酸钠干预后小鼠肠道菌群的otu数量极显著增加,说明双乙酸钠的干预会使得小鼠肠道菌群种类丰富程度(多样性)有极明显提高(p<0.05)。
4、双乙酸钠干预后小鼠肠道菌群在门水平下的差异比较
从图4可以看出,低、高剂量条件下拟杆菌门(bacteroidetes)比例丰度显著提高,厚壁菌门(firmicutes)和变形菌门(proteobacteria)比例丰度均显著降低,中剂量变化不显著。
5、双乙酸钠干预前后小鼠肠道菌群在属水平下的差异比较
对小鼠的肠道菌群在属水平上进行分析,结果如图5所示。在低剂量条件下,普氏菌(prevotella)、螺杆菌属(helicobacter)和某些未知名菌比例丰度显著增加;脱硫弧菌属(desulfovibrio)、安德克氏菌属(adlercreutzia)、肠杆菌属(enterobacter)、埃希氏-志贺氏菌(escherichia-shigella)、变形杆菌属(proteus)、肠球菌属(enterococcus)、链球菌属(streptococcus)和某些未知名菌比例丰度显著降低;其它菌属丰度无显著差异。
在中剂量条件下,丰度显著增加的有拟杆菌属(bacteroides)、考拉杆菌属(phascolarctobacterium)、颤螺菌属(oscillospira)、脱硫弧菌属(desulfovibrio)和某些未知名菌;丰度显著降低的有肠杆菌属(enterobacter)、埃希氏-志贺氏菌(escherichia-shigella)、变形杆菌属(proteus)、粪杆菌属(faecalibacterium)、肠球菌属(enterococcus)、链球菌属(streptococcus)、螺杆菌属(helicobacter)和某些未知名菌。
在高剂量条件下,丰度显著增加的有普氏菌属(prevotella)和某些未知名菌;丰度显著降低的有肠杆菌属(enterobacter)、埃希氏-志贺氏菌(escherichia-shigella)、变形杆菌属(proteus)、粪杆菌属(faecalibacterium)、肠球菌属(enterococcus)链球菌属(streptococcus)、螺杆菌属(helicobacter)、akk菌属(akkermansia)、特布尔西氏菌属(trabulsiella)、丁酸弧菌(butyricimonas)、梭菌属(clostridium)和某些未知名菌。
6、双乙酸钠对人源化小鼠需厌氧菌群丰度的影响
从图6中可以看出,低剂量和高剂量条件下,需氧菌、兼性厌氧菌丰度显著下降,厌氧菌丰度有所增加,有利于降低肠道及机体的炎症水平。中剂量条件下,需氧菌和厌氧菌比例变化不大,而兼性厌氧菌比列丰度显著降低。
最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!