一种藻蓝蛋白微球的制备的制作方法
本发明属于生物制药领域,具体涉及一种以海藻酸钠为主要材料包被藻蓝蛋白,制备载藻蓝蛋白微球的方法。
背景技术:
藻蓝蛋白(Phycocyanin,PC)是藻胆蛋白(phycobiliproteins)的一种,主要存在于蓝藻(Cyanophyta)、红藻(Rhodophyta)、隐藻(Cryptophyta)和少数甲藻(Pyrrophyta)中,是这些藻类进行光合作用的捕光色素蛋白之一。其分子量在40ku左右,由α、β两个亚基组成。肽链上共价结合1个开链的四吡咯环辅基。分离纯化的水溶藻蓝蛋白在溶液中呈蓝色,并发出紫色荧光,在波长620nm具有特异吸收峰,可以A620/A280表示其纯度。因其水溶性、无毒、清亮且着色力强等优点,藻蓝蛋白被广泛用于食品着色剂和化妆品的添加剂。另外,藻蓝蛋白带有荧光,可作为荧光标记物制成荧光试剂、荧光探针、荧光示踪物等,用于临床医学诊断、免疫化学及生物工程等研究领域中。藻蓝蛋白的药理活性非常广泛,具有抗癌、抗氧化、治疗脑缺血损伤、治疗糖尿病等多种生物活性。这为藻蓝蛋白在功能性食物和医药领域的开发提供了重要的决策依据,因此藻蓝蛋白具有广阔的应用前景和较高的市场经济价值,但因其对光、热和酸碱敏感,稳定性差,易失活,限制了其大规模的开发应用。
海藻酸(Alginic acid)是从褐藻中提取的一种亲水性多糖类化合物,由甘露糖醛酸(Mannuronic acid,记为M单元)与其立体异构体古洛糖醛酸(Guluronic acid,记为G单元)两种单糖以三种方式(MM段、GG段、MG段)通过α-(1,4)糖苷键连接而成的一种无支链的线性嵌段共聚物。海藻酸钠在溶液状态下能与金属离子如Ca2+、Al3+等发生化学反应,其结果是金属离子将Na+置换出来,并将海藻酸钠的长分子链维系在一起而形成凝胶。海藻酸钠液滴与氯化钙形成海藻酸钙凝胶微球的过程是溶胶-凝胶相转移过程,制备过程温和,其基本反应方程式如下:2nNaAlginate+nCa2+→nCa(Alginate)+2nNa+
海藻酸钙凝胶具有良好的生物相容性和生物粘附性,至今已被广泛地应用于药物的控制释放和微生物及酶的固定化。海藻酸钙凝胶微球具有以下特点:(1)溶胀特性,可作为缓控释给药的载体。(2)其溶胀特性受pH值的影响,故可防止酸敏感性药物在胃中被降解。
海藻酸盐是阴离子聚合物,与阳离子聚合物结合时会发生复合凝聚,形成复合凝胶,现已应用于制剂的开发。壳聚糖是有甲壳素脱乙酰化后得到的具有优良生物降解性和成膜性的天然高分子直链多糖,其分子链上有大量的伯氨基,而海藻酸钠的分子链上有大量的羧基, 因此壳聚糖和海藻酸钠可以通过正、负电荷吸引形成复合凝胶,增加壳聚糖-海藻酸钠凝胶微球的强度,降低海藻酸钙凝胶微球对pH值的敏感度,抑制微球的崩解,从而进一步控制药物释放。
技术实现要素:
本发明目的在于提供一种海藻酸钠包被的藻蓝蛋白微球制剂及其制备方法。它采用藻蓝蛋白为包裹物,制备出适合肠道靶向给药的微球制剂,该方法工艺简单、制备过程易控、制备的微球质量稳定。
本发明的具体技术方案为:将藻蓝蛋白溶解于2%(w/v)的海藻酸钠溶液中,通过磁力搅拌混匀。将海藻酸钠藻蓝蛋白混合溶液通过恒流泵以4ml/min的速度经过6.5#针头滴入含滴到含氯化钙的壳聚糖溶液(以1%醋酸、2.0%tween20溶解,NaOH调节pH5.0)中,600r/min搅拌30min,4℃静置1h后,抽滤,用去离子水洗涤微球3次,37℃干燥得微球。
海藻酸钠浓度(w/v)分别为0.5%、1.0%、1.5%、2.0%、2.5%,壳聚糖浓度(w/v)分别为0.3%、0.5%、0.7%、0.9%,氯化钙浓度(w/v)分别为1%、1.5%、2%、2.5%,藻蓝蛋白/海藻酸钠(w/w)分别为1/1、1/2、1/3、1/4,凝固浴pH分别为3、4、5及5.6。
微球的包埋率和载药量的测定
取一定质量的干燥微球,置于0.2mol/L磷酸缓冲液(pH7.4)中,振荡,直至微球完全溶解,离心后吸取上清,经稀释后测定释放液的A652和A620,根据以下公式计算藻蓝蛋白含量、微球的包埋率和载药量:其中,A652、A620表示释放溶液在652nm和620nm下的吸光度。
本发明选取的海藻酸钠是从海藻中提取的一种天然高分子钠盐,相对分子质量7~15万,不仅具有可调节性、生物相容性、缓释性、安全性等诸多特点,并且将其作为主要材料制备口服蛋白微球具有以下优点:在口服药物中加入可增大粘度,延长药物的释放时间,减少不良反应;利用微球的溶胀对pH值的依赖性,使得该制剂在胃中不溶胀,不崩解,而在肠道的中性或稍碱性环境中崩解,适用于肠道给药系统。
采用本方法制备得到的微球形态圆整,大小均匀,粒径分布窄。控制优化微球制备条件(海藻酸钠浓度、壳聚糖浓度、氯化钙浓度、藻蓝蛋白和海藻酸钠质量比和凝固浴pH),.可使藻蓝蛋白微球包埋率达到99.78%~99.86%,载药量达到40.78%~43.86%,药物在模拟胃环境中累计释放少于1%,在模拟肠环境中累计释放率大于90%,可实现藻蓝蛋白的肠定 向释放。
附图说明
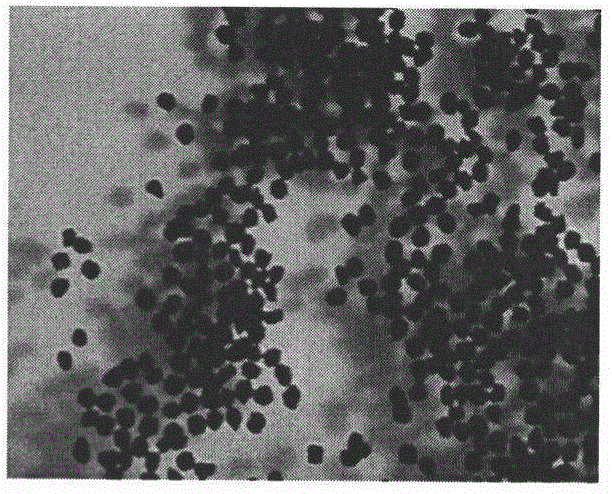
图1为未干燥海藻酸钠藻蓝蛋白微球光学显微镜下形态。
图2为干燥海藻酸钠藻蓝蛋白微球光学显微镜下形态。
图3为海藻酸钠藻蓝蛋白溶胀度曲线。
图4为海藻酸钠藻蓝蛋白微球体外累计释放曲线,纵坐标为藻蓝蛋白累计释放率,横坐标为释放时间。
具体实施方式
下面结合一些实例对发明做进一步详细说明。应理解,这些实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。
实施例1
正交化实验
以海藻酸钠浓度(A)、壳聚糖浓度(B)、藻蓝蛋白/海藻酸钠质量比(C)、氯化钙浓度(D)为主要考查因素,每个因素选择3个水平,进行L9(34)正交实验。以包封率(S1)和载药量(S2)为观察指标,综合指标S=(S1+S2)/2,S愈大效果越好。
表一:正交实验因素与水平表
表二:借助正交助手软件对实验数据进行直观分析和方差分析,结果如下表所示。
由表可知对壳聚糖海藻酸钠微球影响最大的是藻蓝蛋白投入量,其次是海藻酸钠浓度、氯化钙浓度,最小的是壳聚糖浓度,即,影响壳聚糖海藻酸钠微球的主要顺序是C>A>D>B。经正交实验的出的最佳实验组合是A3B1C3D2,即海藻酸钠浓度2%,壳聚糖浓度0.2%,藻蓝蛋白/海藻酸钠为1,氯化钙浓度浓度1.5%。
实施例2
优化工艺条件下制备的壳聚糖海藻酸钠藻蓝蛋白微球的包封率和载药量重复性考察不同批次载药微球之间包封率的稳定性
表三:最优工艺条件下制备的6批载药微球的包封率列于下表所示。
假定ηi随实验次数n成正态分布,则标准差S为: 当置信水平α=0.1时,置信区间为(99.78%,99.86%)。结果表明90%的概率证明微球中藻蓝蛋白的包封率在99.78%~99.86%之间,说明此工艺制备的藻蓝蛋白微球包封率较高,而且具有良好的重复性和稳定性。
实施例3
不同批次载药微球之间载药量的稳定性
表四:最优工艺条件下制备的6批载药微球的载药量列于下表。
假设Li随实验次数n成正态分布,则标准差S为当置信水平α=0.1时,置信区间为(40.78%,43.86%)。结果表明90%的概率证明微球中藻蓝蛋白的载药量在40.78%~43.86%之间,说明此工艺制备的藻蓝蛋白微球包封率较高,而且具有良好的重复性和稳定性。
实施例4
海藻酸钠藻蓝蛋白微球形态和粒径检测
微球形态的观察:取少量干燥微球均匀分散于载玻片上,光学显微镜下观察微球形态。结果表明未干燥的藻蓝蛋白微球为蓝色,均一圆球形,表面光滑(见图1)。干燥后藻蓝蛋白微球为灰色,均一圆球形,表面粗糙(见图2)。
微球平均粒径测定:利用生物显微镜随机测定50个载药微球的粒径,将微球的算术平均值作为微球的平均粒径测得为1mm。
实施例5
藻蓝蛋白微球溶胀度的测定
精确称取0.2g干燥的微球,分别置于5m1的蒸馏水、模拟肠液和模拟胃液的溶胀介质中,于不同的时间抽滤,除去上清,用滤纸吸干微球表面的水分,测定其质量,至微球为恒重。溶胀度S(%)的计算公式为:
其中,Wt为t时间微球的质量,W0为0时干燥微球的质量
如图3所示,微球在蒸馏水和模拟胃液4h的平均溶胀率分别是227%和544%,在模拟肠液中达到了2893%,继续延长时间模拟肠液中的微球溶解。
实施例6
藻蓝蛋白微球体外释放性能测定
肠环境:取0.5g干燥的藻蓝蛋白微球加入到100mL模拟肠液(SIF,NaOH 1.60g,KH2PO46.80g,适量蒸馏水溶解后,蒸馏水定容至1000ml,测定溶液pH为7.4)中,置于37℃的恒温振荡器中,转速100r/min,每隔一定时间取5mL溶液,测其吸光度,计算藻蓝蛋白浓度,在取样的同时补充等量新鲜释放液,保持模拟肠液的体积不变。
胃环境:同法测定在模拟胃液(SGF,NaCl 2.0g,36.5%浓盐酸7ml,加蒸馏水至1000ml,测定pH为1.2)下的释放性能。
如图4所示,藻蓝蛋白微球在模拟胃液中的累计释放率小于1%,在模拟肠液中的累计释放率大于90%,微球能够有效地保护藻蓝蛋白在胃中不被破坏,达到了有效地控释的目的。
- 还没有人留言评论。精彩留言会获得点赞!