基于医学影像数据的几何模型建立方法与流程
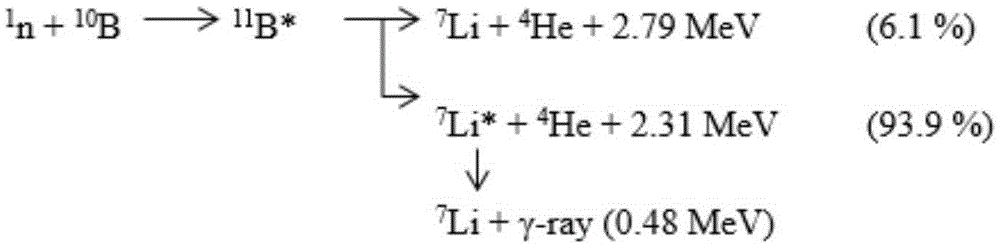
本发明涉及一种几何模型建立方法,尤其涉及一种基于医学影像数据的几何模型建立方法。
背景技术:
随着原子科学的发展,例如钴六十、直线加速器、电子射束等放射线治疗已成为癌症治疗的主要手段之一。然而传统光子或电子治疗受到放射线本身物理条件的限制,在杀死肿瘤细胞的同时,也会对射束途径上大量的正常组织造成伤害;另外由于肿瘤细胞对放射线敏感程度的不同,传统放射治疗对于较具抗辐射性的恶性肿瘤(如:多行性胶质母细胞瘤(glioblastoma multiforme)、黑色素细胞瘤(melanoma))的治疗成效往往不佳。
为了减少肿瘤周边正常组织的辐射伤害,化学治疗(chemotherapy)中的标靶治疗概念便被应用于放射线治疗中;而针对高抗辐射性的肿瘤细胞,目前也积极发展具有高相对生物效应(relative biological effectiveness,RBE)的辐射源,如质子治疗、重粒子治疗、中子捕获治疗等。其中,中子捕获治疗便是结合上述两种概念,如硼中子捕获治疗,借由含硼药物在肿瘤细胞的特异性集聚,配合精准的中子射束调控,提供比传统放射线更好的癌症治疗选择。
硼中子捕获治疗(Boron Neutron Capture Therapy,BNCT)是利用含硼(10B)药物对热中子具有高捕获截面的特性,借由10B(n,α)7Li中子捕获及核分裂反应产生4He和7Li两个重荷电粒子,两粒子的总射程约相当于一个细胞大小,因此对于生物体造成的辐射伤害能局限在细胞层级,当含硼药物选择性地聚集在肿瘤细胞中,搭配适当的中子射源,便能在不对正常组织造成太大伤害的前提下,达到局部杀死肿瘤细胞的目的。
三维模型广泛应用于科学实验分析、科学实验模拟领域。比如在核辐射与防护领域,为了模拟人体在一定辐射条件下的吸收剂量,常常需要利用计算机技术对医学影像数据进行各种处理建立精确的MCNP需要的晶格模型,并结合MCNP(蒙特卡罗程序)进行模拟计算。
蒙特卡罗方法是目前能够对辐照目标内部三维空间核粒子碰撞轨迹和能量分布进行精确模拟的工具,蒙特卡罗方法与复杂的三维人体解剖模型相结合代表了模拟在计算机技术中的跃进。在诊断放射检查中,精确的人体器官剂量评估对于放射治疗是非常有益的。目前,国际上已经成功建立多种人体模型并结合蒙特卡罗模拟程序,对人体在辐射环境下的吸收剂量 进行精确性的计算评估。人体三维解剖模型成功转换为蒙特卡罗程序所需要的几何描述是进行蒙特卡罗模拟计算的前提条件,也是目前国际上蒙特卡罗模拟研究的热点和难点。
核磁共振成像(Magnetic Resonance Imaging,MRI)或电子计算机断层扫描(Computed Tomography,CT)等医学影像数据能够针对人体体内特征提供较为详细的组织几何结构信息,为人体内部结构的实体建模提供了数据基础。而在中子捕获治疗领域如何根据医学影像数据建立MCNP所需的几何模型属于一个很重要的课题,换句话说,即如何根据医学影像数据建立MCNP软件输入档所需的晶格模型,从而提高治疗计划的精确性。
因此,有必要提出一种提高治疗计划精确性的根据医学影像数据建立MCNP所需的几何模型的方法。
技术实现要素:
本发明的一个方面提供一种基于医学影像数据的几何模型建立方法,包括:
读取医学影像数据的步骤;
通过医学影像数据与组织种类之间的转换关系定义组织种类的步骤;
决定组织分群数的步骤;
通过医学影像数据与密度之间的转换关系定义组织密度的步骤;
建立带有组织和密度信息的3D编码矩阵的步骤;
产生几何模型的步骤。
该几何模型建立方法根据医学影像的数据与组织种类之间的转换关系,可以根据实际需要确定组织分群数,从而更加精确地提供组织种类、元素组成及密度,建立的几何模型更加匹配于医学影像数据反应出的真实情况。
作为一种优选地,该几何模型建立方法应用于中子捕获治疗,其进一步包括给定B-10浓度的步骤和建立带有B-10浓度信息的3D编码矩阵的步骤。标记有B-10浓度信息的几何模型,便可清楚地知道,各个组织内的含硼药物浓度,然后进行中子捕获治疗照射模拟时,则更加真实地反应出实际情况。
组织分群数为用户手动定义的组织分群数加上数据库中已有的4种组织分群数或14种组织分群数。如果在已有数据库中并未建立有相对应的组织分群数,那么可以由用户自定义一个新的组织分群数。这样即避免了如果已有数据库中不能完全匹配相对应的组织分群数,只能近似选择的情况,从而有效地提高的建模的精确度。
更加优选地,该几何模型建立方法进一步包括建立3D组织编码矩阵的步骤和建立3D密 度编码矩阵的步骤。根据医学影像数据的切片通过相对应的转换关系,每一张切片建立相应的组织编码和密度编码,从而建立起3D组织编码矩阵和3D密度编码矩阵。
几何模型包括MCNP软件输入档所需的晶格卡、栅元卡、曲面卡和材料卡。通过医学影像数据最终获得MCNP软件输入档所需的晶格卡、栅元卡、曲面卡和材料卡,从而为模拟计算提供理论依据并获得精确的模拟计算结果。
本发明的另一方面提供一种基于医学影像数据的几何模型建立方法,包括:
读取医学影像数据的步骤;
定义或读取ROI边界的步骤;
判断医学影像体素是否在ROI边界内的步骤:
如果是,则进入通过为每个ROI边界内体素给定一个特定组织与密度的方式进行用户手动定义组织种类与密度的步骤或进入通过医学影像数据与组织种类/密度之间的转换关系自动定义ROI组织种类与密度的步骤,
如果否,则进入通过医学影像数据与组织种类之间的转换关系自动定义组织种类的步骤并通过医学影像数据与密度之间的转换关系定义组织密度的步骤;
建立带有组织和密度信息的3D编码矩阵的步骤;
产生几何模型的步骤。
所谓ROI是指感兴趣区域(下文统称ROI),用户可以手动定义ROI的组织种类、元素组成以及密度。如果医学影像体素点不在ROI边界内,则根据医学影像的数据与组织种类之间的转换关系进行组织种类的定义,并根据实际需要确定组织分群数,从而更加精确地提供组织种类、元素组成及密度,建立的几何模型更加匹配于医学影像数据反应出的真实情况。
作为一种优选地,该几何模型建立方法应用于中子捕获治疗,几何模型建立方法包括给定B-10浓度的步骤和建立带有B-10浓度信息的3D编码矩阵的步骤。标记有B-10浓度信息的几何模型,便可清楚地知道,各个组织内的含硼药物浓度,然后进行中子捕获治疗照射模拟时,则更加真实地反应出实际情况。
组织分群数为用户手动定义的组织分群数加上数据库中已有的4种组织分群数或14种组织分群数。如果在已有数据库中并未建立有相对应的组织分群数,那么可以由用户自定义一个新的组织分群数。这样即避免了如果已有数据库中不能完全匹配相对应的组织分群数,只能近似选择的情况,从而有效地提高的建模的精确度。
更加优选地,该几何模型建立方法进一步包括建立3D组织编码矩阵的步骤和建立3D密 度编码矩阵的步骤。根据医学影像数据的切片通过相对应的转换关系,每一张切片建立相应的组织编码和密度编码,从而建立起3D组织编码矩阵和3D密度编码矩阵。
几何模型包括MCNP软件输入档所需的晶格卡、栅元卡、曲面卡和材料卡。通过医学影像数据最终获得MCNP软件输入档所需的晶格卡、栅元卡、曲面卡和材料卡,从而为模拟计算提供理论依据并获得精确的模拟计算结果。
医学影像数据可以为核磁共振成像(Magnetic Resonance Imaging,MRI)或电子计算机断层扫描(Computed Tomography,CT),下文实施例中将基于电子计算机断层扫描(CT)的数据来阐述,CT的文件格式通常为DICOM。但本领域技术人员熟知地,还可以使用其他的医学影像数据,只要该医学影像数据能够被转换成带有组织种类、密度及B-10浓度信息的MCNP晶格模型的,就能够应用于本发明揭示的基于医学影像数据的几何模型建立方法中。
本发明实施例中的有益效果和/或特点如下:
1、手动定义感兴趣区域(ROI)的组织种类、元素组成及密度;
2、针对非ROI的CT影像体素点,可自动进行组织种类匹配,依据CT值大小差异,已有数据库可区分出4种或14种不同元素组成的组织,也可以根据实际的实验结果确定其他数别的不同元素组成的组织;
3、对于CT值涵盖较广范围的ROI,如黏膜腔室,难以给定唯一的组织密度,用户可根据本发明实施例揭示的方法自动进行CT值与组织/密度的转换;
4、经输入正常血液含硼药物浓度、组织/肿瘤-血液硼浓度比值等参数后,本发明实施例揭示的方法自动将B-10元素编写入所有体素点中;
5、最终产生的三维MCNP晶格模型将带有组织种类(元素组成)、密度和B-10浓度等信息。
附图说明
图1是硼中子捕获反应示意图。
图2是10B(n,α)7Li中子捕获核反应方程式。
图3是本发明实施例中的基于医学影像数据的几何模型建立方法的逻辑框图。
图4是CT值(HU)与组织密度回归曲线公式及相关系数图。
具体实施方式
下面结合附图对本发明的实施例做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
作为一种优选地,以用于中子捕获治疗的基于医学影像数据的几何模型建立方法为本发 明的实施例。下面将简单介绍一下中子捕获治疗,尤其是硼中子捕获治疗。
中子捕获治疗作为一种有效的治疗癌症的手段近年来的应用逐渐增加,其中以硼中子捕获治疗最为常见,供应硼中子捕获治疗的中子可以由核反应堆或加速器供应。本发明的实施例以加速器硼中子捕获治疗为例,加速器硼中子捕获治疗的基本组件通常包括用于对带电粒子(如质子、氘核等)进行加速的加速器、靶材与热移除系统和射束整形体,其中加速带电粒子与金属靶材作用产生中子,依据所需的中子产率与能量、可提供的加速带电粒子能量与电流大小、金属靶材的物化性等特性来挑选合适的核反应,常被讨论的核反应有7Li(p,n)7Be及9Be(p,n)9B,这两种反应皆为吸热反应。两种核反应的能量阀值分别为1.881MeV和2.055MeV,由于硼中子捕获治疗的理想中子源为keV能量等级的超热中子,理论上若使用能量仅稍高于阀值的质子轰击金属锂靶材,可产生相对低能的中子,不须太多的缓速处理便可用于临床,然而锂金属(Li)和铍金属(Be)两种靶材与阀值能量的质子作用截面不高,为产生足够大的中子通量,通常选用较高能量的质子来引发核反应。
硼中子捕获治疗(Boron Neutron Capture Therapy,BNCT)是利用含硼(10B)药物对热中子具有高捕获截面的特性,借由10B(n,α)7Li中子捕获及核分裂反应产生4He和7Li两个重荷电粒子。参照图1和图2,其分别示出了硼中子捕获反应的示意图和10B(n,α)7Li中子捕获核反应方程式,两荷电粒子的平均能量约为2.33MeV,具有高线性转移(Linear Energy Transfer,LET)、短射程特征,α粒子的线性能量转移与射程分别为150keV/μm、8μm,而7Li重荷粒子则为175keV/μm、5μm,两粒子的总射程约相当于一个细胞大小,因此对于生物体造成的辐射伤害能局限在细胞层级,当含硼药物选择性地聚集在肿瘤细胞中,搭配适当的中子射源,便能在不对正常组织造成太大伤害的前提下,达到局部杀死肿瘤细胞的目的。
本发明实施例的目的在于将医学影像数据转换为带有组织种类、密度及B-10浓度信息的MCNP晶格模型,以进行硼中子捕获治疗的组织剂量模拟计算。医学影像数据可以为核磁共振成像(Magnetic Resonance Imaging,MRI)或电子计算机断层扫描(Computed Tomography,CT),下文实施例中将基于电子计算机断层扫描(CT)的数据来阐述,CT的文件格式通常为DICOM。但本领域技术人员熟知地,还可以使用其他的医学影像数据,只要该医学影像数据能够被转换成带有组织种类、密度及B-10浓度信息的MCNP晶格模型的,就能够应用于本发明揭示的基于医学影像数据的几何模型建立方法中。
简单来说,本发明实施例揭示的基于医学影像数据的几何模型建立方法主要包括如下流程:
1、输入计算机断层影像(DICOM格式),CT影像将呈现于对应接口上;
2、自动读取DICOM档案中已定义的ROI边界,亦可另外新增ROI;
3、软件将对CT影像上每一体素点(voxel)的位置进行判别,将所有体素点分为「落于ROI边界内」及「落于ROI边界外」;
4、针对ROI边界内的体素点,可根据实际需求,由使用者手动对每一ROI定义相对的唯一组织种类及组织密度,或自动进行CT值与组织种类、密度的匹配,以避免因给定CT值涵盖范围较大的ROI(如黏膜腔室)唯一组织种类(元素组成)及密度,而造成剂量计算的误差;
5、而针对ROI边界外的体素点,则自动进行组织种类的定义,依据CT值大小差异,可区分为4或14种不同元素组成的组织,用户可根据实际判断,选择使用ICRU-46报告表列的4种组织(将在下文详述),或使用Vanderstraeten等人于2007年发表文献中的14种不同元素组成的组织(将在下文详述);
6、对于未手动定义密度的体素点,依据CT值大小差异,将自动给定密度,共可区分出96个密度分群;
7、使用者手动输入正常血液含硼药物浓度、肿瘤-血液硼浓度比值、组织-血液硼浓度比值等参数,将编写B-10元素于所有体素点中;
8、软件将整合组织种类(元素组成)、组织密度、组织B-10浓度等信息,产生三维MCNP晶格模型,并编写出MCNP输入档规定格式的晶格卡(lattice card)、栅元卡(cell card)、曲面卡(surface card)及材料卡(material card)。
具体来说,请参照图3,本发明揭示的基于医学影像数据的几何模型建立方法包括两个实施例。
本发明的第一实施例提供一种基于医学影像数据的几何模型建立方法,包括:读取医学影像数据的步骤;通过医学影像数据与组织种类之间的转换关系定义组织种类的步骤;决定组织分群数的步骤;通过医学影像数据与密度之间的转换关系定义组织密度的步骤;建立带有组织和密度信息的3D编码矩阵的步骤;产生几何模型的步骤。
根据医学影像的数据与组织种类之间的转换关系,可以根据实际需要确定组织分群数,从而更加精确地提供组织种类、元素组成及密度,建立的几何模型更加匹配于医学影像数据反应出的真实情况。
几何模型建立方法进一步包括给定B-10浓度的步骤和建立带有B-10浓度信息的3D编码矩阵的步骤。标记有B-10浓度信息的几何模型,便可清楚地知道,各个体素点内的含硼药物浓度,然后进行中子捕获治疗照射模拟时,则更加真实地反应出实际情况。
组织分群数为用户手动定义的组织分群数加上数据库中已有的4种组织分群数或14种组织分群数。如果在已有数据库中并未建立有相对应的组织分群数,那么可以根据实验情况确 定一个新的组织分群数。这样即避免了如果已有数据库中不能完全匹配相对应的组织分群数,只能近似选择的情况,从而有效地提高的建模的精确度。
几何模型建立方法进一步包括建立3D组织编码矩阵的步骤和建立3D密度编码矩阵的步骤。根据医学影像数据的切片通过相对应的转换关系,每一张切片建立相应的组织编码和密度编码,从而建立起3D组织编码矩阵和3D密度编码矩阵。
几何模型包括MCNP软件输入档所需的晶格卡、栅元卡、曲面卡和材料卡。通过医学影像数据最终获得MCNP软件输入档所需的晶格卡、栅元卡、曲面卡和材料卡,从而为模拟计算提供理论依据并获得精确的模拟计算结果。
本发明的第二实施例提供一种基于医学影像数据的几何模型建立方法,包括:读取医学影像数据的步骤;定义或读取ROI边界的步骤;判断医学影像体素是否在ROI边界内的步骤:如果是,则进入通过为每个ROI边界内体素给定一个特定组织与密度的方式进行用户手动定义组织种类与密度的步骤或或进入通过医学影像数据与组织种类/密度之间的转换关系自动定义ROI组织种类与密度的步骤,如果否,则进入通过医学影像数据与组织种类之间的转换关系自动定义组织种类的步骤并通过医学影像数据与密度之间的转换关系定义组织密度的步骤;建立带有组织和密度信息的3D编码矩阵的步骤;产生几何模型的步骤。
所谓ROI是指感兴趣区域,用户可以手动定义ROI的组织种类、元素组成以及密度。如果不在ROI边界内,根据医学影像的数据与组织种类/密度之间的转换关系进行组织种类的定义,并根据实际需要确定组织分群数,从而更加精确地提供组织种类、元素组成及密度,建立的几何模型更加匹配于医学影像数据反应出的真实情况。
几何模型建立方法包括给定B-10浓度的步骤和建立带有B-10浓度信息的3D编码矩阵的步骤。标记有B-10浓度信息的几何模型,便可清楚地知道,各个体素点内的含硼药物浓度,然后进行中子捕获治疗照射模拟时,则更加真实地反应出实际情况。
组织分群数为用户手动定义的组织分群数加上数据库中已有的4种组织分群数或14种组织分群数。如果单一ROI边界内涵盖CT值范围较大(如黏膜腔室),则可自动进行CT值与组织种类、密度的匹配,以避免因给定唯一组织种类(元素组成)及密度,而造成剂量计算的误差。如果在已有数据库中并未建立有相对应的组织分群数,那么可以根据实验情况确定一个新的组织分群数。这样即避免了如果已有数据库中不能完全匹配相对应的组织分群数,只能近似选择的情况,从而有效地提高的建模的精确度。
几何模型建立方法进一步包括建立3D组织编码矩阵的步骤和建立3D密度编码矩阵的步 骤。根据医学影像数据的切片通过相对应的转换关系,每一张切片建立相应的组织编码和密度编码,从而建立起3D组织编码矩阵和3D密度编码矩阵。
几何模型包括MCNP软件输入档所需的晶格卡、栅元卡、曲面卡和材料卡。通过医学影像数据最终获得MCNP软件输入档所需的晶格卡、栅元卡、曲面卡和材料卡,从而为模拟计算提供理论依据并获得精确的模拟计算结果。
请参照图4,下面将阐述本发明揭示的基于医学影像数据的几何模型建立方法中已有数据库中的CT值-组织种类及CT值-组织密度转换关系图表。
CT值,又称为Hounsfield Unit(HU),为反应光衰减系数之单位,其定义如公式一:
公式一
引用Vanderstraeten等人于2007年发表之文献(Barbara Vanderstraeten et al,“Convension of CT numbers into tissue parametersfor Monte Carlo dose calculations:a multi-centre study”,Phys.Med.Biol.52(2007)539–562.),依据CT值大小不同,可转换出1种空气(air)、1种肺组织(lung)、2种软组织(脂肪(adipose)及肌肉软组织(muscle))、10种骨组织(bone),换言之,不同CT值共对应出14种不同元素组成的组织,如下表一。
表一.CT值对应14种不同元素组成的组织(元素重量百分比)
引用ICRU-46号报告(International Commission on Radiation Units and Measurements,Photon,electron,proton and neutron interaction data for body tissues,ICRU-46,Tech.Rep.,1992.),撷取4种人体脑部主要组织,包含空气(air)、脑组织(adult brain)、皮肤(adult skin)、头骨(cranium),其对应之密度与元素组成如表二。
表二.CT值对应4种不同元素组成的组织(元素重量百分比)
同样引用Vanderstraeten等人的文献,该份文献统整了医院真实的实验值,整理出CT值对应组织密度的关系公式,如图4所示;本发明揭示的基于医学影像数据的几何模型建立方法使用图4的三组回归公式,将CT值(-1000~2000)区分为96组密度分群,如表三。
表三.CT值与质量密度的转换.HUL和HUU分别为CT值的下限和上限
本发明实施例中的有益效果和/或特点如下:
1、手动定义感兴趣区域(ROI)的组织种类、元素组成及密度;
2、针对非ROI的CT影像体素点,可自动进行组织种类匹配,依据CT值大小差异,已有数据库可区分出4种或14种不同元素组成的组织,也可以根据实际的实验结果确定其他数别的不同元素组成的组织;
3、对于CT值涵盖较广范围的ROI,如黏膜腔室,难以给定唯一的组织元素组成与密度,用户可根据本发明实施例揭示的方法自动进行CT值与组织/密度的转换;
4、经输入正常血液含硼药物浓度、组织/肿瘤-血液硼浓度比值等参数后,本发明实施例揭示的方法自动将B-10元素编写入所有体素点中;
5、最终产生的三维MCNP晶格模型将带有组织种类(元素组成)、密度和B-10浓度等信息。
尽管上面对本发明说明性的具体实施方式进行了描述,以便于本技术领域的技术人员理解本发明,但应该清楚,本发明不限于具体实施方式的范围,对本技术领域的普通技术人员来讲,只要各种变化在所附的权利要求限定和确定的本发明的精神和范围内,这些变化是显而易见的,都在本发明要求保护的范围之内。
- 还没有人留言评论。精彩留言会获得点赞!