半胱胺在治疗由酵母菌/霉菌引起的感染中的用途的制作方法
本发明涉及半胱胺及其衍生物在治疗和/或预防由酵母菌和/或霉菌引起的感染中的用途。
发明背景
在一般群体和具有绝大多数由曲霉菌属(Aspergillus species)和念珠菌属(Candida species)引起的感染的免疫抑制患者中,侵袭性真菌感染的频率在过去二十年中持续提高(Pasqualotto,A.C.和Denning,D.W.(2005)Diagnosis of Invasive Fungal Infections–Current Limitations of Classical and New Diagnostic Methods.Euro Oncol Rev)。这些感染具有高死亡率,并且对医疗保健系统造成沉重负担。仍然迫切需要更有效的和更安全的用来治疗和预防由酵母菌和霉菌(包括例如念珠菌属(Candida spp.)或曲霉菌属(Aspergillus spp.))引起的感染的治疗剂。
发明概述
根据本发明的第一方面,提供了用于治疗或预防由酵母菌和/或霉菌引起的感染的半胱胺或其衍生物(或包含半胱胺和/或其衍生物的组合物)。
本发明是基于以下令人惊讶的发现:半胱胺和/或其衍生物在治疗或预防酵母菌和霉菌感染,合适地为真菌感染,如曲霉菌和/或念珠菌感染中具有特别的用途。
合适地,感染可以是真菌感染或由真菌感染引起的疾病,例如念珠菌感染和/或曲霉菌感染。合适地,感染可以由酵母菌和/或霉菌引起。合适地,感染可以是由以下中的一种或多种引起的感染:念珠菌属(例如白色念珠菌(C.albicans)),表皮癣菌属(Epidermophyton spp.),外瓶柄霉菌属(Exophiala spp.),小孢霉属(Microsporum spp.),发癣菌属(Trichophyton spp.)(例如红色发癣菌(T.rubrum)和趾间发癣菌(T.interdigitale)),癣属(Tinea spp.),曲霉菌属(Aspergillus spp.),芽生菌属(Blastomyces spp.),芽生裂殖菌属(Blastoschizomyces spp.),球孢子菌属(Coccidioides spp.),隐球菌属(Cryptococcus spp.)(例如新型隐球菌(Cryptococcus neoformans),组织胞浆菌属(Histoplasma spp.),副球孢子菌属(Paracoccidiomyces spp.),孢子丝菌属(Sporotrix spp.),犁头霉属(Absidia spp.),支孢霉属(Cladophialophora spp.),产色芽生菌属(Fonsecaea spp.),瓶霉菌属(Phialophora spp.),Lacazia属,爪甲白癣菌属(Arthrographis spp.),支顶孢菌属(Acremonium spp.),马都拉放线菌属(Actinomadura spp.),鳞质霉属(Apophysomyces spp.),伊蒙菌属(Emmonsia spp.),团担子菌属(Basidiobolus spp.),白僵菌属(Beauveria spp.),金孢子菌属(Chrysosporium spp.),耳霉属(Conidiobolus spp.),小克银汉霉属(Cunninghamella spp.),镰刀菌属(Fusarium spp.),地霉属(Geotrichum spp.),粘束孢属(Graphium spp.),小球腔菌属(Leptosphaeria spp.),马拉塞霉菌属(Malassezia spp.)(例如糠秕马拉塞霉菌(Malassezia furfur)),毛霉菌属(Mucor spp.),新龟甲属(Neotestudina spp.),诺卡尔菌属(Nocardia spp.),诺卡尔土壤菌属(Nocardiopsis spp.),拟青霉属(Paecilomyces spp.),茎点霉属(Phoma spp.),毛孢子菌属(Piedraia spp.),肺孢子虫属(Pneumocystis spp.),伪霉样真菌属(Pseudallescheria spp.),核菌属(Pyrenochaeta spp),根毛霉属(Rhizomucor spp.),根霉属(Rhizopus spp.),红酵母属(Rhodotorula spp.),酵母菌属(Saccharomyces spp.),足放线病菌属(Scedosporium spp.),帚霉属(Scopulariopsis spp.),掷孢酵母属(Sporobolomyces spp.),共头霉属(Syncephalastrum spp.),木霉属(Trichoderma spp.),毛孢子菌属(Trichosporon spp.),单格孢属(Ulocladium spp.),黑粉菌属(Ustilago spp.),轮枝孢菌属(Verticillium spp.),万吉拉菌属(Wangiella spp.)。
合适地,感染可由念珠菌属(例如白色念珠菌)引起。
合适地,感染可以由曲霉属(例如烟曲霉菌(Aspergillus fumigatus))引起。
合适地,感染可以由外瓶柄霉菌属(例如皮炎外瓶霉(Exophiala dermatitidis))引起。
合适地,感染可以由隐球菌属引起。
另一方面,本发明提供了半胱胺或其衍生物或包含半胱胺和/或其衍生物的药物组合物,其用于预防或治疗以下中的任意一种或多种:念珠菌病(包括OPC),囊胞性纤维症,曲霉菌病(包括支气管肺曲霉菌病,慢性肺曲霉菌病和曲霉病),足癣;蛙粪霉病(basidiodiabolomycosis);芽生菌病;球孢子菌病,隐球菌病(cryptoccocis),慢性阻塞性肺疾病(COPD);基底脑膜炎(basal meningitis);皮肤真菌病;甲真菌病(onchomycosis);皮霉癣菌病(dermatophytids);毛内癣菌病(endothrix);毛外癣菌病(exothrix);真菌性脑膜炎,真菌血症,肺气肿(heaves);组织胞浆菌病,霉菌病,肉芽霉病(myrinogmycosis),副球孢子菌病(paracoccidioidomycosis),青霉病,毛孢子菌病(piedra),肺孢子菌肺炎(pneumocytosis pneumonia),孢子丝菌病(sporptrichosis),癣,zeospora和接合菌病。COPD包括肺部疾病,肺部疾病包括慢性支气管炎,肺气肿和慢性阻塞性气道疾病。
合适地,该组合物可以是包含药学上可接受的载体、赋形剂或稀释剂的药物组合物。
合适地,该组合物可以进一步包含抗生素或抗真菌剂。合适地,抗生素可以选自:妥布霉素、粘菌素、庆大霉素或环丙沙星。合适地,抗生素可以是妥布霉素。抗真菌剂可以是氟康唑、伊曲康唑、卡泊芬净和两性霉素B中的一种或多种。
优选地,组合物还包含抗真菌剂。优选地,所述组合物还用于治疗由外瓶柄霉菌属引起的感染。
合适地,半胱胺可以与修饰肽组合使用。
如本文所用,术语“修饰肽”是指包含3至50个α,D和/或L氨基酸的肽,其中所述氨基酸主要是精氨酸,并且其中所述肽任选地还包含选自以下中的一种或多种的修饰:
1)组氨酸标签的掺入;
2)脂质化;和
3)聚乙二醇化。
合适地,组氨酸标签可以包含至少两个组氨酸残基。
在另外的或可选的方面中,本发明的任选的修饰肽可以是脂质化的肽,使得脂肪酸结合(conjugate)到肽。
合适地,脂肪酸可以是C2至C20脂肪酸。优选地,脂肪酸可以是C3至C14。
在另一个另外的或可选的方面中,本发明的任选的修饰肽可以是聚乙二醇化的。
合适地,本发明的组合物还可以包含含有3-500个氨基酸的肽,其中氨基酸主要是精氨酸。
另一方面,本发明提供了治疗或预防受试者的由酵母菌或霉菌引起的感染的方法,该方法包括给予药学有效量的包含半胱胺或其衍生物的组合物。
合适地,感染可以由以下中的一种或多种引起:念珠菌属(例如白色念珠菌),曲霉菌属(Aspergillus spp.),表皮癣菌属(Epidermophyton spp.),外瓶柄霉菌属(Exophiala spp.),小孢霉属(Microsporum spp.),发癣菌属(Trichophyton spp.)(例如红色发癣菌(T.rubrum)和趾间发癣菌(T.interdigitale)),癣属(Tinea spp.),芽生菌属(Blastomyces spp.),芽生裂殖菌属(Blastoschizomyces spp.),球孢子菌属(Coccidioides spp.),隐球菌属(Cryptococcus spp.)(例如新型隐球菌(Cryptococcus neoformans),组织胞浆菌属(Histoplasma spp.),副球孢子菌属(Paracoccidiomyces spp.),孢子丝菌属(Sporotrix spp.),犁头霉属(Absidia spp.),支孢霉属(Cladophialophora spp.),产色芽生菌属(Fonsecaea spp.),瓶霉菌属(Phialophora spp.),Lacazia属,爪甲白癣菌属(Arthrographis spp.),支顶孢菌属(Acremonium spp.),马都拉放线菌属(Actinomadura spp.),鳞质霉属(Apophysomyces spp.),伊蒙菌属(Emmonsia spp.),团担子菌属(Basidiobolus spp.),白僵菌属(Beauveria spp.),金孢子菌属(Chrysosporium spp.),耳霉属(Conidiobolus spp.),小克银汉霉属(Cunninghamella spp.),镰刀菌属(Fusarium spp.),地霉属(Geotrichum spp.),粘束孢属(Graphium spp.),小球腔菌属(Leptosphaeria spp.),马拉塞霉菌属(Malassezia spp.)(例如糠秕马拉塞霉菌(Malassezia furfur)),毛霉菌属(Mucor spp.),新龟甲属(Neotestudina spp.),诺卡尔菌属(Nocardia spp.),诺卡尔土壤菌属(Nocardiopsis spp.),拟青霉属(Paecilomyces spp.),茎点霉属(Phoma spp.),毛孢子菌属(Piedraia spp.),肺孢子虫属(Pneumocystis spp.),伪霉样真菌属(Pseudallescheria spp.),核菌属(Pyrenochaeta spp),根毛霉属(Rhizomucor spp.),根霉属(Rhizopus spp.),红酵母属(Rhodotorula spp.),酵母菌属(Saccharomyces spp.),足放线病菌属(Scedosporium spp.),帚霉属(Scopulariopsis spp.),掷孢酵母属(Sporobolomyces spp.),共头霉属(Syncephalastrum spp.),木霉属(Trichoderma spp.),毛孢子菌属(Trichosporon spp.),单格孢属(Ulocladium spp.),黑粉菌属(Ustilago spp.),轮枝孢菌属(Verticillium spp.),万吉拉菌属(Wangiella spp.)。
合适地,感染可由念珠菌属或曲霉属引起。
合适地,感染可以由外瓶柄霉菌属引起。
另一方面,本发明提供了预防或治疗患者的以下中的任意一种或多种的方法:念珠菌病(包括OPC),囊胞性纤维症,曲霉菌病(包括支气管肺曲霉菌病,慢性肺曲霉菌病和曲霉病),足癣;蛙粪霉病(basidiodiabolomycosis);芽生菌病;球孢子菌病,COPD,隐球菌病;基底脑膜炎(basal meningitis);皮肤真菌病;甲真菌病(onchomycosis);皮霉癣菌病(dermatophytids);毛内癣菌病(endothrix);毛外癣菌病(exothrix);真菌性脑膜炎,真菌血症,肺气肿(heaves);组织胞浆菌病,霉菌病,肉芽霉病(myrinogmycosis),副球孢子菌病(paracoccidioidomycosis),青霉病,毛孢子菌病(piedra),肺孢子菌肺炎(pneumocytosis pneumonia),孢子丝菌病(sporptrichosis),癣,zeospora和接合菌病,该方法包括给予患者包含药学有效量的半胱胺或其衍生物的组合物。
合适地,本发明的组合物可以是包含药学上可接受的载体、赋形剂或稀释剂的药物组合物。
合适地,本发明的组合物可以包含抗生素,如选自以下中的一种或多种:妥布霉素、粘菌素、庆大霉素或环丙沙星。
合适地,组合物可以包含含有3至50个α,D和/或L氨基酸的肽,其中所述氨基酸主要是精氨酸,并且其中所述肽任选地还包含选自以下中的一种或多种的修饰:
1)组氨酸标签的掺入;
2)脂质化;和
3)聚乙二醇化。
合适地,组合物可以包含含有3-500个氨基酸的肽,其中所述氨基酸主要是精氨酸。
详述
本发明提供用于治疗或预防由酵母菌和/或霉菌引起的感染的半胱胺或其衍生物(或包含半胱胺和/或其衍生物的组合物)。
术语“包含半胱胺和/或其衍生物的组合物”包括将半胱胺和/或其衍生物任选地与其它未限定的成分组合使用。使用的术语“组合物包含”可以任选地被“基本上由...组成”或“由...组成”代替。
半胱胺衍生物的实例包括:2-甲硫基乙胺(肉桂酸酯),2-甲硫基乙基脲,N-(2-甲硫基乙基)对乙酰胺基苯甲酰胺,2-氨基乙硫醇,N-(2-甲硫基乙基)对乙酰胺基苯磺酰胺,N-(2-丙硫基乙基)-对甲氧基苯甲酰胺,N-(丁硫基乙基)烟酰胺,N-(2-十二烷基硫基乙基)对丁氧基苯甲酰胺,N-(2-甲硫基乙基)对甲苯磺酰胺,N-(2-异丙基硫基乙基)丙酰胺,N-(2-辛基硫基乙基)乙酰胺,N-(2-丁硫基乙基)甲烷磺酰胺,N-(2-异戊基硫基乙基)丁烷,双1,4(2-乙酰胺基乙硫基),2,3-丁二醇,2-十六烷基硫基乙胺盐酸盐,2-烯丙基硫基乙胺苹果酸盐,9-十八烯2-基硫基乙胺盐酸盐,2-十二烷基硫基乙胺盐酸盐,2-异戊基硫基乙胺扁桃酸盐,2-十八烷基硫基乙胺水杨酸盐,2-β-羟乙基硫基乙基脲,2-β-羟乙基硫基乙胺盐酸盐,2-(2,3-二羟基丙硫基)乙胺对甲苯磺酸盐,2-(2-羟基丙硫基)乙胺草酸盐,N-(2-甲硫基乙基)苯基乙酰胺,2-(2,2-二甲氧基乙硫基)乙胺盐酸盐,2-(2,2-二甲氧基乙硫基)乙胺十一碳烯酸盐,2-(2,2-二乙氧基乙硫基)乙胺十一碳烯酸盐,2-(2,2-二乙氧基乙硫基)乙胺乙酸盐,2-十一碳烯基硫基乙胺,2-β-脲基乙硫基乙胺盐酸盐,2-β-乙酰胺基乙硫基乙胺托品酸盐,2,2'-硫基二乙胺富马酸盐,2,2'-硫基二乙脲,3-β-氨基乙硫基丙胺盐酸盐,S-β-脲基乙基硫基氨基甲酸酯,2-乙氧基羰基硫基乙胺盐酸盐,2-二甲氨基羰基硫基乙胺硫酸盐,2-丁氧基羰基甲硫基乙基脲,2-乙氧基羰基甲硫基乙胺盐酸盐,6-β-氨基乙硫基己酸甲酯盐酸盐(6-.beta.-aminoethylthio hexanoate of methyl hydrochloride),5-β-氨基乙硫基戊酸,2-苯硫基乙胺磷酸二氢盐,2-对叔丁基苯硫基乙胺三氯乙酸盐,2-对甲氧基苯硫基乙胺二酒石酸盐,2-甲苯基硫基乙胺氢溴酸盐,2-(1-联苯硫基)乙胺盐酸盐,2-N-五氯苯硫基乙基乙酰胺,2-苄硫基乙胺苹果酸盐,2-苄硫基乙胺烟酸盐,2-苄硫基2-甲基丙胺盐酸盐,2-苄硫基丙胺乳酸盐,N-(2-苄硫基乙基)烟酰胺盐酸盐,N-(2-苄硫基乙基)10-十一烯酰胺,N-(2-苄硫基乙基)十六酰胺,S-β-氨乙基巯基丁酸,N-(2-苄硫基乙基)甲酰胺,N-(2-苄硫基乙基)苯基乙酰胺,N-[2-(2,6-二甲基苯基)乙基]己酰胺,2-邻氨基苯硫基乙胺琥珀酸盐,N-(2-苄硫基乙基)谷氨酰胺,S-β-氨基乙基巯基乙酸,(3-S-β-氨基乙基)巯基丙酸,(3-S-γ-氨基丙基)巯基乙酸,S(2-对甲氧基苯甲酰胺基乙基)巯基2-(2-萘基甲硫基)乙胺盐酸盐,2-(2-萘基甲硫基)乙胺二琥珀酸盐,(2-噻吩甲基)2-硫基乙胺氢溴酸盐,2-N-乙酰基(2-噻吩甲基硫基-乙胺,2-邻氯苄硫基乙胺盐酸盐,2-对氯苄硫基乙胺乙醇酸盐,2-邻氟苄硫基乙胺盐酸盐,2-糠基硫基乙胺盐酸盐,2-四氢糠基硫基乙胺对氨基苯甲酸盐,2-β-苯乙基硫基乙胺谷氨酸盐,2-二苯基甲硫基乙胺盐酸盐,2-三苯基甲硫基乙胺盐酸盐半水合物,2-(2-吡啶基乙硫基)乙胺盐酸盐,2-(2-对甲苯磺酰胺基乙硫基)吡啶N-氧化物,2-β-氨基乙硫基甲基吡啶N-氧化物二盐酸盐,2-β-氨基乙硫基吡啶N-氧化物盐酸盐,2,4-二氯-2-苄硫基乙胺天冬氨酸盐,N-[2-(3,4-二氯苄硫基)乙基]丁酰胺,N-[2-(2,6-二氯苄硫基)乙基]十二酰胺,N-[2-(3,5-二氯苄硫基)乙基]三氟乙酰胺盐酸盐,2-对乙氧基苄硫基乙胺盐酸盐,N-[2-间氟苄硫基乙基]氯乙酰胺,2-对溴苄硫基乙胺琥珀酸盐,2-(3,4-二甲氧基苄硫基)乙胺苹果酸盐,2-(3,4-亚甲二氧基苄硫基)乙胺盐酸盐,2-(2,4-二氯十六烷基硫基)乙胺,2(3,4,5-三甲氧基苄硫基)乙胺氢化肉桂酸盐(2(3,4,5-trimethoxy benzylthio)ethylamine hydrocinnamate),2-对甲氧基苄硫基乙胺水杨酸盐,2-邻甲基苄硫基乙胺苯基乙酸盐,N-[2-对二甲基氨基苄硫基乙基]甲烷磺酰胺,2-对苯氧基苄硫基乙胺盐酸盐,2-β-氨基乙硫基吡啶盐酸盐,2-苄硫基乙胺柠檬酸盐,N-[2-苄硫基乙基]2,4-二羟基3,3-二甲基丁酰胺,N-(2-苄硫基乙基)6,8-二羟基7,7-二甲基5-氧代-4-氮杂辛酰胺,N-[2-(2-吡啶硫基)乙基]丙酰胺,2-(2-吡啶基甲硫基)乙胺二盐酸盐,2-苄硫基乙胺泛酸盐,S-(β-乙酰氨基乙基)巯基乙酸β-吗啉代乙酯(S-(.beta.-acetamidoethyl)mercaptoacetate of beta.-morpholinoethyl),S-(β-苯基乙酰胺基乙基)巯基乙酸N'-甲基2-哌嗪基乙酯,S-(β-脲基乙基)巯基乙酸β吡咯烷基乙酯,S-(β-三氟乙酰胺基乙基)-β-巯基丙酸β-二甲氨基乙酯,2-对硝基苄硫基乙胺巴豆酸盐,2-β-吗啉代羰基乙硫基乙胺盐酸盐,N,N-二(羟乙基)S-(β-苄酰氨基-乙基)巯基乙酰胺(N,N-di(hydroxyethyl)S-(.beta.-benzamido-ethyl)mercapto-acetamido),N[2-N'-甲基哌嗪基羰基硫基乙基]乙酰胺,2-(1-萘基硫基)乙胺盐酸盐,N-(3-β-脲基乙硫基丙基)琥珀酰胺酸,3-烯丙基硫基丙胺,3-(2,2'-二甲氧基乙硫基)丙胺,3-(2,2'-二甲氧基乙硫基)丙胺硫酸盐,S-β-氨基乙基巯基乙酸,S-β-氨基乙基巯基乙酸的盐酸盐,N-(2-苄硫基乙基)乙酰胺,N-(2-苄硫基乙基)丙酰胺,N-(2-苄硫基乙基)丁酰胺,N-(2-苄硫基乙基)甲磺酰胺,N-(2-苄硫基乙基)丁磺酰胺,N-(2-苄硫基乙基)甲磺酰胺,N-(2-苄硫基乙基)乙磺酰胺,N-(2-苄硫基乙基-丙磺酰胺,N-(2-苄硫基乙基)丁磺酰胺,S-(2-对乙酰胺基苯磺胺基乙基)巯基乙酸,S-(2-对乙酰胺基苯甲酰胺基乙基)巯基乙酸,N-(2-噻吩甲基硫基乙基)乙酰胺,2-苄硫基丙胺,2-苄硫基2-甲基丙胺,2-(2-对甲苯磺酰胺基乙硫基)吡啶N-氧化物,S-(2-对丁氧基苄酰胺基乙基)巯基乙酸,2-叔丁基硫基乙胺盐酸盐,2-甲氧基羰基甲硫基乙胺盐酸盐,2-乙氧羰基甲硫基乙胺盐酸盐,2-丙氧基羰基甲基硫基乙胺盐酸盐,2-丁氧基羰基甲硫基乙胺盐酸盐,2,2'-硫基二乙胺二盐酸盐,3-(2-氨基乙硫基)丙氨酸盐酸盐,2-苄硫基乙基铵二酸磷酸盐(2-benzylthio ethylammonium diacid phosphate),2-甲硫基乙胺,N-(甲硫基乙基)对乙酰胺基苄酰胺,N-(2-甲硫基乙基)烟酰胺,N-(2-甲硫基乙基)苄酰胺,N-(2-甲硫基乙基)对丁氧苄酰胺,N-(2-甲硫乙基)丁酰胺,N-(2-甲硫基乙基)丙酰胺,N-(2-甲硫基乙基)乙酰胺,N-(2-甲硫基乙基)丁磺酰胺,N-(2-辛硫基乙基)甲磺酰胺,2-十六烷基硫基乙胺盐酸盐,2-(2-羟基乙硫基)乙胺盐酸盐,2-甲硫基乙胺苯乙酸盐和2-甲硫基乙胺十一碳烯酸盐。
任选的修饰肽
本发明的组合物还可以包含含有3至50个D和/或L氨基酸的修饰肽,其中所述氨基酸主要是精氨酸,并且其中所述肽包含选自以下中的一种或多种的修饰:
1)组氨酸标签的掺入;
2)脂质化;和
3)聚乙二醇化。
组氨酸标签的掺入
一方面,当使用修饰肽时,优选在N末端或C末端包含组氨酸标签。有利地,组氨酸的存在可以增强肽对真菌感染如念珠菌的有效性。考虑到当与不存在组氨酸标签的相当的肽相比较时,阳离子电荷在这样的pH范围内可以不被显著地改变,这是极其意外的。
合适地,组氨酸标签可以包含至少两个组氨酸残基。优选地,组氨酸残基的数目可以高达10个。例如,组氨酸标签可以由1至10个,优选2至6个组氨酸残基组成。在一个实施方案中,组氨酸标签可以由两个组氨酸残基组成。
有利地,组氨酸标签的存在对于治疗口腔真菌感染,诸如口咽念珠菌病可以是特别有用的。
口腔在疾病状态下具有5.5至7的pH,而当不进食时,健康口腔的正常口pH为约7。然而,pH影响AMP的电荷。此外,分泌的唾液也含有有助于肽分解的蛋白酶。
本发明人已令人惊讶地发现,经修饰以包含组氨酸标签的本发明的肽特别适合克服与口服给药相关的pH和蛋白酶难题。
因此,包含组氨酸标签的修饰肽可以包含在适于口服给药的药物制剂中。
适当地,用于本发明的药物组合物中的肽,本发明的治疗或预防方法和本发明的第二医疗用途可以在给药途径或预期给药途径是口服给药时包含组氨酸标签。
优选地,本发明的药物组合物的pH在pH 5.5至6.5的范围内。
脂质化
一方面,当用于本发明的组合物中时,修饰肽是脂质化的。例如,脂质可以与包含3至50个D和/或L氨基酸的肽结合,其中所述氨基酸主要是精氨酸。
本发明已令人惊讶地发现,肽的脂质化可有利地拓宽肽针对微生物的活性谱(spectrum of activity)和/或增强肽针对某些微生物感染的活性。
合适地,本发明的脂质化肽可用于治疗或预防酵母菌和霉菌感染(优选例如念珠菌和/或曲霉菌感染,优选曲霉菌感染)。已经令人惊讶地发现,所要求保护的肽的脂质化可赋予这些脂质化的肽有效的活性。
因此,本发明的修饰肽可以包含可以在C末端、N末端的脂质,或侧面连接(flank)氨基酸残基的脂质。
合适地,本发明的肽可以包含C3至C20脂肪酸,优选C4至C14脂肪酸,优选C8至C14脂肪酸,优选C12脂肪酸。
合适地,本发明的修饰肽可以包含3至50个氨基酸和C3至C20脂肪酸,优选C4至C14脂肪酸,优选C8至C14脂肪酸,优选C12脂肪酸。优选地,本发明的修饰肽可以包含6至50个氨基酸和C3至C20脂肪酸,优选C4至C14脂肪酸,优选C8至C14脂肪酸,优选C12脂肪酸。
一方面,脂肪酸可以在任一侧侧面连接氨基酸残基。已经令人惊讶地发现,脂肪酸的侧面连接可导致溶血活性的降低。
另一方面,脂肪酸可以位于肽的末端上。已经令人惊讶地发现,就较低的MIC而言,这可以增加肽的抗微生物效果。
在一个优选的实施方案中,脂肪酸是C12脂肪酸。有利地,该长度的脂肪酸表现出良好的抗微生物效果并且另外具有低的细胞毒性和溶血活性。
聚乙二醇化的肽
一方面,本发明的修饰肽是聚乙二醇化的肽。
有利地,这样的聚乙二醇化的肽具有增强的稳定性,同时仍提供抗微生物效果。
合适地,PEG组分的尺寸可以为约300Da至约40KDa。
氨基酸残基
如果用于本发明的组合物中,则该肽可以包含3至50个(优选连续的)氨基酸。
合适地,肽可以包含至少3或至少4或至少5或至少6或至少7或至少8或至少9或至少10或至少12或至少15或至少20或至少25或至少30或至少35或至少40或至少45个氨基酸。
合适地,肽可以包含少于50或少于45或少于40或少于35或少于30或少于25或少于0或少于15个的氨基酸。
一方面,在上述范围内涉及的氨基酸残基数目不包含组氨酸标签残基。因此,一方面,当确定修饰肽中氨基酸的编号时,在肽的任一端的组氨酸残基不被计数(discount)。另一方面,包括组成组氨酸标签的那些氨基酸残基的所有氨基酸残基被计数。
在本发明的优选方面中,所述肽包含3至20个(优选连续的)氨基酸,例如3至16个氨基酸。进一步优选地,肽包含5至14个氨基酸。在一些方面,肽可以包含12个(优选连续的)氨基酸。
正如技术人员所知的,主要根据氨基酸侧链的化学和物理性质,可以将氨基酸分为不同的类别。例如,一些氨基酸通常被认为是亲水性或极性氨基酸,而其它的则被认为是疏水性或非极性氨基酸。疏水性氨基酸可以选自由甘氨酸、亮氨酸、苯丙氨酸、脯氨酸、丙氨酸、色氨酸、缬氨酸、异亮氨酸、蛋氨酸、酪氨酸以及苏氨酸组成的疏水氨基酸组;阳离子氨基酸可以选自由鸟氨酸、组氨酸、精氨酸和赖氨酸组成的组。本发明使用的术语“疏水性”和“阳离子的”可以是指疏水性大于或等于-1.10和/或如Fauchere和Pliska Eur.J.Med Chem.10:39,1983所描述的方法,净电荷大于或等于0的氨基酸。疏水性或非极性氨基酸也可以指具有在生理pH下不带电荷的非极性侧链的氨基酸,并且该侧链通常与水溶液不相容。氨基酸可以是天然的或合成的。
合适地,精氨酸残基是肽中的主要氨基酸。合适地,至少50%的氨基酸残基是精氨酸残基,优选肽中至少60%或至少70%或至少80%的氨基酸是精氨酸。优选地,至少90%是精氨酸残基。在一些实施方案中,肽中的所有氨基酸是精氨酸残基(任选地除组氨酸标签外)。
合适地,肽可以包含除精氨酸以外的、非优势量的氨基酸。例如,可以使用组氨酸、鸟氨酸和赖氨酸。
合适地,3至50个(优选连续的)D和/或L氨基酸由精氨酸或精氨酸和赖氨酸残基的组合组成,除了对精氨酸或赖氨酸以外的氨基酸残基的0、1或2个取代以外。优选地,这种取代(如果存在)是对选自组氨酸、鸟氨酸和赖氨酸的另一种阳离子氨基酸的取代。优选地,对赖氨酸进行取代。
合适地,所述肽可以被0、1、2、3、4、5、6、7或8个取代基取代,条件是精氨酸占肽的至少60%,优选至少75%。
优选地,氨基酸是L-氨基酸。
在本发明的优选方面中,肽中至少90%,例如至少95%,诸如97-99%或甚至100%的氨基酸是L-氨基酸。
本发明也包括上述氨基酸的已知异构体(结构异构体、立体异构体、构象和构型异构体),肽模拟物(peptidomimetics)以及结构类似物,以及天然修饰的(例如翻译后修饰)或化学修饰的、包括但不限于磷酸化、糖基化、磺酰化和/或羟基化的那些。
一般来说,本发明的肽不包括以下氨基酸:天冬氨酸、谷氨酸、天冬酰胺、谷氨酰胺或丝氨酸,但是即使这些氨基酸存在,本发明的某些肽仍可以具有生物活性。
肽的一个或多个残基可以被交换成另一个,以改变、增强或保留肽的生物活性。这样的变体可以具有例如至少约10%的相应的非变体肽的生物活性。经常使用保守性氨基酸,即上述具有相似的化学和物理性质的氨基酸的替换。因此,例如保守性氨基酸替换可以包括赖氨酸交换精氨酸、鸟氨酸或组氨酸;或者精氨酸交换赖氨酸或异亮氨酸,鸟氨酸交换组氨酸;或者一种疏水性氨基酸交换另一种。在进行替换后,筛选变体的生物学活性。
肽
在通常的术语中,本发明使用的术语“肽”是指通过肽键连接起来的多个氨基酸残基。该术语可以与多肽和蛋白质互换使用,并且意义相同。
术语“修饰肽”是指包含3至50个氨基酸残基,主要是精氨酸的肽,肽还包含:组氨酸标签;和/或脂肪酸和/或聚乙二醇化的肽。合适地,本发明的修饰肽可以是线性肽。
优选地,本发明的修饰肽可以由以下组成:
1)主要是精氨酸的3至50个氨基酸残基和组氨酸标签;
2)主要是精氨酸的3至50个氨基酸残基和一个或多个脂肪酸;
3)主要是精氨酸的3至50个氨基酸残基,组氨酸标签和一种或多种脂肪酸;
4)主要是精氨酸的3至50个氨基酸残基的聚乙二醇化的肽和组氨酸标签;
5)主要是精氨酸的3至50个氨基酸残基的聚乙二醇化的肽和一种或多种脂肪酸;或
6)主要是精氨酸的3至50个氨基酸残基的聚乙二醇化的肽、组氨酸标签和一种或多种脂肪酸。
肽通常可以是合成的肽。肽可以是分离的、纯化的肽或者其变体,这些可以是体外合成的,例如通过固相肽合成方法、通过酶催化的肽合成或者借助重组DNA技术。
为了鉴定对哺乳动物细胞具有很小或者没有不希望的毒性的活性肽,可以制备单一的肽或肽文库(libraries of peptides),并且可以筛选单一的肽或来自这些肽文库的肽的抗微生物活性和毒性,包括但并不限于抗真菌、抗细菌、抗病毒、抗原生动物、抗寄生虫活性以及毒性。
本发明的肽可以以不同形式存在,如游离酸、游离碱、酯和其它前药、盐或互变异构体,例如,并且本发明包括了化合物所有的变体形式。
因此,本发明包括了本发明的肽或肽变体的盐或前药。
给药
本发明的组合物可以以药学上可接受的盐的形式给药。本发明的药学上可接受的盐可以通过常规化学方法由母体肽合成,该母体肽包含碱性或酸性部分。一般来说,这些盐是通过在水或在有机溶剂、或两者的混合物中,游离酸或碱形式的肽与化学计量的适合的碱或酸反应来制备的;通常,非水介质如醚、乙酸乙酯、乙醇、异丙醇或乙腈是优选的。适合的盐类的列表见于Remington's Pharmaceutical Sciences,17th ed.,Mack Publishing Company,Easton,Pa.,US,1985,p.1418,在此通过引用将其公开内容并入;还参见Stahl等编的“Handbook of Pharmaceutical Salts Properties Selection and Use”,Verlag Helvetica Chimica Acta和Wiley-VCH,2002。
因此,本发明包括了本发明的组合物的药学上可接受的盐,其中通过制备母体化合物的酸或碱的盐对其进行修饰,所述盐例如常规的无毒盐或者由无机或有机酸或碱形成的季铵盐。这样的酸加成盐的例子包括醋酸盐、己二酸盐、藻酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、硫酸氢盐、丁酸盐、柠檬酸盐、樟脑酸盐、樟脑磺酸盐、环戊丙酸盐、二葡萄糖酸盐、十二烷基硫酸盐、乙磺酸盐、延胡索酸盐、葡糖庚酸盐(glucoheptanoate)、甘油磷酸盐、半硫酸盐、庚酸盐、己酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、2-羟基乙磺酸盐、乳酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、草酸盐、棕榈酸盐(palmoate)、果胶酸盐、过硫酸盐、3-苯丙酸盐、苦味酸盐、新戊酸盐、丙酸盐、琥珀酸盐、酒石酸盐、硫氰酸盐、甲苯磺酸盐以及十一酸盐。碱性盐包括铵盐,碱金属盐如钠盐和钾盐,碱土金属盐如钙盐和镁盐,含有机碱的盐如双环己胺盐、N-甲基-D-谷氨酰胺,以及含氨基酸如精氨酸、赖氨酸的盐,等等。此外,含氮的碱性基团可以被以下试剂季铵化,低级卤代烷烃,如氯甲烷、氯乙烷、氯丙烷、氯丁烷、溴甲烷、溴乙烷、溴丙烷、溴丁烷、碘甲烷、碘乙烷、碘丙烷和碘丁烷;二烷基硫酸盐,如二甲基硫酸盐、二乙基硫酸盐、二丁基硫酸盐和二戊基硫酸盐;长链卤化物,如氯代癸烷、溴代癸烷、碘代癸烷、月桂基氯、月桂基溴、月桂基碘、肉豆蔻基氯、肉豆蔻基溴、肉豆蔻基碘、硬脂基氯、硬脂基溴和硬脂基碘;卤代芳香烷,如溴代苯甲烷和溴代苯乙烷以及其它。
本发明的肽或肽的变体的羧酸盐可以按照常规方式制备,即通过肽与一当量或多当量的希望的碱接触,例如金属氢氧化物碱,如氢氧化钠;金属碳酸盐或碳酸氢盐,如碳酸钠或碳酸氢钠;或者胺类碱,如三乙胺、三乙醇胺等。
本发明包括用于所述肽的药物活性形式的前药,例如其中一个或多个官能团被保护或衍生化,但其在体内可以转化为官能团,如可以在体内被转化为游离酸的羧酸酯的情形,或可以转化为游离氨基的被保护的胺的情形。本发明使用的术语“前药”特指在体内被迅速转化为母体结构的结构,例如在血液中水解。
本发明的另一方面提供了包含药学有效量的半胱胺和/或其衍生物的药物组合物。当使用修饰肽时,其可以形成组合物的部分或可以分别给药。
组合物也可以包括药学上可接受的载体、赋形剂和稀释剂。本发明使用的短语“药学上可接受的”是指在合理的医学判断范围内,适合用于与人类的组织接触,或者视情况可以是与动物的组织接触,而没有过量毒性、刺激和过敏反应、或其它问题或并发症,并且与合理效益/风险比相称的那些化合物、材料、组合物和/或剂型。
在根据本发明的优选用途中,真菌病原体是念珠菌属或曲霉属。例如,真菌病原体可以是白色念珠菌或烟曲霉菌。
真菌感染可以是全身性、局部、皮下、皮肤或粘膜感染。优选地,真菌感染可以是全身性或粘膜感染。
本发明的组合物是对多种病原酵母菌和霉菌均有效的抗真菌剂。然而,本发明的组合物也可以用于其它病征的治疗,包括但不限于与粘膜感染有关的病征,例如囊性纤维化,胃肠道、泌尿生殖系统、泌尿系统(如肾脏感染或膀胱炎)或呼吸系统的感染。
在一个实施方案中,本发明的组合物可用于治疗呼吸性/肺部疾病症状,特别是囊性纤维化或COPD的症状。
术语“治疗”涉及本发明所述的肽在使经受(感染性)疾病痛苦的患者受益方面的作用,包括改善患者的症状或延缓疾病发展。
另一方面,本发明提供了治疗或预防受试者的微生物感染的方法,其包括给予所述受试者治疗有效量的根据本发明的组合物。
在本发明的优选方法中,微生物感染为真菌感染。在本发明的方法中,肽优选口服给药。
本发明所述的肽、组合物或方法可以治疗哺乳动物、鸟类和其它动物。这些哺乳动物和鸟类包括人,狗,猫和家畜,如马、牛、绵羊、山羊,鸡和火鸡等。此外,本发明的肽、组合物或方法也可以治疗植物。
当受试者为动物时,本发明的方法可以施用于具有指(趾)甲样特征部位,包括但不限于蹄、爪和脚。
为了获得理想的效果,组合物及其变体或组合可以以单剂量或分剂量给药,例如至少约0.01mg/kg至约500-750mg/kg,至少约0.01mg/kg至约300-500mg/kg,至少约0.1mg/kg至约100-300mg/kg或者至少约1mg/kg至约50-100mg/kg体重,或者至少约1mg/kg至20mg/kg体重,尽管其它剂量也可以提供有益的效果。给药剂量将随着各种因素而变化,包括但不限于所选择的肽及其临床效果、疾病、体重、身体状况、健康状况、哺乳动物的年龄、要实现的是治疗还是预防,以及肽是否经过化学修饰。
根据本发明,治疗剂的给药可以是单剂量、多剂量、连续的或间歇的方式,这取决于例如接受者的生理状况,给药的目的是治疗还是预防,以及专业技术人员已知的其它因素。本发明的肽的给药可以是在预定的时间期间基本上连续的,或者可以是以一系列间隔的剂量的形式。局部和全身给药都考虑在内。
为了制备组合物,合成半胱胺和/或其衍生物或以其它方式获得半胱胺和/或其衍生物,必要的话或根据期望纯化,然后经冻干和稳定化。然后可以调节组合物至适当的浓度,并且任选地与其它试剂组合。单位剂量中包含的特定肽的绝对重量可以有很大的变化。例如,可以给予约0.01mg至约2g或约0.01mg至约500mg的至少一种本发明的肽,或特异性针对特定细胞类别的多种肽。供选择地,单位剂量可以从约0.01g至约50g,从约0.01g至约35g,从约0.1g至约25g,从约0.5g至约12g,从约0.5g至约8g,从约0.5g至约4g或者从约0.5g至约2g变化。
因此,一种或多种包含本发明的治疗性组合物的适宜的单位剂型可以通过多种途径给药,包括口服,肠胃外(包括皮下、静脉内、肌内和腹膜内),直肠,皮肤,透皮,胸内,肺内,鼻内(呼吸的)途径。治疗性肽也可以配制成脂质制剂或用于缓释(例如使用微囊化,参见WO 94/07529和美国专利No.4,962,091)。如果适合,剂型可以方便地以离散的单位剂型呈现,并且可以通过药学领域熟知的任何方法来制备。这些方法可以包括以下步骤:治疗剂与液体载体、固体基质、半固体载体,细分散的固体载体或其组合混合,以及随后如果需要,将产品加入所需的输送系统或成型进入所需的输送系统。
当本发明的治疗性组合物被制成用于口服给药时,它们通常与药学上可接受的载体、稀释剂或赋形剂组合以形成药物制剂或单位剂型。为了口服给药,肽可以以呈现为粉末、颗粒形式、溶液、悬浮液、乳液,或者处在天然的或合成的聚合物或树脂中用于从口香糖摄入活性成分。活性成分也可以呈现为丸剂、药糖剂或糊剂。本发明的口服给药的治疗性组合物也可以被配制成缓释的,例如半胱胺可以被包衣、微囊化或者以其他方式置于缓释输送的装置中。在这样的制剂中,活性成分总量占制剂重量的0.1%-99.9%。
包含本发明的治疗性组合物的药物制剂可以使用熟知且容易获得的成分通过本领域已知的方法制备。例如,肽可以与常用的赋形剂、稀释剂或载体一起配制并形成片剂、胶囊、溶液、悬浮液、粉末和气雾剂等。适于这些制剂的赋形剂、稀释剂和载体的例子包括缓冲剂以及填充剂和膨胀剂,如淀粉、纤维素、蔗糖、甘露醇以及含硅的衍生物。也可以包括粘合剂,如羧甲基纤维素、羟甲基纤维素、羟丙甲基纤维素以及其它纤维素衍生物、藻酸盐、明胶和聚乙烯吡咯烷酮。可以包括的保湿剂如甘油,崩解剂如碳酸钙和碳酸氢钠。还可以包括用于延迟溶出的试剂,如石蜡。也可以包括再吸收促进剂(Resorption accelerators),如季铵化合物。可以包括表面活性剂,如鲸蜡醇、甘油单硬脂酸酯。可以加入吸附载体如高岭土和膨润土。还可以包括润滑剂如滑石、硬脂酸钙和硬脂酸镁,以及固体聚乙二醇。也可以加入防腐剂。本发明的组合物也可以包含增稠剂,如纤维素和/或纤维素衍生物。它们也可以包含树胶如黄原胶、瓜尔胶或卡波(carbo)胶或阿拉伯胶,或供选择的聚乙二醇、有机皂土和蒙脱土等。
例如,包含本发明的组合物的片剂或囊片(caplets)可以包括缓冲剂,如碳酸钙、氧化镁和碳酸镁。适宜的缓冲剂还包括醋酸盐、柠檬酸盐、硼酸盐和磷酸盐等。囊片和片剂也可以包括非活性成分,如纤维素、预胶化淀粉、二氧化硅、羟丙甲基纤维素、硬脂酸镁,微晶纤维素、淀粉、滑石、二氧化钛、苯甲酸、柠檬酸、玉米淀粉、矿物油、聚丙二醇、磷酸钠、硬脂酸锌等。包含至少一种本发明的肽的硬或软明胶胶囊可以包含非活性成分如明胶、微晶纤维素、十二烷基硫酸钠、淀粉、滑石和二氧化钛等,以及液体载体如聚乙二醇(PEG)和植物油。此外,设计了包含一种或多种本发明的肽的肠衣囊片或片剂以防止在胃内崩解,并且在十二指肠内更加中性到碱性的环境下溶解。
本发明的治疗性组合物也可以被配制成酏剂或溶液以便于口服给药,或者配制成适于肠胃外给药的溶液,例如通过肌内、皮下、腹膜内或静脉内的途径。本发明的药物制剂也可以采用水溶液或无水溶液或分散体的形式,或者供选择的乳剂、悬浮剂或软膏的形式。
因此,治疗性组合物可以配制成用于肠胃外给药(例如,通过注射,例如团注或连续输注),并且可以以单位剂量的形式存在于安瓿、预填充的注射器、小体积输注容器或多剂量容器中。活性成分可以在油性或水性载体中形成悬浮液、溶液或乳液,并且可以包含调节剂(formulatory agent),如悬浮剂、稳定剂和/或分散剂。供选择地,活性成分可以是粉末形式,其是通过无菌固体的无菌分离,或由用适合的载体,例如使用前无菌无热原的水构成的溶液经冻干而获得的。
这些制剂可以包含本领域熟知的药学上可接受的载体(carriers)、载体(vehicles)和佐剂。例如,能够使用一种或多种从生理学的观点来看可接受的有机溶剂来制备溶液,除水之外,所述有机溶剂选自例如丙酮,醋酸,乙醇,异丙醇,二甲基亚砜,乙二醇醚如以名称为“Dowanol”销售的产品,聚二醇和聚乙二醇,短链酸的C1-C4烷基酯,乳酸乙酯或乳酸异丙酯,脂肪酸甘油三酯如以名称为“Miglyol”出售的产品,肉豆蔻酸异丙酯(isopropyl mytrisate),动物油,矿物油和植物油以及聚硅氧烷的溶剂。
包含本发明的肽的溶剂或稀释剂可以包括酸性溶液,二甲基亚砜,N-(2-巯基丙酰)甘氨酸,2-正壬基-l,3-二氧戊环和乙醇。优选地,溶剂/稀释剂是酸性溶剂,例如醋酸、柠檬酸、硼酸、乳酸、丙酸、磷酸、苯甲酸、丁酸、苹果酸、丙二酸、草酸、琥珀酸或酒石酸。
还考虑了包括一种或多种本发明的肽以及一种或多种其它抗微生物剂或抗真菌剂的组合产品,所述其它抗微生物剂或抗真菌剂例如多烯,如两性霉素B、两性霉素B脂质复合物(ABCD)、两性霉素B脂质体(L-ABM)以及制霉菌素脂质体;唑和三唑,如伏立康唑、氟康唑、酮康唑、伊曲康唑、泊沙康唑(pozaconazole)等;葡聚糖合成酶抑制剂,如卡泊芬净,米卡芬净(FK463)和V-棘白菌素(LY303366);灰黄霉素;烯丙基胺,如特比萘芬;氟胞嘧啶或其它抗真菌剂,包括本发明描述的那些。此外,考虑肽可以与局部抗真菌剂组合起来,局部抗真菌剂如环吡酮胺,卤普罗近,托萘酯,十一烯酸酯(盐),局部用制霉菌素(nysatin),阿莫罗芬,布替萘芬,萘替芬,特比萘芬以及其它局部药剂。
此外,组合物可以配制成持续释放剂型等。制剂的组成可以使得其能够在一段时间内,例如在肠道或呼吸道的特定部分中释放活性肽。包衣,包膜和保护性基质可以由例如聚合物质,如聚乳酸-羟乙酸酯,脂质体,微乳,微粒,纳米颗粒或蜡制成。这些包衣、包膜和保护性基质用于包覆留置装置,例如支架、导管、腹膜透析管、排液装置(draining devices)等。
对于局部给药,如本领域已知的那样,可以将活性药物配制成用于直接应用于靶区域。主要为局部应用而配制的形式采用例如乳膏,乳液,凝胶,粉末,分散体,微乳,调节得更稠或更稀的洗剂,浸渍的垫,软膏或棒,气雾剂(例如喷雾或泡沫),皂,洗涤剂,皂类洗剂或皂块的形式。用于该目的的其它常规形式包括伤口敷料,涂层绷带(coated bandages),或其它聚合物覆盖物,软膏,乳膏,洗剂,糊剂,凝胶,喷雾剂和气雾剂。因此,可以通过贴剂和绷带输送本发明的治疗性肽以用于皮肤给药。供选择地,也可以将组合物配制成粘性聚合物,如聚丙烯酸酯或丙烯酸酯/醋酸乙烯酯共聚物的一部分。为了长期应用,可能希望使用带微孔的和/或透气的衬底层压物,这样可以使皮肤的水合作用和浸渍最小。衬底层可以是能够提供所需的保护和支持功能的任何厚度。适宜的厚度一般为约10微米至约200微米。
局部给药可以是指(趾)甲涂层或漆的形式。例如,抗真菌的肽可以配制成溶液以用于局部给药,其包含乙酸乙酯(NF),异丙醇(USP)以及聚[甲基乙烯基醚/马来酸]单丁酯的异丙醇溶液。
局部给药的药物制剂可以包含例如生理上可接受的缓冲盐溶液,该溶液包含约0.001mg/ml至100mg/ml,例如0.1mg/ml至10mg/ml的一种或多种特异性针对将被治疗的适应症或疾病的本发明的肽。
例如,在加入适宜的增稠剂和/或胶凝剂的情况下,可以用水性或油性基质(base)配制软膏和乳膏。洗剂可以用水性或油性基质配制,并且通常还含有一种或多种乳化剂,稳定剂,分散剂,悬浮剂,增稠剂或着色剂。活性肽也可以通过电离子导入来输送,例如美国专利第4,140,122、4,383,529或4,051,842号中所公开的方法。局部制剂中存在的本发明的治疗剂的重量百分比要取决于多种因素,但通常会为制剂总重量的0.01%至95%,并且典型的是0.1-85%重量。
滴剂,如滴眼剂或滴鼻剂,可以采用水性或非水性基质中的一种或多种治疗性肽来配制,该基质中还包含一种或多种分散剂,增溶剂或悬浮剂。液体喷雾剂可以被泵送,或者是从加压包装便利地输送。滴剂可以通过简单的眼用带盖滴管瓶(eye dropper-capped bottle),通过适于输送液体内容物液滴的塑料瓶,或者通过特定形状封闭容器来输送。
治疗性肽可以被进一步配制成用于口腔和咽喉局部给药。例如,活性成分可以配制成进一步含有调味基质,通常是蔗糖和阿拉伯胶或西黄蓍胶的锭剂(lozenge);包含惰性基质如明胶和甘油或蔗糖和阿拉伯胶中的组合物的锭剂(pastille);以及包含适宜液体载体中的本发明的组合物的漱口水。供选择地,活性成分可以配制为膜带(film strip)或颊含片,其可以是或不是可溶解的。
用于本发明的药物制剂的载体和/或稀释剂的具体非限制性例子包括水和生理上可接受的缓冲盐溶液,如pH 7.0-8.0的磷酸盐缓冲盐溶液。
本发明的组合物也可以给药至呼吸道。为了吸入或吹入给药,组合物可以采用干粉形式,例如治疗剂与适宜的粉状基质如乳糖或淀粉的粉状混合物。当以气雾剂或吸入的形式给药时,本发明的治疗性肽也可以以水溶液给药。因此,其它的气雾剂药物制剂可以包含例如生理上可接受的缓冲盐溶液,该溶液包含约0.001mg/ml至100mg/ml,例如0.1至100mg/ml,如0.5-50mg/ml、0.5-20mg/ml、0.5-10mg/ml、0.5-5mg/ml或1-5mg/ml的一种或多种特异性针对将被治疗的适应症或疾病的本发明的肽。
抗生素/抗真菌剂
本发明的组合物还可以包含抗生素。术语“抗生素”用于指代可来自细菌来源的抗菌剂。抗生素剂可以是杀菌和/或抑菌的。
通常,抗生素剂属于由氨基糖苷、安莎霉素、碳头孢烯、碳青霉烯、头孢菌素(包括第一,第二,第三,第四和第五代头孢菌素)、林可酰胺、大环内酯、单环β-内酰胺、硝基呋喃、喹诺酮、青霉素(penicillin)、磺酰胺、多肽和四环素组成的组。供选择地或另外地,抗生素剂可有效抗分枝杆菌。
根据一个实施方案,抗生素剂可以是氨基糖苷,如阿米卡星、庆大霉素、卡那霉素、新霉素、奈替米星、妥布霉素或巴龙霉素。
根据一个实施方案,抗生素剂可以是诸如格尔德霉素和除莠霉素。
供选择地,抗生素剂可以是碳头孢烯如氯碳头孢。
根据另一个实施方案,抗生素剂是碳青霉烯,如厄他培南、多利培南、亚胺培南/西司他丁或美洛培南。
供选择地,抗生素剂可以是头孢菌素(第一代)如头孢羟氨苄、头孢唑啉、头孢氨苄、头孢噻吩(Cefalotin)或先锋霉素(Cefalothin),或供选择地,头孢菌素(第二代)如头孢克洛、头孢孟多、头孢西丁、头孢丙烯或头孢呋辛。供选择地,抗生素剂可以是头孢菌素(第三代),如头孢克肟、头孢地尼、头孢托仑、头孢哌酮、头孢噻肟、头孢泊肟、头孢布烯、头孢唑肟和头孢曲松,或头孢菌素(第四代)如头孢吡肟和头孢吡普。
抗生素剂可以是林可酰胺如克林霉素和阿奇霉素,或大环内酯如阿奇霉素、克拉霉素、地红霉素、红霉素、罗红霉素、醋竹桃霉素、泰利霉素和壮观霉素。
供选择地,抗生素剂可以是单环β-内酰胺如氨曲南,或硝基呋喃如呋喃唑酮或硝基呋喃妥因。
抗生素剂可以是青霉素,如阿莫西林、氨苄青霉素、阿洛西林、羧苄青霉素、氯唑西林、双氯西林、氟氯西林、美洛西林、萘夫西林、苯唑西林、青霉素G或V、哌拉西林、替莫西林和替卡西林。
抗生素剂可以是磺酰胺,如磺胺米隆,磺酰胺柯衣定(Sulfonamidochrysoidine)、磺乙酰胺、磺胺嘧啶、磺胺嘧啶银盐、磺胺甲噻二唑、磺胺甲噁唑、磺亚胺(Sulfanilimide)、柳氮磺胺吡啶、磺胺异噁唑、甲氧苄氨嘧啶和甲氧苄氨嘧啶-磺胺甲噁唑(复方新诺明(Co-trimoxazole))(TMP-SMX)。
抗生素剂可以是喹诺酮,如环丙沙星、依诺沙星、加替沙星、左氧氟沙星、洛美沙星、莫西沙星、萘啶酸、诺氟沙星、氧氟沙星、曲伐沙星、格帕沙星、司帕沙星和替马沙星。
根据一个实施方案,抗生素剂可以是多肽,如杆菌肽、粘菌素和多粘菌素B。
供选择地,抗生素剂可以是四环素,如地美环素、多西环素、米诺环素和氧四环素。
供选择地或另外地,抗生素剂可有效抗分枝杆菌。特别地,抗生素剂可以是氯法齐明、氯苯吩嗪、氨苯砜、卷曲霉素、环丝氨酸、乙胺丁醇、乙硫异烟胺、异烟肼、吡嗪酰胺、利福平、利福布汀、利福喷丁或链霉素。
通常,抗生素剂在治疗或预防由革兰氏阴性或革兰氏阳性细菌如大肠杆菌(Escherichia coli)和克雷伯氏菌(Klebsiella),特别是绿浓杆菌(Pseudomonas aeruginosa)引起的感染中具有活性。
在本发明的产品中,半胱胺和/或其衍生物与抗生素的比例可以为1:10至10:1;通常为至少2:1,例如至少3:1或4:1。供选择地,本发明的产品中抗生素剂与第二试剂的比例可以为1:100至1:2000,例如1:500至1:1000。根据一个实施方案,抗生素剂与第二试剂的比例为约1:1。优选地,第一抗生素剂是非肽抗生素,并且第二试剂是半胱胺,且产物以2:1至高达4:1的比例包含这些组分。根据另一个实施方案,该比例可以为约1:1。
抗真菌剂可选自氟康唑、伊曲康唑、卡泊芬净和两性霉素B,例如氟康唑、伊曲康唑和卡泊芬净中的一种或多种。
活性剂可以同时、顺序或分开给药。活性剂可以作为组合包装提供。组合包装可以包含本发明的产品以及用于同时、分开或顺序给予每种活性剂的说明书。对于顺序给药,活性剂可以以任何顺序给药。
贯穿本申请的说明书和权利要求书,词语“包括(comprise)”和“包含(contain)”以及这些词语的变体,例如“包括(comprising)”和“包括(comprises)”意思是“包括但不限于”,并且不想要(和不)排除其它部分、添加剂、组分、整数或步骤。
贯穿本申请的说明书和权利要求书,单数包含了复数,除非上下文另有要求。特别地,当使用不定冠词时,说明应被理解为考虑了复数以及单数,除非上下文另有要求。
与本发明的特定方面、实施方案或实施例一起描述的特征、整数、特性、化合物、化学部分(chemical moieties)或基团将被理解为可适用于本发明描述的任何其它方面、实施方案或实施例,除非与之不相容。
附图
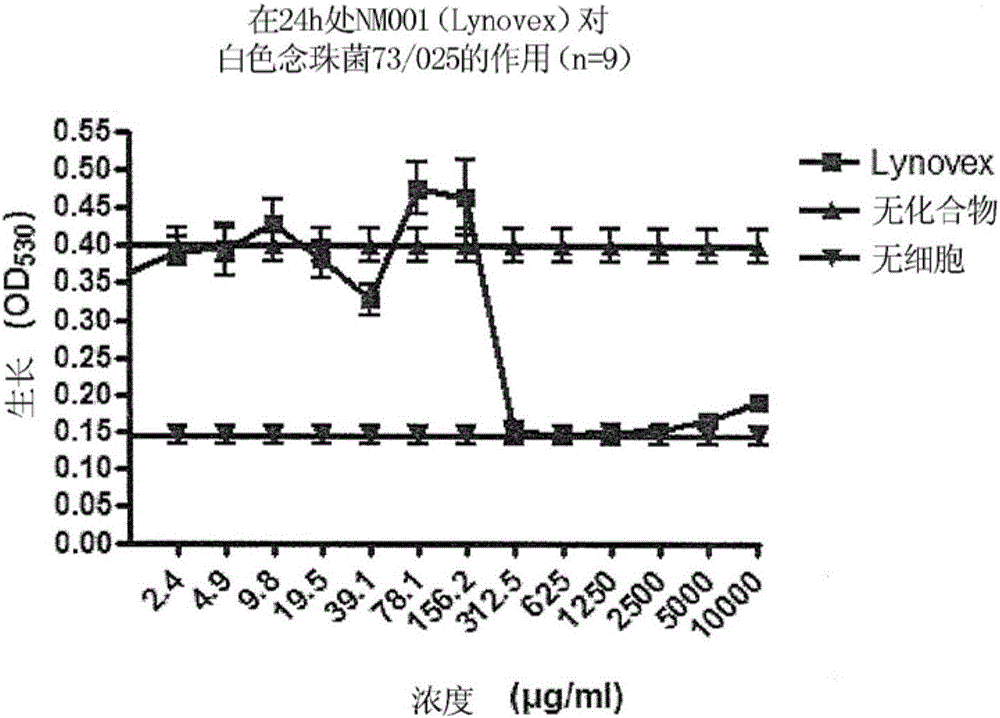
图1显示了24小时后半胱胺(Lynovex,NM001)对白色念珠菌73/025的作用。
图2显示了48小时后半胱胺(Lynovex,NM001)对白色念珠菌73/025的作用。
图3A-B显示了半胱胺(NM001)对四种烟曲霉菌株(图3A中的AF20,AF22和NCPF2939以及图3B中的AF2002/0066)的作用。
图4A-D显示从4个患有囊性纤维化的患者的痰分离的曲霉菌生长的培养皿。
图5A-B显示了用半胱胺(Lynovex)、妥布霉素或其组合治疗4小时(图5A)和24小时(图5B)的10名囊性纤维化患者的痰的微生物负载。
实施例
以下实施例解释本发明。
实施例1
半胱胺(Lynovex)(NM001)对阴道分离的白色念珠菌的最小抑制浓度试验。
目的:
实验的目的是确定Lynovex(NM001)对外阴阴道分离的白色念珠菌73/025的MIC。制备含有2x最终浓度的Lynovex(NM001)的连续倍增稀释液(a serial doubling dilution)的板。然后根据CLSI M27-A3方案,以2×RPMI-1640制备培养物,并且在板中以等体积(equal volumes)混合,得到1×RPMI-1640、下述化合物浓度和白色念珠菌的CLSI标准接种物。将这些在35℃下孵育,并在24小时和48小时处在BioTek读板仪(BioTek plate reader)上读数。
用于抗真菌测试的化合物
Lynovex(NM001)
方法:
培养物制备
1.白色念珠菌培养物在30℃下生长过夜
2.从培养箱移出培养物。向过夜培养物加入2ml无菌dH2O,并从琼脂表面清洗细胞。将细胞置于新的小管(bijou tube)中。
3.进行连续倍增稀释,并且相对于相同体积的MacFarland标准品进行测量。
a.将100μl培养物加入微量滴定板(microtitre plate)的孔A1。
b.将100μl无菌dH2O加入到孔A2-A11。
c.将100μl培养物加入微量滴定板的孔A2,充分混合,得到1/2稀释液(1in 2dilution)。
d.从A2取出100μl,并添加到板上的A3,并充分混合,得到1/4稀释液(1in 4dilution)。
e.这样继续到A11,其中100μl被移出并丢弃。
f.孔A12含有100μl 0.5MacFarland标准品,其已被充分混合。
g.在BioTek上在OD530处读板。
h.所需细胞浓度将是等同于(equivalent to)0.5MacFarland标准品的浓度。
4.用无菌dH2O将细胞稀释至0.5MacFarland标准品(可能需要例如1/16稀释)的当量。
5.然后以1/50将培养物进一步稀释到水中(其为100μl培养物+4900μl无菌水)。
6.然后以1/20将培养物进一步稀释为2×RPMI-1640(其为1ml培养物+19ml 2×RPMI-1640)。
板制备
1.板上的最高最终浓度将在方案结尾处的布局中描述。为了能够加入细胞,其以所述的2×最终浓度制备,例如制备20,000μg/ml,并且因此当加入细胞时,其减半至10,000μg/ml。
2.在无菌小管(bijoux)中制备每种化合物的溶液,得到5ml(5000μl)的最终体积。
3.通过向孔加入100μl最高浓度的化合物制备孔A1-A3、A4-A6、A7-A9和A10-A12(除了克霉唑板,其中化合物仅进入A1-3和A7-9)。
4.所有其他孔含有50μl无菌dH2O。
5.从A1-A3到B1-B3进行连续倍增稀释,其中从A1-A3移出50μl,并置于B1-B3中并充分混合。然后从B1-B3取50μl,并置于C1-C3中,并充分混合。从C1-C3取50μl,并添加至D1-D3,并充分混合。这样重复直到F1-F3。在F1-F3处,移出50μl并弃去。G1-G3和H1-H3仅含有水,并且将是未处理和未接种的对照。
6.对于列A4-A6、A7-A9和A10-A12中的孔重复相同的过程。参见页面底部的板布局。
用念珠菌接种板
1.向板上除了将仅含有水和2×RPMI-1640的孔H1-H12(底行)以外的所有孔加入50μl制备的念珠菌培养物,得到未接种的对照。
2.在BioTek中在OD530处读板。
3.然后将板放在塑料盒中,该塑料盒包含含水的培养皿或湿纸巾的床。将盒密封并置于35℃下。盘中或纸巾上存在的水提供了相对高湿度的环境。
4.在24小时和48小时处读板,绘制MIC图。
板布局
Lynovex板
结果
可以看出,半胱胺抑制白色念珠菌的生长。
实施例2
Lynovex(半胱胺)(NM001)对烟曲霉的最小抑制浓度试验。
目的:
实验的目的是确定Lynovex(NM001)对各种烟曲霉菌株的MIC。以2x最终浓度制备含有Lynovex(NM001)的连续倍增稀释液的微量滴定板。然后根据CLSI M38-A2方案以2×RPMI-1640制备培养物,并在板中以等体积混合,得到1×RPMI-1640、下述化合物浓度和烟曲霉的CLSI标准接种物。将这些在37℃下孵育,并在24小时和48小时处在BioTek读板仪上读数。
用于抗真菌测试的化合物
Lynovex(NM001)
方法:
培养物制备
1.烟曲霉菌培养物2002/0066、AF20、AF22和NCPF2939在37℃下在马铃薯葡萄糖琼脂(PDA)斜面上生长>72小时,以能够产生最佳孢子)。
2.从培养箱移出培养物,将1ml无菌的0.85%盐水加入斜面上的培养物,以从琼脂表面清洗培养物。将孢子收集在新管中。
3.进行孢子的连续倍增稀释,并在530nm的光密度下测量。然后如CLSI文件M38A中所规定的,将细胞密度调节至OD 530nm为0.09至0.13。
4.然后以1/50将孢子进一步稀释到2×RPMI-1640。
5.然后以等体积将稀释的孢子加入微量滴定板中的Lynovex(将50μl细胞加入到微量滴定板中的50μl Lynovex)。
板制备
1.制备10mg/ml的Lynovex的储备溶液。该方案结尾处的板布局是在加入孢子之后板中的最终浓度,因此必须以2x最终浓度制备板,以实现在加入细胞时的稀释。因此,在板中制备的Lynovex是10mg/ml(10,000μg/ml),并且在添加细胞之后板中的最终浓度是5mg/ml(5,000μg/ml)。
2.将100μl 10mg/ml的Lynovex加入孔A1-A3和A7-A9。
3.所有其他孔含有50μl无菌dH2O。
4.从A1-A3到B1-B3进行连续倍增稀释,其中从A1-A3移出50μl,并置于B1-B3并充分混合。然后从B1-B3取50μl,并置于C1-C3中,充分混合。从C1-C3取50μl,并添加至D1-D3,并且充分混合。这样重复直到H1-H3。在H1-H3处,移出50μl并加入到A4-6,并将稀释液转至F4-6。G4-6和H4-6仅含有水,并且将是未处理和未接种的对照。
5.对板的另一半中的孔重复相同的过程,其中将Lynovex加入到A7-9,并进行稀释至H7-9,然后从A10-12继续。
用烟曲霉菌接种板
1.向板上除了将仅含有水和2×RPMI-1640的孔H4-6和H10-H12之外的所有孔加入50μl制备的烟曲霉菌孢子,得到未接种的对照。
2.G4-6和G10-12是接种的对照并且具有孢子,但没有Lynovex。
3.在BioTek中在OD530处读板。
4.然后将板放在塑料盒中,该塑料盒包含含水的培养皿或湿纸巾的床。将盒密封并置于37℃。盘中或纸巾上存在的水提供了相对高湿度的环境。
5.在24小时和48小时处读板,绘制MIC图。
板布局
添加孢子后的最终Lynovex板。
实施例3
从CF患者获得新产生的痰样品,并将该样品暴露于单剂量的1mg/ml半胱胺和妥布霉素(10-100μg/ml),然后铺板(plate out)并孵育4小时和24小时,然后与来自未处理的痰样品的微生物菌落形成单位相比,评价所得的微生物菌落形成单位的数目。结果示于图5中。
实施例4
伊曲康唑、氟康唑和卡泊芬净对临床分离的皮炎外瓶霉的最小抑制浓度试验。
目的:
该实验的目的是确定伊曲康唑、氟康唑和卡泊芬净对临床分离的皮炎外瓶霉CA01的MIC。两种念珠菌属菌株(克鲁斯念珠菌(C.krusei)ATCC6258和近平滑念珠菌(C.parapsilosis)ATCC22019)和甄氏外瓶霉(Exophiala jeanselmei)参考菌株NCPF2377也被测试。这些用作质量控制菌株。制备平底Nunc板,其含有2x最终浓度的抗真菌剂的连续倍增稀释液。然后根据CLSI M38-A2方案以2×RPMI-1640制备培养物,并在板中以等体积混合,得到1×RPMI-1640、下述化合物浓度和CLSI标准接种物。将这些在35℃下孵育,并在BioTek读板器上在530nm处在24小时和48小时(念珠菌属)或120小时(外瓶柄霉菌属)读数。
用于抗真菌测试的化合物
伊曲康唑
氟康唑
卡泊芬净
二甲基亚砜(DMSO;载体对照)
方法:
培养物制备
7.念珠菌培养物在Sabouraud葡萄糖琼脂斜面上在30℃下生长过夜。
8.外瓶柄霉菌培养物在35℃下在马铃薯葡萄糖琼脂斜面上生长6天。
9.从培养箱取出培养物,向过夜培养物加入2ml无菌0.15M NaCl,从琼脂表面收获孢子和菌丝悬浮液,并转移到无菌塑料小管。
a.使外瓶柄霉菌属培养物静置长达10分钟,使菌丝沉降到底部。将孢子的顶层转移到无菌塑料小管。
10.进行两倍连续稀释,并用分光光度法测量光密度,以得到0.5McFarland标准品。
a.将100μl培养物加入微量滴定板的A1。
b.向孔A2-A12加入100μl无菌0.15M NaCl。
c.将100μl培养物加入微量滴定板的孔A2,通过吸取(pipetting)混合。这产生1/2稀释液。
d.从A2取出100μl并加至板上的A3,并通过吸取混合(1/4稀释液)。
e.这样继续到A12,其中100μl被移出并丢弃。
f.对于剩余的3种培养物,在行B-D中重复该连续稀释。
g.将0.5McFarland标准品添加到孔E1-E3。
h.在BioTek上在OD530处读板。
i.所需细胞浓度将是等同于0.5McFarland标准品的浓度。
11.在无菌0.15M NaCl中稀释细胞至0.5McFarland标准品的当量(例如可能需要1/32稀释液)。
12.然后以1/50将培养物进一步稀释到2×RPMI-1640(100μl培养物+4900μl 2×RPMI-1640)。
板制备
7.板上的最高最终浓度将如方案结尾处的布局中所描述的。为了能够加入细胞,其以2×所述的最终浓度制备,例如制备2000μg/ml的氟康唑,并且因此当将加入细胞时,其减半至1000μg/ml。
8.在无菌塑料小管中制备每种测试化合物的溶液,得到5ml的最终体积。
9.通过向孔加入200μl最高浓度的化合物来制备孔A1-A3和A7-A9。
10.所有其他孔含有100μl无菌dH2O。
11.从A1-A3到B1-B3进行连续稀释,其中从A1-A3取出100μl,并置于B1-B3中,通过吸移充分混合。然后从B1-B3取100μl,并置于C1-C3中,并充分混合。从C1-C3取100μl,并添加到D1-D3,并且充分混合。这样重复直到H1-H3。在H1-H3处,100μl被移出并添加到A4-A6。将连续稀释以相同的方式沿着板进行,至孔G4-G6,其中移出最终的100μl并弃去。H4-H6仅含有水,并且将是未处理的对照。
12.对于列A7-A9和A10-A12中的孔重复相同的过程。参见页面底部的板布局。
用念珠菌属/外瓶柄霉菌属接种板
5.向板上除了将仅含有水和2×RPMI-1640的孔H10-H12(底行)之外的所有孔加入100μl制备的培养物,得到未接种的对照。
6.在BioTek中在OD530nm处读板。
7.然后将板放置在包含含水的培养皿的塑料盒中。将盒密封并在35℃(外瓶柄霉菌属)或30℃(念珠菌属)下孵育。盘中或纸巾上存在的水提供了相对高湿度的环境。
8.在24小时和48小时后读取念珠菌属板的OD530,而在96小时和120小时后读取生长较慢的外瓶柄霉菌属的板。
9.使用Gen5软件转化原始BioTek数据,并使用GraphPad Prism 4软件对其进行图形显示,并确定MIC。
板布局
与Lynovex(NM001)组合使用的抗真菌药物对皮炎外瓶霉CA01的抗真菌活性。
目的:
本实验的目的是确定Lynovex(NM001)对皮炎外瓶霉CA01的抗真菌易感性的作用。根据关于肉汤微量稀释棋盘法(broth microdilution chequerboard method)的CLSI规范制备微量滴定板。这些板含有与抗真菌药物:氟康唑、伊曲康唑、卡泊芬净和两性霉素B的连续倍增稀释液组合的Lynovex(NM001)的连续倍增稀释液。首先以4x最终浓度制备Lynovex(NM001)和抗真菌剂,在它们组合后将其稀释至2x最终浓度。然后以2×RPMI-1640制备培养物,并在板中等体积混合,得到1×RPMI-1640和1×浓度的下述化合物。将这些在35℃下孵育,并在BioTek读板器上在72小时、96小时、120小时和144小时处读数。
用于抗真菌试验的化合物
与氟康唑、伊曲康唑、卡泊芬净和两性霉素B组合的Lynovex(NM001)。
方法:
培养物制备
6.三个独立的皮炎外瓶霉CA01培养物在35℃下在PDA斜面上生长6天。
7.从培养箱取出培养物。将2ml无菌0.15M NaCl加入到过夜的培养物,并从琼脂表面收获细胞。将细胞置于新的小管中。
8.使培养物静置长达10分钟,使任何菌丝沉降到底部。将分生孢子的顶层移至新的小管中。丢弃菌丝。
9.对每个培养物进行两倍连续稀释,并用分光光度法测量光密度,以得到0.5McFarland标准品。
a.将100μl培养物加入微量滴定板的F1。
b.将100μl无菌0.15M NaCl加入到孔F2-F12。
c.将100μl培养物加入微量滴定板的孔F2并通过吸取混合。这产生1/2稀释液。
d.从F2取出100μl并添加至板上的F3,并通过吸取混合。(1/4稀释液)。
e.这样继续到F12,其中100μl被移出并丢弃。
f.对于剩余的2种培养物,在行G-H中重复该连续稀释。
g.在BioTek上在OD530处读板。
h.所需细胞浓度将是等同于0.5McFarland标准品的浓度,或OD530为0.12-0.15。
10.在无菌0.15M NaCl中将细胞稀释至0.5McFarland标准品的当量(例如,可能需要1/128稀释)。
11.然后以1/50将培养物进一步稀释到2×RPMI-1640(1.1ml培养物+53.9ml 2×RPMI-1640)。
板制备
该制备步骤分两部分进行。首先,沿着并跨微量滴定板将Lynovex(NM001)和抗真菌剂分别连续稀释。然后在接种前将等体积的Lynovex和抗真菌剂在新的微量滴定板中合并。
步骤1:抗真菌板的制备
6.以4x所需浓度制备Lynovex和抗真菌剂的储备溶液。该方案结尾的板布局是将Lynovex和抗真菌剂组合并添加接种物之后的板中的最终浓度。例如,Lynovex最初以10mg/ml制备,并且在添加细胞后的板中的最终浓度为2.5mg/ml。
7.将300μl 10mg/ml的Lynovex加入行A中的每个孔。
8.所有其他孔含有150μl无菌dH2O。
9.从A到B进行连续倍增稀释,其中从A移出150μl,并置于B中并充分混合。然后从B取150μl,并置于C中,并充分混合。这样重复直到行G,其中最后的150μl被弃去。行H仅含有水,并且当组合时将仅是抗真菌剂以及未处理和未接种的对照。
10.对于其他4种抗真菌剂重复相同的过程,跨板,即列1至2进行稀释。在列10中的最终稀释液处,弃去最终的150μl。列11和12仅含有水,并且当组合时将仅为Lynovex以及未处理和未接种的对照。
步骤2:测试板(Challenge Plate)制备
1.将50μl来自A1的Lynovex稀释液与来自A1的50μl抗真菌剂稀释液合并到新的微量滴定板的A1中。
2.重复该步骤,直到所有孔已合并,将Lynovex/抗真菌剂浓度减半至总体积为100μl。
3.孔H11和H12含有100μl无菌dH2O,并将分别成为未处理和未接种的对照。
用皮炎外瓶霉CA01接种板
6.向板上除孔H12之外的所有孔加入100μl(总体积200μl)制备的皮炎外瓶霉CA01培养物。针对所有组合测试一种培养物,这样形成针对每种组合的3次重复。
7.H12将仅含有100μl水和100μl 2×RPMI-1640,构成未接种的对照。
8.在BioTek中在OD530处读板。
9.然后将板放置在包含含水的培养皿的塑料盒中,密封并在35℃下孵育。盘中或纸巾上存在的水提供了相对高湿度的环境。
10.然后在72小时、96小时、120小时和144小时处读取OD530,并使用Microsoft Excel处理原始数据。
11.用下式使用MIC10072小时数据和后面时间点的MIC50得到分数抑制浓度(FIC)指数值:
板布局
步骤1布局:
其中χ对于两性霉素B而言为120μg/ml,对于卡泊芬净而言为500μg/ml,对于氟康唑而言为8000μg/ml,并且对于伊曲康唑而言为64μg/ml。
步骤2布局:
其中χ对于两性霉素B而言为30μg/ml,对于卡泊芬净而言为125μg/ml,对于氟康唑而言为2000μg/ml,并且对于伊曲康唑而言为16μg/ml。
结果
表1:使用CLSI M38-A2*肉汤微稀释方法,临床抗真菌剂氟康唑、伊曲康唑和卡泊芬净对皮炎外瓶霉CA01的体外最小抑制浓度(MIC)。CLSI认可的念珠菌属QC菌株提供在可接受范围内的MIC值。
*用于丝状真菌的肉汤稀释抗真菌易感性测试的-CLSI(2008)参考方法;批准标准-第二版。(M38-A2)。
表2:与临床抗真菌剂组合使用的Lynovex(NM001)的肉汤微量稀释棋盘分析。分开的和组合的Lynovex和抗真菌剂的体外MIC100数据在35℃下孵育72小时后产生,并分析FICI。确定每种组合的FICI值并给出平均值,其中<0.5;协同,0.5-1;加和的,>1;无差别(indifference)。(Burkhart等人2002)
表3:与临床抗真菌剂组合使用的Lynovex(NM001)的肉汤微量稀释棋盘分析。分开的和组合的Lynovex和抗真菌剂的体外MIC50数据在35℃下孵育96小时后产生,并分析FICI。确定每种组合的FICI值并给出平均值,其中<0.5;协同,0.5-1;加和的,>1;无差别。(Burkhart等人2002)
表4:与临床抗真菌剂组合使用的Lynovex(NM001)的肉汤微量稀释棋盘分析。分开的和组合的Lynovex和抗真菌剂的体外MIC50数据在35℃下孵育120小时后产生,并分析FICI。确定每种组合的FICI值并给出平均值,其中<0.5;协同,0.5-1;加和的,>1;无差别。(Burkhart等人2002)
表5:与临床抗真菌剂组合使用的Lynovex(NM001)的肉汤微量稀释棋盘分析。分开的和组合的Lynovex和抗真菌剂的体外MIC50数据在35℃下孵育144小时后产生,并分析FICI。确定每种组合的FICI值并给出平均值,其中<0.5;协同,0.5-1;加和的,>1;无差别。(Burkhart等人2002)
- 还没有人留言评论。精彩留言会获得点赞!