C17H17N3O2作为制备阻断炎癌转化和/或预防肿瘤发生的药物或保健品的应用的制作方法
本发明属于预防肿瘤药物领域,具体涉及1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮作为制备阻断炎癌转化和/或预防肿瘤发生的药物或保健品的应用。
背景技术:
据统计,大约有15%的癌症是由慢性炎症特别是溃疡性炎症促发的,近年来流行病学调查与科学研究结果证实多种慢性炎症与肿瘤的发生有关。例如,消化道肿瘤发生率居高不下,和多种炎症有密切关系,包括食管炎和Barrett食管与食管癌发生,幽门螺杆菌感染与胃癌发生,炎症性肠病与结直肠癌发生,肝炎与肝细胞癌发生,慢性胰腺炎与胰腺癌发生,等。消化系统肿瘤像肝癌、胃癌和肠癌的发生尤其与炎症密切相关,以肠炎癌转化为例,慢性炎症可严重增加炎症性肠病(IBD)患者的致癌风险,有研究发现在30年的病程中,累积约18%的IBD患者最终进展为大肠癌[1-2]。
在炎症微环境中,免疫细胞能够释放多种细胞因子、趋化因子等免疫调节分子,通过激活体细胞内的NF-κB、AP-1、STAT、SMAD等关键转录因子,引起体细胞基因组、表观遗传学变化,导致细胞增殖、凋亡和分化等异常[3-4]。在动物实验中已证实炎症相关性大肠癌与APC,p38,TGF-β,PI3K等基因的突变、表达异常及细胞因子TNF-α,IL-6,TGF-β等密切相关[5]。同时,炎症微环境中大量存在的活性氧、活性氮等基团,不仅通过影响DNA和蛋白质的化学修饰来影响体细胞的表观基因组变化[6],而且在DNA损伤中发挥关键作用[7],从而导致体细胞的基因组、表观基因组持续暴露在高风险环境中,最终引起体细胞变异和肿瘤发生。所以如何阻断轻度炎症-重度炎症-肿瘤的转化对于预防肿瘤具有极为重要的意义,而发现具有相关阻断和抑制炎癌转化作用的药物也成为近年来备受人们关注的重点。
预防肿瘤和治疗肿瘤是截然不同的两个概念。目前虽然抗肿瘤药物很多,但迄今为止发现的能够有效预防肿瘤发生的药物还很少见。最近有研究报道长期服用阿司匹林的人群结肠癌发病率降低24%[8],胃肠道癌症死亡率整体下降35%[9],机制可能涉及对COX2和NF-κB的抑制作用,及DNA错配修复等方面[10]。但英国牛津大学和John Radcliffe医院Peter Rothwell教授指出健康中年人群服用阿司匹林所致的出血风险会部分抵消其带来的获益,因为阿司匹林是一种血液稀释剂,它容易损耗胃部的保护性黏膜导致消化道出血,甚至还会造成脑出血。所以阿司匹林在临床上被用于防止和阻断胃肠道炎癌转化方面的安全性还值得人们进一步研究和确定。还有一种具有预防肠癌发生的药物是治疗关节炎的药物塞来昔布(Celecoxib),塞来昔布是一种COX-2抑制剂,该药的一个新的适应症是能够预防肠癌发生[11],但该药也有头痛、眩晕、便秘、恶心、腹痛、腹泻、消化不良、胀气、呕吐等副作用。除此之外,具有防止、阻断消化道炎癌转化且安全性好的药物还未见报道。由此可见,发现预防肿瘤发生的药物,周期长,难度大。
技术实现要素:
阻断炎癌转化的预防肿瘤药物是独立于抗肿瘤药物、抗炎药物的一个专门领域。由于抗肿瘤药物研究是直接用肿瘤细胞系或肿瘤组织来进行研究,临床上对应的是肿瘤中晚期的治疗。这与预防肿瘤发生,尤其是阻断正常细胞或组织向肿瘤的转化功能是完全不同的概念。
同时,预防炎癌转化的药物和抗炎药也不是一个概念,目前众多的抗炎药物并不具有预防肿瘤的功能。例如,阿司匹林能够阻断炎癌转化,但是阿司匹林并不是抗肿瘤药物,也不是抗炎药物。
本发明的目的在于提供1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮作为阻断胃、肠道炎癌转化和预防肿瘤药物的应用,可用于消化道肿瘤特别是肠癌的预防。本发明涉及的药物成分1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮,其制备技术成熟,成本低廉。
本发明人经过一系列实验,证实了1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮具有抑制预防肿瘤发生、抑制炎症向肿瘤转化的功效。
根据本发明的一个方面,提供了一种物质作为制备抑制炎癌转化的产品的应用,所述产品为选自药品和保健品的一种,该物质是从下列中选出的一种:
1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮,
1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮的衍生物,以及
包含从以上各项中选出的至少两种的混合物。
根据本发明的一个进一步的方面,其中,1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮属于羽扇烷型五环三菇类化合物,分子式:C17H17N3O2,结构式为:
根据本发明的一个进一步的方面,上述炎癌转化包括胃炎癌转化和肠炎癌转化中的至少一种。
根据本发明的另一个方面,提供了一种物质作为制备预防肿瘤发生的产品的应用,所述产品为选自药品和保健品的一种,该物质是从下列中选出的一种:
1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮,
1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮的衍生物,以及
包含从以上各项中选出的至少两种的混合物。
根据本发明的一个进一步的方面,上述预防肿瘤发生包括阻断炎癌转化、治疗癌前病变和阻止消化道肿瘤的发生中的至少一种。
根据本发明的一个进一步的方面,上述预防肿瘤发生包括治疗消化道癌前病变和预防消化道炎症转变为消化道肿瘤中的至少一种。
根据本发明的一个进一步的方面,上述预防肿瘤发生包括治疗胃癌前病变和预防胃炎症转变为消化道肿瘤中的至少一种。
根据本发明的一个进一步的方面,上述消化道肿瘤是胃部肿瘤和肠部肿瘤中的至少一种。
根据本发明的又一个方面,提供了一种产品,其特征在于:以从下列物质中选出的一种作为活性成分:
1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮,
1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮的衍生物,以及
包含从以上各项中选出的至少两种的混合物,并含有其他辅料,其中所述产品为选自药品和保健品的一种。
根据本发明的一个进一步的方面,上述药品和保健品用于预防肿瘤发生,所述预防肿瘤发生包括阻断炎癌转化、治疗癌前病变和阻止肿瘤的发生中的至少一种。
根据本发明的一个进一步的方面,上述药品和保健品用于预防肿瘤发生,所述预防肿瘤发生包括治疗消化道癌前病变和预防消化道炎症转变为消化道肿瘤中的至少一种。
根据本发明的一个进一步的方面,上述药品和保健品的剂型选自片剂、胶囊、丸剂、针剂、缓释剂、控释剂、粉剂。
附图说明
图1显示了根据本发明的一个实施例中1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮与对照药塞来昔布对MNNG处理后的GES-1胃上皮细胞的集落形成率的实验结果对比。
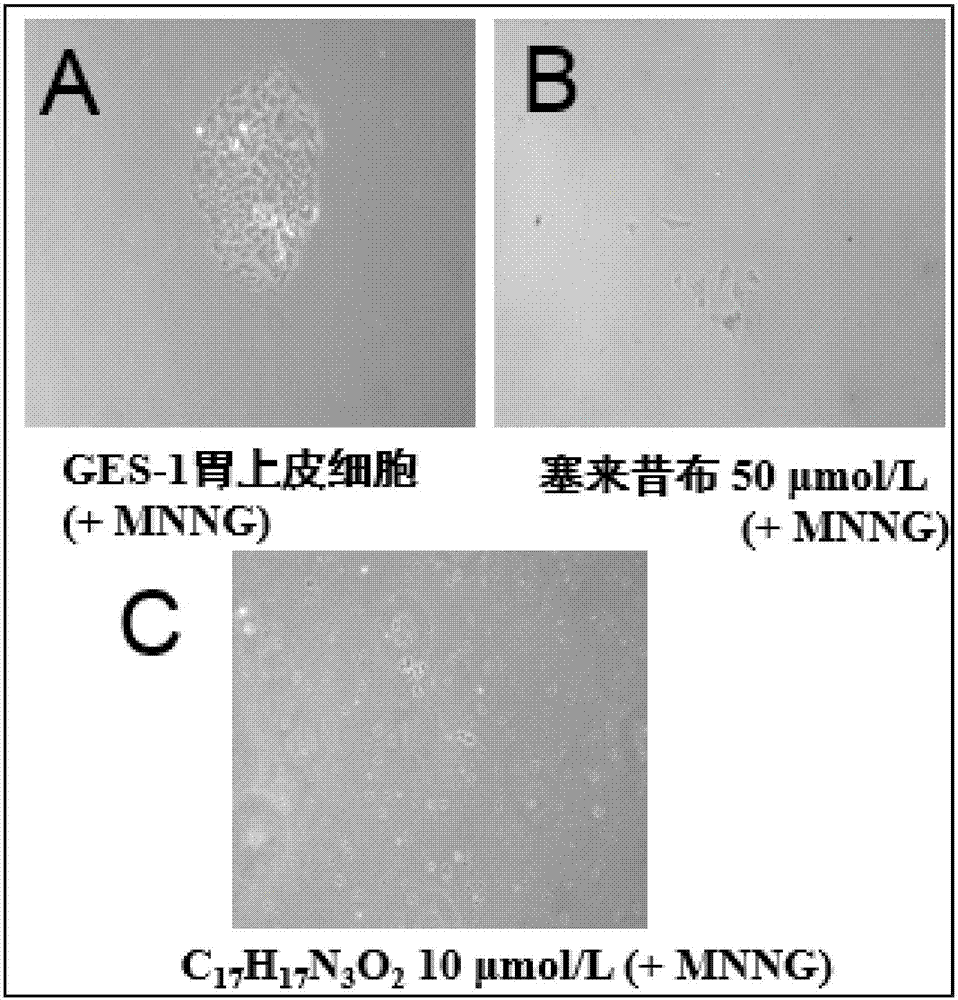
图2显示了GES-1胃上皮细胞在加入MNNG后细胞集落形成明显、加入C17H17N3O2和对照药塞来昔布能够显著抑制细胞集落形成的显微镜下观测照片。
图3显示了NCM460肠上皮细胞在加入TGF-β1后细胞集落形成明显、加入不同浓度的C17H17N3O2显著抑制细胞集落形成的显微镜下观测照片。
具体实施方式
本发明的一个方面在于提供一种新型炎癌转化阻断化合物,该化合物为C17H17N3O2,毒副作用小且能够有效地预防肿瘤发生、防止炎癌转化,可用于多种炎症向肿瘤的转化,特别是胃部炎症向肿瘤发生、肠部炎症向肿瘤发生的预防。
本发明的另一个方面在于含有C17H17N3O2的产品作为制备抑制炎癌转化和/或预防肿瘤发生的药物或保健品的应用。
为了实现本发明上述方面而采用的化合物的通用名:1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮(英文名:1-[3-[(E)-3-(1-methylpyrazol-4-yl)prop-2-enoyl]phenyl]pyrrolidin-2-one),CID编号:25638073,CAS编号:1173619-95-8,分子式:C17H17N3O2,分子质量:95.342g/mol。
TopScience药物公司提供的基本信息:
本发明所述用途中,所述预防肿瘤发生包括阻断炎癌转化、治疗癌前病变和阻止肿瘤的发生。
尤其是,所述预防肿瘤发生包括治疗消化道癌前病变和预防消化道炎症转变为消化道肿瘤。
所述预防肿瘤发生包括:治疗胃部癌前病变、治疗肠部癌前病变、预防胃部炎症转变为消化道肿瘤、预防肠部炎症转变为消化道肿瘤。
本发明人进行的一系列实验表明,1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮在安全的剂量下能够显著预防肿瘤发生,具有显著的预防肿瘤发生和阻断炎癌转化功能。本发明人的相关具体工作如下。
实施例1
实验原理/模型
选择公认的胃癌发生细胞模型——MNNG(N-甲基-N'-硝基-N-亚硝基胍)诱导的人胃粘膜上皮细胞GES-1集落为对象,进行MNNG诱导的人胃粘膜上皮细胞GES-1集落形成实验。MNNG是一种常用的化学诱变剂和致癌剂,尤其是在胃癌致癌研究中常用的一种化学致癌物[12]。具体实验如下:
实验步骤:
1.向对数生长期的GES-1细胞中加入2.0×10-5mol/L MNNG,避光培养24h后,换新鲜完全培养基(10%FBS)培养;
2.1周左右可见大量细胞死亡脱落,残存的细胞2周后长至70%~80%的饱和度时,开始消化传代,
3.传至第3代时,进行集落形成实验(MNNG处理GES-1细胞19天);
4.将MNNG处理后第3代的细胞配制成单细胞悬液,计数后调整细胞浓度为150个/ml,将单细胞悬液接种于6孔板内,2ml/每孔,培养24h后,加不同浓度的化合物C17H17N3O2;溶剂对照组和C17H17N3O2各剂量组均各设3个平行孔。12天后弃去培养基,每孔用冷PBS洗2次,2ml/次;无水甲醇固定5min,弃去后静置干燥;加入2ml姬姆萨染色液染色10min后,冲洗掉多余的染料,室温干燥、计数,根据下述公式计算各加C17H17N3O2组集落形成率。并按中效方程计算EC50。
加C17H17N3O2组集落形成率(%)=
加C17H17N3O2组集落平均值/溶剂对照组集落平均值×100%。
实验结果:
1.经过MNNG处理后的GES-1胃上皮细胞由原来的梭形,逐渐变为不规则,克隆间界限清楚,出现多核巨大细胞,胞浆内可见空泡;
2.如图1所示,通过观测不同药物对于MNNG处理后的GES-1胃上皮细胞的集落形成率,发现化合物C17H17N3O2可明显抑制MNNG处理后的GES-1细胞集落形成,且其作用优于对照药塞来昔布对集落形成的抑制效果。化合物C17H17N3O2和对照药塞来昔布对GES-1胃上皮细胞集落形成的半数有效浓度(EC50)分别为1.16μmol/L和3.84μmol/L。
如图2所示,显微镜下观察到(100X放大后)GES-1胃上皮细胞在加入MNNG后细胞集落形成明显(图2中的照片A),加入塞来昔布(图2中的照片B)、加入C17H17N3O2(图2中的照片C)能够显著抑制细胞集落形成。
实施例2
选择国际认可的肠炎癌转化的细胞模型——炎症因子TGF-β1刺激的人结肠上皮细胞NCM460炎癌转化模型[13]为对象。通过TGF-β1诱导人结肠上皮细胞(NCM460)形成肠炎癌转化模型,在该模型细胞中进行的集落形成实验中:加入10.0μmol/L C17H17N3O2后,对细胞集落形成具有显著的抑制作用,表明C17H17N3O2能够显著地防止和阻断肠上皮细胞从肠炎向肠癌的转化。
实验过程:取对数生长期的NCM460细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,把细胞悬浮在10%胎牛血清的RPMI1640培养液中备用。将细胞悬液作梯度倍数稀释,以每孔50、100、200个细胞的梯度密度分别接种含2ml 37℃预温培养液的6孔板中,每个梯度铺2个重复孔,轻轻转动,使细胞分散均匀。然后置于37℃,5%CO2及饱和湿度条件下静置培养。24h待细胞贴壁后加,取其中一组孔加TGF-β1造模:将NCM460细胞培养基中血清降为5%,去除双抗,加入终浓度为10ng/mL的TGF-β1因子,作用24h。刺激24h后换液,不同处理组分别加入不同浓度的C17H17N3O2继续静置培养,期间每隔2-3d换液一次。经常观察,当肉眼可见克隆(10-50个细胞左右)时,终止培养。弃去上清液,用PBS小心清洗2次,每孔加入1ml甲醇,固定15min。然后去固定液,每孔加1ml Giemsa染色液染色30min,再用流水缓慢洗去染色液,室温干燥。最后拍照记录并用肉眼计数克隆(集落)并计算集落形成率。
实验结果:
表1给出了C17H17N3O2对TGF-β1诱导的肠上皮细胞集落形成的抑制率的实验数据。
表1:C17H17N3O2对TGF-β1诱导NCM460肠上皮细胞集落形成的抑制作用
如图3所示,显微镜下观察到(100X放大后)在加入TGF-β1后细胞集落形成明显(细胞数>10)(图3中的照片B),分别加入2.0μmol/L C17H17N3O2(图3中的照片C)和10.0μmol/L(图3中的照片D)C17H17N3O2的结果表明,对细胞集落的抑制率随化合物C17H17N3O2的浓度升高而变大。
以上实施例的实验结果综合表明,1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮可以显著地防止和/或阻断胃和/或肠炎癌转化。由此可见,1-[3-[(E)-3-(1-甲基吡唑-4-基)丙-2-烯酰基]苯基]吡咯烷-2-酮可以作为一种有效的预防消化道肿瘤发生,特别是从胃部和/或肠部炎症向消化道肿瘤发生的预防药物或保健品,或作为该预防药物或保健品的有效成分。
参考文献
[1]Eaden J A,Abrams K R,Mayberry J F.The risk of colorectal cancer in ulcerative colitis:a meta-analysis.Gut,2001,48(4):526-535.
[2]Viennot S,Deleporte A,Moussata D,et al.Colon cancer in inflammatory bowel disease:recent trends,questions and answers.Gastroentérologie Clinique Et Biologique,2009,33(33Suppl 3):S190-201.
[3]Esteller M.Esteller M.Aberrant DNA-methylation as a cancer inducing mechanism.Annu Rev Pharmacol Toxicol 45:629-665.Annual Review of Pharmacology,2005,45(1):629-56.
[4]Saleh N,Ibrahim M A,Archoukieh E,et al.Identification of Genomic Markers by RAPD-PCR Primer in Leukemia Patients.Biotechnology,2010,9(2):170-175.
[5]Grivennikov S I,Greten F R,Karin M.Immunity,Inflammation,and Cancer.Cell,2010,140(6):883-899.
[6]Ziech D,Franco R,Pappa A,et al.Reactive Oxygen Species(ROS)–Induced genetic and epigenetic alterations in human carcinogenesis.Mutation Research/fundamental&Molecular Mechanisms of Mutagenesis,2011,711(1-2):167-73.
[7]Denicola G M,Karreth F A,Humpton T J,et al.Oncogene-induced Nrf2transcription promotes ROS detoxification and tumorigenesis.Nature,2011,475(7354):106-9.
[8]Benamouzig R,Uzzan B.Aspirin to prevent colorectal cancer:time to act?Lancet,2010,376(9754):1713-4.
[9]Rothwell P M,Algra A,Amarenco P.Medical treatment in acute and long-term secondary prevention after transient ischaemic attack and ischaemic stroke.Lancet,2011,377(9778):1681-92.
[10]Elwood P C,Gallagher A M,Duthie G G,et al.Aspirin,salicylates,and cancer.Lancet,2009,373(9671):1301-1309.
[11]Kawamori T,Rao C,Seibert K,et al.Chemopreventive activity of celecoxib,a specific cyclooxygenase-2inhibitor,against colon carcinogenesis.Cancer Research,1998,58(3):409-12.
[12]刘雪,孙向红,戚欣.MNNG诱导GES-1细胞恶性转化细胞模型的建立.齐鲁医学杂志2013;28(2):115-120
[13]H,Struck B,Feldmann EM,Bergmann F,Grage-Griebenow E,Geismann C,Ehlers S,Altevogt P,Sebens S.TGF-β1-dependent L1CAM expression has an essential role in macrophage-induced apoptosis resistance and cell migration of human intestinal epithelial cells.Oncogene.2013;32(2):180-9.
- 还没有人留言评论。精彩留言会获得点赞!