TEM1特异性核磁探针及其应用的制作方法
本发明涉及分子影像学领域,具体涉及核磁探针领域,特别涉及一种TEM1特异性核磁探针及其应用。
背景技术:
卵巢癌是一种女性生殖系统恶性肿瘤,死亡率高居妇科癌症首位,由于其发病隐蔽,临床症状、体征不典型,目前缺乏有效的早期诊断方法。超声检查是探查卵巢癌最常用的方法,准确率高于CT,但成像影响因素较多,如患者体型、腹壁厚薄、肿块位置深浅、腹水影响等,且常和肠腔混淆,易出现漏诊。CT对卵巢肿瘤的定位诊断较好,但除了在诊断囊性畸胎瘤方面准确度高以外,对于其他卵巢肿瘤的良、恶性鉴别准确度低于B超。MRI(核磁共振成像)是非损伤性、非辐射性成像方法,但MRI是非特异性的,同时受到磁性纳米颗粒大小的影响,而使结果不稳定。
新近发现肿瘤组织中存在肿瘤内皮细胞标志物(TEM),其在正常组织中少量表达或不表达,能够成为良好的肿瘤标志物。研究证明内皮唾液酸蛋白(TEM1/endosialin/CD248)在卵巢癌组织中高表达,与体内其他器官差异明显。
分子影像探针是现代生物影像技术发展的一个重要领域,该技术的核心是具有细胞靶向功能的不同种类和大小的分子探针,包括蛋白、抗体、多肽、化学小分子等。抗体靶向技术在肿瘤检测领域的应用越来越受到重视。然而,抗体由于其分子量大,一方面,在血清中不易被清除,且抗体作为外源性蛋白其免疫原性较大,在体内易引发特异性反应;另一方面,抗体分子量大导致其不易进入实体瘤周边,影响它们与受体的结合效率,难以获得足够的影像对比度。
技术实现要素:
为解决上述问题,本发明提供了一种TEM1特异性核磁探针,其包括通过交联剂连接的抗TEM1单链抗体和氨基化的SPIO(超顺磁氧化铁)纳米颗粒,其中,所述氨基化的SPIO纳米颗粒通过酰胺键与交联剂连接,所述抗TEM1单链抗体的C末端为半胱氨酸,并通过硫醚键与交联剂连接。
在本发明一个优选的实施方案中,所述抗TEM1单链抗体的氨基酸序列如SEQ ID NO.1所示。
在本发明另一个优选的实施方案中,所述抗TEM1单链抗体由SEQ ID NO.2所示的核酸序列编码。
本发明的编码抗TEM1单链抗体的核酸,可以根据其序列通过现有技术已知的方法合成,如固相亚磷酸酰胺法等。
在本发明另一个优选的实施方案中,氨基化的SPIO纳米颗粒粒径为60-120nm,优选为70-90nm。
在本发明另一个优选的实施方案中,氨基化的SPIO纳米颗粒的横向弛豫率为70-90mM-1S-1。
在本发明另一个优选的实施方案中,所述交联剂是SMCC或sulfo-SMCC。
在本发明另一个优选的实施方案中,所述TEM1特异性核磁探针含有的铁离子的浓度为0.15-2.2nM,优选0.5-2nM,更优选1-1.5nM。
本发明还提供了一种TEM1特异性核磁探针的制备方法,其包括以下步骤:
(1)合成C末端为半胱氨酸的抗TEM1单链抗体,然后进行纯化及复性;
(2)合成氨基化的SPIO纳米颗粒;
(3)通过交联剂连接抗TEM1单链抗体和氨基化的SPIO纳米颗粒。
本发明还提供了TEM1特异性核磁探针在制备诊断卵巢癌的试剂中的用途。
本发明还提供了一种试剂盒,其包含TEM1特异性核磁探针。
本文所使用的术语“试剂盒”包括本发明的TEM1特异性核磁探针和使用说明书。该试剂盒能进一步包含至少一种另外的试剂。试剂盒通常包括一个标签,简要地说明了试剂盒内容的目的用途。
本发明提供的TEM1特异性核磁探针特异性好,灵敏度高,无细胞毒性,由于抗TEM1单链抗体的分子量较小,其在血清中易于清除,并且免疫原性较小,在体内不易引发特异性反应;另外,抗体分子量较小使其易进入实体瘤周边,并且与受体的结合效率很高,能够获得足够的影像对比度。
附图说明
图1为构建质粒的克隆验证的结果;
图2为各表达菌株超声破碎后的SDS-PAGE结果;
图3为不同批次复性的包涵体蛋白的SDS-PAGE结果;
图4为抗TEM1单链抗体的亲和力检测结果;
图5为氨基化的SPIO纳米颗粒的粒径的DLS测量结果;
图6为氨基化的SPIO纳米颗粒的横向弛豫率的测量结果;
图7为用Bradford蛋白测定试剂盒建立的检测NP-linker-78C浓度的标准曲线;
图8为NP-linker-78C饱和曲线的检测的结果;
图9为NP-linker-78C的毒性检测的结果;
图10为NP-linker-78C的亲和力检测的结果;
图11为NP-linker-78C的特异性检测的结果;
图12为NP-linker-78C的内吞能力检测的结果;
图13为NP-linker-78C的内吞实验的统计学分析结果;
图14为荧光共聚焦的方法验证NP-linker-78C具有内吞的效果;
图15为NP-linker-78C特异性结合抗原的MRI扫描结果;
图16为NP-linker-78C的特异性结合抗原能力的统计学分析结果。
具体实施方式
下面将结合具体实施例对本发明的技术方案进行描述,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1载体构建与抗TEM1单链抗体的表达、纯化与复性
编码抗TEM1单链抗体的核酸其序列如SEQ ID NO.2所示,3’末端是编码半胱氨酸(Cys)的密码子,用限制性内切酶Nsi I/Xho I将其克隆到PET302载体上,构建成一个完整的质粒。将质粒转化大肠杆菌感受态细胞,铺板并过夜培养。待平板上长出菌落后提取质粒,用外源基因上的一个引物与载体上的另一个引物进行PCR,克隆验证的结果如图1所示,除了2号克隆没有特异性的条带之外,其他克隆均有特异性条带出现。测序结果也证明载体构建成功。
将上述质粒转化大肠杆菌BL21D3,铺板并过夜培养。挑取单菌落,用5ml LB培养基重悬,并置于37℃培养过夜。按1:100的比例将上述5ml培养基转移到装有500ml LB培养基的烧瓶内,置于37℃摇床中培养2小时。按1:1000的比例加入IPTG诱导(计算得到IPTG终浓度为1mM)作为诱导组,设置未加IPTG的对照组,37℃培养2小时。4℃条件下以4000rpm的转速离心15分钟,收集菌体。用40ml EQ缓冲液洗涤一次,并用40ml含8M尿素的EQ缓冲液将菌体配成悬液。将菌体悬液的容器置于冰浴中,采用超声波破碎,设置功率40%,破碎时间1秒,间歇时间2秒,运行6分钟,超声后的对照组菌液作为诱导前蛋白,超声后的诱导组菌液作为诱导后总蛋白。4℃条件下以最大转速离心15分钟,收集上清(诱导后可溶性蛋白)和菌体。分别取10μl诱导前蛋白、诱导后总蛋白和诱导后可溶性蛋白进行SDS-PAGE,结果见图2,可以看出诱导后总蛋白里面有大量的诱导蛋白存在,而诱导后可溶性蛋白中却没有相应的诱导蛋白,证明诱导蛋白以包涵体形式存在。因此按以下步骤进行包涵体纯化和复性。
用PBS重悬菌体,加入3ml磁珠液(预先用10ml EQ缓冲液清洗磁珠),4℃条件下结合2小时。用20ml含8M尿素的清洗液洗涤磁珠2次。用3ml含8M尿素的洗脱液洗涤2次,将目的蛋白78C洗脱下来。将2次洗涤后的洗脱液合并共6ml,用含8M尿素的EQ缓冲液定容至25ml。4℃条件下,将上述25ml悬液放置于1L PBS缓冲液中透析过夜。将不同批次复性的包涵体蛋白(1-12批)进行SDS-PAGE,上样量为5μl或10μl。结果见图3,可见蛋白纯度较高,几乎没有杂质存在。利用Millipore公司50ml浓缩管的对蛋白悬液浓缩离心,将蛋白浓度浓缩至1mg/ml。
实施例2 ELISA检测抗TEM1单链抗体的亲和力
用2%明胶为96孔板铺板,每孔50μl。37℃下孵育30至60分钟。将MS1-TEM1细胞(转染了TEM1质粒能够高表达TEM1蛋白的小鼠胰岛内皮细胞)加入96孔板,每孔细胞数约为104-105。37℃培养过夜。利用PBS液洗涤细胞3次。每孔加入合适浓度(0.0001nM、0.001nM、0.01nM、0.1nM、1nM、10nM、100nM、1mM、10mM)的抗TEM1单链抗体,4℃条件下孵育1小时。再次用PBS液洗涤细胞3次。加入抗His-HRP二抗,4℃条件下孵育1小时。再次用PBS液洗涤细胞3次。每孔加入100μl TMB液,37℃条件下孵育时间不超过30分钟。每孔加入100μl终止液,利用bioteck比色仪检测OD值。图4显示了抗TEM1单链抗体的亲和力检测结果,可见抗TEM1单链抗体具有极高的亲和力,亲和常数达到3.941nM。
实施例3 SPIO纳米颗粒的合成
取一只250ml烧瓶,在其内部放置搅拌子。放入12.5g葡聚糖。加入25ml去离子水,同时准备好可加热的搅拌台(ika RCT基本型加热磁力搅拌器),将搅拌器速度设置为4级。将搅拌器温度调节至120℃,并用铝箔将封闭烧瓶开口,将烧瓶放置于盛满二甲硅油的玻璃容器内,开启搅拌器持续1小时(此步骤也可选择过夜,同时搅拌器温度需设置为75℃-80℃,确保不超过100℃)。1小时后停止加热待其自然冷却。用0.22μm的滤器对葡聚糖溶液进行过滤,之后让其混匀过夜。过夜后的葡聚糖溶液经氮气(N2)清洗。清洗过程持续30分钟,在前20分钟过后,在玻璃容器内装满碎冰。(在烧瓶橡胶盖上插入2根针管,其中一根连接氮气,这根针管底部需顺着烧瓶壁,并没入溶液内部;另一根连接外部空气,维持烧瓶内部压力平衡。当氮气进入时,可以观察到溶液中出现许多气泡。)
称量0.985g FeCl3及0.366g FeCl2,分别放入50ml离心管内,并且加入6.25ml去离子水。旋转摇动使溶质完全融化混匀。随后用大型注射器将FeCl3溶液以及FeCl2溶液注入到含有葡聚糖溶液的烧瓶中,注入时确保注射器头部进入葡聚糖溶液内。(注:在称量氯化铁时,如果之后需要加其他稀有金属,氯化铁的量需减去60mg稀有金属的质量。)新得到混合溶液置于冰上并再次用氮气净化45至60分钟。启动Kds洗脱仪(美国伯乐422型),在注射器内准备15ml氢氧化铵溶液。氢氧化铵溶液将被加入到步骤7所得的溶液内,加入过程遵循以下几步(因纳米颗粒溶液的不稳定性,需时刻关注并及时调整速率):(1)将机器速率调节至每3至4分钟1滴,持续1小时;(2)将机器速率调节至前一步骤(1)的2倍,持续30分钟;(3)将机器速率调节至步骤(1)的3倍,持续30分钟;(4)将机器速率调节至步骤(1)的4倍,持续30分钟;(5)将机器速率调节至每小时5ml,持续15分钟;(6)将速率调节至每小时4至5ml,加入准备好的15ml氢氧化铵溶液。全部结束后,将装有溶液的烧瓶移出冰浴,停止氮气净化。将烧瓶置于90℃干浴1小时。室温下搅拌过夜。
4℃条件下,以20000g的转速对纳米颗粒溶液进行离心30分钟。离心完后,上清转移到100kd MW的超滤离心管(Amicon Ultra Centrifugation tubes)中。4℃条件下,以每分钟2000转离心过夜。离心过后,纳米颗粒将保存在超滤离心管的上部溶液内。尽可能将上部所有溶液都收集起来,放入50ml的锥形瓶中。残留的纳米颗粒可用柠檬酸盐缓冲液转移出来(过滤器底部呈V型处容易有纳米颗粒的残留,可以用移液器吸取5ml柠檬酸盐缓冲液(氯化钠35g,脱水柠檬酸钠23.5g,4L去离子水)对其进行吹打,再将溶液全部吸出。对纳米颗粒溶液进行过滤。过滤系统首先用柠檬酸盐缓冲液进行冲洗,确保废液进入废液瓶。先用柠檬酸盐缓冲液冲洗过滤系统,压强不能超过20psi。当体积达到25ml的时候,开始将合成好的SPIO纳米颗粒加入到柠檬酸缓冲液中。当废液变澄清后,意味着过滤结束。过滤结束后,用2L的柠檬酸缓冲液冲洗过滤系统。
实施例4 SPIO纳米颗粒加氨基尾巴
取实施例3制备的SPIO纳米颗粒溶液25ml加入到500ml的三角瓶中,加入25ml的10M NaOH,然后将该混合液体在搅拌器上混匀搅拌10分钟。10分钟后,加入50ml的表氯醇,然后用锡箔纸将瓶口封住,接着在搅拌器上搅拌过夜。第二天,将混合液体转移到50ml的离心管中,2000g离心10分钟。离心后,用玻璃管去掉最上面的表氯醇层,然后将下层的SPIO纳米颗粒重新转移到一个新的500ml的三角瓶中。在同一个三角瓶中加入相同体积的氢氧化铵,然后开口搅拌过夜。第二天,将已经氨基化的SPIO纳米颗粒继续在35℃下搅拌过夜,同时将瓶口盖上锡箔纸。分别用0.45μm以及0.22μm的过滤管将氨基化的SPIO纳米颗粒过滤。等氨气挥发完后,将氨基化的SPIO纳米颗粒重新应用过滤系统进行过滤和纯化,最终所得到的氨基化的SPIO纳米颗粒体积需要降低到至多5ml。
实施例5氨基化的SPIO纳米颗粒的表征
取100μl氨基化的SPIO纳米颗粒溶液,利用仪器Malvern HPPS5001进行动态光散射(DLS)测量,测3次,取平均值分析氨基化的SPIO纳米颗粒的粒径大小。从图5可以看出,氨基化的SPIO纳米颗粒的粒径为80nm左右。
利用Bruker(美国)1.4T minispec mq60NMR分析仪检测氨基化的SPIO纳米颗粒的横向弛豫率(R2)。首先将纳米簇样品按铁浓度稀释成不同的浓度,浓度范围为0.001-10mM,并且恒温至310K。取0.3mL的溶液于测试管中,采用标准Carr-Purcell-Meiboom-Gill脉冲序列测量其T2弛豫时间。以测得的T2时间为纵坐标,铁浓度为横坐标进行线性拟合,得到的直线斜率就为样品的横向弛豫率。由图6可知氨基化的SPIO纳米颗粒的横向弛豫率为80.48mM-1S-1。
实施例6氨基化的SPIO纳米颗粒与抗TEM1单链抗体连接
(1)氨基化的SPIO纳米颗粒与交联剂sulfo-SMCC的结合
在100μl的sulfo-SMCC中加入500μg氨基化的SPIO纳米颗粒,加水稀释到sulfo-SMCC终浓度为4.8mg/ml,此时混合液中sulfo-SMCC过量。混合液置于室温下缓慢震荡结合30分钟。脱盐柱(Thermo)预先用水清洗2次,以1000g的转速离心2分钟。利用结合缓冲液(PBS)在脱盐柱中将过量的sulfo-SMCC清除。将混合液缓慢注入脱盐柱内,以1000g的转速离心2分钟,收集溶液,即得氨基化的SPIO纳米颗粒与sulfo-SMCC的连接体,简称NP-linker。
(2)在NP-linker溶液中加入400μg抗TEM1单链抗体,室温下缓慢震荡结合2小时,或者4℃过夜。将NP-linker与抗TEM1单链抗体的连接体简称为NP-linker-78C。
(3)加入100μl浓度为20mM的新鲜配置的半胱氨酸溶液,室温下缓慢震荡结合1小时,封闭sulfo-SMCC上剩余的马来酰亚胺基团。
(4)磁柱(Invitrogen)预先用结合缓冲液洗涤2次。
(5)用磁柱纯化NP-linker-78C。加入结合缓冲液和NP-linker-78C到磁柱内,离心纯化,最终将NP-linker-78C浓度调至40μg/ml。
实施例7 NP-linker-78C饱和曲线的检测
将实施例6制备的NP-linker-78C等比例稀释,以氨基化的SPIO纳米颗粒作为空白对照,应用Bradford蛋白测定试剂盒建立检测NP-linker-78C浓度的标准曲线(图7)。以不同浓度(72μg、200μg、400μg、800μg、1600μg)的抗TEM1单链抗体分别加入到500ng氨基化的SPIO纳米颗粒中,进行反应。反应完成后,应用Bradford蛋白测定试剂盒进行蛋白浓度的测定。由图8可见,随着反应体系中抗TEM1单链抗体浓度的增加,NP-linker-78C浓度也在增加,但是当体系中单链抗体的浓度达到800μg时,NP-linker-78C浓度增加的趋势减缓。
实施例8 NP-linker-78C的毒性检测
将对数期生长的MS1(小鼠胰岛内皮细胞)、MS1-TEM1(转染了TEM1质粒能够高表达TEM1蛋白的小鼠胰岛内皮细胞)细胞按照2×104个/ml的密度接种于96孔板中。培养板在细胞培养箱中培养24小时。将含有不同铁离子浓度的纳米颗粒分别加入到细胞中,过夜培养24小时。在每一个孔中加入10μl5mg/ml的MTT,再继续培养4小时。再在每孔中加入100μl DMSO(Sigma-Aldrich),20分钟后,在570nm下进行检测。进行三次重复实验。应用软件One-way ANOVA和Turkey test对所得结果进行统计分析。结果如图9所示,当NP-linker-78C中铁离子浓度小于2.4nM的时候,无论是MS1细胞还是MS1-TEM1细胞都没有出现明显的降低,即细胞没有出现明显的死亡趋势;但是当铁的浓度达到2.4nM的时候,两种细胞的细胞存活率都降低到原来的50%,说明高浓度的磁性纳米颗粒具有很强的细胞毒性,因此本发明的TEM1特异性核磁探针中铁离子的浓度为0.15-2.2nM,优选0.5-2nM,更优选1-1.5nM。
实施例9 NP-linker-78C的亲和力检测
采用ELISA方法进行亲和力检测。首先用2%明胶为96孔板铺板,每孔50μl。37℃下孵育30至60分钟。将MS1-TEM1细胞加入96孔板,每孔细胞数约为104-105。37℃培养过夜。利用PBS洗涤细胞3次。每孔加入合适浓度(10-2nM、10-1nM、1nM、10nM、100nM、1mM)的NP-linker-78C,4℃条件下孵育1小时。再次用PBS洗涤细胞3次。加入抗His-HRP二抗,4℃条件下孵育1小时。再次用PBS洗涤细胞3次。每孔加入100μl TMB,37℃条件下孵育时间不超过30分钟。每孔加入100μl终止液,利用bioteck比色仪检测OD值。通过上述细胞ELISA实验检测出当反应体系中含有200μg的单链抗体时,最终NP-linker-78C的亲和力为196.8nM(图10A),当反应体系中含有400μg的单链抗体时,NP-linker-78C的亲和力为56.72nM(图10B)。
实施例10 NP-linker-78C的特异性检测
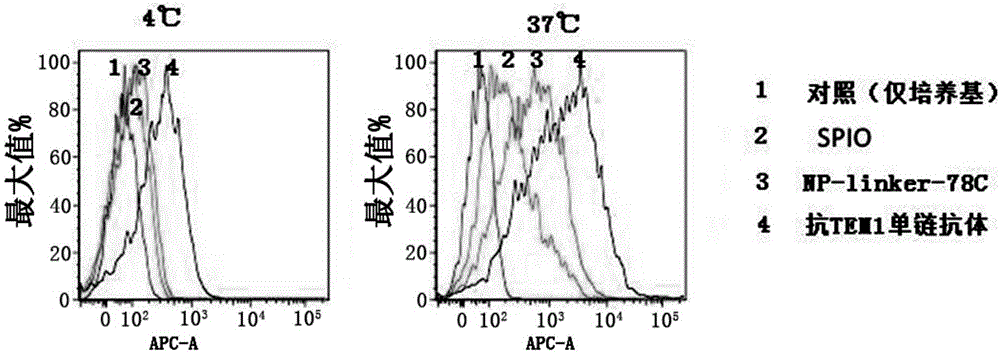
在细胞长满的75cm2细胞培养皿中加入6ml维尔烯(versene)溶液,37℃下消化10分钟。加入6ml的细胞培养液重悬细胞,以每分钟2000转速离心5分钟,弃上清。用7ml流式缓冲液(FACS缓冲液)重悬细胞,缓慢吹打混匀,按每管1ml分装入7只流式管中。每管加入2ml缓冲液混匀后,以每分钟2000转速离心5分钟,弃上清。加入用流式缓冲液稀释的浓度为50mM的抗体100μl。4℃条件下(避免抗体被细胞内吞)孵育结合1小时。加入3ml缓冲液混匀,以每分钟2000转速离心5分钟,弃上清。再次用3ml缓冲液洗涤2次。每管加入100μl的鼠源His抗体,4℃条件下孵育结合1小时。加入3ml缓冲液洗涤2次。每管加入100μl的鼠源APC抗体,4℃条件下孵育结合1小时。加入3ml缓冲液洗涤2次。加入300μl vial死细胞探针溶液,上机。由图11可以看出,NP-linker-78C保持了其特异性结合抗原的能力,而氨基化的SPIO不与抗原结合,因此可以排除抗原与NP-linker-78C的结合是由于纳米颗粒的粘附等作用。
实施例11 NP-linker-78C的内吞能力检测
准备2块24孔板,将盖玻片放入24孔板的每孔中。每孔加入2×104个细胞过夜培养。每孔中加入预先结合好的鼠源His抗体和鼠源APC抗体,2块24孔板分别置于37℃和4℃下孵育2小时使细胞与抗体结合。用PBS洗涤3次。每孔加入100μl浓度为1%的甲醛,常温孵育30分钟。用PBS洗涤3次。37℃条件下,用100μl浓度为5%的胎牛血清(BSA)封闭1小时。每孔加入100μl细胞膜绿色荧光探针(DIOc18(3))并孵育30分钟,DIOc18(3)的终浓度为10μg/ml。用PBST洗涤3次,每次10分钟。每孔加入100μl DAPI室温孵育5分钟,DAPI的终浓度为0.1μg/ml。用PBST洗涤3次,每次10分钟。用3μl甘油封片。通过图12可以看出,NP-linker-78C仍然保持内吞的作用。图13是对三次实验的统计学意义分析,证明NP-linker-78C具有内吞的作用。
本实验中还应用了荧光共聚焦的方法验证NP-linker-78C具有内吞的效果。首先是将相应的抗体预反应,然后分别在4℃和37℃的条件下与相应的细胞进行结合实验,通过图14结果,可以明显看到,37℃条件下,细胞内部由很多的荧光信号,而在4℃条件下,细胞内部没有相应的荧光信号,再次证明,NP-linker-78C具有内吞的效果。
实施例12 MRI的细胞实验检测
在细胞(MS1,MS1-TEM1)长满的75cm2细胞培养皿中加入6ml维尔烯(versene)溶液,37℃下消化10分钟。加入6ml的细胞培养液重悬细胞,以每分钟2000转速离心5分钟,弃上清。用7ml流式缓冲液(FACS缓冲液)重悬细胞,缓慢吹打混匀,按每管1ml分装入7只流式管中。每管加入2ml FACS缓冲液混匀后,以每分钟2000转速离心5分钟,弃上清。加入100μl用FACS缓冲液稀释的浓度为50mM的氨基化的SPIO和NP-linker-78C。37℃条件下孵育结合1小时。加入3ml缓冲液混匀,以每分钟2000转速离心5分钟,弃上清。再次用3ml缓冲液洗涤2次。每管加入100μl的鼠源His抗体,4℃条件下孵育结合1小时。加入3ml缓冲液洗涤2次。每管加入100μl的鼠源抗体APC,4℃条件下孵育结合1小时。加入3ml缓冲液洗涤2次。将洗好后的细胞用PBS重悬,放入到细胞MRI专用的板子中。
应用细胞团(cell pellet)实验对NP-linker-78C的特异性在MRI水平上进行检测。将NP-linker-78C和未结合NP-linker的抗TEM1单链抗体分别与细胞进行结合,在37℃的条件下反应,然后将细胞通过离心与洗脱的方式去掉没有与细胞结合的抗TEM1单链抗体,再将剩余的细胞放入到其相对应的细胞板上,再放入MRI仪器进行检测。未结合抗TEM1单链抗体的SPIO纳米颗粒作为阳性对照,在该实验中,阴性为亮色,颜色越深,表明结合到细胞上的磁性纳米颗粒越多,图15为相应的MRI结果图,图16为实验结果的统计学意义分析,由该结果可以看出,NP-linker-78C具有特异性结合抗原的性质,同时该性质在MRI检测水平上同样被检测到。
本文中应用了具体实施例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其中心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护。
序列表
<110> 天津医科大学
<120> TEM1特异性核磁探针及其应用
<130> PP169733
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 939
<212> DNA
<213> 人工序列
<220>
<223> 抗TEM1单链抗体的编码序列
<400> 1
gtgagcggat aacaattccc ctctagaaat aattttgttt aaactttaag aaggagatat 60
acatatgcat catcatcacc atcaccatgt ccagcctgtg ctgactcagc caccttccct 120
ctctgcatct cctggagcat cagccagtct cacctgcacc ttacgcagtg acatcaatgt 180
tggttcctac aggatatcct ggtaccagca gaagccaggg agtcctcccc agtatctcct 240
gagctacaaa tcagactcag ataagcagaa gggctctgga gtccccagcc gcttctctgg 300
atccaaagat gcttcggcca atgcagggat tttactcatc tctgggctcc agtctgagga 360
tgaggctgac tattattgta tgatttggca caacagcgct ggggtgttcg gcgggggcac 420
caagctgacc gtcctaggcg gtggttcctc tagatcttcc tcctctggtg gcggtggctc 480
gggcggtggt gggcaggtgc agctgcagga gtcgggggga accttggtac agcctggggg 540
gtccctgaga ctctcttgtg aagcctctgg attcaccttt agcaactatg ccatgggctg 600
ggtccgccag actccaggaa aggggctgga gtggctgtcg gctattcgta aaagtggcac 660
taccacatac tacgcggact ccgtgaaggg ccggttcatc atctccagag acaattccaa 720
gaacaccctg tatctgcaaa tgaataggct gagagtcggc gacacggcca cttattactg 780
tgcgactcac cccatcgcgg gctactgggg ccagggaacc ctggtcaccg tctcctccgg 840
aggttcttgc tagctcgaga tcgatgatat tcgagcctag gtataatcgg atccggctgc 900
taacaaagcc cgaaaggaag ctgagttggc tgctgccac 939
<210> 2
<211> 262
<212> PRT
<213> 人工序列
<400> 2
Met His His His His His His His Val Gln Pro Val Leu Thr Gln Pro
1 5 10 15
Pro Ser Leu Ser Ala Ser Pro Gly Ala Ser Ala Ser Leu Thr Cys Thr
20 25 30
Leu Arg Ser Asp Ile Asn Val Gly Ser Tyr Arg Ile Ser Trp Tyr Gln
35 40 45
Gln Lys Pro Gly Ser Pro Pro Gln Tyr Leu Leu Ser Tyr Lys Ser Asp
50 55 60
Ser Asp Lys Gln Lys Gly Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
65 70 75 80
Lys Asp Ala Ser Ala Asn Ala Gly Ile Leu Leu Ile Ser Gly Leu Gln
85 90 95
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Met Ile Trp His Asn Ser Ala
100 105 110
Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly Ser
115 120 125
Ser Arg Ser Ser Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Gln
130 135 140
Val Gln Leu Gln Glu Ser Gly Gly Thr Leu Val Gln Pro Gly Gly Ser
145 150 155 160
Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Ser Asn Tyr Ala
165 170 175
Met Gly Trp Val Arg Gln Thr Pro Gly Lys Gly Leu Glu Trp Leu Ser
180 185 190
Ala Ile Arg Lys Ser Gly Thr Thr Thr Tyr Tyr Ala Asp Ser Val Lys
195 200 205
Gly Arg Phe Ile Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
210 215 220
Gln Met Asn Arg Leu Arg Val Gly Asp Thr Ala Thr Tyr Tyr Cys Ala
225 230 235 240
Thr His Pro Ile Ala Gly Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
245 250 255
Ser Ser Gly Gly Ser Cys
260
- 还没有人留言评论。精彩留言会获得点赞!