一种靶向肺癌的低毒量子点制剂的制作方法
本发明属生物技术及纳米生物材料领域,涉及一种特异性靶向肺癌的低毒量子点制剂及其用途,更具体的涉及该新的靶向肺癌的量子点及其制备方法及其与一种或多种细胞自噬抑制剂制成新量子点制剂或组合物,从而降低传统量子点制剂的毒性。
背景技术:
资料显示,肺癌是全球最常见的恶性肿瘤之一,其病死率位居恶性肿瘤首位。由于早期常无特殊临床表现,80%的肺癌患者就诊时已属中晚期,仅能进行姑息治疗,致使生存时间很短;而早期肺癌(IA期)的5年生存率超过70%,研究显示,肺癌发现较晚的原因很多,但主要是缺乏对于高危人群的有效早期诊断方法,因此,发展新的肺癌诊断方法无疑就成为了为肺癌的早期诊断提供有效依据的重中之重。
目前,荧光显微成像是一种灵敏的进行癌细胞诊断方法,特别是对癌细胞发展早期进行诊断最具发展潜力和最为广泛使用的成像技术,该技术具有灵敏度高、无损、临床安全以及操作技术简单、成本低廉的特点。标记物的灵敏度和稳定性是利用光学成像技术对癌细胞诊断成功的关键。在过去的几十年中,荧光标记技术成为一种重要的生物标记技术。利用荧光染料作为标记物己经在生物医学的许多领域,特别是在癌细胞成像和标记中得到了广泛的应用。与其他的标记物如放射性标记物等相比具有许多优点。但是随着研究的进展,要求检测灵敏度进一步的提高,荧光染料由于其标记效率低、光稳定性差和相对低的荧光强度等缺点已经限制了其在该领域的发展和应用。随之而发展起来的标记物为荧光纳米粒子如量子点等,由于其克服了荧光染料的光稳定性差和相对低的荧光强度等缺点,已成为新的一代最有发展前景的标记物。
量子点(quantum dot,QD)又可称为半导体纳米微晶体(semiconductor nanocrystal),量子点(quantum dot,QD)又可称为半导体纳米微晶体(semiconductor nanocrystal),。目前研究较多的主要是CdX(X=S、Se、Te)。量子点由于粒径很小(约1~100nm),电子和空穴被量子限域,连续能带变成具有分子特性的分立能级结构,因此光学行为与一些大分子(例如:多环的芳香烃)很相似,可以发射荧光。量子点的体积大小严格控制着它的光吸收和发射特征。研究显示,晶体颗粒越小,比表面积越大,分布于表面的原子就越多,而表面的光激发的正电子或负电子受钝化表面的束缚作用就越大,其表面束缚能就越高,吸收的光能也越高,即存在量子尺寸效应(quantum size effect),从而使其吸收带蓝移,荧光发射峰位也相应蓝移。有研究报道,单独的量子点颗粒容易受到杂质和晶格缺陷的影响,荧光量子产率很低,但是当以其为核心,用另一种半导体材料包覆,形成核-壳(core-shell)结构后,就可将量子产率提高到约50%,甚至更高,并在消光系数上有数倍的增加,因而有很强的荧光发射。目前已合成的核-壳结构的纳米颗粒有,CdS/Ag2S、CdS/Cd(OH)2、CdS/ZnS、ZnS/CdSe、ZnSe/CdSe、CdS/HgS、CdS/PbS等以及多层结构的CdS/HgS/CdS。量子点比有机荧光分子稳定,它可以经受反复多次激发,不易发生荧光漂白,因此为研究细胞中生物分子之间长期的相互作用提供了有力工具。
鉴于其独特的光物理性能,量子点被广泛应用于体外细胞标记。相比于传统的有机荧光染料,量子点的主要优势是其具有较强的抗漂白性能(从几分钟到几小时)、较高的消光系数(0.5~5×106L/(mol·cm-1))和量子产率。由量子点标记得到的图像具有更好的对比度和清晰度,因此能够在大多数领域中替代有机染料。近年来,量子点用于细胞内成像取得了较大的进展,很多活细胞和固定细胞内的组分以及蛋白被量子点标记、成像,如细胞核、线粒体、微管、微丝蛋白、细胞角质蛋白和内吞体等;同时,量子点也用来研究细胞膜蛋白和受体,包括前列腺特异性膜抗原(PSMA)、HER激酶、甘氨酸受体、血清素运输蛋白、p-糖蛋白、Band Ⅲ蛋白和钠-钾ATPase等;其在免疫荧光应用中最有利的是微量的量子点就能够产生检测信号;有研究报道量子点在细胞样品中有忽隐忽现的现象,被称为“闪烁”,该特性可将免疫荧光检测灵敏度提高到单分子水平。
量子点因具有近红外发光光谱、长时间稳定性、高亮度荧光、抗光漂白性等独特的优势使它们成为活体内荧光成像和标记的优先选择。Akerman小组、将硫基化靶向肽连接的量子点注射到癌变大鼠体内,取出组织切片,发现大量多肽量子点探针富集在癌变组织内(AkermanME,Chan W,Akkonmen LP.Proc.Natl.Acad.Sci.,2002.99(20):12617-21);Kim小组将量子点分别注入到鼠和猪的皮下,它们定向运动到哨位淋巴结,通过低能量近红外激发(5×10-3W/cm2)得到了猪淋巴结1cm深度处的荧光成像(Kim S,Lim Y,Soltese E.Nature.Biotechnology.2004 22:93-97);研究结果为活体动物的体内成像奠定了基础,为临床医学成像、外科手术的准确性提供了依据。
随着量子点合成技术的不断改进,量子点有望成为最具潜力的荧光标记物之一,尤其是在活体细胞标记领域的应用。但尚未推广到临床实际中,主要是由于量子点本身在体内外都具有一定的毒性;研究表明在量子点与细胞的作用过程中,它们的表面化学基团给细胞膜造成极小的微孔,这可能改变细胞内外的离子浓度差以及细胞内部起保护细胞完整性和正常运作功能的大分子浓度;另一方面,量子点与细胞的相互作用可能直接导致了细胞凋亡及细胞自噬,从而杀伤细胞。
RGD肽是一段由Arg、Gly、Asp三个氨基酸组成的短肽序列,是细胞表面许多整合素如α5β1、α3β1、αvβ1的特异性配体之一,能介导细胞与细胞外基质间的黏附作用,是目前证明最有效、应用最广泛的促黏附性短肽,同时还具有一定的信号传导功能。近年来,受体显像技术作为一项重要的生物医学研究工具受到人们越来越多的关注。肿瘤受体显像技术是利用放射性核素标记的受体配体能与肿瘤组织中高表达的受体特异性结合,从而显示肿瘤受体的空间分布、密度及亲和力的等;该技术亲和力高、特异性好、组织穿透能力强点,可在较短时间内获得高对比度的肿瘤影像,且鲜有人体免疫源性反应[NanMA,etal.One-stepDNA-programmed growth of luminescent and biofunctionalized nanocrystals.Nature Nanotech.,2009,4:121-125.]。Jung等用99mTc标记糖化的RGD肽,结果显示标记的糖化短肽与内皮细胞的结合具有受体数量依赖特性[Jung KH,et al.Favorable biokinetic and tumor-targeting properties of 99mTc-labeled glucosamino RGD and effect of paclitaxel therapy[J].J.Nucl.Med.,2006,47(12):2000-2007.];体内生物显像显示:此放射性药物在血液中被迅速清除,肝脏对其的摄取量很少,而肿瘤细胞呈高度摄取状态;显像过程中肿瘤图像清晰可见;Zhang等[43]将羧基、嘧啶与c(RGDyK)耦联得到BPy-RGD,然后用99mTc标记BPy-RGD得到99mTc(CO)(3)-BPy-RGD。BPy-RGD是亲水性的,所以对整合素受体具有很好的亲和力,此亲水性跟踪剂也可以对肿瘤细胞表面的整合素αvβ受体活性进行调节事实证明,用c(RGDyK)进行受体阻断注药4h后,肿瘤对99mTc(CO)(3)-BPy-RGD的摄取量大大降低;研究结果证明用羧基与嘧啶修饰后的c(RGDyK)对肿瘤具有更高靶向功能,因此99mTc(CO)(3)-BPy-RGD有望成为整合素家族αvβ受体的一种新型高效的靶向肿瘤显像剂。
细胞自噬(autophagy)又称Ⅱ型程序性死亡(type Ⅱ programmed cell death),是真核生物体内常见的“自我消化”(cellular degradation)的现象,能分解细胞内受损或多余的细胞器和蛋白产生核苷酸,氨基酸等小分子物质供细胞合成新的蛋白质,并能维持细胞内微环境的稳定;研究显示其与多种疾病,尤其是肿瘤的发展关系密切。
根据细胞内底物运送到溶酶体腔内方式的不同,哺乳动物细胞自噬可分为三种方式:大自噬(macroautophagy)、小自噬(microautophagy)和分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)。大自噬主要具有以下特征:(1)发展过程迅速;(2)自噬的可诱导性;(3)批量降解;(4)无选择性吞噬;(5)自噬的保守性。其他两种自噬与大自噬的主要区别在于:小自噬是溶酶体膜自身变形,然后包裹吞噬细胞浆中的底物;而分子伴侣介导的自噬则能有选择性地降解蛋白。主要概述的大自噬(以下简称自噬)与肿瘤发展及治疗关系最为密切[Sridhar S,Botbol Y,Macian F,et al.Autophagy and disease:always two sides to aproblem.J Pathol.2012;226(2):255-73.]。
自噬过程大致能分为4个阶段:1.在饥饿、缺氧、药物干扰等某些因素的刺激下,自噬泡的双层膜结构开始逐渐形成并包围在被降解物的周围。2.自噬泡完全成型并将要被降解的物质完全隔离于细胞质。3.自噬体与溶酶体融合形成自噬溶酶体。4.自噬溶酶体最终被溶酶体中的水解酶溶解,降解产物可以在细胞内再循环利用。[Martínez-Borra J,López-Larrea C.Autophagy and self-defense.Adv Exp Med Biol.2012;738:169-84.];自噬能对细胞对外部环境改变及各种刺激产生应激反应。细胞在生长条件下能发生较低水平的自噬,也称基础自噬。然而,一旦受到外界的刺激,如饥饿、缺氧、高温、高细胞密度或是生长因子剥夺等,细胞自噬的水平将会迅速上调。如在营养物质缺乏的情况下,细胞自噬能分解体内坏死细胞器产生氨基酸等供细胞合成新的蛋白质,维持细胞的存活[①Piacentini M,D'Eletto M,Falasca L,et al.Transglutaminase 2 at the crossroads between cell death andsurvival.Adv Enzymol Relat Areas Mol Biol.2011;78:197-246;②Cook KL,Shajahan AN,Clarke R.Autophagy and endocrine resistance in breast cancer.Expert Rev Anticancer Ther.2011;11(8):1283-94.;③Wirawan E,Vanden Berghe T,Lippens S,et al.Autophagy:for better orfor worse.Cell Res.2012;22(1):43-61.]。然而,作为程序性细胞死亡的一种,细胞自噬能通过多种途径直接或是间接导致细胞死亡。这种杀伤可能是通过诱导细胞凋亡、坏死、衰老等机制发生,也可能是使细胞直接发生自噬性死亡[Denton D,Nicolson S,Kumar S.Cell death by autophagy:facts and apparent artefacts.Cell Death Differ.2012;19(1):87-95.]。
目前的量子点制剂均为传统型制剂工艺所制,不仅毒性较大且无肿瘤细胞靶向的能力,难以用于肿瘤示踪和检测。基于现有技术的现状,本申请的发明人拟提供一种靶向肺癌的低毒量子点制剂。
技术实现要素:
本发明的目的是克服现有技术存在的缺陷,提供一种靶向肺癌的低毒量子点制剂及其制备方法。更具体的涉及一种低毒性的、能用于肺癌诊断的量子点制剂及其制备方法。该量子点制剂其毒性低于一般量子点制剂并能特异性靶向肺癌。
本发明在制备靶向肺癌的低毒量子点制剂中,用RGD多肽与量子点相结合,赋予传统量子点靶向肿瘤细胞的能力,使与细胞自噬调控药物相结合,减弱其毒性。更进一步将量子点制成靶向肺癌的低毒纳米制剂用于肺癌及其他肿瘤诊断。
具体的,本发明中,将传统量子点与肺癌靶向性分子相连接,之后与细胞自噬调控剂一起组成组合物或者制剂。
本发明中,所述的量子点制剂由一种或多种靶向肺癌的量子点与一种或多种细胞自噬/增强剂组成。本发明的实施例中,所述量子点制剂由一种或多种靶向肺癌量子点和细胞自噬调节药物组成。
本发明中,靶向肺癌的量子点由一种量子点和一种或几种RGD多肽序列组成。
本发明中,量子点包括但不限于碲化镉量子点(CdTe),硫化锌量子点(ZnS)及硒化镉量子点(CdSe);本发明的一个实施例中,优选的量子点是碲化镉(CdTe)量子点。
本发明中,RGD多肽包括但不限于C-RGD和Y-RGD,其序列如SEQ No.1所示;本发明的一个实施例中,优选的RGD多肽是C-RGD。
本发明的靶向肺癌量子点也可与自噬调节药物组成组合物,序贯使用以降低量子点的毒性。
本发明中,细胞自噬调节药物包括但不限于:氯喹(CQ),3-MA,沃曼青霉素,巴伐洛霉素A-1,氯化铵和LY294002;本发明的一个实施例中,优选的细胞自噬调节药物最优的是:氯喹,3-MA和氯化铵。
本发明制得量子点的粒径为12nm左右,Zeta电位为-32.9mV左右,最大激发波长为259nm,最大发射波长为656nm。具有量子点应有的性质(如表1所示)。
本发明制得量子点制剂进行了与普通量子点的肺癌靶向性比较实验,结果显示,制得的量子点能特异性靶向并能结合到肺癌细胞上。
本发明制得量子点制剂进行了体内毒性评价实验,结果显示,本量子点制剂在体内相对的低毒性,与细胞自噬抑制剂制成制剂能减轻量子点在体内的毒性。
进一步的,本发明制得的量子点制剂可用于制备治疗、诊断、检测肺癌的制剂中;还可用于制备诊断,检测和治疗其它肿瘤的制剂中;同时可用于制备体内肿瘤细胞的示踪及定位制剂。
本发明的量子点制剂具有如下优点:
(1)特异性靶向肺癌细胞,并能发出荧光。
(2)具有比传统量子点更低的毒性;以及
(3)制备工艺简单,适用性广,可用于大规模化的生产。
附图说明
图1是量子点示意图。
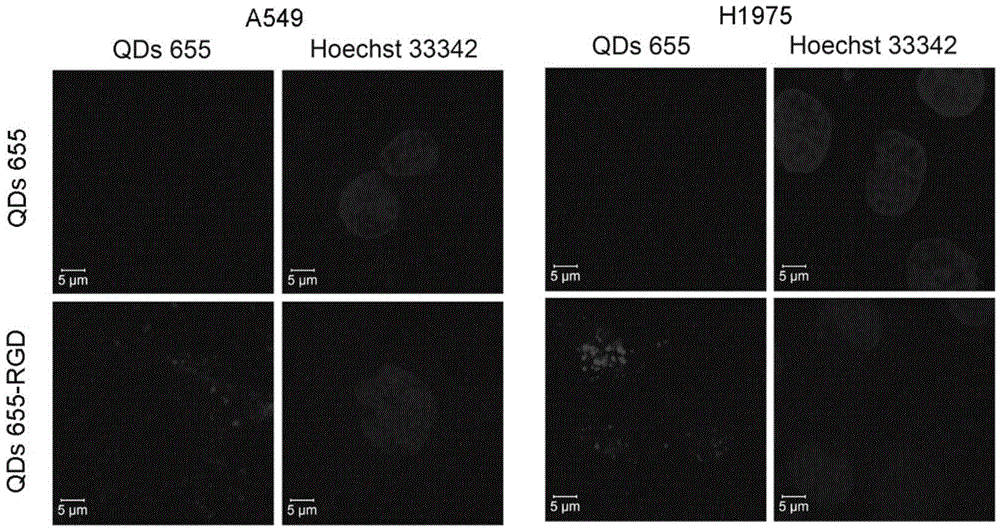
图2是本量子点制剂与传统量子点的肿瘤细胞成像比较。
图3与细胞自噬抑制剂组成的量子点与传统量子点的体内毒性对比。
具体实施方式
实施例1制备量子点制剂
(1)制备量子点:将适量的CdCl2、NaHTe及MPA置入反应器中,用pH=9.0的NaBH4溶解后在氮气的保护下于95℃连续反应16小时,然后于反应器中加入一定量的Na2S,于60℃连续反应1.5小时,反应器中的Cd:Te:S:MPA比例为1:0.45:0.0125:4.161,保存于2℃;
(2)制备靶向肺癌的量子点:将C-RGD以溶解于PBS(pH=7.4)中并制成1mg/mL的RGD短肽溶液(4℃下溶解),之后按摩尔比1:1加入制备的量子点,于4℃反应4小时即得;
(3)制备量子点制剂:将氯喹溶解于0.01M PBS(pH=7.4)中并制成10μM的氯喹溶液,后将制备的带有RGD的量子点溶于该溶液中,使得重金属浓度Cd2+=1μM;所得量子点制剂的鉴定如图1所示,图1显示了量子点溶液中CdTe量子点,表1显示了该量子点的粒径为12nm左右,Zeta电位为-32.9mV左右,最大激发波长为259nm,最大发射波长为656nm,具有量子点应有的性质。
表1.量子点表征统计表:
实施例2.本发明制得的量子点与普通量子点的肺癌靶向性比较实验
取肺癌A549细胞和H1975细胞种于激光共聚焦皿上(1×105个),培养24h后待细胞贴壁;分别加入本量子点与普通传统量子点(20nM)共同孵育2小时后用PBS洗涤细胞3次并用激光共聚焦观察细胞结合量子点的情况,如图2所示,A549细胞在与传统量子点共孵育2h后无明显荧光,而与本靶向肺癌的量子点制剂共孵育2h后细胞膜及细胞内有明显的荧光,证明本量子点特异性靶向并能结合到肺癌细胞上。
实施例3.本量子点制剂的体内毒性评价试验
将0.2nmol的量子点及本制得的量子点制剂分别由尾静脉注射入小鼠体内,分别观察30天,30天内各组均无小鼠死亡,常规对小鼠处理后进行取血分析并解剖分析其脏器,结果如图3所示,30天后普通量子点的肝,肾和脾脏均出现了较严重的损伤,本制得的量子点制剂对肝肾脾造成的损伤显示明显小于普通量子点所造成的损伤,证明制得的量子点制剂在体内相对的低毒性,与细胞自噬抑制剂制成新型制剂能减轻量子点在体内的毒性。
- 还没有人留言评论。精彩留言会获得点赞!