一种靶向性载药硅质体及制备和应用的制作方法
本发明是复合型医药材料制备和应用,涉及一种包埋药物的颗粒型材料,一种靶向性载药硅质体及制备和应用,是脂质体技术与硅质载体技术的交叉应用。
背景技术:
脂质体具有仿生细胞膜脂质双层结构,进入体内被网状内皮系统吞噬而激活机体的自身免疫功能,改变被包封药物的体内分布、使药物在肝、脾、肺和骨髓等组织器官中蓄积、从而提高药物的治疗指数、减少药物治疗剂量和降低药物的毒性。研究表明,脂质体包裹的阿霉素比游离毒性要降低50%~70%。多种脂质体型药物注射液已经得到FDA批准,如两性霉素、多柔比星、柔红霉素和紫衫醇等。然而,脂质体作为药物载体有着存在稳定性差、制剂成本高等局限性。其脂质表面特性如双层膜流动性、表面电荷等给制备技术及工业化生产带来很大难度。脂质体与血浆蛋白之间相互作用容易导致脂质体去稳定化,在包埋一些两亲性药物时极不稳定。靶向型脂质体,及靶向集团修饰脂质体技术,利用靶向型多肽修饰表面,主动靶向将药物浓集定位于靶组织、靶器官、靶细胞或细胞内部机构中。靶向性脂质体是指在脂质体表面联接识别分子(如Lyp-1,cRGD,angiopep-2,RPARPAR,RGERPPR,iNGR等),通过识别分子特异性专一地与靶细胞表面的互补相互作用,将脂质体转运到靶区释放药物。
硅质体材料,即通过溶胶/凝胶法和自组装过程形成的一种新型运载材料,硅质体中Si的含量低于4%,脂质层中形成一层原子厚度的硅氧网络结构,增加了稳定性,解决了稳定性差的问题。与脂质体一样,硅质体具有脂质双层膜囊泡结构,生物相容性好,并且可以生物降解,不会残留在生物体内。它不仅可以包埋亲水性、亲油性药物,甚至还可两亲性药物。利用硅质体作为药物载体可以输送小分子抗癌药物、蛋白质药物、基因以及磁性颗粒等各种不同功能的物质,从而实现多种药物或多种治疗方法的联合,使之成为诊断癌症和杀死癌细胞的有力工具。通过调控硅质体表面Si-O-Si的缩合度,可控制内载药物的释放速率。研究证明,随着Si-O-Si缩合度增加,药物释放速率降低。
阿霉素(Dox)作为临床使用频繁的化疗药物,具有抗癌谱广、化疗指数高,其副作用存在有骨髓移植、恶心、呕吐、脱发、高热等症状,累计剂量大时会发生心肌坏死甚至充血性心力衰竭。使用二氧化硅材料包埋阿霉素药物形成的纳米药物具有缓释功能,延长药物作用时间,增加在体内的半衰期,保护被包埋的药物分子不受体内酶的破坏,增强生物相容性等特点。本发明解决的技术问题是靶向脂质体载体稳定性弱,易氧化的问题,提供一种具有靶向指向作用的稳定性好、生物相容性高、缓释时间长、载药量大、药物包裹效率高的包覆方法, 同时工艺简单、成本低的优点。硅质复合结构克服脂质体不稳定的特点,同时又能发挥靶向性脂质体细胞靶向的功能。
技术实现要素:
本发明针对脂质体包封药物稳定性的不足,提供一种靶向性载药硅质体及制备和应用。使用硅酸四乙酯水解后形成的二氧化硅壳层包载水溶性药物分子,而后靶向性脂质分子物理吸附于药物颗粒表层形成复合结构,并使其具有特定的组织靶向性。
一种靶向性载药硅质体的制备方法,其特征在于,具体步骤如下:
(1)硅质体原料的合成:
三颈瓶中加入十六烷胺和乙醇溶剂,充分溶解后加入1/2摩尔量的溴代十六烷,加入催化剂无水碳酸钠,回流120h后停止反应,反复精制得到双十六烷胺;将双十六烷胺与琥珀酸酐加入干燥的四氢呋喃中,充分反应24h,浓缩,用氯仿溶解后依次用10%柠檬酸及饱和氯化钠洗涤分液,溶剂蒸发后得粗产品,然后用乙腈重结晶精制;
(2)靶向性脂质体原料的制备:
将肿瘤细胞穿膜肽溶于PBS溶液中,取马来酰亚胺-聚乙二醇-磷脂复合物(DSPE-PEG-MAL),其摩尔当量为肿瘤细胞穿膜肽的0.8倍,溶于二甲基甲酰胺,加入多肽水溶液中,超声去除气泡,搅拌反应1小时至DSPE-PEG-Mal反应完全,透析,截留分子量3500Da,透析介质为水,去除过量的肿瘤细胞穿膜肽和DMF,冷冻干燥,得到肿瘤细胞穿膜肽-PEG-DSPE材料;
(3)靶向性脂质插入硅质复合体的制备:
将处方的摩尔组成为硅质材料/胆固醇/ mPEG-DSPE/肿瘤穿膜肽-PEG-DSPE=55:45:2:1,将各组分用氯仿溶解,旋转蒸发去除溶剂,加水溶液至脂质膜中,超声分散并在水浴60度旋转震荡,得脂质体混悬液;挤压过50nm孔径大小的碳酸脂膜,得到粒径大小均匀的靶向性硅质体;载药时,将处方的摩尔组成为硅质材料/胆固醇/ mPEG-DSPE/肿瘤穿膜肽-PEG-DSPE=55:45:2:1,将各组分用氯仿溶解,旋转蒸发去除溶剂,再加入多柔比星等药物,加水溶液至脂质膜中,超声分散并在水浴60度旋转震荡,得脂质体混悬液;挤压过50nm孔径大小的碳酸脂膜,得到载药型粒径大小均匀的靶向性硅质体。
所述的肿瘤细胞穿膜肽为Lyp-1,cRGD,angiopep-2,RPARPAR,RGERPPR,iNGR中的一种或其组合。
肿瘤细胞穿膜肽为多种类型以针对不同肿瘤细胞,具体为脑胶质瘤细胞、胰腺癌细胞、乳腺癌细胞和前列腺癌细胞中的一种。
一种靶向性载药硅质体,其特征在于,根据上述任一所述方法制备得到。
一种靶向性载药硅质体的应用。
本发明解决的技术问题是克服靶向性脂质体稳定性弱,易氧化的问题。靶向脂质体复合硅质体包载阿霉素,提供一种具有靶向指向作用的稳定性好、生物相容性高、缓释时间长、载药量大、药物包裹效率高的包覆方法, 同时工艺简单、成本低的优点。
是脂质体技术与无机颗粒载体技术的交叉应用。通过将合成硅质体材料与靶向脂质体材料复合,硅质水解于药物外部形成壳层,随后将含有不同靶向基团的脂质体形成外壳层,此复合机构实现针对不同肿瘤组织靶向。本发明提供一种具有靶向指向作用的稳定性好、生物相容性高、缓释时间长、载药量大、药物包裹效率高的包覆方法。
本发明有如下优势:该方法使用的硅质材料水化后形成稳定SiO2为内壳层,增强药物的稳定性,同时具有药物缓释效果;靶向性脂质体作为外壳层包覆于SiO2@DOX外层,赋予特异性的细胞靶向性。操作简便,成本低,容易工业化实现;
本复合结构具有高生物相容性,也可包裹CdS量子点等发光材料,轻易实现靶向组织荧光成像。
附图说明
图1为实施例1,2所得的硅质体SEM照片。
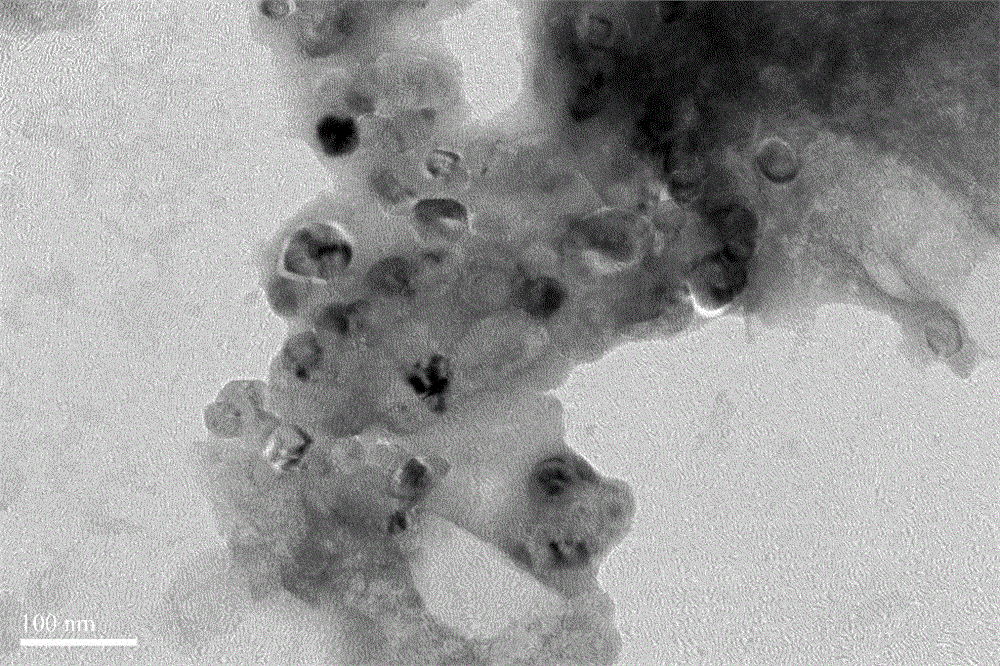
图2为实施例3,4所得的靶向脂质/硅质体TEM照片。
图3为实施例1,2,3,4所得的共聚焦U87MG和NIH3T3细胞吞噬照片。
图4为实施例2,4所得24小时载阿霉素对U87MG的杀伤率。
图5为实施例1,3载体材料对NIH3T3的生存率。
具体实施方式
以下通过具体的实施例对本发明的技术方案作进一步描述。以下的实施例是对本发明的进一步说明,而不限制本发明的范围。
实施例1:
纯硅质体:采用薄膜水化法制备硅质体,称取3mg 硅质材料在pH=3 的酸性乙醇溶液中酸化后置于25mL圆底烧瓶中,旋转蒸发干以后加入4ml去离子水,将烧瓶放入55摄氏度恒温水浴中水化薄膜约30min。水浴超声后,即可得到硅质体悬液。将硅质体悬液稀释滴在铝箔干燥后,形貌SEM照片如图。
实施例2:
纯硅质体@阿霉素:采用薄膜水化法制备硅质体,称取3mg 硅质材料在pH=3 的酸性乙醇溶液中酸化后置于25mL圆底烧瓶中,旋转蒸发干以后,加入一定量的阿霉素溶液(硅质:阿霉素摩尔比为30:1)到圆底烧瓶中,缓慢旋转蒸发(55摄氏度水浴,90r/min)除去溶剂,加入4ml去离子水,将烧瓶放入55摄氏度恒温水浴中水化薄膜约30min。水浴超声后,即可得到硅质体@阿霉素悬液,将悬液加入离心管中,在6000rpm下离心10min,透析。除去硅质体中未包裹的游离阿霉素。所得悬液室温避光过夜使之形成硅酸盐网络,4摄氏度冰箱避光保存待用。
实施例3:
靶向性硅质: 采用薄膜水化法制备硅质体,将处方的摩尔组成为硅质材料/胆固醇/ mPEG-DSPE/肿瘤穿膜肽-PEG-DSPE=55:45:2:1,将各组分用氯仿溶解,旋转蒸发去除溶剂。称取3mg 上述材料在pH=3 的酸性乙醇溶液中酸化后置于25mL圆底烧瓶中,旋转蒸发干以后加入4ml去离子水,将烧瓶放入55摄氏度恒温水浴中水化薄膜约30min。水浴超声后,即可得到靶向硅质体悬液。
实施例4:
靶向性硅质@阿霉素: 采用薄膜水化法制备靶向性硅质体@阿霉素,将处方的摩尔组成为硅质材料/胆固醇/ mPEG-DSPE/肿瘤穿膜肽-PEG-DSPE=55:45:2:1,将各组分用氯仿溶解,旋转蒸发去除溶剂。纯硅质体@阿霉素:采用薄膜水化法制备硅质体,称取3mg 硅质材料在pH=3 的酸性乙醇溶液中酸化后置于25mL圆底烧瓶中,旋转蒸发干以后,加入一定量的阿霉素溶液(硅质:阿霉素摩尔比为30:1)到圆底烧瓶中,缓慢旋转蒸发(55摄氏度水浴,90r/min)除去溶剂,加入4ml去离子水,将烧瓶放入55摄氏度恒温水浴中水化薄膜约30min。水浴超声后,即可得到硅质体@阿霉素悬液,将悬液加入离心管中,在6000rpm下离心10min,透析。除去硅质体中未包裹的游离阿霉素。所得悬液室温避光过夜使之形成硅酸盐网络,4摄氏度冰箱避光保存待用。
硅质体及靶向型硅质体纳米粒子的形貌考察:将实施例1,2,3,4制得的硅质体,硅质体@阿霉素、靶向硅质体和靶向硅质体@阿霉素的照片,可以看到尺寸均分布在100-300nm之间如图1,2 所示。
纳米粒子的体外靶向性考察:在无血清培基中(200μL),将实施例1,3 制得的具有荧光发光性能普通硅质体2@阿霉素,和靶向硅质体@阿霉素分别与靶向性细胞U87mg (105/mL)在CO2孵育箱下25℃孵育24 hour ;然后用800μL 的PBS溶液液离心清洗细胞两次,将非特异性吸附在细胞表面的纳米颗粒清除;第二次离心后,用200μL 的PBS 重新将细胞分散并在在激光共聚焦显微镜下观察普通硅质体2@阿霉素,和靶向硅质体@阿霉素, 对靶向性细胞U87mg的识别情况,其观察结果如图3所示。普通硅质材料,对U87mg细胞的吞噬率为45%,靶向硅质体对细胞的吞噬率为90%;这说明实施例3中修饰到硅质体表面的穿模肽会增强U87mg细胞摄取的EPR效应。
硅质体对肿瘤细胞靶向杀伤效果的评价:参照实施例2, 4 的步骤制备普通硅质体2@阿霉素和靶向硅质体@阿霉素。为考察其选择性杀伤效果,选取对U87mg细胞,以2×104个细胞/ 孔的浓度接种于96 孔细胞培养板内( 每孔100μL 培基),加入10μL 不同浓度的药物材料,在无血清培基中37℃、5%的CO2条件下孵育32小时;共孵育后75μL 无血清培养基溶液去除,补充含10%血清的新鲜培基至100μL,继续培养4h ;10μL Cell Counting Kit 单溶液细胞增殖检测试剂盒加入每孔,孵育4h ;直接在酶标仪490nm 处读数据,计算出细胞在不同浓度作用下的存活率。由图4 可见,游离阿霉素药物、普通硅质体2@阿霉素,和靶向硅质体@阿霉素在1~ 50μnmol 的浓度范围内U87mg细胞的影响。随着药物浓度增大,细胞的存活率呈下降趋势,细胞杀伤率高低顺序依次为阿霉素 > 靶向硅质体@阿霉素 > 硅质体@阿霉素。
硅质体安全性评价:参照实施例1,3 的步骤制备普通硅质体2、脂质体和靶向硅质体。为考察其选择性杀伤效果,选取对NIH3T3细胞,以2×104个细胞/ 孔的浓度接种于96 孔细胞培养板内( 每孔100μL 培基),加入10μL 不同浓度的药物材料,在无血清培基中37℃、5%的CO2条件下孵育32小时;共孵育后75μL 无血清培养基溶液去除,补充含10%血清的新鲜培基至100μL,继续培养4h ;10μL Cell Counting Kit 单溶液细胞增殖检测试剂盒加入每孔,孵育4h ;直接在酶标仪490nm 处读数据,计算出细胞在不同浓度作用下的存活率。由图5 可见,细胞的存活率无明显趋势,说明硅质体载体材料安全性高。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种肿瘤靶向丝胶蛋白胶束及其制备方法和应用与流程
- 一种靶向缺血心肌的VEGF重组蛋白的制作方法与工艺
- 一种胰岛靶向蛋白及其真核表达方法与流程
- 一种基于Ion Torrent测序平台的靶向叶绿体测序方法与流程
- 用于癌症靶向治疗的包含基于重组血红蛋白蛋白质或亚基的治疗剂的药物组合物的制作方法与工艺
- 基于STAT3蛋白靶点的靶向抗癌药物的发明的制作方法与工艺
- 靶向泛素化降解PLK1和BRD4蛋白的化合物及其应用的制造方法与工艺
- 抗HBV复制的靶向融合蛋白及其构建方法与流程
- 靶向于钙粘着蛋白‑11的EC1结构域的人源化抗体及相关组合物和方法与流程
- 用于刺激靶向热休克蛋白以及促进蛋白质修复的脉冲电磁和超声疗法的制造方法与工艺