功能靶向性载体材料二硬脂酰基磷脂酰乙醇胺-聚乙二醇-苯基葡萄糖苷及其制备方法与应用与流程
本发明属于药物领域,涉及一种功能靶向性载体材料二硬脂酰基磷脂酰乙醇胺-聚乙二醇-苯基葡萄糖苷及其制备方法与应用。
背景技术:
4-氨基苯基-β-D-葡萄糖苷(4-Aminophenylβ-D-glucopyranoside,GLU),又称对氨基苯基葡萄糖苷,是一种葡萄糖衍生物。葡萄糖是生命活动中必不可少的物质之一,能够直接参与细胞的代谢活动,并提供细胞生长所需的能量。血脑屏障内皮细胞上具有大量表达的葡糖糖转运体(GLUTs),用以将脑部所必需的营养物质葡萄糖从血液中主动摄取入脑。与此同时,肿瘤细胞中通常存在有一种特殊的糖代谢机制——它们比正常的组织需要更多的葡萄糖用于糖酵解,因此也相应地高度表达协助葡萄糖转运进入细胞的葡萄糖转运体。脑胶质瘤细胞中有显著过度表达的GLUT 1葡萄糖转运体。最新实验研究发现,另一种葡萄糖转运体GLUT 3可作为脑胶质瘤干细胞的生物标记物,其在脑胶质瘤干细胞中特异性的高表达能够帮助脑胶质瘤干细胞竞争葡萄糖,以适应脑肿瘤区域葡萄糖缺乏的恶劣环境。
二硬脂酰基磷脂酰乙醇胺-聚乙二醇(DSPE-PEG2000)是一种用于长循环脂质体制备的材料。1992年Maruyama等就报导了将DSPE-PEG2000材料用于大单层脂质体的制备,可以显著增加药物在血液系统中循环时间的实验结果。由于长链PEG的存在,修饰有二硬脂酰基磷脂酰乙醇胺-聚乙二醇材料的脂质体可以有效避免人体内网状内皮系统(RES)对脂质体的清除,从而提高载药系统在血液循环系统中的稳定性,使其具有生物学稳定的性质,延长脂质体在体内的循环时间。并且,该种具有适当粒径的长循环脂质体可以在肿瘤组织的非正常血管区域表现出渗透与滞留增强效应(enhanced permeability and retention effect,EPR effect),可以实现肿瘤部位的被动靶向,从而增加药物在肿瘤部位的聚集。
技术实现要素:
本发明的目的是提供一种功能靶向性载体材料二硬脂酰基磷脂酰乙醇胺-聚乙二醇-苯基葡萄糖苷及其制备方法与应用。
本发明提供的式I所示化合物,也即DSPE-PEG2000-GLU,其结构式如式I所示,
本发明提供的制备式I所示化合物的方法,包括如下步骤:
将式II所示化合物(也即4-氨基苯基-β-D-葡萄糖苷(4-Aminophenylβ-D-glucopyranoside,GLU))和式III所示化合物(也即二硬脂酰磷脂酰乙醇-聚乙二醇-N-琥珀酰亚胺(DSPE-PEG2000-NHS))于溶剂中进行取代反应,反应完毕得到所述式I所示化合物;
上述方法中,所述溶剂选自DMF、DMSO和氯仿中的至少一种;
所述式II所示化合物和式III所示化合物的投料摩尔比为1:5-15,优选为1:10,质量比为1:1;
所述式II所示化合物与所述溶剂的用量比为3mg:0.1-2mL,优选为3mg:0.5mL;
所述取代反应步骤中,温度通常为室温,时间通常为24h-48h,优选为48h;该取代反应是由GLU分子上的氨基亲核取代DSPE-PEG2000-NHS上的NHS基团形成酰胺键而得式I;
所述取代反应可在惰性气氛中进行;所述惰性气氛具体为氩气气氛
所述方法还包括如下步骤:在所述反应完毕后,将所得反应体系置于截留分子量为2500Da左右的透析袋中用水进行透析;
所述透析步骤中,时间通常为36h-72h,优选为48h。
所述方法还包括如下步骤:在所述用水进行透析步骤之后,将透析所得液体进行冻干的步骤。经过该冻干步骤,可得到干燥的呈现白色粉末状的式I所示化合物。
另外,上述本发明提供的式I所示化合物在制备靶向性产品中的应用,也属于本发明的保护范围。其中,所述靶向性产品为靶向性药物制剂,具体为靶向性脂质体,更具体为靶向性柔红霉素脂质体、靶向性香豆素脂质体或靶向性DiR脂质体。
本发明还提供了一种制备GLU修饰的靶向性空白脂质体的方法,为以卵磷脂、胆固醇、式I所示化合物和DSPE-PEG2000为原料制得;
该方法具体包括如下步骤:
1)将卵磷脂、胆固醇、式I所示化合物和DSPE-PEG2000于有机溶剂中溶解后,旋转蒸发减压干燥除去所述有机溶剂,得到脂膜;
所述DSPE-PEG2000的结构式如式IV所示:
2)向步骤1)所得脂膜中加入硫酸铵水溶液,进行水浴超声5min后,再在超声波细胞粉碎机进行超声,将超声所得含有粗脂质体的液体通过孔径为400nm的聚碳酸酯膜3次后,再通过孔径为200nm的聚碳酸酯膜3次后,于透析袋中透析,得到所述GLU修饰的靶向性空白脂质体。
上述方法的步骤1)中,所述有机溶剂为氯仿、二氯甲烷或二氯甲烷与甲醇的混合溶剂;
所述卵磷脂、胆固醇、式I所示化合物和DSPE-PEG2000的投料摩尔比为60-65:30-35:0.5-5:0.5-5,具体为63:32.5:0.5:4;
所述步骤2)中,硫酸铵水溶液的浓度为200-300mM mM,具体为250mM;
所述水浴超声步骤中,超声的能量为100-200W;温度为20-30℃;
所述在超声波细胞粉碎机进行超声的步骤中,超声的能量为100-300W,具体为200W;温度为20-40℃,具体为35℃;超声工作时间为10s,间歇时间为10s,全程时间为10min;
所述透析步骤中,透析袋的截留分子量为10,000-12,000Da;透析的时间为12-48小时,具体为24小时;
透析所用试剂为HBS缓冲溶液;
所述HBS缓冲液的成分如下:151mMNaCl、25.2mMHepes,PBS pH值为7.4。
另外,按照上述方法得到的GLU修饰的靶向性空白脂质体,也属于本发明的保护范围。
本发明还提供了一种GLU修饰的靶向性柔红霉素脂质体,为以前述本发明提供的GLU修饰的靶向性空白脂质体和柔红霉素为原料制得。
上述GLU修饰的靶向性柔红霉素脂质体中,所述GLU修饰的靶向性柔红霉素脂质体的包封率大于90%。
本发明提供的制备所述GLU修饰的靶向性柔红霉素脂质体或靶向性香豆素脂质体的方法,为以所述GLU修饰的靶向性空白脂质体和盐酸柔红霉素的水溶液为原料制得;
该方法具体包括如下步骤:将所述GLU修饰的靶向性空白脂质体和盐酸柔红霉素的水溶液于水浴中振荡,得到所述GLU修饰的靶向性柔红霉素脂质体。
上述方法中,所述盐酸柔红霉素和所述GLU修饰的靶向性空白脂质体脂材的质量比为1:10-100,具体为1:20;
所述振荡步骤中,温度为35-70℃,具体为60℃;
时间为10-45min,具体为20min。
上述本发明提供的GLU修饰的靶向性柔红霉素脂质体在制备真核生物肿瘤细胞增殖的抑制剂、制备真核生物肿瘤细胞凋亡诱导剂、制备真核生物肿瘤细胞内caspase8和/或caspase 3活化诱导剂和提升真核生物肿瘤细胞的摄取中任意一种的应用及所述GLU修饰的靶向性柔红霉素脂质体或靶向性香豆素脂质体在制备预防和/或治疗肿瘤的药物中的应用,也属于本发明的保护范围;
其中,所述真核生物具体为哺乳动物;所述肿瘤细胞具体为癌细胞;所述癌细胞具体为脑胶质瘤细胞,更具体为鼠源C6细胞或脑胶质瘤干细胞;
所述肿瘤具体为脑胶质瘤,更具体为脑胶质瘤干细胞。
本发明还提供了制备PEI和GLU共同修饰的功能靶向性空白脂质体的方法,该方法为以卵磷脂、胆固醇、DSPE-PEG2000-PEI600化合物和所述式I所示化合物为原料制得;
所述DSPE-PEG2000-PEI600化合物为由重复结构单元a、重复结构单元b及端基-NH2构成的聚合物;
其中,所述重复结构单元a为-NHCH2CH2-,总个数为x,x为0-15;
重复结构单元b为-N(CH2CH2NH2)CH2CH2-,总个数为y,y为1-10。
该方法具体包括如下步骤:
1)将卵磷脂、胆固醇、DSPE-PEG2000-PEI600化合物和所述式I所示化合物于有机溶剂中溶解后,旋转蒸发减压干燥除去所述有机溶剂,得到脂膜;
2)向步骤1)所得脂膜中加入硫酸铵水溶液,进行水浴超声5min后,再在超声波细胞粉碎机进行超声,将超声所得含有粗脂质体的液体通过孔径为400nm的聚碳酸酯膜3次后,再通过孔径为200nm的聚碳酸酯膜3次后,于透析袋中透析,得到所述PEI和GLU共同修饰的功能靶向性空白脂质体。
上述方法的步骤1)中,所述有机溶剂为氯仿、二氯甲烷或二氯甲烷与甲醇的混合溶剂;
所述卵磷脂、胆固醇、式I1所示化合物和所述式I所示化合物的投料摩尔比为60-65:30-35:0.5-5:0.5-5,具体为63:32.5:0.5:4;
所述步骤2)中,硫酸铵水溶液的浓度为200-300mM,具体为250mM;
所述水浴超声步骤中,超声的能量为100-200W;温度为20-30℃;
所述在超声波细胞粉碎机进行超声的步骤中,超声的能量为100-300W,具体为200W;温度为20-40℃,具体为35℃;超声工作时间为10s,间歇时间为10s,全程时间为10min;
所述透析步骤中,透析袋的截留分子量为10,000-12,000Da;透析的时间为12-48小时,具体为24小时;
透析所用试剂为HBS缓冲溶液;
所述HBS缓冲液的成分如下:151mMNaCl、25.2mMHepes(羟乙基哌嗪乙硫磺酸),PBS pH值为7.4。
按照上述方法制备得到的PEI和GLU共同修饰的功能靶向性空白脂质体,也属于本发明的保护范围。
另外,上述本发明提供的PEI和GLU共同修饰的功能靶向性空白脂质体在制备真核生物肿瘤细胞增殖的抑制剂、制备真核生物肿瘤细胞凋亡诱导剂、制备真核生物肿瘤细胞内caspase 8和/或caspase 3活化诱导剂和提升真核生物肿瘤细胞的摄取中任意一种的应用及所述PEI和GLU共同修饰的功能靶向性空白脂质体在制备预防和/或治疗肿瘤的药物中的应用,也属于本发明的保护范围;
其中,所述真核生物具体为哺乳动物;所述肿瘤细胞具体为癌细胞;所述癌细胞具体为脑胶质瘤细胞,更具体为鼠源C6细胞或脑胶质瘤干细胞;
所述肿瘤具体为脑胶质瘤,更具体为脑胶质瘤干细胞。
本发明提供的PEI和GLU双重修饰的靶向性柔红霉素脂质体,为以所述PEI和GLU双重修饰的靶向性空白脂质体和柔红霉素为原料制得。
上述PEI和GLU双重修饰的靶向性柔红霉素脂质体中,所述PEI和GLU双重修饰的靶向性柔红霉素脂质体的包封率大于90%。
本发明提供的制备所述PEI和GLU双重修饰的靶向性柔红霉素脂质体的方法,该方法为以所述PEI和GLU双重修饰的靶向性柔红霉素脂质体和盐酸柔红霉素的水溶液为原料制得;
该方法具体包括如下步骤:将所述PEI和GLU双重修饰的靶向性柔红霉素脂质体和盐酸柔红霉素的水溶液于水浴中振荡,得到所述PEI和GLU双重修饰的靶向性柔红霉素脂质体。
上述方法中,所述盐酸柔红霉素和所述PEI和GLU双重修饰的靶向性空白脂质体的质量比为1:10-100,具体为1:20;
所述振荡步骤中,温度为35-70℃,具体为60℃;
时间为10-45min,具体为20min。
另外,上述本发明提供的PEI和GLU双重修饰的靶向性柔红霉素脂质体或靶向性香豆素脂质体在制备真核生物肿瘤细胞增殖的抑制剂、制备真核生物肿瘤细胞凋亡诱导剂、制备真核生物肿瘤细胞内caspase 8和/或caspase 3活化诱导剂和提升真核生物肿瘤细胞的摄取中任意一种的应用及所述PEI和GLU双重修饰的靶向性柔红霉素脂质体在制备预防和/或治疗肿瘤的药物中的应用,也属于本发明的保护范围;
其中,所述真核生物具体为哺乳动物;所述肿瘤细胞具体为癌细胞;所述癌细胞具体为脑胶质瘤细胞,更具体为鼠源C6细胞或脑胶质瘤干细胞;
所述肿瘤具体为脑胶质瘤,更具体为脑胶质瘤干细胞。
本发明中制备了一种脂质-葡萄糖衍生物的功能性载体材料DSPE-PEG2000-GLU,并采用该种功能性载体材料修饰载药脂质体,使其能够经由葡萄糖转运体介导的方式跨越血脑屏障并靶向肿瘤细胞。
本发明将DSPE-PEG2000-GLU化合物作为靶向性分子修饰于载药脂质体表面,能够使药物有效通过血脑屏障,选择性聚集于肿瘤细胞,产生靶向作用。比如,使C6脑胶质瘤细胞及脑胶质瘤干细胞在低糖环境下对药物的摄取比率显著提高,使药物对脑胶质瘤细胞表现为更强的生长抑制作用,使药物显示出更强的跨越血脑屏障、杀伤脑胶质瘤干细胞的效应,即双重靶向性作用,可延长药物在ICR小鼠体内的循环时间和在肿瘤组织中的聚集程度,从而延长生物的生存期。本发明的这些特性使得本发明较现有发明具有优越性。
附图说明
图1为本发明DSPE-PEG2000-GLU化合物的合成路线。
图2为GLU,DSPE-PEG2000-NHS和DSPE-PEG2000-GLU结合物的1H NMR图谱。
图3为PEI600、GLU双重修饰的的柔红霉素脂质体的粒径分布。
图4为柔红霉素从PEI600、GLU双重修饰的的柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体和柔红霉素脂质体的体外释放率结果。
图5为脑胶质瘤干细胞在低糖环境下对GLU修饰的靶向性柔红霉素脂质体的摄取情况。
图6为PEI600、GLU双重修饰的的靶向性香豆素脂质体和GLU修饰的靶向性香豆素脂质体与脑胶质瘤干细胞葡萄糖转运体GLUT 1的靶向性效应。
图7为柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体和PEI600、GLU双重修饰的的靶向性柔红霉素脂质体对脑胶质瘤干细胞的抑制作用。
图8(A)为BMVEC/脑胶质瘤干细胞共培养模型;(B)为柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体和PEI600、GLU双重修饰的靶向性柔红霉素脂质体在跨越血脑屏障后对脑胶质瘤干细胞的生长抑制情况。(a)柔红霉素脂质体;(b)PEI修饰的靶向性柔红霉素脂质体;(c)GLU修饰的靶向性柔红霉素脂质体;(d)功能靶向性柔红霉素脂质体。
图9柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体和PEI600、GLU双重修饰的的靶向性柔红霉素脂质体对细胞内凋亡蛋白Caspase 3、Caspase 8、Bax和Mcl 1的表达情况进行测定的荧光图谱。(A)脑胶质瘤干细胞内Caspase 3,Caspase 8和Bax在高内涵系统下的表达情况的荧光图像。(B)Caspase 3的活性比率;(C)Caspase 8的活性比率;(D)Bax的活性比率;(E)Mcl 1的活性比率.(1)空白培养基;(2)柔红霉素脂质体;(3)PEI修饰的靶向性柔红霉素脂质体;(4)GLU修饰的靶向性柔红霉素脂质体;(5)功能靶向性柔红霉素脂质体。
图10(A)为DiR标记的GLU修饰的靶向性脂质体和PEI600、GLU双重修饰的的靶向性脂质体在脑胶质瘤荷瘤ICR小鼠体内的分布和肿瘤蓄积能力;(B)为尾静脉注射游离DiR、DiR脂质体、GLU修饰的靶向性DiR脂质体和PEI600、GLU双重修饰的的靶向性DiR脂质体在ICR小鼠体内48h后,解剖出心、肝、脾、肺、肾和荷瘤脑组织的体外成像结果。(a)DiR脂质体;(b)PEI修饰的靶向性DiR脂质体;(c)GLU修饰的靶向性DiR脂质体;(d)PEI600、GLU双重修饰的DiR脂质体;(e)游离DiR。
图11脑胶质瘤荷瘤小鼠在肿瘤接种并接受各个制剂组治疗后的卡普兰-迈耶生存曲线。
具体实施方式
下面结合具体实施例对本发明作进一步阐述,但本发明并不限于以下实施例。所述方法如无特别说明均为常规方法。所述原材料如无特别说明均能从公开商业途径获得。
二硬脂酰基磷脂酰乙醇胺-聚乙二醇-N-琥珀酰亚胺(1,2-distearoyl-sn-glycero-3-phosphatidylethanolamine-polyethyleneglycol2000-N-hydroxysuccin-imide,DSPE-PEG2000-NHS),购自日本油脂株式会社(日本NOF公司),产品目录号为M139522。
4-氨基苯基-β-D-葡萄糖苷(4-Aminophenylβ-D-glucopyranoside,GLU),购自美国Sigma-Aldrich公司,产品目录号为012M4005V。
二甲基甲酰胺(Dimethylformamide,DMF),购自美国Acros Organics公司,产品目录号为1339870。
蛋黄卵磷脂(EPC)购自日本油脂株式会社,产品目录号为108057-3。
胆固醇购自北京市海淀区微生物培养基制品厂,批号20020106。
DSPE-PEG2000购自日本油脂株式会社,产品目录号M86563。
下述实施例所用DSPE-PEG2000-PEI600化合物中,重复结构单元a和b的连接方式不固定,可为各种连接方式。
具体的,所述DSPE-PEG2000-PEI600化合物,可为依次由重复结构单元a、重复结构单元b及端基-NH2连接而成的聚合物。
该化合物的制备方法包括如下步骤:将20μmolPEI600(x为0-15,y为1-10)和20μmol式III所示化合物DSPE-PEG2000-NHS溶解在4ml无水DMF中,将反应液混合物在室温、氩气保护下用磁力搅拌器轻轻搅拌24h进行取代反应,反应完毕得到粗产物,继而将粗产物转移到再生纤维素透析袋(截留分子量2500),在去离子水中透析48h,除去未反应的PEI和DMF溶剂。接下来将反应液冻干,得到干燥白色粉末,在-20℃条件下保存。
实施例1、式I所示化合物功能靶向性载体材料DSPE-PEG2000-GLU的合成与表征
将3mg式II所示化合物GLU和3mg式III所示化合物DSPE-PEG2000-NHS溶解在0.5ml无水DMF中,将反应液混合物在室温、避光、氩气保护下用磁力搅拌器轻轻搅拌进行取代反应48h,反应完毕得到粗产物,继而将粗产物转移到再生纤维素透析袋(截留分子量2000),在去离子水中透析48h,除去未反应的GLU和DMF溶剂。接下来将反应液冻干,得到干燥白色粉末式I所示产物,在-20℃条件下保存。
该产物的合成路线如图1所示。
反应产物采用核磁共振氢谱(1H NMR)进行检测验证反应目标产物的存在。1H NMR使用氘代二甲基亚砜(DMSO)为溶剂,使用4-甲基硅烷(TMS,δ=0ppm)进行定标。图2为GLU、DSPE-PEG2000-NHS和DSPE-PEG2000-GLU分子的1H NMR谱图。如图所示,GLU及DSPE-PEG2000-NHS分子的特征峰都可在反应产物DSPE-PEG2000-GLU的1H NMR谱图中找到。可见,所得产物结构正确,为目标产物。
实施例2、脂质体的制备与表征
1)GLU修饰的靶向性空白脂质体的制备
a、精密称取卵磷脂(EPC)、胆固醇(CHOL)、DSPE-PEG2000-GLU、DSPE-PEG2000按摩尔比63:32.5:4:0.5于茄形瓶中,加入适量氯仿溶解,然后在40℃水浴、40rpm转速下通过旋转蒸发减压干燥除去有机试剂,在茄形瓶底部及内壁形成一层薄薄的均匀脂膜;
b、向步骤1)所得脂膜中加入适量250mM硫酸铵溶液水化:先在水浴中超声5min,超声能量为100W,至形成乳白色均匀的粗脂质体后转移到JY92-IID型超声波细胞粉碎机中进一步超声(设置超声工作时间为10s,间歇时间为10s,全程时间为10min,保护温度为35℃,功率为200W)。超声结束后粗脂质体逐渐形成带有微弱蓝色荧光的半透明液体,然后将其依次挤压通过孔径为400nm,200nm的聚碳酸酯膜各3次。挤压后,将脂质体混悬液装入透析袋(截留分子量10,000-12,000Da),在HBS缓冲溶液中(151mM NaCl,25.2mM Hepes,PBS pH 7.4)透析24小时,每8小时更换一次透析液,共三次,得到GLU修饰的靶向性空白脂质体。
2)GLU修饰的靶向性柔红霉素脂质体的制备
采用硫酸铵梯度法,将柔红霉素包载入功能靶向性空白脂质体的内水相中制得柔红霉素脂质体。具体步骤包括:
将盐酸柔红霉素以一定的浓度溶解在蒸馏水中,将该盐酸柔红霉素的水溶液与步骤1)所得GLU修饰的的靶向性空白脂质体分别在60℃水浴中预热,然后按照药脂比(也即盐酸柔红霉素和GLU修饰的靶向性空白脂质体的质量比)1:20,将该盐酸柔红霉素的水溶液加入到步骤1)所得GLU修饰的靶向性空白脂质体的水溶液中,在60℃空气浴恒温培养振荡器里振摇20min,得到本发明提供的GLU修饰的靶向性柔红霉素脂质体。
3)PEI600、GLU双重修饰的靶向性空白脂质体的制备
a、精密称取卵磷脂(EPC)、胆固醇(CHOL)、实施例1所得化合物DSPE-PEG2000-GLU、式I1所示化合物DSPE-PEG2000-PEI600按摩尔比63:32.5:4:0.5于茄形瓶中,加入适量氯仿溶解,然后在40℃水浴、40rpm转速下通过旋转蒸发减压干燥除去有机试剂,在茄形瓶底部及内壁形成一层薄薄的均匀脂膜;
b、向步骤1)所得脂膜中加入适量250mM硫酸铵溶液水化:先在水浴中超声5min,至形成乳白色均匀的粗脂质体后转移到JY92-IID型超声波细胞粉碎机中进一步超声(设置超声工作时间为10s,间歇时间为10s,全程时间为10min,保护温度为35℃,功率为200W)。超声结束后粗脂质体逐渐形成带有微弱蓝色荧光的半透明液体,然后将其通过孔径为400nm的聚碳酸酯膜3次后,再通过孔径为200nm的聚碳酸酯膜3次后,
将脂质体混悬液装入透析袋(截留分子量10,000-12,000Da),在HBS缓冲溶液中(151mM NaCl,25.2mM Hepes,PBS pH 7.4)透析24小时,每8小时更换一次透析液,共三次,得到PEI600、GLU双重修饰的靶向性空白脂质体。
4)PEI600、GLU双重修饰的靶向性柔红霉素脂质体的制备
采用硫酸铵梯度法,将柔红霉素包载入PEI600、GLU双重修饰的靶向性空白脂质体的内水相中制得柔红霉素脂质体。具体步骤包括:
将盐酸柔红霉素以一定的浓度溶解在蒸馏水中,将该盐酸柔红霉素的水溶液与步骤3)所得PEI600、GLU双重修饰的靶向性空白脂质体分别在60℃水浴中预热,然后按照药脂比(也即盐酸柔红霉素和步骤3)所得PEI600、GLU双重修饰的靶向性空白脂质体的质量比)1:20,将该盐酸柔红霉素的水溶液加入到步骤3)所得PEI600、GLU双重修饰的靶向性空白脂质体的水溶液中,在60℃空气浴恒温培养振荡器里振摇20min,得到本发明提供的PEI600、GLU双重修饰的靶向性柔红霉素脂质体。
5)脂质体的表征
取步骤3)所得PEI600、GLU双重修饰的靶向性空白脂质体500μl通过SephadexG-50葡聚糖凝胶柱,以HBS缓冲溶液(151mM NaCl,25.2mM Hepes,PBS pH 7.4)为流动相预饱和葡聚糖凝胶柱。
之后取载药脂质体(柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体和PEI600、GLU双重修饰的靶向性柔红霉素脂质体)500μl通过Sephadex G-50葡聚糖凝胶柱,以HBS缓冲溶液为流动相分离未包进脂质体的游离柔红霉素,收集分离后的脂质体,加入九倍体积甲醇破坏,并用流动相稀释后,用上述高效液相色谱法(HPLC)进行测定。
取未过凝胶柱的载药脂质体(柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体和PEI600、GLU双重修饰的靶向性柔红霉素脂质体)原液,加入九倍体积甲醇破坏,并用流动相稀释相同倍数后,用上述高效液相色谱法进行测定。采用下面的公式对柔红霉素的包封率进行计算:包封率(%)=过凝胶柱分离后脂质体中的药物含量/未过凝胶柱脂质体中的药物含量×100%。药物浓度用对照品法(比较一点法)计算,即得。
分别取新制得的脂质体加入PBS稀释载药脂质体至1ml,混合均匀后,使用Nano Series Zen 4003ZetaSizer(Malvern instruments,Ltd,UK)测定脂质体的粒径、多分散度和Zeta电位。
将柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体和PEI600、GLU双重修饰的靶向性柔红霉素脂质体在含血清蛋白的释放介质(含10%胎牛血清的PBS缓冲液)中进行体外释放实验。取2ml脂质体,加入2ml释放介质混匀后放入透析袋(分子截留量为10,000-12,000Da)内,两端扎紧后将透析袋置于10.0ml释放介质中,在37℃、100rpm的条件下在摇床上振荡。分别于0,0.25,0.5,1,2,4,6和24h时取出0.2ml释放介质,并每次取样后立即补入同等体积的新释放介质。取出的各份样品用九倍体积甲醇进行破坏稀释,使蛋白溶解,高速离心,再用滤膜过膜,除去大分子蛋白,用HPLC进行检测,测定各样品中各样品的峰面积,用其线性回归曲线换算得到相应浓度。然后计算出各个样品在不同时刻的释放量,进而得到其在某一时刻的累积释放量。
各种脂质体的体外释放率分别用下列公式计算:体外释放率(%)=第i时间点释放液中药物的量/与透析体积相同的透析前脂质体溶液中药物的量×100%。
6)脂质体的表征结果
柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体和PEI600、GLU双重修饰的靶向性柔红霉素脂质体的药物包封率、粒径、多分散系数和Zeta电位的表征结果如表1所示。
表1脂质体的包封率、粒径及Zeta电位表征
数据为平均值±标准差的形式(n=3)。
结果显示,上述脂质体的平均粒径在100nm左右,分布均一。柔红霉素在三种脂质体中的包封率均大于94%。三种脂质体的Zeta电位均呈负电性。
图3为PEI600、GLU双重修饰的靶向性柔红霉素脂质体的粒径分布情况,可见该脂质体粒径100nm左右,粒径均一,分散度良好。
图4为柔红霉素从PEI600、GLU双重修饰的靶向性柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体和柔红霉素脂质体的体外释放率结果。选择含10%胎牛血清的PBS缓冲液作为释放介质是为了模拟动物体内的血液环境,更加客观地模拟载药脂质体经静脉注射后在血液循环过程中的释放。实验结果表明,柔红霉素从各种脂质体中的释放率,在最初的2h内,释放率均低于5%,在第24h,PEI600、GLU双重修饰的靶向性柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体和柔红霉素脂质体的体外累积释放率分别为9.98±3.37%、6.49±0.73%及9.87±3.04%。
实施例3、脂质体的体内外药效实验
(1)细胞摄取情况
图5脑胶质瘤干细胞在低糖环境下对GLU修饰的靶向性柔红霉素脂质体的摄取情况。流式细胞仪测定结果以柱状图表示,相对于在低葡萄糖浓度(1g/L)的环境下,脑胶质瘤干细胞在低糖环境及正常葡萄糖浓度(4.5g/L)环境下对GLU修饰的靶向性柔红霉素脂质体的摄取率分别为1.00±0.01和1.27±0.02,即在低糖环境下,脑胶质瘤干细胞对GLU修饰的靶向性柔红霉素脂质体的摄取量显著高于正常葡萄糖浓度环境。
(2)葡萄糖转运体GLUT 1靶向性效应
图6为各制剂组在脑胶质瘤干细胞中的亚细胞共定位激光共聚焦显微图象。如图所示,在共聚焦显微镜下,各含香豆素荧光探针的制剂组呈绿色荧光,由抗体染色后的葡萄糖转运体GLUT 1呈红色荧光,细胞核呈蓝色荧光。在荧光叠加的图中,黄色荧光为绿色和红色荧光的组合,表示制剂与葡萄糖转运体GLUT 1的共定位。结果显示,在GLU修饰的靶向性香豆素脂质体组和PEI600、GLU双重修饰的靶向性香豆素脂质体组中,可以观察到最明显的黄色荧光,而香豆素脂质体组中则没有显示黄色荧光。
(3)对脑胶质瘤干细胞的抑制效应
图7所示为柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体和PEI600、GLU双重修饰的靶向性柔红霉素脂质体对脑胶质瘤干细胞的抑制作用。PEI600、GLU双重修饰的靶向性柔红霉素脂质体和GLU修饰的靶向性柔红霉素脂质体与柔红霉素脂质体相比,均对脑胶质瘤干细胞表现为更强的生长抑制作用。
(4)体外跨越血脑屏障后对脑胶质瘤干细胞的杀伤效应
建立BMVEC/脑胶质瘤干细胞共培养模型,如图8A所示,并用于GLU修饰的靶向性柔红霉素脂质体和PEI600、GLU双重修饰的靶向性柔红霉素脂质体的体外跨越血脑屏障后对脑胶质瘤干细胞的杀伤效应(双重靶向性效应)评价。柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体和PEI600、GLU双重修饰的靶向性柔红霉素脂质体在跨越血脑屏障后对脑胶质瘤干细胞的生长抑制情况见图8B。结果显示,脑胶质瘤干细胞的存活率分别为:PEI600、GLU双重修饰的靶向性柔红霉素脂质体(45.85±0.51%),GLU修饰的柔红霉素脂质体(67.04±1.72%),以及柔红霉素脂质体(72.96±2.78%)。PEI600、GLU双重修饰的靶向性柔红霉素脂质体和GLU修饰的靶向性柔红霉素脂质体,与柔红霉素脂质体制剂组相比,显示出更强的跨越血脑屏障、杀伤脑胶质瘤干细胞的效应,即双重靶向性作用。
(5)对脑胶质瘤干细胞的诱导凋亡效应与机制
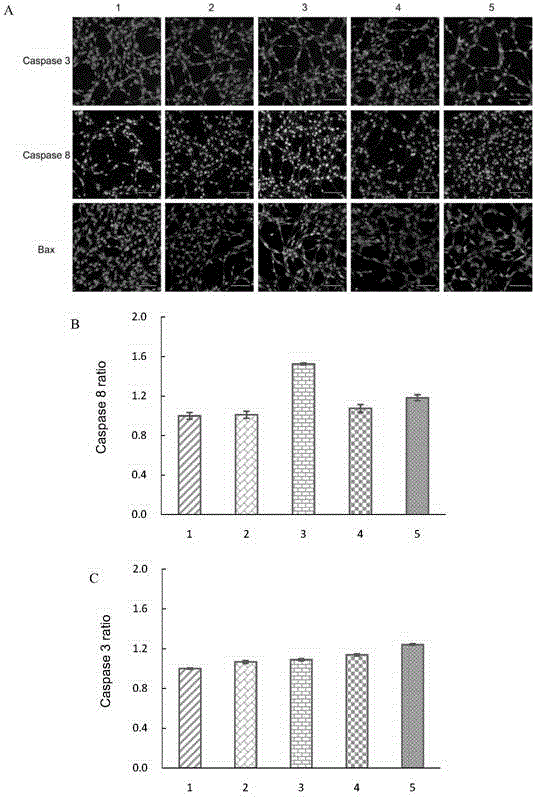
图9A所示为脑胶质瘤干细胞在给以柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体和PEI600、GLU双重修饰的靶向性柔红霉素脂质体6小时后,采用高内涵筛选系统对细胞内凋亡蛋白Caspase 3、Caspase 8和Bax的表达情况进行测定的荧光图谱。图中绿色荧光的强度代表细胞内凋亡蛋白表达的量,结果显示,凋亡蛋白酶Caspase 3、Caspase 8和促凋亡蛋白Bax均在给药孵育后而呈现表达量提高的趋势,其中GLU修饰的靶向性柔红霉素脂质体制剂组和PEI600、GLU双重修饰的靶向性柔红霉素脂质体制剂组较柔红霉素脂质体呈现更高的表达量。
脑胶质瘤干细胞在给以柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体和PEI600、GLU双重修饰的靶向性柔红霉素脂质体6小时后,采用高内涵筛选系统对细胞内凋亡相关信号通路的蛋白Caspase 3、Caspase 8、Bax和Mcl 1的表达情况进行测定,相应的蛋白活性比率的数值以柱形图的形式体现。如图9B、C、D&E所示,空白培养基、柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体和PEI600、GLU双重修饰的靶向性柔红霉素脂质体给药后,脑胶质瘤干细胞中凋亡蛋白酶Caspase 8的活性比率分别为1.00±0.03,1.01±0.04,1.08±0.04,1.18±0.03(图9B);凋亡蛋白酶Caspase 3的活性比率分别为1.00±0.01,1.07±0.01,1.14±0.01,1.24±0.01(图9C);促凋亡蛋白Bax的活性比率分别为1.00±0.01,1.01±0.02,1.02±0.04,1.09±0.03(图9D);抗凋亡蛋白Mcl 1的活性比率分别为1.00±0.01,0.97±0.01,0.94±0.02,0.92±0.02(图9E)。
(6)在荷瘤小鼠体内的分布情况
DiR标记的GLU修饰的靶向性脂质体和DiR标记的PEI600、GLU双重修饰的靶向性脂质体在脑胶质瘤荷瘤ICR小鼠体内的分布和肿瘤蓄积能力如图10所示。图10(A)为尾静脉注射游离DiR、DiR脂质体、GLU修饰的靶向性DiR脂质体和PEI600、GLU双重修饰的靶向性DiR脂质体后各个时间点下ICR小鼠体内的荧光分布;图10(B)为尾静脉注射游离DiR、DiR脂质体、GLU修饰的靶向性DiR脂质体和PEI600、GLU双重修饰的靶向性DiR脂质体在ICR小鼠体内48h后,解剖出心、肝、脾、肺、肾和荷瘤脑组织的体外成像结果。
从图10(A)中可以看出,尾静脉注射GLU修饰的靶向性DiR脂质体和PEI600、GLU双重修饰的靶向性DiR脂质体后1h时,可以在ICR小鼠体内观察到强烈的DiR荧光信号,而且在肿瘤组织48h仍可观察到强烈的荧光信号。相反,尾静脉注射游离DiR荧光染料后,在ICR小鼠体内观察到的DiR荧光信号较弱且持续时间较短,脑组织没有观察到明显的荧光信号,且荧光信号主要蓄积于肝脏和肾脏内。离体组织研究结果图10(B)表明,两种靶向性脂质体均在脑肿瘤组织部位有明显的聚集。结果表明,尾静脉注射GLU修饰的靶向性DiR脂质体和PEI600、GLU双重修饰的靶向性DiR脂质体可延长药物在ICR小鼠体内的循环时间和在肿瘤组织中的聚集程度,可在肿瘤组织观察到最强的荧光信号。
(7)在荷瘤小鼠体内的分布情况
图11为脑胶质瘤荷瘤小鼠在肿瘤接种并接受各个制剂组治疗后的卡普兰-迈耶生存曲线。从肿瘤接种后第14天开始给药,柔红霉素按4.5mg/kg体重给药量,每3-4天给药1次,连续给药四次,每组7只考察生存曲线。观察脑胶质瘤荷瘤小鼠模型的行为状态,记录小鼠活动状况、症状、死亡日期,绘制卡普兰-迈耶生存曲线。结果如图所示,脑胶质瘤荷瘤小鼠在接受生理盐水、柔红霉素脂质体、GLU修饰的靶向性柔红霉素脂质体、PEI600、GLU双重修饰的靶向性柔红霉素脂质体和柔红霉素游离药的治疗后,中位生存期分别为29、32、36、56和27天。结果表明,与对照制剂相比,GLU修饰的靶向性柔红霉素脂质体和PEI600、GLU双重修饰的靶向性柔红霉素脂质体能够显著性提高对脑胶质瘤荷瘤小鼠脑肿瘤的治疗作用。
- 还没有人留言评论。精彩留言会获得点赞!