一种光动力疗法辅助手术治疗小鼠乳腺癌细胞的试验方法与流程
本发明涉及辅助手术治疗癌细胞,特别是一种光动力疗法辅助手术治疗小鼠乳腺癌细胞的试验方法。
背景技术:
癌症具有细胞分化和增殖异常、生长失去控制、浸润性和转移性等生物学特征,其发生是一个多因子、多步骤的复杂过程。外科手术过程中,外科手术主要依据肉眼观察组织的色泽、形态、触质地等判断肿瘤切除的范围和切缘。若是以手术完全移除肿瘤细胞,癌症是可以被治愈的且疗效直接迅速。对早期或较早期实体肿瘤来说,手术切除仍然是首选的治疗方法。但如果一些肿瘤由于肿瘤浸润和周围结构异常,常常导致意外损伤或肿瘤残余,甚至不能识别,因此不能彻底的消灭癌细胞,在一定的时间内癌细胞还会再长。因此,如何准确地识别肉眼难以识别的肿瘤及其边缘,精确手术切除肿瘤病灶,最大程度地保留正常组织,成为现代外科需要解决的重要技术问题。
聚乙二醇(PEG)具有很强的吸水性,在常温条件下可从空气中吸收水分,液体可与水任意比例混溶,当温度升高后,任何级分的固体聚乙二醇均能与水任意比例互溶,当温度高至水的沸点是,聚合物会沉淀出来,析出温度取决于聚合物的分子量和浓度。聚乙二醇(PEG)属非离子型聚合物,在正常条件下是稳定的,作为一种两亲性聚合物,既可溶于水,又可溶于绝大多数的有机溶剂,且具有生物相容性好、无毒、免疫原性低等特点,可通过肾排出体外,在体内不会有积累。
荧光纳米粒子是指与蛋白质或其他大分子结构非共价相互作用而使一种或几种荧光性质发生改变的小分子物质。可用于研究大分子物质的性质和行为。可以发荧光的半导体纳米微晶体(量子点)或将荧光团通过包埋、共价键连接以及超分子组装等方式引入有机或无机纳米粒子中,并让纳米粒子承担有机小分子荧光染料的检测、标记等功能。与传统的荧光染料相比,荧光纳米粒子具有更高的亮度和光稳定性,也能更加容易地实现水分散性和生物相容性。另外,随着纳米制备技术的进一步提高,对纳米粒子的尺度的精确控制及对粒子功能化手段的日臻完善,这在很大程度上使荧光纳米粒子满足了化学传感器、生物探针等领域的要求。而且纳米粒子作为新一类的荧光标记材料已经逐步发展到活体细胞成像中。将纳米粒子直接用于生物检测主要优势是利用纳米粒子的高荧光稳定性,可以在几十分钟到数小时研究细胞的过程中进行实时跟踪检测。
近年来研究发现,650-900纳米的近红外光与可见光相比可穿透更深层的组织,而且在此光谱范围内近红外光的自体荧光较小。因此,肿瘤组织被包有光敏剂(近红外荧光纳米探针)的纳米粒子标记后,当近红外激发光照射时,肿瘤组织就会发出近红外荧光,从而有效地显示肿瘤及其边缘,再通过活体成像仪对小鼠肿瘤部位进行切除。
光动力疗法(Photodynamic Therapy,PDT)是利用光动力效应进行疾病诊断和治疗的一种新技术。其作用基础是光动力效应。这是一种有氧分子参与的伴随生物效应的光敏化反应。其过程是,特定波长的激光照射使组织吸收的光敏剂受到激发,而激发态的光敏剂又把能量传递给周围的氧,生成活性很强的单态氧,单态氧和相邻的生物大分子发生氧化反应,产生细胞毒性作用,进而导致细胞受损乃至死亡。此外,在光动力治疗中,除了光能转化过程中产生的单态氧和自由基能直接杀伤病变细胞外,还因这一过程引发的毛细血管内皮损和血管栓塞造成的局部微循环障碍,进一步导致病变组织的缺血性坏死。
光动力疗法原理是先将光敏剂注入病变部位,然后用特定波段激光照射患病区域。光敏剂激活后产生光动力反应并导致病变部位出现光性过程,产生活性氧如单线态氧等杀死异常增生的细胞,而邻近组织则不受任何影响。
肿瘤对手术切除没有生物抵抗性,同时手术没有潜在的致癌效果。手术能治疗很大一部分没有扩散的癌症。手术治疗亦有其不足之处。切除术对恶性组织并无特异性,亦即正常组织和肿瘤组织同样受到破坏,外科切除对已经扩散超过局部或区域的肿瘤是不能治愈的。而由于光动力学疗法对靶组织及损伤程度都具有可选择性,攻击目标是光照区的病变组织,对病灶周边的正常组织损伤轻微,可减少对正常组织的损伤。此外,毒性低,进入组织的光动力疗法的药物,只有达到一定浓度并受到足量光辐照,才会引发光动力反应杀伤细胞,未受到光辐照的部分,并不产生光动力反应,体内造血功能也不会受到影响。
因此在癌症等治疗过程中,应联合手术切除和光动力疗法,进行综合治疗。本发明希望将光敏剂(具有聚集诱导发光效应)包裹于聚乙二醇中形成一种新型荧光纳米粒子,这种纳米粒子可以富集在肿瘤细胞部位,在近红外激光照射条件下,可以发出较强的荧光,定位肿瘤组织及边缘,并通过手术实时切除肿瘤,最大程度地保留正常组织(指导手术)。同时,这种纳米粒子可以在近红外激光照射条件下,可以产生活性氧物质(ROS),如单线态氧等,对肿瘤细胞(包括不能被肉眼识别的异常增生的细胞)进行直接杀伤,而邻近组织则不受任何影响(杀死残留细胞)。此外,在纳米粒子活性氧物质(ROS)对肿瘤细胞的杀伤过程中,招募大量的淋巴细胞浸润,产生急性炎症反应,暴露大量的肿瘤抗原,促进抗原提呈细胞的对肿瘤抗原的摄取和提呈,最终募集大量的CD8+T淋巴细胞到残余肿瘤部位,进一步对残余肿瘤进行歼灭,并且能够产生特异性的免疫记忆淋巴细胞,防止同种肿瘤细胞复发。(免疫记忆)。
技术实现要素:
本发明的目的在于针对上述存在问题和技术分析,提供一种光动力疗法辅助手术治疗小鼠乳腺癌细胞的试验方法,该方法联合具有聚集诱导发光性质的光敏剂和手术切除,解决了传统方法不能根除的局限、治疗慢、术后复发的缺点。
本发明的技术方案:
一种光动力疗法辅助手术治疗小鼠乳腺癌细胞的试验方法,步骤如下:
1.荧光纳米粒子溶液的制备
将聚乙二醇4毫克和具有聚集诱导发光性质的光敏剂TPE-DCM1毫克溶于1毫升四氢呋喃(THF)中,在超声破碎仪中将这1毫升溶液缓慢逐滴地加入9毫升的超纯水中制成10毫升纳米溶液体系,之后将溶液中的四氢呋喃(THF)吹掉,得到澄清的荧光纳米粒子溶液;
2.小鼠乳腺癌细胞培养
将处于对数生长期的肿瘤细胞经胰酶消化后,用pH为7.4的磷酸缓冲盐溶液(pH=7.4)洗涤一次,用无血清的培养基重悬细胞;在37℃、含5%的二氧化碳的一个潮湿的环境中,将小鼠乳腺癌细胞培养在含有10%胎牛血清、1%青霉素、1%链霉素的DMEM培养基(Dulbecco's Modified Eagle Medium)中。
3实验方法
1)接种
将六周龄小鼠进行腋下接种小鼠乳腺癌细胞(LUC-4T1),每只接种50万细胞,当肿瘤达到200–400mm3,小鼠被用于活体成像研究;
2)分组
2周后,将小鼠分为4组,分别为对照组、单纯手术切除组、单纯光动力组和手术切除联合光动力组,每组5只;
3)手术联合光动力杀伤残余肿瘤
术前12小时将制备好的荧光纳米粒子溶液尾静脉注射入各组小鼠体内,各组小鼠体的实施方法是:
假手术对照组,暴露肿瘤之后不手术,不光照;
单纯手术组,只手术切除3/4的肿瘤组织;
单纯光动力组,暴露肿瘤之后不手术,直接光照15分钟;
手术联合光动力组,手术切除3/4的肿瘤组织;
然后利用白光进行照射15分钟,然后分别进行肿瘤大小的监控;
4)背部再次接种同种肿瘤细胞
在确定实验组肿瘤消失之后,各组小鼠背部再次接种同种肿瘤细胞,继续监测后续接种的肿瘤发展。
本发明的优点是:
1)配合手术实施光动力治疗的过程,术前静脉注射荧光纳米粒子,在荧光成像仪的辅助下对肿瘤进行精准定位,并且完成对肿瘤切除手术的导航过程,利用肿瘤与正常组织高的信噪比,清晰的确定肿瘤的边缘以及散布在周围组织中的微小肿瘤;
2)当遇到无法完全进行手术切除的肿瘤,或者说只能进行姑息手术切除的肿瘤时,对残余肿瘤实施光动力治疗,利用聚集诱导发光的光敏剂产生的大量的活性氧物质(ROS)对肿瘤细胞进行直接杀伤;
3)在纳米粒子活性氧物质(ROS)对肿瘤细胞的杀伤过程中,能够诱导肿瘤细胞的免疫原性死亡,招募大量的淋巴细胞浸润,产生急性炎症反应,暴露大量的肿瘤抗原,促进抗原提呈细胞的对肿瘤抗原的摄取和提呈,最终募集大量的CD8+T淋巴细胞到残余肿瘤部位,进一步对残余肿瘤进行歼灭,并且能够产生特异性的免疫记忆淋巴细胞,防止同种肿瘤细胞复发;
4)将光敏剂包裹于聚乙二醇中制成荧光纳米粒子,由于实体癌细胞的高通透性和滞留效应,可在肿瘤部位富集;光敏剂经过聚乙二醇表面修饰,解决光敏剂易团聚及难以输运的问题;
5)采用近红外光(波长通常在700~1000纳米)作为光动力源,由于近红外光穿透深度比可见光大一个数量级,且对正常组织和细胞具有比较低的光毒性。所以,构建新型光敏剂递送系统,其被近红外光激发,然后转换为可见光,再由可见光激发其负载的光敏剂,可克服光动力难以深入组织内部的难题。
附图说明
图1纳米粒子(NPs)结构示意图。
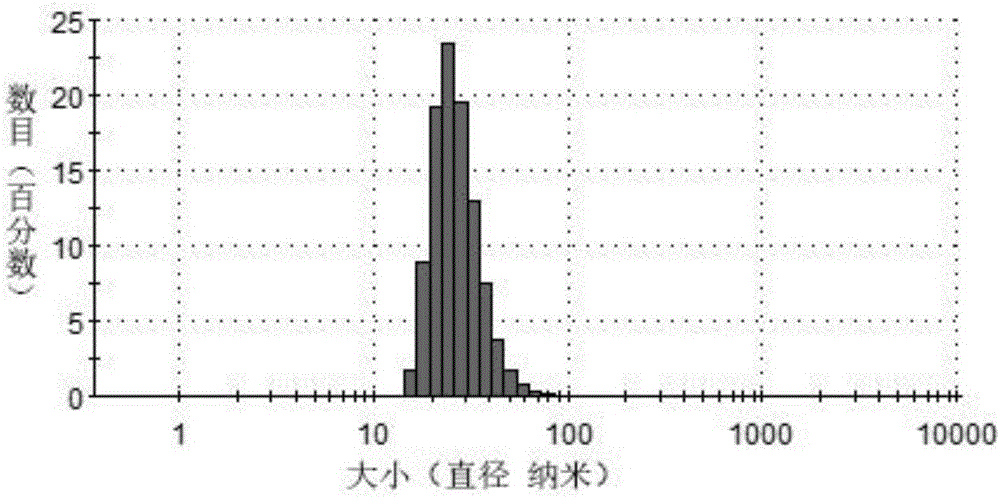
图2纳米粒子的动态光散射(DLS)。
具体实施方式
下面结合具体实施例,进一步阐述本发明。以上所述,仅是本发明的操作和实施方法而已,并非对本发明作任何形式上的限制,凡是依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
实施例:
本次实验小鼠来源于免疫缺陷的小鼠(BALB/C)。
一种光动力疗法辅助手术治疗小鼠乳腺癌细胞的试验方法,步骤如下:
1.荧光纳米粒子的制备
将聚乙二醇4毫克和具有聚集诱导发光性质的光敏剂TPE-DCM1毫克溶于1毫升四氢呋喃(THF)中,在超声破碎仪中将这1毫升溶液缓慢逐滴地加入9毫升的超纯水中制成10毫升纳米溶液体系,之后将溶液中的四氢呋喃(THF)吹掉,得到澄清的荧光纳米粒子溶液。
图1纳米粒子(NPs)结构示意图。
图2纳米粒子的动态光散射(DLS)。图中显示:该纳米粒子平均粒径41.91纳米。
制备的纳米粒子活性氧物质(ROS)的测定:
9,10-蒽基-双(亚甲基)二丙二酸(ABDA)能与活性氧物质(ROS)快速反应,使用波长为680纳米的红光照射,在0-15分钟不同的时间间隔后,观察活性氧指示剂9,10-蒽基-双(亚甲基)二丙二酸(ABDA)的荧光发射光谱在375、394以及412纳米处的荧光强度随着光照时间延长而降低,间接证实产生活性氧物质(ROS),并随时间的延长,活性氧物质(ROS)产率越多。
2.小鼠乳腺癌细胞培养
将处于对数生长期的肿瘤细胞经胰酶消化后,用pH为7.4的磷酸缓冲盐溶液洗涤一次,用无血清的培养基重悬细胞;在37℃、含5%的二氧化碳的一个潮湿的环境中,将小鼠乳腺癌细胞培养在含有10%胎牛血清、1%青霉素、1%链霉素的DMEM培养基(Dulbecco's Modified Eagle Medium)中。
3.实验方法
1)接种
将六周龄小鼠进行腋下接种小鼠乳腺癌细胞(LUC-4T1),每只接种50万细胞,当肿瘤达到200–400mm3,小鼠被用于活体成像研究;
2)分组
2周后,将小鼠分为4组,分别为对照组、单纯手术切除组、单纯光动力组和手术切除联合光动力组,每组5只;
3)手术联合光动力杀伤残余肿瘤
通过静脉注射或局部外用药物(光敏剂),通常在用药后需等待一定时间才能进行光照射。其目的是病变组织中的光敏剂浓度仍保持在较高水平,而周边正常组织中的光敏剂浓度已降到低水平。因此,术前12小时将制备好的荧光纳米粒子尾静脉注射入小鼠体内。
术前12小时将制备好的荧光纳米粒子溶液尾静脉注射入各组小鼠体内,各组小鼠体的实施方法是:
假手术对照组,暴露肿瘤之后不手术,不光照;
单纯手术组,只手术切除3/4的肿瘤组织;
单纯光动力组,暴露肿瘤之后不手术,直接光照15分钟;
手术联合光动力组,手术切除3/4的肿瘤组织,之后利用白光进行照射15分钟,然后分别进行肿瘤大小的监控。
实验结果表明,对照组(假手术组)相对肿瘤体积比(治疗后肿瘤体积与初始肿瘤体积比)逐步增大;单纯手术组,相对肿瘤体积比逐步增大,单纯光动力组,可以有效抑制肿瘤的体内生长;通过手术切除联合光动力治疗组,可以治疗肿瘤,治愈率为70%。
4)背部再次接种同种肿瘤细胞
在确定实验组肿瘤消失之后,各组小鼠背部再次接种同种肿瘤细胞,继续监测后续接种的肿瘤发展。
实验表明:实验组肿瘤消失后,再次接种同种肿瘤细胞后肿瘤很快消失。即荧光纳米粒子能够诱导肿瘤细胞的免疫原性死亡,招募大量的淋巴细胞浸润,产生急性炎症反应,暴露大量的肿瘤抗原,促进抗原提呈细胞的对肿瘤抗原的摄取和提呈,最终募集大量的CD8+T淋巴细胞到残余肿瘤部位,进一步对残余肿瘤进行歼灭,并且能够产生特异性的免疫记忆淋巴细胞,防止同种肿瘤细胞复发。
- 还没有人留言评论。精彩留言会获得点赞!