Cav2.1通道突变与Ca2+浓度的增长速度关系的制作方法
本发明涉及生物医药领域,特别是涉及Cav2.1通道突变与Ca2+浓度的增长速度关系。
背景技术:
:
细胞膜去极化的时,电压门控Ca2+(Cav)通道允许Ca2+进入到细胞内。在神经系统中,Cav通道在不同神经元功能的调节上发挥着重要的作用归因于细胞内Ca2+浓度的升高[1]。Cav通道是一种复杂的分子复合物,由α1,β,α2-δ和γ亚基组成[2]。α1亚基对于进行适当的通道功能和确定信道的基本特性是必不可少的[1]。在突触前终端,有三大Cav2通道类型,Cav2.1(P/Q型),Cav2.2(N型)和Cav2.3(R型),这三种类型广泛表达于中枢神经系统[3]和参与Ca2+依赖的胞吐释放神经递质[4]。鉴于Cav2通道的关键作用在于控制特定神经递质的产生和释放,突触前Cav2通道的表达、定位、结构或调制发生缺陷都可能会导致异常的突触信号和导致神经网络功能障碍的各种模式。
Ca2+浓度的增加在缺血性神经元损伤的发病机理中扮演着重要的角色[5-8],缺血时,Ca2+浓度通过细胞外空间Ca2+的内流和细胞内存储Ca2+的释放而升高[9]。Cav2通道作为重要的Ca2+内流路线,他们参与缺血性神经元损伤的病理生理学是至关重要的。
检测Cav2.1通道的功能和Cav2.1通道的疾病过程,小鼠遗传学的研究可能是有用的。小鼠Cacna1a基因发生突变可编码出Cav2.1通道成孔的α1单元,突变包括以Cav2.1电流缺乏的基因敲除菌株和包涵表现共济失调现象为常见症状的自发突变[10-12]。RollingNagoya小鼠在电压测量S4段第三重复突变[13],leaner小鼠在剪接供体序列上发生突变,从而改变C-末端序列[14]。Cav2.1通道的rollingNagoya型突变激活时有一个更低的电压灵敏度,导致小脑受损突触的传递 [15]。Cav2.1通道的leaner型突变导致了小脑中通道的低密度表达[16]。以往的研究也表明,leaner突变型(60%)小鼠的浦肯野细胞中P型Ca2+电流的下降量比rollingNagoya(40%)突变型小鼠的要大[13,16]。应用Cav2.1通道α1亚基(Cav2.1α1)基因敲除小鼠来检测Cav2.1通道和缺血性神经损伤两者之间的关系是不可能的, 因为大多数的小鼠断奶不生存。尽管rollingNagoya和leaner两种突变型小鼠表现出正常的寿命,但是它们共济失调的严重程度显著不同,leaner突变小鼠要更严重些。由于Ca2+信号的精确调节对于神经细胞突起是非常重要的,通过不同的Cav2.1通道突变体改变Ca2+离子流能够引起神经元和电路不同的功能障碍。因此,通过rollingNagoya,leaner小鼠和野生型小鼠的比较,可以阐明Cav2.1通道在缺血性神经元损伤中的生理作用。
在本研究中,我们建立了一个大脑中动脉完全阻塞的体内缺血模型和一个在海马切片上氧-葡萄糖剥夺的体外缺血模型来研究Cav2.1通道在缺血性神经元损伤中的作用,这些模型都是采用rollingNagoya和leaner小鼠来建立的。
技术实现要素:
:
细胞死亡和脑损伤导致局部缺血的主要原因是由Ca2+离子调节异常引起的。神经元细胞膜的去极化导致电压门Ca2+控通道的激活和Ca2+的内流。在神经系统中,Cav通道在不同神经元功能的调节上发挥着重要的作用归因于细胞内Ca2+浓度的升高。Cav通道是一种复杂的分子复合物,由α1,β,α2-δ和γ亚基组成[2]。α1亚基对于进行适当的通道功能和确定信道的基本特性是必不可少的。鉴于Cav2通道的关键作用在于控制特定神经递质的产生和释放,突触前Cav2通道的表达、定位、结构或调制发生缺陷都可能会导致异常的突触信号和导致神经网络功能障碍的各种模式。Ca2+浓度的增加在缺血性神经元损伤的发病机理中扮演着重要的角色。Cav2通道作为重要的Ca2+内流路线,他们参与缺血性神经元损伤的病理生理学是至关重要的。检测Cav2.1通道的功能和Cav2.1通道的疾病过程,小鼠遗传学的研究可能是有用的。
鉴于以上所述现有技术,本发明第一方面提供Cav2.1α1mRNA的表达模式。
Cav2.1α1mRNA在野生型小鼠(n=6)、rollingNagoya和(n=5)和leanermice(n=5)在三种小鼠体内分布都一样(数据未显示)。利用反义探针检测到α1亚基在这三种小鼠大脑内部都有一个广泛的表达,尤其是在嗅球神经元细胞,大脑皮层神经元细胞,海马神经元细胞和小脑神经元细胞中有强烈的表达。但是使用正义探针之后未检测到任何的信号。用real-timeqRT-PCR来检测Cav2.1α1mRNA在这三种小鼠中的嗅球、大脑皮层、尾状壳核、海马、小脑以及肝脏中的表达水平,总Cav2.1α1的相对表达水平并未有明显的不同,肝脏部分未检测到任何的 PCR产物(数据未显示)。
本发明第二方面提供Cav2.1α1基因突变小鼠在体内缺血模型中梗死体积的降低。
对野生型小鼠(n=12),rollingNagoya(n=11)以及leanermice(n=12)进行大脑中动脉阻塞处理,三种小鼠中的梗死区域有明显不同。梗死区域在rollingNagoya中占大脑的总体积的比例为27.1±3.5%,leanermice中的比例为20.2±3.5%,野生型小鼠为42.9±4.5%。
本发明第三方面提供Cav2.1α1基因突变小鼠在体外缺血模型中[Ca2+]i的降低。
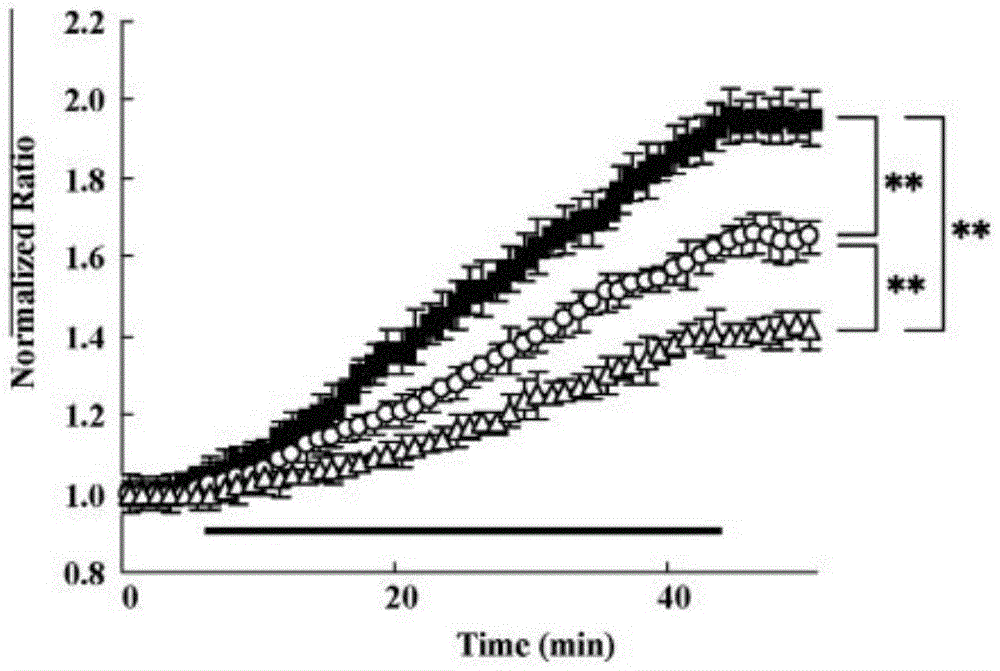
用海马切片来检测OGD处理后[Ca2+]i的变化,OGD处理后能使局部缺血。Cav2.1通道在海马区域内的表达十分强烈。在OGD处理前,在这三种小鼠中CA1区的锥体细胞层的基础比率并未有明显的区别(野生型:0.847±0.011;rollingNagoya:0.827±0.022;leanermice:0.803±0.013)。一旦OGD开始处理后,[Ca2+]i出现递增,处理后的4min内,野生型小鼠的标准化指数要远远高于其他两组的小鼠。
综上所述,本发明发明人证实了Cav2.1通道突变与Ca2+浓度的增长速度关系具有实际应用价值。
附图说明:
图1:脑梗死的评价(A)大脑中动脉阻塞处理后的一系列的脑区域。分别用TTC处理后的野生型小鼠(左),rollingNagoya(中),leanermice(右)。(B)和对照组相比,野生型小鼠(n=12),rollingNagoya(n=11)以及轻瘦型小鼠(n=12)中对梗死区域体积的统计。
图2:海马切片经OGD诱导后[Ca2+]i增加的剖面图。经OGD处理后,取自野生型小鼠(n=14,closedsquare),rollingNagoya(n=14,opencircle),leanermice的(n=14,opentriangle)的海马CA1区域的锥体细胞层的标准化曲线随着时间的变化而变化。标准化曲线的数据是从OGD处理前5min开始搜集,到OGD处理结束后7min。水平黑色标线指OGD处理组。
图3:缺血环境下Cav2.1通道突变体介导的神经保护作用机制。Cav2.1通道的重要性和钙离子内流与调节谷氨酸释放一致。[Ca2+]i的升高在缺血性脑损伤的 发生中起着至关重要的作用。在局部缺血中,不同的Cav2.1通道突变体影响着不同的钙离子电流以及谷氨酸的释放,最终导致神经元损伤。
具体实施方式:
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的原位杂交、实时定量反转录聚合酶链式反应、MCA闭塞、心肌梗死面积的评价、氧-葡萄糖剥夺海马切片的Ca2+成像和统计分析方法及相关领域的常规技术。
各实施例中所使用的所有的动物程序由上海交通大学和RIKEN动物实验委员会批准,并依照实验室动物使用要求进行实验。rollingNagoya小鼠由RIKEN生物资源中心提供,是C57BL/6J的第14代杂交小鼠。Leaner的小鼠由Jackson实验室提供,具有C57BL/6J的遗传背景。这些小鼠被免费获得物颗粒和水,饲养温度为23±1℃,湿度为55±5%,光暗周期为12/12-h(开灯时间为8:00到20:00)。所有的分析都是由一个不知道小鼠基因型,训练有素的实验者来做。
原位杂交
用于原位杂交的16周龄雄性小鼠大脑的包埋蜡块和石蜡切片是从Genostaff有限公司(日本东京)获得的。对小鼠进行灌注,然后解剖取出大脑,用组织固定液(Genostaff)对其进行固定,然后根据专有程序进行石蜡包埋,最后进行切片,切片厚度为6um。杂交协议按照之前报道的那样进行实施[17]。我们设计了一个含有691个碱基片段的探针,从位置6068到6748的Cav2.1α1亚基CDNA,用地高辛标记的RNA标记试剂盒(德国,Mannhein,罗氏诊断)进行示踪。用NBT/BCIP染色液(美国Sigma)进行着色反应,过夜,然后用PBS洗。切片,kernechtrot染色液复染和安装CC/安装(诊断生物系统公司,普莱森顿,CA,USA)。
实时定量反转录聚合酶链式反应
从嗅球,大脑皮层,尾状核,海马体,小脑和16周雄性小鼠的肝中根据制造商的协议(美国表达载体,卡尔斯巴德,CA)使用试剂盒提取出总的RNA。使用ABI7700序列检测系统,采用实时定量逆转录聚合酶链反应(qRT-PCR)量化感兴趣基因的表达水平[18]。确定野生型和Cav2.1α1突变体基因表达的总量,我们所使用的引物是CT1F(5’-CTGCGCTA CTTCGAGAT GTG-3’)和CT1R(5’-AACATAGTCA AAATATCGCAG CAC-3’),所使用的探针是MT-prob e1(5’-ATCCTCATGG TCATTGCCA TGAGCAG-CATCGCTCTGGCCGCCGAGGACCCGGTGC AGCCCAACGCACCCC-3’)。为了确定等效荷载,每个样本中的18s核糖体RNA的量使用标准的引物和TaqMan探针测定。所有的样本都进行了重复的分析,用平均值来表示基因表达的相对量化。野生型小鼠中mRNA的表达水平的计算与Cav2.1α1mRNA的表达水平是相关的。
MCA闭塞
MCA闭塞导致的体内缺血的方法正如前边所描述的一样[19]。用异氟烷对16周龄的雄性小鼠进行麻醉,使用一个水套加热垫来使小鼠的体温保持在(36±0.5摄氏度)。切开皮肤,将左侧枕叶,甲状腺上动脉,外颈动脉的分支和翼腭动脉暴露出来,电凝然后切开。用微型夹将颈总动脉结扎后,结扎并凝固左颈外动脉,切断远端脑甲状腺动脉。将一条21mm的单丝尼龙线(5–0,哈佛仪器,霍利斯顿,MA,USA;热的直径圆尖:0.2–0.3mm)插入到ECA中,轻轻地通过颈内动脉,直至其尖端闭塞MCA的起源。缝线的位置如果正确,到左侧大脑中动脉区域局部脑血流量就会突然下降,我们可以用激光多普勒血流仪来监测10– 15%的基本流动监测。成功闭塞后,结扎固定到位,用手术夹闭合皮肤切口。
心肌梗死面积的评价
大脑中动脉闭塞24小时后,给小鼠注射过量的戊巴比妥钠进行麻醉处死。取出大脑,然后用振动切片机(1000S,徕卡软体系统,韦茨拉尔,德国)连续切为5冠切片(厚1mm)。这些部分浸泡在含有1%2,3,5-氯化三苯基四氮唑(TTC)的生理盐水中,然后在37℃的环境下孵育30min。梗死图像和整个对侧大脑半球均采用数码相机拍摄区域测量则使用图像软件(WinRoof版本5.7,山谷公司,东京,日本)。减去面积非梗死侧大脑半球对侧组织测定心肌梗死面积。梗死体积百分比通过将梗死面积的总和除以如前面所述的总对侧半球求得[20]。
氧-葡萄糖剥夺海马切片的Ca2+成像
体外缺血被诱导正如前边描述的[21]。海马脑片(350μm)是由5周龄的雄性小鼠用振动切片机(1000S,徕卡软体系统)放在冰冷的人工脑脊液(ACSF)制作出来的。ACSF是由137mM的NaCl,2.5mMKCl,21mMNaHCO3,0.58mMNaH2PO4,2.5mMCaCl2,1.2mMMgCl2和10mM的葡萄糖以及PH为7.4在饱和状态下的95%O2/5%CO2。孵育2小时后,用Ca2+荧光指示剂Fura-PE3/AM和0.01%聚氧乙烯蓖麻油在37℃对切片进行染色45min。然后将切片彻底清洗30分钟,以除去额外的细胞染料。35℃时,在荧光倒置显微镜阶段对脑片进行灌流(4ml/min),并分别在340和380的波长下每分钟对荧光信号进行捕捉。从CA1椎体细胞层两个不同的区域对Ca2+浓度在CA1区荧光比率的平均值进行估计(比=F340/F380)。应用OGD,用95%N2/5%CO2使ACSF饱和,并用2-脱氧葡萄糖取代葡萄糖。规范OGD时Ca2+浓度的非时间性增加,标准化率等于基线比除以每一个得到的比例(应用OGD前五个值的平均值)。然后在3分钟的时间间隔使用运算箱计算标准比率上升的最大速率。
统计分析
数据是标准误差的平均值,使用Excel2006对行为的统计分析和免疫细胞化学研究进行统计,采用重复测量的方差分析对数据进行分析,然后Tukey事后测试。
实施例1
Cav2.1α1mRNA的表达模式
我们用原位杂交的方法来评估Cav2.1α1mRNA在野生型小鼠(n=6)、rollingNagoya(n=5)和leanermice(n=5)的分布;在三种小鼠体内分布都一样(数据未显示)。我们利用反义探针检测到α1亚基在这三种小鼠大脑内部都有一个广泛的表达,尤其是在嗅球神经元细胞,大脑皮层神经元细胞,海马神经元细胞和小脑神经元细胞中有强烈的表达。但是使用正义探针之后未检测到任何的信号。我们用real-timeqRT-PCR来检测Cav2.1α1mRNA在这三种小鼠中的嗅球、大脑皮层、尾状壳核、海马、小脑以及肝脏中的表达水平。在这三种小鼠的嗅球、大脑皮层、尾状壳核、海马、小脑中,总Cav2.1α1的相对表达水平并未有明显的不同,(野生型小鼠,rolling Nagoya和leaner mice在嗅球中的值分别是1.01±0.04,1.03±0.06,1.04±0.07,F(2,27)=0.153,p>0.05;大脑皮层分别为1.03±0.01,1.03±0.04,1.04±0.08,F(2,27)=0.173,p>0.05;尾状壳壳中分别为1.02±0.05,1.03±0.03,1.04±0.04,F(2,27)=0.145,p>0.05;海马中分别为1.02±0.01,1.05±0.08,and 1.02±0.07,F(2,27)=0.166,p>0.05;小脑中分别为1.02±0.02,1.03±0.03,and 1.06±0.03,F(2,27)=0.182,p>0.05)。而在三种小鼠的肝脏部分未检测到任何的PCR产物(数据未显示)。
实施例2
Cav2.1α1基因突变小鼠在体内缺血模型中梗死体积的降低
对野生型小鼠(n=12),rollingNagoya(n=11)以及leanermice(n=12)进行大脑中动脉阻塞处理。我们从颜色上来辨别脑梗死,为白色未染色区域,周边是红色活体组织。Fig.1A是一组具有代表性的实验结果,它是梗死部分用TTC永久闭塞之后染色24h所得到的结果。经大脑中动脉阻塞处理后,在这三种小鼠中的梗死区域有明显不同。梗死区域在rollingNagoya中占大脑的总体积的比例为27.1±3.5%,leanermice中的比例为20.2±3.5%,野生型小鼠为42.9±4.5%。
实施例3
Cav2.1α1基因突变小鼠在体外缺血模型中[Ca2+]i的降低
为了调查在突变型小鼠中梗死体积的降低是否和神经元钙离子型号通路有 关,我们用海马切片来检测OGD处理后[Ca2+]i的变化,OGD处理后能使局部缺血。Cav2.1通道在海马区域内的表达十分强烈。在OGD处理前,在这三种小鼠中CA1区的锥体细胞层的基础比率并未有明显的区别(野生型:0.847±0.011;rollingNagoya:0.827±0.022;leanermice:0.803±0.013)。一旦OGD开始处理后,[Ca2+]i出现递增,处理后的4min内,野生型小鼠的标准化指数要远远高于其他两组的小鼠。在这三种小鼠中增加的最大比率也都是不同的。rollingNagoya中的增加速率为0.083±0.007/min(p<0.01),leanermice为0.062±0.006/min(p<0.01),野生型小鼠为0.105±0.008/min。
综上所述,本发明有效克服了现有技术中的种种缺点而具高度产业利用价值。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!