一种exosomes装载的miR‑93‑5p在治疗类风湿性关节炎中的应用的制作方法
本发明属于生物医学技术领域,涉及一种exosomes装载的mir-93-5p在治疗类风湿性关节炎中的应用,具体涉及粒细胞样髓源性抑制细胞来源exosomes装载的mir-93-5p在治疗类风湿性关节炎中的应用。
背景技术:
类风湿性关节炎(rheumatoidarthritis,ra)是一种病因不明的慢性进行性并累及全身多系统的自身免疫性疾病,病理特征表现多为手、足小关节对称性的滑膜慢性炎症,其造成的身体危害,严重影响人类生产和生活。ra的确切发病机制不明,免疫学与流行病上的研究认为与遗传、激素、环境、病毒感染等因素有关。目前对其治疗的主要目的在于减轻关节的炎症,抑制疾病的发展,尽可能保护关节和降低疾病的活动度。临床上对于ra的治疗主要包括药物治疗和免疫学治疗。药物治疗主要包括非甾体类药物、抗风湿类药物、糖皮质激素等,但药物带来的毒副作用较多,影响肝肾代谢功能,容易产生药物依赖,此外激素类药物可导致患者胃肠不良反应、向心性肥胖、免疫力低下、骨质疏松等。免疫学治疗主要包括免疫净化和生物靶向药物治疗,其中免疫净化可以去除类风湿性关节炎患者血中自身抗体、免疫复合物和免疫球蛋白等,但治疗成本高、操作复杂,创伤较大。生物靶向药物主要包括tnf-α拮抗剂和针对ra炎症分子的生物制剂,这些药物具有快速抑制炎症反应,修复已损伤关节的作用,但价格十分昂贵,并且存在导致潜伏结核感染的患者结核病复燃,肝损伤,罹患肿瘤等风险。另外针对ra炎症分子的生物制剂包括il-1受体拮抗剂和il-6受体拮抗剂等。传统药物治疗带来极大的毒副作用,目前免疫学治疗方法相对单一且价格昂贵,对于ra的治疗仍然有很多需要研究和改进之处。
已有研究者发现一类新的cd4+辅助性t细胞,由此细胞亚群特异性分泌il-17而被称为辅助t细胞17型(helpertcelltype17,th17),它还可以分泌il-6、tnf-α等细胞因子,il-17和th17细胞在ra及其动物模型的发病中发挥重要作用。
近年来相关研究表明mdscs在自身免疫性疾病的治疗方面有巨大的潜能,已有实验利用mdscs治疗小鼠胶原诱导性关节炎(collagen-inducedarthritis,cia),并取得一定疗效;但是,由于mdscs来源不足、储存不便及成分复杂等缺点限制了其应用。髓源性抑制细胞(myeloidderivedsuppressorcells,mdsc)是骨髓来源的异质性细胞群体,在小鼠中,mdsc是gr-1(由ly6g和ly6c组成)和cd11b双阳性的细胞,根据细胞形态及ly6g、ly6c的表达量的高低,又将mdsc分为两个亚型:cd11b+ly6g+ly6clow粒细胞样mdsc(g-mdsc)和cd11b+ly6g-ly6chi单核细胞样mdsc(m-mdsc),其中g-mdscs主要通过精氨酸酶1(arginine1,arg-1)和活性氧(reactiveoxygenspecies,ros)来抑制t细胞的活化和增殖,m-mdsc则主要通过arg-1和一氧化氮来发挥抑制作用。
有研究表明g-mdsc来源的exosomes(g-exosomes)对于炎症性肠病模型小鼠和cia模型小鼠均有保护作用,exosomes是由细胞内吞系统产生的具有生物活性的囊泡,exosomes内包裹各种脂质、蛋白质、核酸,并能将其携带的物质运输至受体细胞而发挥生物学作用。目前exosomes的应用主要包括药物载体和疾病诊断,以exosomes作为药物转运载体,相对于目前的脂质体载体和聚合物载体具有免疫原性低、运输效率高、稳定性好、靶向性强及跨越血脑屏障的优点,目前以exosomes作为载体的药物主要有基因类药物(sirna、mrna、mirna)和抗癌类药物(阿霉素、紫杉醇等)以及增强免疫的抗原等。由于不同疾病下不同细胞分泌的exosomes含有不同的核酸、蛋白成分,所以分析从病人体液中分离的exosomes所包含的成分可以作为疾病诊断的依据。越来越多的研究表明exosomes在自身免疫性疾病的炎症发生过程中起到重要作用,但是g-mdsc来源的exosomes成分复杂,其具体作用机制仍不清楚。
较多研究表明exosomes携带的mirna具有抑制t细胞增殖分化的作用,例如treg细胞来源exosomes携带的let-7d可以抑制th1细胞介导的炎症反应,并且在体内减轻炎症性肠病小鼠模型的疾病严重程度(okoyeis,coomessm,pellyvs,cziesos,papayannopoulosv,tolmachovat,etal.microrna-containingt-regulatory-cell-derivedexosomessuppresspathogenicthelper1cells[j].immunity.2014,41(1):89-103.)。微小rna(microrna,mirna)是一系列长度为18~22核苷酸的非编码小rna,它们主要是通过与靶基因的3’非翻译区(3’-utr)特异性结合,抑制其靶基因的翻译或诱导其mrna的降解,从而抑制靶标蛋白的表达。
根据g-exosomes的结构和功能特性,利用其装载的mirna应用于ra的治疗,可达到“安全性高、靶向性强”的目的,具有良好的临床应用前景,有望在维持机体免疫平衡方面发挥积极作用,为ra的治疗提供一种全新的治疗途径。本发明对g-exosomes中mirna进行人工干预,过表达后能显著提高应用效果,以获得具有更佳治疗效果的g-exosomes。
技术实现要素:
本发明的目的在于克服现有技术中的缺陷,提供一种过表达mir-93-5p的g-exosomes的制备方法及其在制备治疗类风湿性关节炎的药物中的应用。
为达到上述目的,本发明采取的技术手段如下:
本发明首先提供一种mir-93-5p在制备治疗类风湿性关节炎的药物中的应用。
本发明还提供一种mir-93-5p的筛选方法。
本发明还提供一种过表达mir-93-5p的g-exosomes的制备方法。
本发明还提供一种治疗类风湿性关节炎的药物,所述药物包含过表达mir-93-5p的g-exosomes。
具体的,采用的技术方案如下:
本发明首先分离提取m-mdsc和g-mdsc,然后提取鉴定这两种细胞所分泌的exosomes(g-exosomes和m-exosomes),通过实验验证g-exosomes和m-exosomes对于cia模型小鼠发病的影响,结果表明,g-exosomes具有抑制cia模型小鼠的发病的作用,通过g-exosomes和m-exosomes对th17细胞进行处理,进一步表明,g-exosomes可以抑制th17细胞的分化,进而减轻小鼠发病,而m-exosomes没有明显的抑制作用。
对g-exosomes和m-exosomes进行mirna的提取测序分析,筛选出在g-exosomes和m-exosomes中含量相差的差值绝对值较大的前二十个mirna;进一步根据mirna的结构和功能特性进行筛选,筛选出9个可能对ra产生作用的mirna,分别为:mir-16-5p、mir-29a-3p、mir-93-5p、mir-22-3p、mir-26b-5p、let-7f-5p、let7g-5p、mir-221-3p、mir-92a-3p。
根据筛选出的9个mirna序列设计引物,通过qrt-pcr检测9个mirna在g-exosomes处理后的th17细胞中表达量的变化,结果筛选出g-exosomes处理后的th17细胞中表达量增加最大3个mirna为mir-16-5p、mir-29a-3p、mir-93-5p。
将筛选出的3个mirna(mir-16-5p、mir-29a-3p、mir-93-5p)相对应的mimics和mimics-阴性对照转染初始t细胞,并诱导分化th17细胞,通过qrt-pcr检测,结果显示mir-93-5p可以抑制初始t细胞向th17细胞的分化,也表明g-exosomes可能是通过其装载携带的mir-93-5p抑制th17细胞的分化。
进一步通过转染mimics和inhibors的g-mdsc,制备过表达或阻断mir-93-5p的g-exosomes,并通过体外实验证明,过表达mir-93-5p的g-exosomes相对于原有g-exosomes更加明显的抑制了th17细胞的分化;而阻断mir-93-5p的g-exosomes则失去了原有g-exosomes对th17细胞分化的抑制作用。结果表明g-exosomes携带的mir-93-5p体外抑制th17的分化,本发明制备的过表达mir-93-5p的g-exosomes相对于原有的g-exosomes对th17细胞分化的抑制能力更强。
本发明通过研究过表达和阻断mir-93-5p的g-exosomes对于cia模型小鼠发病的作用,发现过表达mir-93-5p的g-exosomes相对于原有g-exosomes对cia小鼠的保护作用更强了,而阻断mir-93-5p的g-exosomes则失去了原有g-exosomes对cia小鼠发病的抑制作用。结果表明g-exosomes携带的mir-93-5p减轻cia模型小鼠的发病,本发明制备的过表达mir-93-5p的g-exosomes相对于原有的g-exosomes对cia模型小鼠的保护作用更强。
本发明发现g-exosomes装载的mir-93-5p可以在体内外抑制相应受体细胞靶标蛋白stat3的表达,以此发挥对th17细胞分化的抑制作用。
本发明的优点
(1)本发明首次发现g-exosomes携带的mir-93-5p可以通过抑制th17细胞的分化减轻cia模型小鼠的发病,为ra的治疗提供了新的方法。
(2)本发明制备过表达mir-93-5p的g-exosomes的方法耗时短,操作方便,所含成分活性稳定,-80℃保存时间达1年以上;室温下结构及活性成分也稳定,有利于临床上的应用。
(3)本发明中制备的过表达mir-93-5p的g-exosomes相对于普通g-exosomes具有更强的抑制th17细胞分化以及缓解cia模型小鼠疾病严重程度的作用。
(4)本发明中g-exosomes装载的mir-93-5p可以在体内外抑制相应受体细胞靶标蛋白stat3的表达,作用靶点明确。
(5)以exosomes作为药物转运载体具有免疫原性低、运输效率高、稳定性好、吸收快、靶向性强的优点,本发明制备的过表达mir-93-5p的g-exosomes相对于现有治疗ra药物,具有无毒副作用,不影响正常肝肾代谢功能,制备过程简便,所需成本低的优势,此外本发明制备的过表达mir-93-5p的g-exosomes,药物作用机制明确,利于药物疗效的监测。
附图说明
图1为本发明分选制备的g-mdsc和m-mdsc的纯度鉴定结果,其中a为g-mdsc,b为m-mdsc。
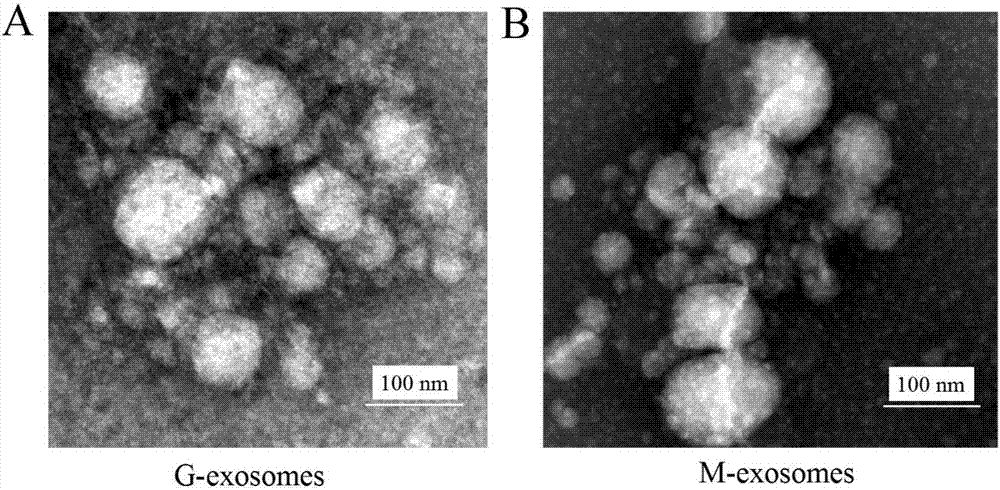
图2为本发明分选制备的g-exosomes和m-exosomes的透射电镜图,其中a为g-exosomes,b为m-exosomes。
图3为本发明分选制备的g-exosomes和m-exosomes的粒径大小频数分布图,其中a为g-exosomes,b为m-exosomes。
图4为westemblot检测g-exosomes和m-exosomes的标志性蛋白表达结果。
图5为g-exosomes和m-exosomes对cia模型小鼠发病过程中平均关节炎指数的影响结果。
图6为g-exosomes和m-exosomes对cia模型小鼠足趾肿胀程度的影响结果。
图7为g-exosomes和m-exosomes体外对于th17细胞分化的影响结果,图中a为磷酸盐缓冲液对照组th17细胞比例;b为n-exosomes处理组th17细胞比例;c为m-exosomes处理组th17细胞比例;d为g-exosomes处理组th17细胞比例。
图8为g-exosomes和m-exosomes装载的mirna含量差值的绝对值排前20位的mirna。
图9为g-exosomes处理的th17细胞中mirna表达量的变化结果。
图10为转染了相应mimics到初始t细胞后,诱导分化的th17细胞中mir-93-5p、mir-16-5p、mir-29a-3p的表达量变化结果。
图11为转染了mir-93-5p、mir-16-5p、mir-29a-3p相应mimics到初始t细胞后,对诱导分化th17细胞的影响结果,图中a为mimics-阴性对照组th17细胞比例;b为mir-16-5p-mimics处理组th17细胞比例;c为mir-29a-3p-mimics处理组th17细胞比例;d为mir-93-5p-mimics处理组th17细胞比例。
图12为将mir-93-5p的mimics或者inhibitors转染到g-mdsc后对其表达mir-93-5p的影响。
图13为将mir-93-5p的mimics或者inhibitors转染到g-mdsc后,g-exosomes表达mir-93-5p的表达量结果图。
图14为过表达或阻断mir-93-5p的g-exosomes对th17细胞分化的影响结果,图中a为阴性对照组th17细胞比例,b为磷酸盐缓冲液对照组th17细胞比例,c为g-exosomes处理组th17细胞比例,d为mimics-nc处理组th17细胞比例,e为mimic处理组th17细胞比例,f为inhibitors-nc处理组th17细胞比例,g为inhibitors处理组th17细胞比例。
图15为过表达或阻断mir-93-5p的g-exosomes对th17诱导体系中细胞中mir-93-5p的表达量。
图16为过表达或阻断mir-93-5p的g-exosomes对cia模型小鼠关节炎指数的影响程度。
图17为过表达或阻断mir-93-5p的g-exosomes对cia模型小鼠足趾肿胀的影响程度直观图片。
图18为过表达或阻断mir-93-5p的g-exosomes处理cia模型小鼠后足趾的he染色切片结果,其中a为pbs缓冲液组,b为g-exosomes组,c为mimics-nc-exosomes组,d为mimics-exosomes组,e为inhibors-nc-exosomes组,f为inhibors-exosomes组。
图19为过表达或阻断mir-93-5p的g-exosomes处理cia模型小鼠后腘窝淋巴结细胞中th17细胞比例的流式结果。
图20为过表达或阻断mir-93-5p的g-exosomes对cia模型小鼠引流淋巴结cd4+t细胞中mir-93-5p表达量的结果。
图21为mir-93-5p与stat3的可能结合位点。
图22为过表达或阻断mir-93-5p的g-exosomes对th17诱导体系中细胞总stat3的表达量,其中,a为westernblot检测结果,b为统计分析图。
图23为过表达或阻断mir-93-5p的g-exosomes对cia模型小鼠引流淋巴结cd4+t细胞总stat3的表达量,其中,a为westernblot检测结果,b为统计分析图。
具体实施方式
下面结合具体实施例对本发明的技术方案作进一步描述,但本发明并不限于这些实施例。
实施例1:g-mdsc和m-mdsc的提取及鉴定
(1)构建荷瘤小鼠模型:使用含有10%小牛血清(购于美国gibco公司)、ph7.3的dmem培养液培养(购于美国gibco公司),37℃、5%co2条件下培养小鼠lewis肺腺癌细胞系(购于上海生命科学院)。在培养过程中密切观察细胞的形态、贴壁情况、密度、培养液颜色变化,待细胞生长至密度达到培养皿底部的85%左右时,用0.25%的胰酶(购于博士德生物工程有限公司)消化并传代。取对数生长期lewis细胞,按每只小鼠右腹部皮下注射3.0×106个细胞的方法,对6-8周龄雄性c57bl/6小鼠(购于江苏大学实验动物中心)进行移植瘤的构建,模型构建过程中密切观察小鼠生活状态和肿瘤大小。
(2)分离荷瘤小鼠脾细胞:在lewis细胞注射给小鼠后的第30天,眼球取血并颈部脱臼处死小鼠,在用75%酒精浸泡小鼠5min后,超净台中解剖小鼠获取脾脏;使用0.22μm孔径的筛网过滤研磨后的脾脏,用pbs(磷酸盐缓冲液)冲洗,收集悬液在4℃、500g条件下离心5min,弃上清;在沉淀的细胞中加入5mlack红细胞裂解液(acklysisbuffer,ack)(上海锐谷生物科技有限公司),混匀后,裂解红细胞5min;加含有10%小牛血清的rpmi-1640培养液(美国gibco公司)至10ml,混匀后在4℃、500g条件下离心5min,弃上清;在细胞重悬至10ml时留取少量细胞显微镜下计数。
(3)磁珠分选g-mdsc:每108个脾细胞用350μlpbe重悬,加入50μl的fcrblockingreagent(德国美天旎公司),混匀后置于冰上孵育10min;每108个脾细胞加入40μl的anti-ly-6gbiotin(德国美天旎公司),混匀后置于冰上孵育30min,每10min混匀一次;加入10mlpbe,混匀后将悬液在4℃、500g离心5min,弃上清;每108个脾细胞加入50μlanti-ly-6g-biotinbeads(德国美天旎公司),混匀后置于冰上孵育30min,每10min混匀一次;加入10mlpbe,混匀后将悬液在4℃、500g条件下离心5min,弃上清;加入500μlpbe,混匀;将macs分选柱装在variomacs分选器(德国美天旎公司)上,加3mlpbe润洗1次后加入脾细胞悬液,待最后一滴细胞悬液流出后,再用3mlpbe洗涤分选柱,重复3次;从分选器上撤出分选柱,将分选柱置于10ml离心管上,加入5ml预冷的pbe,推动活塞,压出分离柱中的细胞,重复1次,得到10ml的细胞悬液,即为g-mdsc,留取少量显微镜下计数。
(4)磁珠分选m-mdsc:收集分选g-mdsc时分选柱流出的细胞悬液,4℃、500g条件下离心5min,弃上清;每108个脾细胞加入40μl的anti-gr-1biotin(德国美天旎公司),混匀后置于冰上孵育30min,每10min混匀一次;加入10ml的pbe,混匀后4℃、500g离心5min,弃上清;每108个脾细胞加入50μl的anti-gr-1-biotinbeads(德国美天旎公司),混匀后置于冰上孵育30min,每10min混匀一次;加入10ml的pbe,混匀后4℃、500g条件下离心5min,弃上清;加入500μl的pbe,混匀;将macs分选柱装在分选器(德国美天旎公司)上,加3ml的pbe润洗1次,然后加入上述待分选细胞悬液,待最后一滴流尽,再加入3ml的pbe洗涤分选柱,重复3次;撤出分选柱置于10ml离心管上,加入5ml的pbe,推动活塞,压出柱中细胞,重复1次,得到10ml的细胞悬液,即为m-mdsc,留取少量显微镜下计数。
(5)g-mdsc和m-mdsc的纯度鉴定:分别取步骤(4)和步骤(5)得到的g-mdsc1×106个和m-mdsc1×106个于ep管中,1ml的pbs重悬,在4℃、500g条件下离心5min,弃上清后剩余约100μl的pbs;混匀后在g-mdsc的ep管中加0.5μl的抗ly-6g抗体(美国ebioscience公司)和0.5μl的抗cd11b抗体(美国ebioscience公司),m-mdsc的ep管加0.5μl的抗ly-6c抗体(美国ebioscience公司)和0.5μl的抗cd11b抗体(美国ebioscience公司);分别在4℃孵育30min;1ml的pbs重悬后4℃、500g条件下离心5min,弃上清,加200μl的pbs重悬,流式细胞仪(美国bd公司)检测。结果如图1所示,本发明中得到的g-mdsc纯度为97.6%,m-mdsc纯度为95.3%。
实施例2:g-exosomes和m-exosomes的提取及蛋白浓度测定
(1)将分选的g-mdsc和m-mdsc分别重悬于含10%小牛血清(美国gibco公司,血清经过4℃、100000g离心16h处理后,留取血清上层2/3,去除血清中外泌体)的rpmi-1640培养液(美国gibco公司)中,以每孔1.5×106个细胞,以及每孔1ml的体积种于24孔板;在37℃、5%co2的条件下培养24小时后,收集培养上清。
(2)将收集的g-mdsc和m-mdsc的培养上清在4℃、300g条件下离心20min,收集上清;再将上清4℃、1000g离心30min,收取上清;再将上清4℃、10000g离心30min,收取上清;将上清加入到100kda超滤管(德国milipore公司)中,4℃、1000g离心30min,收取管中浓缩液。
(3)通过exoquick-tctmexosome试剂盒(美国sbi公司)提取exosomes:将浓缩液与exoquick-tctmexosome试剂按体积比5:1混合,轻微混匀,4℃冰箱内静置16h以上;在4℃、1000g条件下离心30min,弃去上清,收集沉淀物,即为g-exosomes或m-exosomes。将制备获得的exosomes用pbs溶解,分装至ep管中,-80℃保存。
(4)exosomes的溶解液与等体积的裂解液(ripa:pmsf=250:1)混匀后,冰上放置1小时,期间每10min在震荡器上震荡1min;4℃、12000g离心15min,收集上清。按bca微量蛋白定量试剂盒(北京康为世纪有限公司)说明书的方法检测exosomes裂解上清中的蛋白浓度,以确定提取exosomes的含量。结果显示,本发明中得到的每个g-mdsc或m-mdsc在培养24h后可以提取约3×10-6μg的exosomes。
实施例3:g-exosomes和m-exosomes的鉴定
(1)透射电镜观察g-exosomes的形态:取20μlg-exosomes或m-exosomes悬液滴加于直径3mm的载样铜网上,室温静置2min;用滤纸轻轻吸干液体,滴加ph6.8的2%磷钨酸溶液(上海君瑞科技有限公司)于铜网上,复染lmin;滤纸吸干染液,白炽灯下烤干,透射电镜(荷兰飞利浦公司)下观察,结果如图2所示,透射电子显微镜下观察到g-exosomes和m-exosomes为圆形或椭圆形的微囊结构,有完整包膜,腔内为低电子密度成分;图3分别为g-exosomes和m-exosomes的粒径大小频数分布,结果显示g-exosomes和m-exosomes的粒径主要分布在20-120nm之间。
(2)westernblot检测g-exosomes和m-exosomes包含的蛋白分子cd9、cd63和线粒体包含的钙联蛋白分子calnexin:配制5%的浓缩胶和12%分离胶,用ripa蛋白裂解液(上海碧云天生物技术有限公司)裂解g-exosomes和m-exosomes,将裂解后的g-exosomes按250μg蛋白总量上样,经100v恒压电泳后;再经350ma恒流电转90min后,5%脱脂牛奶封闭pvdf膜lh;用抗cd63单克隆抗体(美国ebioscience公司)和抗calnexin单克隆抗体(美国ebioscience公司)4℃孵育过夜;取出后用tbs/t(上海经科化学科技有限公司)洗膜,10min×3次,用辣根过氧化物酶标记的二抗(美国ebioscience公司)37℃孵育30min;取出后用tbs/t(上海经科化学科技有限公司)洗膜,10min×3次;imagequantlas4000凝胶成像系统(美国ge公司)曝光显色,结果如图4所示,g-exosomes、m-exosomes特异性高表达cd9、cd63分子,但g-exosomes和m-exosomes不包含定位在细胞内质网膜上的钙联蛋白。鉴于提取的g-exosomes和m-exosomes的形态、大小、蛋白分子表达结果,证明本实施例成功提取了g-exosomes和m-exosomes。
实施例4:实验证明g-exosomes和m-exosomes的免疫抑制功能
(1)构建cia模型小鼠:
第一次免疫:用2mg/ml的牛二型胶原(美国sigma公司)与2mg/ml的弗氏完全佐剂(美国赛默飞公司)等体积混合,冰上研磨至油包水状态;对每只dba/1小鼠(上海斯莱克实验动物有限责任公司)尾根部皮下注射0.1ml的上述混合液;
第二次免疫:用2mg/ml的牛二型胶原(美国sigma公司)与2mg/ml的弗氏不完全佐剂(美国赛默飞公司)等体积混合,冰上研磨至油包水状态,在第一次免疫后的第21天对每只dba/1小鼠(上海斯莱克实验动物有限责任公司)尾根部皮下注射0.1ml的上述混合液。
(2)制备小鼠成熟中性粒细胞来源的exosomes(n-exosomes):
对6-8周龄雄性c57bl/6小鼠(江苏大学实验动物中心)摘除眼球取血,滴加到含有edta-na2的抗凝采血管(苏州灵岩医疗器械有限公司)中,1000rpm离心眼球血10min,吸出血浆,用500μl的pbs重悬血细胞。将1ml的单个核淋巴细胞分离液(天津灏洋生物制品科技有限公司)加到10ml容量的玻璃试管中,将血细胞悬液沿管壁缓缓滴加到玻璃试管中,使用水平离心机,4℃、2000rpm离心15min。用吸管自上而下缓缓吸取除红细胞层外的其他细胞层并弃去,加入5mlack(上海锐谷生物科技有限公司),吹打混匀,室温静置5min,加入5ml的含有10%小牛血清的rpmi1640培养液(美国gibico公司)终止裂解,混匀后4℃,500g离心5min。弃上清,用10mlpbe洗涤2次,得到中性粒细胞。然后按照实施例2中方法提取n-exosomes。
(3)实验分组:
pbs对照组:分别在第一次免疫后的第18天和24天对每只小鼠尾静脉注射pbs100μl;
n-exosomes组:分别在第一次免疫后的第18天和24天对每只小鼠尾静脉注射100μlpbs溶解的n-exosomes,其中100μlpbs溶解100μgn-exosomes;
g-exosomes组:分别在第一次免疫后的第18天和24天对每只小鼠尾静脉注射100μlpbs溶解的g-exosomes,其中100μlpbs溶解100μgg-exosomes;
m-exosomes组:分别在第一次免疫后的第18天和24天对每只小鼠尾静脉注100μlpbs溶解的m-exosomes,其中100μlpbs溶解100μgm-exosomes。
(4)在第二次免疫后每3天对各组小鼠的足趾情况进行监测,记录每只小鼠的关节炎分数(arthriticscore,as),as代表每只小鼠所有病变关节分数的总和,而各关节病变分数采用5级评分法,无红肿得0分,关节红而不肿得1分,关节轻度红肿得2分,关节中度红肿得3分,关节重度红肿并伴有功能障碍得4分。计算各组小鼠的平均关节炎指数(meanarthriticindex,mai),mai由各组小鼠as的总和除以各组小鼠的个数。如图5所示,g-exosomes处理组小鼠的平均关节炎指数相对n-exosomes处理组降低了,而pbs缓冲液、n-exosomes、m-exosomes处理组之间无明显差异;图6表示g-exosomes处理组小鼠的足趾只有轻度的红肿,关节活动正常;然而pbs缓冲液、n-exosomes、m-exosomes处理组小鼠的足趾大多红肿明显,关节活动受限,这些结果表明g-exosomes具有抑制cia模型小鼠发病的作用,而m-exosomes没有明显抑制cia模型小鼠发病的作用。
(5)建立th17细胞诱导分化体系:用含有2μg/ml抗小鼠cd3单克隆抗体(美国ebioscience公司)的包被液200μl包被24孔圆底培养板,4℃过夜;吸出各孔中的包被液,pbs洗涤1次,通过德国美天旎公司的初始t细胞分选试剂盒分选出初始t细胞,按每孔1.5×106个细胞的密度将初始t细胞接种于24孔板,每孔总体积为1ml;各孔加入终浓度为2μg/ml的抗小鼠cd28单克隆抗体(美国ebioscience公司)、终浓度为5ng/ml的小鼠重组tgf-β(美国ebioscience公司)、终浓度为30ng/ml的il-6(美国ebioscience公司)、终浓度为30ng/ml的il-23(美国ebioscience公司)、终浓度为5μg/ml的anti-il-4(美国ebioscience公司)、终浓度为5μg/ml的anti-ifn-γ(美国ebioscience公司);用含15%胎牛血清(美国gibico公司,经过100000g离心16h处理)、ph7.2-7.4的rpmi-1640细胞培养液(美国gibico公司),37℃、5%co2条件下培养72h。
(6)实验分组:对照组:加入100μl的pbs作为对照;其余组各孔加入终浓度为60μg/ml的n-exosomes、g-exosomes和m-exosomes,如图7所示,g-exosomes处理组th17细胞的比例相对n-exosomes处理组降低了,而pbs缓冲液、n-exosomes、m-exosomes处理组之间无明显差异。这些结果表明g-exosomes相比m-exosomes在cia模型小鼠中起到减轻小鼠发病的作用,体外抑制th17细胞的分化,g-exosomes相对m-exosomes而言展现出更强大的免疫抑制功能。
实施例5:g-exosomes和m-exosomes中mirna的测序结果及分析
(1)委托广州锐博公司对g-exosomes和m-exosomes中携带的mirna进行提取测序分析,本领域技术人员公知g-exosomes和m-exosomes包含许多特定的mirna,并且在表达量上存在一定差异。根据测序结果分析,结合targetscan网站上相关mirna的信息,确定mirna的类别;如图8所示,g-exosomes和m-exosomes包含的相关mirna含量差值的绝对值前二十位为mir-148a-3p(mimat0000516)、mir-340-5p(mimat0004651)、mir-16-5p(mimat0000527)、mir-22-3p(mimat0000531)、mir-27a-3p(mimat0000537)、mir-92a-3p(mimat0000539)、mir-140-3p(mimat0000152)、mir-27b-3p(mimat0000126)、mir-24-3p(mimat0000219)、mir-26b-5p(mimat0000534)、mir-423-3p(mimat0000516)、let-7f-5p(mimat0000525)、mir-29a-3p(mimat0000535)、mir-7a-5p(mimat0000677)、mir-140-5p(mimat0000151)、let7g-5p(mimat0000121)、mir-26a-5p(mimat0000533)、mir-221-3p(mimat0000669)、mir-93-5p(mimat0000540)、mir-148b-3p(mimat0000580),括号内编号为根据mirbase网站分析对应的编号信息,并以它们作为待筛选mirna。
(2)本发明对待筛选mirna进一步筛选,由于mir-16-5p、mir-29a-3p、mir-93-5p、let7g-5p与骨关节炎的发展和成骨细胞的增殖、分化、迁移相关;mir-22-3p和mir-26b-5p参与ra的发病;mir-29a-3p、mir-93-5p、mir-221-3p与t细胞增殖、分化、免疫应答等有关;mir-16-5p、mir-29a-3p、let-7f-5p、mir-92a-3p的潜在靶标smad7、smad6、fos、pik3r1、stat3、emos、pik3r1等与t细胞的增殖分化密切相关。由此本发明进一步筛选出mir-16-5p、mir-29a-3p、mir-93-5p、mir-22-3p、mir-26b-5p、let-7f-5p、let7g-5p、mir-221-3p、mir-92a-3p作为候选mirna。
(3)检测候选mirna在g-exosomes处理后th17诱导细胞中表达量的倍数变化:收集实施例4步骤(6)中对照组与加g-exosomes处理的th17诱导细胞,用1ml的trizol(美国invitrogen公司)将1×106个th17诱导细胞溶解,用移液器充分吹打混匀,加入预冷氯仿(上海化学试剂公司)200μl,立即震荡15~30s,常温静置10min;在4℃条件下,12000g离心15min;ep管中液体出现分层,吸取上层水相层(含有rna)至新的干净ep管中,加入500μl的异丙醇,使用移液器轻轻混匀,常温静置5~10min;在4℃条件下,12000g离心15min,此时rna沉于管底,呈半透明状;弃去上清,加1ml的75%乙醇(上海化学试剂公司)洗涤;在4℃条件下,7800g离心5min;室温置于超净台中吹干至rna呈半透明状;加5μl的depc(上海碧云天有限公司)水溶解;用美国赛默飞检测仪检测rna的浓度。
(4)按照日本takara逆转录试剂盒要求对步骤(3)中提取的rna进行逆转录,根据mirna序列设计引物,然后委托广州锐博公司合成mir-16-5p、mir-29a-3p、mir-93-5p、mir-22-3p、mir-26b-5p、let-7f-5p、let7g-5p、mir-221-3p、mir-92a-3p的前后向引物,通过上海bio-rad公司购买的qrt-pcr试剂盒检测候选mirna在g-exosomes处理后th17诱导细胞中的表达量变化,结果如图9所示,g-exosomes处理后th17诱导分化细胞中,候选mirna的表达量增加最大的是mir-16-5p、mir-29a-3p和mir-93-5p。
(5)通过entrancetm-r转染试剂(北京engreen公司)将mir-16-5p、mir-29a-3p和mir-93-5p的mimics和mimics-阴性对照(广州锐博生物科技有限公司)分别转染到实施例4步骤(5)分选出的初始t细胞,然后按照实施例4中方法诱导分化为th17细胞,通过qrt-pcr检测,结果如图10,转染mimics的th17细胞中mir-16-5p、mir-29a-3p和mir-93-5p表达量相应提高;如图11,转染了mir-93-5p的mimics的初始t细胞向th17细胞分化的比例明显低于转染了mimics-阴性对照的初始t细胞,而转染了mir-16-5p对应mimics和mir-29a-3p对应mimics的初始t细胞则没有明显变化。这些结果表明,外源性的mir-93-5p可以抑制初始t细胞向th17细胞的分化,这提示g-exosomes可能通过其携带的mir-93-5p抑制th17细胞的分化。
实施例6:制备过表达或阻断mir-93-5p的g-exosomes
(1)将mir-93-5p的mimics、mimics-阴性对照(mimics-negitivecontrol,mimics-nc)以及inhibitors、inhibitors-阴性对照(inhibitors-negitivecontrol,inhibitors-nc)的冻干粉(广州锐博生物科技有限公司)离心后,用无菌depc水溶解,吹打混匀成终浓度为20μm的储存液,分装保存于-80℃冰箱;
(2)接种细胞,在24孔板中每孔接种1×106个g-mdsc,用10%小牛血清的rpmi1640培养液(美国gibico公司)补足体系为450μl;
(3)mimics、mimics-nc以及inhibitors、inhibitors-nc稀释液的制备:取干净的ep管,分别加入mimics和mimics-nc50nm,再分别加入1.25μl的mimics或mimics-nc的储存液,然后用无血清的rpmi1640培养液(美国gibico公司)补足至25μl;再取干净的ep管,分别加入inhibitors和inhibitors-nc100nm,再分别加入2.5μl的inhibitors、inhibitors-nc的储存液,然后用无血清的rpmi1640培养液(美国gibico公司)补足至25μl;
(4)entrancetm-r转染试剂稀释液的制备:取一个干净ep管,加入相应量的entrancetm-r转染试剂(北京engreen公司),根据mimics、mimics-nc、inhibitors、inhibitors-nc的量控制转染试剂的用量,每50nm加入1μl转染试剂,然后用无血清的1640培养基(美国gibico公司)补足至25μl,室温静置5min;
(5)转染复合物的制备:将entrancetm-r转染试剂(北京engreen公司)稀释液加入到相应mimics、mimics-nc或者inhibitors、inhibitors-nc稀释液中,然后立即充分混匀,室温静置30min;
(6)将50μl的转染复合物滴加到步骤(2)中的接种细胞中,轻轻混匀;
(7)转染6个小时后观察细胞状态,如果细胞状态佳,则离心收集g-mdsc;
(8)按照实施例2中方法利用转染了mimics或者inhibitors的g-mdsc制备过表达或阻断mir-93-5p的g-exosomes。
实施例7:验证过表达或阻断mir-93-5p的g-exosomes
(1)收集实施例6步骤(6)中各处理组1×106个g-mdsc,按照实施例5步骤(3)中的方法提取各处理组g-mdsc的总rna,并检测其浓度;
(2)按照实施例5中的方法对各处理组g-mdsc的mir-93-5p的含量进行荧光定量检测,结果如图12所示mir-93-5p的mimics或者inhibitors成功转染到了g-mdsc。
(3)收集实施例6步骤(8)中各处理组每3×107个g-mdsc分泌的g-exosomes,用1ml的trizol(美国invitrogen公司)溶解。
(4)按照实施例5中操作方法对各组g-exosomes包含的mir-93-5p进行定量分析,如图13所示转染了mir-93-5p的mimics的g-mdsc分泌的g-exosomes中相对于mimics-nc组mir-93-5p的表达量显著提高(p<0.01),而转染了mir-93-5p的inhibitors的g-mdsc分泌的g-exosomes中相对于inhibitors-nc组mir-93-5p的表达量降低了(p<0.05)。这些结果说明本实施例成功提取了过表达或阻断mir-93-5p的g-exosomes,本实施例中制备的过表达mir-93-5p的g-exosomes相对于原有的g-exosomes相比,mir-93-5p的含量大约增加了15倍。
实施例8:g-exosomes装载的mir-93-5p可以体外抑制th17细胞的分化
(1)在th17细胞诱导分化体系中加入60μg/ml过表达或阻断mir-93-5p的g-exosomes,如图14所示,过表达mir-93-5p的g-exosomes处理组(转染mimics组)相对于mimics-nc组th17细胞的比例明显降低了(p<0.01),而阻断mir-93-5p的g-exosomes处理组(转染inhibitors组)相对于inhibitors-nc组th17细胞的比例增高了(p<0.05)。这些结果表明g-exosomes携带的mir-93-5p可以体外抑制th17细胞的分化,并且过表达mir-93-5p的g-exosomes对于th17细胞分化的抑制能力更强。本实施例中过表达mir-93-5p的g-exosomes相对于原有的g-exosomes相比对于th17细胞分化的抑制能力更强,th17细胞的比例减少了一倍。
(2)根据实施例5中操作方法检测过表达或阻断mir-93-5p的g-exosomes处理后th17诱导体系中细胞的mir-93-5p的表达量,如图15所示,过表达mir-93-5p的g-exosomes处理组与mimics-nc组相比较,可以使诱导细胞mir-93-5p表达水平明显提高(p<0.01),阻断mir-93-5p的g-exosomes处理组mir-93-5p表达水平相对于inhibitors-nc组则显著降低了(p<0.001)。这些结果说明g-exosomes可以将其携带的mir-93-5p传递到受体细胞,从而发挥抑制功能,并且本发明制备的过表达mir-93-5p的g-exosomes传递mir-93-5p的效率更高。
实施例9:g-exosomes装载的mir-93-5p可以更加有效的抑制cia模型小鼠的发病,缓解疾病的严重程度
(1)利用实施例4中构建的cia模型小鼠;
(2)在第一次免疫后第18天和第24天对cia模型小鼠进行尾静脉注射过表达或阻断mir-93-5p的g-exosomes。
(3)实验分组:
pbs缓冲液组:分别在免疫的第18天和24天对每只小鼠尾静脉注射pbs100μl;
g-exosomes组:分别在免疫的第18天和24天对每只小鼠尾静脉注射100μl的pbs溶解的g-exosomes;
mimics-nc-exosomes组:分别在免疫的第18天和24天对每只小鼠尾静脉注射100μlpbs溶解的转染mimic-nc后g-mdsc分泌的g-exosomes;
mimics-exosomes组:分别在免疫的第18天和24天对每只小鼠尾静脉注射100μl的pbs溶解的转染mimic后g-mdsc分泌的g-exosomes;
inhibitors-nc-exosomes组:分别在免疫的第18天和24天对每只小鼠尾静脉注射100μl的pbs溶解的转染inhibitors-nc后g-mdsc分泌的g-exosomes;
inhibitors-exosomes组:分别在免疫的第18天和24天对每只小鼠尾静脉注射100μl的pbs溶解的转染inhibitors后g-mdsc分泌的g-exosomes。
上述各组中,100μlpbs中溶解100μg不同处理组的g-exosomes。
(4)如图16所示,mimics-exosomes处理组小鼠的平均关节炎指数相对mimics-nc-exosomes处理组明显降低(p<0.05),inhibitors-exosomes处理组小鼠的平均关节炎指数相对inhibitors-nc-exosomes处理组显著升高(p<0.01)。如图17所示,g-exosomes、mimics-nc-exosomes、mimics-exosomes、inhibitors-nc-exosomes组小鼠的足趾只有轻度的红肿,关节活动正常;然而pbs缓冲液组、inhibitors-exosomes组小鼠的足趾大多红肿明显,关节活动受限。如图18所示,g-exosomes、mimics-nc-exosomes、mimics-exosomes、inhibitors-nc-exosomes组小鼠的足趾关节处骨结构相对完整,关节间隙相对正常,少有炎症性细胞浸润;然而pbs缓冲液组、inhibitors-exosomes组小鼠的足趾关节处骨结构遭到严重破坏,关节间隙减小,有大量炎症性细胞浸润。这些结果表明g-exosomes携带的mir-93-5p可以抑制cia模型小鼠的发病,缓解疾病的严重程度,并且过表达mir-93-5p的g-exosomes对cia模型小鼠具有更强的保护作用。
本实施例中过表达mir-93-5p的g-exosomes相对于原有的g-exosomes相比对于cia小鼠的保护作用更强,相对于原有的g-exosomes,过表达mir-93-5p的g-exosomes处理小鼠的平均关节炎指数下降了接近一倍,足趾肿胀程度明显减轻,关节结构更加完整。
(5)分离各组小鼠腘窝淋巴结,制备单细胞悬液,如图19所示流式细胞术分析各组小鼠腘窝淋巴结细胞中th17细胞比例,mimics-exosomes处理组小鼠的腘窝淋巴结细胞中th17细胞比例相对于mimics-nc-exosomes处理组显著降低(p<0.01),inhibitors-exosomes处理组相对于inhibitors-nc-exosomes处理组th17细胞比例显著升高(p<0.001),另外pbs处理组与mimics-nc-exosomes处理组或者inhibitors-nc-exosomes处理组相比无明显差异(p>0.05)。如图20所示qrt-pcr检测各组小鼠引流淋巴结cd4+t细胞mir-93-5p的表达量,mimics-exosomes处理组小鼠引流淋巴结cd4+t细胞mir-93-5p的表达量相对于mimics-nc-exosomes处理组显著升高(p<0.01),inhibitors-exosomes处理组相对于inhibitors-nc-exosomes处理组mir-93-5p的表达量明显降低(p<0.01),另外pbs缓冲液组与mimics-nc-exosomes处理组或者inhibitors-nc-exosomes处理组相比无明显差异(p>0.05)。这些结果说明g-exosomes可以通过运输mir-93-5p到受体细胞,抑制cia模型小鼠引流淋巴结致病性th17细胞的比例,缓解疾病的严重程度,并且本发明制备的过表达mir-93-5p的g-exosomes具有更高的运输mir-93-5p的效率,对于cia模型小鼠的保护作用也更强。
本实施例中过表达mir-93-5p的g-exosomes相对于原有的g-exosomes相比对于cia小鼠的保护作用更强,相对于原有的g-exosomes,过表达mir-93-5p的g-exosomes处理小鼠腘窝淋巴结细胞中th17细胞的比例下降了一倍,致病性th17细胞比例的减少对于抑制cia小鼠的发病至关重要。
实施例10:g-exosomes装载的mir-93-5p可以降低靶标蛋白stat3的表达
(1)根据targetscan网站分析,如图21所示,mir-93-5p可以与靶标基因stat3的3’utr区域的248-254、495-501两个区域特异性结合。
(2)收集过表达或阻断mir-93-5p的g-exosomes处理后th17诱导体系中的细胞,westernblot检测各处理组细胞stat3的表达水平,如图22所示,过表达mir-93-5p的g-exosomes处理组相对于mimics-nc组stat3的表达水平降低了(p<0.05),而阻断mir-93-5p的g-exosomes处理组相对于inhibitors-nc组stat3的表达水平增高了(p<0.05)。这些结果表明g-exosomes携带的mir-93-5p可以抑制受体细胞stat3的表达,从而抑制th17细胞的分化,本发明制备的过表达mir-93-5p的g-exosomes具有更强的抑制靶标蛋白stat3表达的作用,从而发挥更强的免疫抑制功能。本发明制备的过表达mir-93-5p的g-exosomes具有更强的抑制靶标蛋白stat3表达的作用,相对于原有g-exosomes相比,stat3表达水平下降了一倍,从而发挥更强的抑制th17细胞分化的功能。
(3)收集过表达或阻断mir-93-5p的g-exosomes处理后cia模型小鼠引流淋巴结cd4+t细胞,westernblot检测各处理组细胞stat3的表达水平,如图23所示,过表达mir-93-5p的g-exosomes处理组相对于mimics-nc组stat3的表达水平明显降低了(p<0.01),而阻断mir-93-5p的g-exosomes处理组相对于inhibitorss-nc组stat3的表达水平增高了(p<0.05)。这些结果说明g-exosomes携带的mir-93-5p可以在cia模型小鼠体内外降低受体细胞靶标蛋白stat3的表达,并且本发明制备的过表达mir-93-5p的g-exosomes具有更强的抑制靶标蛋白stat3表达的能力,从而对cia模型小鼠发挥更强的保护作用。本发明制备的过表达mir-93-5p的g-exosomes具有更强的抑制靶标蛋白stat3表达的能力,相对于原有g-exosomes相比,stat3表达水平下降了近2倍,从而对cia模型小鼠发挥更强的保护作用。
- 还没有人留言评论。精彩留言会获得点赞!