一种四面体结构的载药体系及制药用途的制作方法
本发明提供一种具有四面体结构的载药体系的设计、制备及制药用途,属于生物医药技术领域。
背景技术:
鼻咽癌(nasopharyngealcarcinoma,npc)是目前发病率最高的头颈部恶性肿瘤。在世界范围内,其主要发病地区为中国南部、东南亚以及非洲的中东部和南部,尤其以中国南部粤语人群发病率最高,达25-30/10万;而大多数西方国家npc的发病率较低。npc对射线相对敏感,部分早期npc患者经过单纯放射治疗后即可治愈;但晚期(ⅲ、ⅳ)npc即使放化疗结合治疗,其5年生存率仍徘徊在10%~40%左右,治疗效果未从根本上得到改善。难治性npc及转移性npc的治疗仍然存在巨大的挑战。因此,对鼻咽癌新的治疗方法的探索尤为重要。相对于鼻咽黏膜正常上皮细胞,鼻咽癌肿瘤细胞往往会特异性的高表达某些分子标记。利用肿瘤细胞与正常细胞之间表面分子表达的这种差异性,能够设计特异性识别肿瘤细胞的靶向治疗策略,从而提高抗肿瘤药物在体内的选择性,实现鼻咽癌的靶向治疗。
cd44蛋白是细胞外基质的主要成分,是一类跨膜单链糖蛋白,参与细胞-细胞/基质间的粘附,激活淋巴细胞归巢及细胞迁移。研究发现,cd44在多种肿瘤细胞表面过表达并与肿瘤发生发展及侵袭转移密切相关,是潜在的肿瘤治疗分子靶点。研究显示,cd44在npc细胞中高表达并在npc的发生发展过程中发挥重要作用,可用作独立的肿瘤不良预后指标。在本课题组的前期研究中,通过激光扫描共聚焦技术研究发现,在人鼻咽癌sune-15-8f细胞表面cd44过表达。体外实验证实,与cd44-细胞相比,cd44+细胞具有更强的增殖、侵袭和转移能力,以及对放化疗的抵抗性。这些研究提示:cd44+鼻咽癌细胞表现出类肿瘤干细胞物性,靶向cd44+肿瘤细胞的抗肿瘤治疗是颇具前景的鼻咽癌精准治疗策略。
目前,最有效的靶向cd44的抗肿瘤策略是以抗cd44抗体作为靶头分子,将其与抗肿瘤药物耦联,从而将药物靶向传送至cd44高表达的肿瘤细胞中。然而,由于ⅰ期临床试验中出现的各种强烈的毒副作用,相关的临床试验均已被叫停。究其原因,虽然cd44分子在肿瘤细胞中高表达,但是在正常人体组织细胞中也有表达,由于抗cd44抗体的特异性强,导致基于该策略的靶向药物难以避免地产生对正常细胞的非特异性杀伤副作用。据报道,cd44存在两种不同的状态:正常细胞表面cd44多处于静息态,而肿瘤细胞表面的cd44由于受到多种因素的影响而处于活化状态。因此,如能实现特异性识别肿瘤细胞表面处于活化状态的cd44,将为鼻咽癌的靶向治疗提供新的契机。
核酸适配体是通过指数富集配基进化系统(selex)筛选得到的一段单链/双链寡聚核苷酸,它可以高亲和性、高特异性地与靶蛋白结合,故可作为靶头分子与药物载体相连接,并促进这些药物靶向进入肿瘤组织和肿瘤细胞之中。目前,以核酸适配体作为靶头分子构建高靶向性的药物递送系统是抗肿瘤研究的热点领域之一。有研究表明selex实验筛选获得的硫代修饰的dna核酸适配体能够特异性识别肿瘤细胞表面cd44分子,如将其作为靶头分子将具有如下优势:(1)以肿瘤细胞为模型筛选获得,因此只有活化态cd44才能与其结合,而静息态则不能,由此避免了对正常细胞的毒副作用;(2)与天然配体相比,具有更高的靶标亲和力和特异性;(3)核酸适配体分子很小,可以在cd44介导下内吞入细胞内,将携带的药物靶向递送至肿瘤细胞内;(4)核酸是人体天然存在的物质,进入人体不会导致强烈的免疫反应。因此,与当前主流的针对cd44靶向治疗的抗体策略相比,基于核酸适配体的靶向治疗策略具有更加广阔的应用前景。
目前常用于靶向治疗的药物递送载体主要为病毒载体和非病毒载体。病毒载体由于其潜在的致病性、免疫原性等缺点,使其应用受到局限;非病毒载体则存在生物相容性差、不易代谢,易在体内蓄积产生毒性等问题。因此,研发安全有效的靶向递送载体系统仍是目前靶向治疗亟需解决的重大问题之一。dna不仅是生命体的遗传物质,还是组成生物纳米结构功能材料的理想元件。dna纳米材料具有良好的机械性能,并富有可编程性和可控性。更为重要的是,该材料以人体固有的dna作为原材料,具有很好的生物相容性和降解能力,对生物体毒害作用小;目前该dna四面体作为药物转运载体在药物输送方面已经表现出很大的应用潜能。因此,dna纳米药物载体的出现为药物靶向治疗提供了新的手段和途径。
as1411是一种正在研发中的抗肿瘤核酸适配体,由26个碱基组成。己经证实,as1411对多种肿瘤细胞均能发挥明显的增殖抑制作用。进一步研究表明核仁素是as1411的分子靶点。核仁素是核仁中含量最丰富的磷酸化蛋白,具有多种生物学功能:参与细胞增殖、生长以及抗细胞凋亡作用。有研究表明:as1411的抗肿瘤作用机制为靶向抑制肿瘤细胞中核仁素的功能而阻止dna损伤修复,继而诱发细胞凋亡而达到抑制肿瘤的目的。目前,as1411作为一种新型的抗癌药物已经进入二期临床试验,试验结果显示as1411的安全性及对各种实体癌具有很好的抗癌效果。
综上所述,相对于正常细胞,鼻咽癌肿瘤细胞表面特异性的高表达cd44分子标记这一特征,为鼻咽癌靶向治疗策略的设计提供了条件。本研究工作的总体思路是,以dna四面体结构作为药物载体的主体结构,研发新型抗肿瘤靶向载药体系。该载药体系通过dna四面体每条边上伸出的手臂链,以碱基互补配对的方式将能靶向识别cd44分子的核酸适配体和能靶向抑制核仁素的核酸适配体as1411组合修饰到dna四面体上,由此构建一种新型抗鼻咽癌药物靶向递送体系。该载药体系将药物分子as1411高效靶向递送至鼻咽癌细胞中,进而发挥抗肿瘤效应。本项目的成功实施,将研发出一种能特异性靶向鼻咽癌细胞的智能型、高效低毒的新型药物递送系统,为鼻咽癌的靶向治疗提供新技术和新途径,具有重要的临床应用前景。
技术实现要素:
基于上述目的,本发明提供一种靶向药物,具体为四面体结构的载药复合物,具体为aptamer-as1411-dna。
优选为该载药体系的结构为aptamer1-as1411-dna,该载药体系的结构为aptamer1-as1411-dna具体是以一条aptamer1和三条as1411以碱基互补配对的方式同时连接到dna四面体上。
所述的aptamer1为
tgc*ag*atgc*a*aggt*a*acc*at*atcc*a*a*agc*a*aattgatctatgatcgtacgat;三条as1411为as1411(1)、as1411(2)、as1411(3),其中,
as1411(1)具体为
ggtggtggtggttgtggtggtggtggtcggaatgcaatacgactgta;
as1411(2)具体为
ggtggtggtggttgtggtggtggtgggaaagcttgtagctatagtta;
as1411(3)具体为
ggtggtggtggttgtggtggtggtggagttaaacatcgcatgtgctt。
或优选载药体系的结构为aptamer2-as1411-dna,该载药体系的结构为aptamer2-as1411-dna具体是以一条aptamer2和三条as1411以碱基互补配对的方式同时连接到dna四面体上
所述的aptamer2为
ttggg*acggtgtt*a*a*acg*a*a*agggg*acg*acattgatctatgatcgtacgat;三条as1411为as1411(1)、as1411(2)、as1411(3),其中,as1411(1)具体为
ggtggtggtggttgtggtggtggtggtcggaatgcaatacgactgta;
as1411(2)具体为
ggtggtggtggttgtggtggtggtgggaaagcttgtagctatagtta;
as1411(3)具体为
ggtggtggtggttgtggtggtggtggagttaaacatcgcatgtgctt。
或进一步优选为载药体系的结构为aptamer3-as1411-dna,该载药体系的结构为aptamer3-as1411-dna具体是以一条aptamer3和三条as1411以碱基互补配对的方式同时连接到dna四面体上。
所述的aptamer3为
gtccc*a*aggcctgc*a*aggg*a*acc*a*agg*ac*ac*aggacattgatctatgatcgtacgat;三条as1411为as1411(1)、as1411(2)、as1411(3),其中,as1411(1)具体为
ggtggtggtggttgtggtggtggtggtcggaatgcaatacgactgta;
as1411(2)具体为
ggtggtggtggttgtggtggtggtgggaaagcttgtagctatagtta;
as1411(3)具体为
ggtggtggtggttgtggtggtggtggagttaaacatcgcatgtgctt。
本发明将所述的四面体结构的载药体系在制备治疗鼻咽癌的药物上的应用。
所述的鼻咽癌是针对cd44+鼻咽癌5-8f细胞。
所述的四面体结构的载药体系的浓度为0.1μm-1.0μm。
附图说明
图1分子动力学模拟后aptamer1-cd44复合物的平均结构(a)和rmsd曲线(b)。
图2分子动力学模拟后aptamer2-cd44复合物的平均结构(a)和rmsd曲线(b)。
图3分子动力学模拟后aptamer3-cd44复合物的平均结构(a)和rmsd曲线(b)。
图4dna四面体的page表征图。1到6分别指代s1+s2,s1,s1+s2+s3,s1+s2+s3+s4,s1+s2+s3+s4+s5和s1+s2+s3+s4+s5+s6。
图5三种dna核酸适配体修饰的dna四面体的page表征图。1到4分别指代dna四面体,aptamer1-dna四面体,aptamer2-dna四面体和aptamer3-dna四面体。
图6为aptamer1-as1411-dna四面体的page表征图。1指代dna四面体,2指代aptamer1-dna四面体,3指代aptamer1-dna四面体连接一条as1411,4指代aptamer1-dna四面体连接两条as1411,5指代aptamer1-dna四面体连接三条as1411。
图7为aptamer2-as1411-dna四面体的page表征图。5指代dna四面体,4指代aptamer1-dna四面体,3指代aptamer1-dna四面体连接一条as1411,2指代aptamer1-dna四面体连接两条as1411,1指代aptamer1-dna四面体连接三条as1411。
图8为aptamer3-as1411-dna四面体的page表征图。5指代dna四面体,4指代aptamer1-dna四面体,3指代aptamer1-dna四面体连接一条as1411,2指代aptamer1-dna四面体连接两条as1411,1指代aptamer1-dna四面体连接三条as1411。
图9为血清稳定性评价结果。
图10.鼻咽癌5-8f细胞对载药体系的摄取量。
图11.流式细胞术检测入胞效率(aptamer2-as1411-dna四面体载药体系)。
图12.流式细胞术检测入胞效率(aptamer3-as1411-dna四面体载药体系)。
图13.流式细胞术检测nih3t3细胞的入胞效率(aptamer1-as1411-dna四面体载药体系。
图14.流式细胞术检测nih3t3细胞的入胞效率(aptamer2-as1411-dna四面体载药体系)。
图15.流式细胞术检测nih3t3细胞的入胞效率(aptamer3-as1411-dna四面体载药体系)。
图16.荧光显微镜检测入胞效率(aptamer1-as1411-dna四面体载药体系)。
图17.荧光显微镜检测入胞效率(aptamer2-as1411-dna四面体载药体系)。
图18.荧光显微镜检测入胞效率(aptamer3-as1411-dna四面体载药体系)。
图19.cck8实验检测细胞增殖(aptamer1-as1411-dna四面体载药体系)。
图20.cck8实验检测细胞增殖(aptamer2-as1411-dna四面体载药体系)。
图21.cck8实验检测细胞增殖(aptamer3-as1411-dna四面体载药体系)。
具体实施方式
实施例1
仪器与设备
细胞系
人鼻咽癌细胞株sune-15-8f,购于中山大学细胞库。
主要试剂
dna序列购自上海生工生物生物工程有限公司,纯化级别为ultrapage或者hplc,dna序列见表1。
表1dna序列
注:*指修饰位点
1)rpmi1640培养基液gibco,美国
2)胎牛血清gibco,美国
3)胰酶gibco,美国
4)cck-8试剂盒索莱宝(solarbio),中国
5)pbs粉剂谷歌生物,中国
6)二甲基亚飒(dmso)sigma,美国
7)ripa裂解液碧云天,中国
8)tris-base索莱宝(solarbio),中国
9)mgcl2·5h2obiosharp,中国
10)青霉素gibco,美国
11)链霉素gibco,美国
12)凝胶配制试剂盒博士德,中国
13)temedsigma,美国
14)丙烯酰胺biosharp,中国
15)甲叉双丙烯酰胺biosharp,中国
16)溴化乙锭(eb)谷歌生物,中国
17)甘氨酸biosharp,中国
18)硼酸索莱宝(solarbio),中国
19)核仁素抗体(westernblot)abcam,英国
20)核仁素抗体(流式)abcam,英国
21)hrp标记的山羊抗兔igg谷歌生物,中国
22)edtabiosharp,中国
23)甲醛国药集团化学试剂有限公司,中国
24)pvdf膜谷歌生物,中国
试剂的配制
1)rpmi1640完全培养液:90%rpmi1640培养基+10%fbs+双抗(青霉素100units/ml、链霉素100μg/ml)
2)rpmi1640不完全培养液:100%dmem/f12(1:1)培养基+10ng/mlbfgf+20ng/mlegf+5μg/mlisulin+双抗(青霉素200units/ml、链霉素200μg/ml)
3)磷酸盐缓冲液(pbs,ph7.4)
将pbs粉末置于盛有200m细胞用水的烧杯中,磁珠搅拌使其完全溶解,得到10×的储存液,使用前再用细胞用水稀释10倍,得到工作液(1x),高压消毒灭菌,放置于4℃冰箱中,保存备用;
4)细胞冻存液:dmso:fbs:rpmi1640培养基液=1:2:7,即配即用。
5)细胞洗液:98%rpmi1640培养基液+2%fbs+双抗(青霉素100units/ml、链霉素100μg/ml)
6)细胞收集液:80%rpmi1640培养基液+20%fbs+双抗(青霉素100units/ml、链霉素100μg/ml)
7)tm缓冲液
购置的tris-base粉末和mgcl2·5h2o粉末溶解于盛有10ml细胞用水的洁净烧杯中,待其完全溶解后,置于4℃冰箱保存备用。
8)tbe(5×)溶液
购置的tris-base粉末(54g)、硼酸(27.5g)和edta(3.72g)溶解于1l的去离子水中,待其完全溶解后,室温保存备用。
9)电泳液缓冲液:tris-base1.515g
甘氨酸9.385g
sds0.5g
加蒸馏水至500ml,溶解后室温保存;
10)转膜缓冲液:tris-base1.5g
甘氨酸7.2g
甲醇100ml
加蒸馏水至500ml,溶解后室温保存;
11)tbs(tris-hcl缓冲盐溶液)缓冲液:将购置的tbs粉末置于洁净烧杯中,磁珠搅拌使其溶解于200ml蒸馏水中,得到储存液(10×),室温保存。临用前再用蒸馏水稀释10倍,得到工作液(1×);
12)tbst:将0.5ml的吐温20加入0.5l的tbs缓冲液(1×)中,摇匀。即配即用。
13)30%n,n-亚甲基双丙烯酰胺(37.5:1):电子天平秤取丙烯酰胺、甲叉双丙烯酰胺各29.221g和0.779g,加入盛有90ml去离子水的烧杯中。磁力搅拌器搅拌约30min(避光),待其混匀后,去离子水定容至100ml。并继续磁力搅拌器搅拌过夜,直至液体澄清。避光4℃冰箱保存。
14)native-page非变性聚丙烯酰胺胶:将配胶所需的玻璃板清水洗净,蒸馏水冲洗数次。电吹风吹干后,安装。配胶配方如下:蒸馏水4.7ml、30%n,n-亚甲基双丙烯酰胺(37.5:1)1.25ml、tbe(5×)1.5ml、过硫酸铵(ap)55ul以及temed5ul加入50ml离心管中,涡旋振荡直至充分混匀。采用加样器将液体状的胶液从玻璃板一侧缓慢加入(尽量避免有气泡)直至加满,插入梳子。待30min左右完全凝固,如室温较低,可适当延长凝固时间。
15)分离胶配方:水4.6ml、30%丙烯酰胺2.7ml、1.5mol/ltris(ph8.8)2.5ml、10%sds100ul、10%过硫酸铵100ul以及temed6ul。
16)浓缩胶配方:水2.1ml、30%丙烯酰胺500ul、1.5mol/ltris(ph6.8)380ml、10%sds30ul、10%过硫酸铵30ul以及temed3ul。
计算模型的构建及分子动力学模拟
手动构建了三个带有互补手臂链的核酸适配体的分子模型,并采用z-dock的方法将其与cd44蛋白(pdbid:2jcq.pdb)进行分子对接,最后获得三个核酸适配体-cd44复合物分子模型。随后,对构建的三个复合物模型进行分子动力学模拟。具体流程如下:
首先,利用discoverystudio2.5软件处理上述构建好的三个初始结构,将蛋白结构中缺失的氨基酸和原子补全,然后使用软件中的结构评价模块对复合物中的蛋白和核酸结构进行检查,确保复合物结构的正确性,最后使用amber11软件包中的leap模块构建三个用于分子动力学模拟的初始结构。
分子动力学模拟采用的是amber11中的sander程序。将处理好的初始结构浸入
5-8f细胞培养、传代、冷冻以及复苏
1)细胞培养:人鼻咽癌细胞株sune-15-8f培养在含10%fbs+双抗(青霉素100units/ml、链霉素100μg/ml)的rpmi1640完全培养基中。分选后,部分cd44+细胞培养在含10ng/mlbfgf+20ng/mlegf+5μg/mlinsulin+双抗(青霉素200units/ml、链霉素100μg/ml)rpmi1640培养基中。置于含5%co2,温度为37℃的培养箱,每1~2天更换一次培养基;根据细胞密度用accutase酶消化传代,每隔1~2天传代1次。实验采用处于对数生长期的细胞。
2)细胞的传代:sune-15-8f细胞为贴壁生长型,当细胞密度达到85%左右融合度时,弃去旧培养基,pbs液洗涤细胞1~2次,加入37℃预热的0.25%胰蛋白酶-0.02%edta消化液1.0ml,轻轻转动培养瓶,使消化液铺满培养瓶底。于显微镜下观察细胞形态,当细胞收缩变圆时即吸出消化液,加入4~5ml新鲜培养基中止消化,反复吹打10~20次,使其形成单细胞悬液,平均分配到2~3个培养瓶中即完成传代。
3)细胞的冻存:取状态佳的细胞,于24h内换液。消化细胞,1500rpm,离心5min收集细胞,加入现配的细胞冻存液,重悬细胞。吸取1ml的悬液分装至1.5ml经高压灭菌的冻存管中,封口并记录(细胞名称及冻存时间)。置于4℃30min,-20℃60min,再转入-80℃,最后移入液氮罐中长期保存。
4)细胞的复苏:将恒温水浴锅预热至37℃,将细胞冻存管从-80℃冰箱或液氮中取出,迅速置入水浴锅内,使其在1min内快速解冻熔化。离心(1800rpm,5min),小心吸弃上清液,滴加1ml37℃预温的培养液并吹打成悬液后转移至培养瓶中,补加培养基至5~6ml,并用滴管吹匀,置于37℃,5%co2饱和湿度培养箱中培养。观察细胞状态,24h内待细胞贴壁后给予换液,此后按常规方法培养。
nih/3t3小鼠胚胎细胞培养、传代
培养
将购置的nih/3t3细胞培养在含10%fbs+双抗(青霉素100units/ml,链霉素100ug/ml)的dmem完全培养基中。采用一次性细胞培养瓶(规格:25cm2)为并置于恒温培养箱(37℃、5%浓度co2)中培养。细胞培养过程中,每隔24h换液一次。如细胞融合度超过85%时,应及时采用0.25%浓度的胰酶消化后传代。
传代
1)吸弃培养基,并采用pbs缓冲液重洗。
2)加入1ml胰酶消化液,恒温培养箱中孵育约1分钟后置于倒置纤维镜下观察。若细胞回缩变圆、轻拍一侧培养瓶的瓶壁可脱落时,即消化完成。此时因及时加入5ml完全培养基终止消化。
3)将细胞悬液收集到离心管中离心(1000rpm/5min),离心后弃上清液。并用1ml完全培养基重悬细胞。
4)重悬的细胞悬液可以分装于2培养瓶中进行传代,也可以用于冻存。
dna四面体的合成
在tm缓冲液中混合等摩尔浓度的s1、s2、s3、s4、s5和s6,置于pcr仪中加热到95℃变性10min,再迅速降到4℃,即可得到dna四面体结构。
aptamer-dna四面体的合成
在tm缓冲液中混合等摩尔浓度的核酸适配体、s1、s2、s3、s4、s5和s6,置于pcr仪中加热到95℃变性10min,再迅速降到4℃,即可得到三种核酸适配体-dna四面体结构(aptamer1-dna四面体、aptamer2-dna四面体和aptamer3-dna四面体)。
aptamer-as1411-dna四面体的合成
在tm缓冲液中混合等摩尔浓度的核酸适配体、s1、s2、s3、s4、s5、s6以及三条as1411分子,置于pcr仪中加热到95℃变性10min,再迅速降到4℃,即可得到三种同时携带核酸适配体和as1411的dna四面体结构
(aptamer1-as1411-dna四面体、aptamer2-as1411-dna四面体和aptamer3-as1411-dna四面体)。
结构表征
采用5%的非变性聚丙烯酰胺凝胶电泳(page)对上述合成的各种结构进行鉴定。配制5%的page分离胶(30%acr-bis,1.25ml;超纯水4.7ml;5×tbe缓冲液,1.5ml;10%aps,55ul;temed,5μl),待胶凝好后置于1×tbe缓冲液中,将上述合成的样品与6×上样缓冲液按体积5:1混合均匀,上样,100v电泳90min,加入eb染色30min,置于凝胶成像仪中成像。
血清稳定性试验
将as1411、dna四面体以及各种修饰的dna四面体结构与胎牛血清按体积比9:1的比例混合,在37℃温箱中分别孵育0h、2h、4h、6h、8h和24h,并通过非变性聚丙烯酰胺凝胶电泳对孵育后的各种结构的降解情况进行结构鉴定。
荧光显微镜检测入胞效率
1)种板:选取形态较好、处于对数生长期的5-8f细胞,采用胰酶消化液进行消化后制成单个细胞的悬液。以1×104/孔种植于24孔板中,并在每孔中加入2ml的rpmi1640完全培养基。置于5%co2浓度、37℃的恒温培养箱中培养12h。
2)合成:取出dna干粉s1(fitc)、s2、s3、s4、s5、s6、aptamer1、aptamer2、aptamer3、as1411(1)、as1411(2)以及as1411(3)各一支。按照以上方法配制工作液并采用pcr技术合成aptamer1-as1411-dna四面体、aptamer2-as1411-dna四面体(fitc)、aptamer3-as1411-dna四面体、as1411+dna四面体。待合成完成后,用不含血清的空白培养基将各组浓度稀释为0.5um。
3)孵育:将24孔板取出,吸弃培养基后,pbs缓冲液冲洗三次。将以上合成的荧光药物添加于相应的孔中,置于5%co2浓度、37℃的恒温培养箱中孵育2h。
4)采集图像:孵育完成后孵育完成后,取出细胞培养板。超净工作台中负压吸引器吸弃液体,pbs冲洗三次后,移至荧光倒置显微镜下观察。首先在明场中找到目标的视野,将焦距调节至清晰,并采集此刻明场时候的图片。随后关闭灯光,打开激发光源,于暗场中观察同一视野中的绿色荧光,并采集收集到的暗场图片。按照以上方法,分别采集各组明场图片和暗场图片。
流式细胞术检测靶向载药体系的入胞效率
首相,将处于对数期的细胞用0.25%的胰酶进行消化,制成单细胞悬液,
以每孔1×105个细胞接种于24孔培养板中,接种完毕后,将24孔培养板置于37℃、5%co2的恒温培养箱中培养24h。培养24h后,弃去培养板中的旧培养基,用pbs洗3次,将s1链上标记有cy5的各组合成结构以0.5μm的终浓度与细胞共孵育2h。终止培养,弃去培养基,使用pbs溶液清洗3次,0.25%胰酶消化,收集细胞,用流式细胞仪进行分析。
cck8实验检测细胞增殖
首先,选取处于对数生长期的鼻咽癌5-8f细胞,将细胞以1×104个/孔铺在96孔板中,培养24小时后,除去旧的培养基,用pbs清洗3次。将各组按0.75μm、0.5μm、0.1μm和0μm的终浓度分别与细胞在96孔板中共培养72h。置于含5%co2、温度为37℃的培养中培养,根据培养基的颜色适时换液。培养72h后,分别于每孔加入100μlcck-8,并于培养箱中孵育2h,最后用酶标仪检测450nm处的吸光度a值,来观察细胞的存活率。
统计学分析
采用统计学软件graphpadprism5进行数据的统计,两样本数据采用两独立样本t检验,多组间比较采用单因素重复测量数据的方差分析,计量资料采用均数(mean)±标准差(standarddeviation,sd)表示,检验水准α=0.05,p<0.05为具有统计学差异。
“aptamer-as1411-dna四面体”载药体系的设计、制备及表征“aptamer-as1411-dna四面体”载药体系的设计
aptamer1-cd44分子复合物结构模型
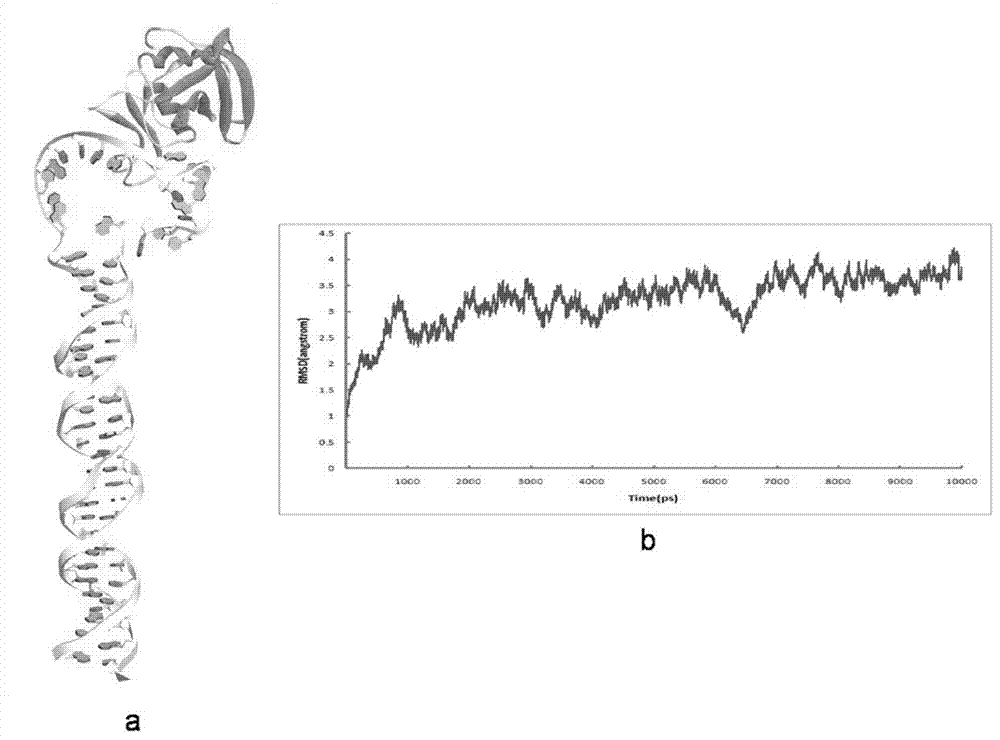
在本研究工作中,我们对构建的aptamer1-cd44复合物分子模型进行了10ns的分子动力学模拟。图1显示的是复合物的rmsd值与模拟时间的关系曲线。由图可知:在开始的5ns模拟时间内缓缓上升,5ns以后,体系进入平衡,rmsd维持在
aptamer2-cd44分子复合物结构模型
在本研究工作中,我们对构建的aptamer2-cd44复合物分子模型进行了10ns的分子动力学模拟。图2显示的是复合物的rmsd值与模拟时间的关系曲线。由图可知:在开始的7ns模拟时间内缓缓上升,7ns以后,体系进入平衡,rmsd维持在
aptamer3-cd44分子复合物结构模型
在本研究工作中,我们对构建的aptamer3-cd44复合物分子模型进行了10ns的分子动力学模拟。图3显示的是复合物的rmsd值与模拟时间的关系曲线。由图4可知:在开始的2ns模拟时间内迅速上升,2ns以后,体系进入平衡,rmsd维持在
“aptamer-as1411-dna四面体”载药体系的合成鉴定
dna四面体合成
采用pcr的方法将6条单链的dna链,以碱基互补配对的方式组装成dna四面体结构。由于所形成的dna四面体的结构比较特殊,常规的marker无法标记准确,所以我们采取了核酸链逐条递增,相互验证的方式。page鉴定结果如图4所示:随着核酸链数目的增加,分子量明显增大,且条带单一,这些结果表明我们已经成功合成了dna四面体结构。
aptamer-dna四面体合成鉴定
aptamer修饰的dna四面体的合成过程中我们将三种aptamer分别以碱基互补配对的方式连接到dna四面体上。page鉴定结果如图5所示:1道指代dna四面体,2-4分别代表各连接了一条核酸适配体的结构,与1道相对,分子量明显增大,且条带单一,这些结果表明我们已经成功合成了三种分别带有一条核酸适配体的dna四面体结构。
aptamer-as1411-dna四面体合成鉴定
aptamer1-as1411-dna四面体合成鉴定
在前面实验的基础上,我们将一条aptamer1和三条as1411以碱基互补配对的方式同时连接到dna四面体上,用page进行鉴定。结果如图6所示:3、4和5道分别代表连有一条、两条和三条as1411的aptamer1-dna四面体,同1道dna四面体以及2道aptamer1-dna四面体相比,分子量随着连接as1411数目的不同依次递增,且条带单一,证明我们已经成功获得了同时连接有一条aptamer1和三条as1411的载药体系。
aptamer2-as1411-dna四面体合成鉴定
在前面实验的基础上,我们将一条aptamer2和三条as1411以碱基互补配对的方式同时连接到dna四面体上,用page进行鉴定。结果如图7所示:3、2和1道分别代表连有一条、两条和三条as1411的aptamer2-dna四面体,同5道dna四面体以及4道aptamer2-dna四面体相比,分子量随着连接as1411数目的不同依次递增,且条带单一,证明我们已经成功获得了同时连接有一条aptamer2和三条as1411的载药体系。
aptamer3-as1411-dna四面体合成鉴定
在前面实验的基础上,我们将一条aptamer3和三条as1411以碱基互补配对的方式同时连接到dna四面体上,用page进行鉴定。结果如图8所示:3、2和1道分别代表连有一条、两条和三条as1411的aptamer3-dna四面体,同5道dna四面体以及4道aptamer3-dna四面体相比,分子量随着连接as1411数目的不同依次递增,且条带单一,证明我们已经成功获得了同时连接有一条aptamer3和三条as1411的载药体系。
“aptamer-as1411-dna四面体”载药体系的在鼻咽癌靶向治疗中的应用研究血清稳定性评价
核酸类结构很容易被体内的核酸酶降解,为了考察本研究工作中的靶向载药体系在生理环境中的结构稳定性,我们在体外实验中将其与10%的血清在37℃的环境下进行共孵育,并分别于不同的时间点通过page鉴定这些结构的稳定性。实验结果表明,在含10%血清的溶液中,三种载药体系均能稳定存在8小时;dna四面体能够稳定存在4小时;单独的as1411分子仅能稳定存在2小时,as1411与10%血清共作用6小时后,结构全部被降解;24小时后,dna四面体和三种载药体系的结构基本全部被降解(图9)。
流式细胞术检测入胞效率
为了验证本研究工作中设计的靶向载药体系是否具有靶向性,我们在体外进行了鼻咽癌细胞对靶向载药体系的摄取实验。首先,我们将标记有cy5荧光分子的aptamer1-as1411-dna四面体与5-8f细胞进行共孵育,孵育2小时后用流式细胞仪检测细胞内荧光量。检测结果表明,共孵育2h后,修饰有aptamer1的载药体系与未修饰aptamer1的as1411-dna四面体相比,荧光量显著增加,(图10)。
为了验证本研究工作中设计的靶向载药体系是否具有靶向性,我们在体外进行了鼻咽癌细胞对靶向载药体系的摄取实验。首先,我们将标记有cy5荧光分子的aptamer2-as1411-dna四面体与5-8f细胞进行共孵育,孵育2小时后用流式细胞仪检测细胞内荧光量。检测结果表明,共孵育2h后,修饰有aptamer2的载药体系与未修饰aptamer2的as1411-dna四面体相比,荧光量显著增加,(图11)。
为了验证本研究工作中设计的靶向载药体系是否具有靶向性,我们在体外进行了鼻咽癌细胞对靶向载药体系的摄取实验。首先,我们将标记有cy5荧光分子的aptamer3-as1411-dna四面体与5-8f细胞进行共孵育,孵育2小时后用流式细胞仪检测细胞内荧光量。检测结果表明,共孵育2h后,修饰有aptamer3的载药体系与未修饰aptamer3的as1411-dna四面体相比,荧光量显著增加,(图12)。
本研究工作中设计的靶向载药体系目的是能够特异性的识别肿瘤细胞表面的cd44分子,从而避免对正常细胞的识别所导致的毒副作用。为了验证所设计的靶向载药体系对cd44-细胞是否具有一定的靶向性,我们在体外进行了nih3t3细胞对靶向载药体系的摄取实验。首先,我们将标记有cy5荧光分子的aptamer1-as1411-dna四面体与nih3t3细胞进行共孵育,孵育2小时后用流式细胞仪检测细胞内荧光量。检测结果表明,共孵育2h后,修饰有aptamer1的载药体系与未修饰aptamer1的as1411-dna四面体相比,荧光量并无明显差异(图13)。
为了验证aptamer2-as1411-dna四面体对cd44-细胞是否具有一定的靶向性,我们在体外进行了nih3t3细胞对靶向载药体系的摄取实验。首先,我们将标记有cy5荧光分子的aptamer2-as1411-dna四面体与nih3t3细胞进行共孵育,孵育2小时后用流式细胞仪检测细胞内荧光量。检测结果表明,共孵育2h后,修饰有aptamer2的载药体系与未修饰aptamer2的as1411-dna四面体相比,荧光量并无明显差异(图14)。
为了验证aptamer3-as1411-dna四面体对cd44-细胞是否具有一定的靶向性,我们在体外进行了nih3t3细胞对靶向载药体系的摄取实验。首先,我们将标记有cy5荧光分子的aptamer3-as1411-dna四面体与nih3t3细胞进行共孵育,孵育2小时后用流式细胞仪检测细胞内荧光量。检测结果表明,共孵育2h后,修饰有aptamer2的载药体系与未修饰aptamer3的as1411-dna四面体相比,荧光量并无明显差异(图15)。
荧光显微镜检测入胞效率
为了更直观的观察5-8f细胞对aptamer1-as1411-dna四面体的摄取情况,我们用倒置荧光显微镜观察了aptamer1-as1411-dna四面体与细胞共孵育2小时后细胞对aptamer1-as1411-dna四面体的摄取情况。结果表明:未修饰aptamer1的载药体系进入5-8f细胞内的量非常少,而aptamer1-as1411-dna四面体进入5-8f细胞的量明显增多,这些结果表明aptamer1-as1411-dna四面体能够在aptamer1的帮助下进入5-8f细胞内,从细胞层面上证明了aptamer1-as1411-dna四面体可以靶向cd44+鼻咽癌细胞(图16)。
为了更直观的观察5-8f细胞对aptamer2-as1411-dna四面体的摄取情况,我们用倒置荧光显微镜观察了aptamer2-as1411-dna四面体与细胞共孵育2小时后细胞对aptamer2-as1411-dna四面体的摄取情况。结果表明:未修饰aptamer2的载药体系进入5-8f细胞内的量非常少,而aptamer2-as1411-dna四面体进入5-8f细胞的量明显增多,这些结果表明aptamer2-as1411-dna四面体能够在aptamer2的帮助下进入5-8f细胞内,从细胞层面上证明了aptamer2-as1411-dna四面体可以靶向cd44+鼻咽癌细胞(图17)。
为了更直观的观察5-8f细胞对aptamer3-as1411-dna四面体的摄取情况,我们用倒置荧光显微镜观察了aptamer3-as1411-dna四面体与细胞共孵育2小时后细胞对aptamer3-as1411-dna四面体的摄取情况。结果表明:未修饰aptamer3的载药体系进入5-8f细胞内的量非常少,而aptamer1-as1411-dna四面体进入5-8f细胞的量明显增多,这些结果表明aptamer3-as1411-dna四面体能够在aptamer3的帮助下进入5-8f细胞内,从细胞层面上证明了aptamer3-as1411-dna四面体可以靶向cd44+鼻咽癌细胞(图18)。
cck8实验检测细胞增殖
为了验证本研究工作中设计并合成的aptamer1-as1411-dna四面体进入肿瘤细胞后,能否发挥抗肿瘤增殖活性,我们采用cck8方法进行检测。细胞增殖实验结果表明:在同等剂量下,aptamer1-as1411-dna四面体具有一定的杀伤肿瘤细胞的能力,并且在浓度为0.75μm时,对肿瘤细胞的抑制作用最明显,具有一定的剂量依赖性。dna四面体组和aptamer1-dna四面体组的增殖比例与对照组一致,这表明用于携带药物的材料本身对细胞增殖没有影响。而且,在单独as1411组和as1411-dna四面体组中,细胞生长的比例与对照组也无显著性差异,这些结果表明aptamer1-as1411-dna四面体能将as1411靶向递送至肿瘤细胞中,从而发挥抗肿瘤活性(图19)。
为了验证本研究工作中设计并合成的aptamer2-as1411-dna四面体进入肿瘤细胞后,能否发挥抗肿瘤增殖活性,我们采用cck8方法进行检测。细胞增殖实验结果表明:在同等剂量下,aptamer2-as1411-dna四面体具有一定的杀伤肿瘤细胞的能力,并且在浓度为0.75μm时,对肿瘤细胞的抑制作用最明显,具有一定的剂量依赖性。dna四面体组和aptamer2-dna四面体组的增殖比例与对照组一致,这表明用于携带药物的材料本身对细胞增殖没有影响。而且,在单独as1411组和as1411-dna四面体组中,细胞生长的比例与对照组也无显著性差异,这些结果表明aptamer2-as1411-dna四面体能将as1411靶向递送至肿瘤细胞中,从而发挥抗肿瘤活性(图20)。
为了验证本研究工作中设计并合成的aptamer3-as1411-dna四面体进入肿瘤细胞后,能否发挥抗肿瘤增殖活性,我们采用cck8方法进行检测。细胞增殖实验结果表明:在同等剂量下,aptamer3-as1411-dna四面体具有一定的杀伤肿瘤细胞的能力,并且在浓度为0.75μm时,对肿瘤细胞的抑制作用最明显,具有一定的剂量依赖性。dna四面体组和aptamer3-dna四面体组的增殖比例与对照组一致,这表明用于携带药物的材料本身对细胞增殖没有影响。而且,在单独as1411组和as1411-dna四面体组中,细胞生长的比例与对照组也无显著性差异,这些结果表明aptamer3-as1411-dna四面体能将as1411靶向递送至肿瘤细胞中,从而发挥抗肿瘤活性(图21)。
为了增加载药体系的靶向性,目前研究最有效的策略是将纳米载药系统修饰靶头分子,特异性识别肿瘤细胞表面的受体分子,后经受体介导的胞吞途径将药物分子转运入胞。本研究中选用能够特异性识别肿瘤细胞表面cd44分子的核酸适配体修饰dna四面体来提高靶向载药体系的入胞效率。本论文中,我们将标记有荧光分子cy5的三种靶向载药体系与cd44+鼻咽癌5-8f细胞进行共孵育,孵育2h后用细胞流式仪检测细胞内荧光量。实验结果表明,修饰有三种核酸适配体的载药体系同未修饰核酸适配体的as1411-dna四面体相比荧光量均有显著性增加,但细胞对三种载药体系的摄取量不同,aptamer1-as1411-dna四面体增加的是最明显的。我们的研究发现dna四面体结构也可以进入细胞,这与其紧密的三维结构和特殊的纳米尺寸有关系,现在对于其入胞的机制还不清楚,但是连接了as1411分子以后,其入胞效率显著降低,这可能是由于连接三条as1411一方面增加了分子的体积,另外增加了体系的负电荷,不利于入胞,而连接核酸适配体后,则显著增加了入胞效率。这些实验结果也进一步证实本研究中所设计的靶向载药体系是由cd44的核酸适配体特异性识别cd44分子,并在cd44分子介导下内吞入胞。而且,我们发现细胞的摄取量与文献中报道的核酸适配体与cd44的亲和力的顺序是一致的,据此我们推断亲和力高的核酸适配体更容易在cd44分子的介导下入胞,反之,入胞的效率会有所降低。
- 还没有人留言评论。精彩留言会获得点赞!